鸭病毒性肝炎(duck virus hepatitis, DVH)是鸭肝炎病毒(duck hepatitis A virus, DHAV)感染雏鸭引起的一种传播迅速、发病率高、病死率高的传染性疾病,临床主要以肝肿大及出血为典型病理特征。1949年在美国首次发现本病[1],随后,英国、德国、日本相继报道发生DVH;目前该病在全世界流行。鸭肝炎病毒主要有3个血清型,分别是DHAV-1、DHAV-2、DHAV-3,三种血清型之间无交叉免疫性[2]。临床上一旦暴发该病,常给养鸭业造成严重的经济损失。目前,国内外临床上还没有有效抗DHAV-1药物;该病的预防措施主要是通过对雏鸭注射弱毒疫苗进行人工主动免疫;卵黄抗体、高免血清和单克隆抗体治疗鸭病毒性肝炎有很好的疗效[3],但由于其储存条件要求高以及给药操作方式繁琐,致使在实际应用中有所限制。
中药是多组分的复合体,具有较广泛的抗病毒作用,在我国具有悠久的使用历史。越来越多的研究显示,中药在治疗病毒性疾病方面有良好的治疗效果。张玉清等[4]发现黄芩苷、野菊花黄酮等组成的复方能够显著降低鸡群感染新城疫病毒的病死率。任志华等[5]发现板蓝根、黄芪、连翘等组成的复方可以抑制鸭瘟病毒在鸭胚成纤维细胞上的增殖。周广生[6]研究发现金丝桃素对鸭病毒性肝炎有极好的治疗效果。吴舒渊[7]发现金银花、茵陈等组成的中药复方对人工感染鸭肝炎病毒雏鸭具有良好治疗效果,且疗效明显优于抗生素治疗组。因此研发治疗鸭病毒性肝炎的中药制剂具有重要的生产实践意义。
黄芩为唇形科(Labiatae)植物黄芩(Scutellaria baicalensis)的干燥根,主要成分是黄芩苷,具有抗病毒、抗炎、解热镇痛、肝保护作用[8]。淫羊藿为小檗科(Berberidaceae)淫羊藿属(Epimedium)植物的干燥地上部分,主要成分是淫羊藿黄酮,在免疫方面能提高机体体液免疫能力[9]。本实验室在前期研究过程中,根据中兽医理论将多味中药相互配伍,通过体外细胞试验筛选出黄芩、淫羊藿等几味中药配伍后形成芩藿饮[10]且具有一定的抗DHAV-1效果。本研究旨在通过动物体内试验,进一步验证芩藿饮对雏鸭感染鸭肝炎病毒的临床治疗效果。
1 材料与方法 1.1 主要试剂与仪器天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒、总蛋白(total protein,TP)试剂盒、白蛋白(albumin,ALB)试剂盒,以上试剂盒购自美国Dade Behring公司。
鸭白细胞介素-2(interleukin-2,IL-2)酶联免疫试剂盒、鸭白细胞介素-6(IL-6)酶联免疫试剂盒、鸭白细胞介素-8(IL-8)酶联免疫试剂盒、鸭干扰素-β(interferon-β,IFN-β)酶联免疫试剂盒,以上试剂盒购自南京奥青生物技术有限公司;肝素钠(购自北京索莱宝科技有限公司,批号:HB8060)。
Dimension X Pand Plus全自动生化分析仪(Dade Behring,USA),BX43显微镜(Olympus, Japan),Leica RM 2235切片机(Leica, Germany),Thermo Fisher Multiskan FC酶标仪(Thermo Fisher,USA),BIOFUGE PRIMO R Centrifuge离心机(Thermo Fisher,USA)。
1.2 试验药物芩藿饮:由黄芩、淫羊藿等中药按一定比例组成[10];水煎煮两次,收集滤液后浓缩至生药浓度1 g·mL-1,4 ℃保存备用。
1.3 试验动物和病毒1日龄非免疫(鸭病毒性肝炎疫苗)健康樱桃谷雏鸭,购自安徽朝阳孵化场。
DHAV-1(LQ2株),由山东省农业科学院家禽研究所黄兵惠赠,制备方法参照于可响等[11]的报道。
1.4 试验方法 1.4.1 动物分组与处理1日龄非免疫健康樱桃谷雏鸭饲养至6日龄时,选取300只随机平均分为5组,每组60只,雌雄各半。试验组分别为芩藿饮高剂量组、中剂量组、低剂量组,以及病毒组、空白组。空白组雏鸭腿部肌肉注射0.9%氯化钠注射液0.2 mL·只-1,单独隔离饲养;其他各试验组雏鸭腿部肌肉注射DHAV-1 0.2 mL·只-1,人工攻毒造模。
感染1 h后,芩藿饮高剂量组、中剂量组、低剂量组分别按高剂量(0.6 mL·只-1)、中剂量(0.4 mL·只-1)、低剂量(0.2 mL·只-1)添加芩藿饮于适量饮水中饮喂,每天1次,连续给药3 d;病毒组和空白组饮水中不添加任何药物,连续3 d。
1.4.2 病死率统计每天观察记录各试验组雏鸭的临床症状,每隔4 h定时记录各试验组雏鸭发病死亡情况,直至停止出现死亡后24 h。死亡雏鸭及时逐只剖检、观察肝病变,以具有典型鸭病毒性肝炎病理特征的为有效记录数据,统计各试验组死亡情况及计算病死率。
1.4.3 血清样品制备在雏鸭注射DHAV-1染毒后第4、8和48小时,每组随机抽取雏鸭5只(不计入样本数),采集血液样本,3 000 r·min-1离心10 min;将分离的血清分装在2 mL EP管中,置于-70 ℃保存备用。
1.4.4 肝病理剖检及HE染色上述各试验组雏鸭采血结束后立即处死,采集肝组织,然后放入10%中性甲醛溶液中固定,先制备石蜡/冰冻切片,再进行HE染色,显微镜下观察并拍照。
1.4.5 肝生化指标的测定血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)含量的测定,按照试剂盒说明书操作,采用全自动生化分析仪测定,计算球蛋白(GLO=TP-ALB)含量。
1.4.6 血液中DHAV-1 VP1基因定量分析采用实时荧光定量PCR方法测定。
1.4.6.1 血液中总RNA提取、反转录在攻毒给药治疗后第4、8和48小时,每组随机抽取雏鸭5只(不计入样本数),采集血液样本,肝素钠抗凝,取30 μL抗凝全血加入1 mL Trizol,用于总RNA提取;按照PrimeScript RT Master Mix Kit说明书反转录cDNA。
1.4.6.2 实时荧光定量PCR分析引物设计,根据GenBank上发表的鸭DHAV-1 ZJ株VP1基因序列,用Premier5.0软件设计引物(表 1),引物由生工生物工程(上海)股份有限公司合成,以鸭胚肝细胞看家基因β-actin为内参。Real-time PCR反应在Step One Plus Real-time PCR仪上进行,按照SYBR Premix Ex TaqTM (Tli RNaseH Plus)试剂盒说明书进行操作,反应条件为“95 ℃ 30 s;40个循环95 ℃ 5 s,60 ℃ 31 s;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s”;利用2-ΔΔCt法处理qPCR结果[12]。
|
|
表 1 Real-time PCR引物信息 Table 1 The information of Real-time PCR primer |
采用ELISA法测定血清中IL-2、IL-6、IL-8、IFN-β含量。按照试剂盒说明书操作,在酶标仪上于450 nm处测量各孔OD值,绘制标准曲线,得出回归方程,在回归方程基础上计算各样品所对应的浓度。
1.5 数据处理及分析利用SPSS 22.0统计分析软件对试验数据进行显著性差异分析,除病死率结果外,数据以平均值±标准误(x±sx)的形式表示,P < 0.05为差异显著,P>0.05为差异不显著。
2 结果 2.1 病死率统计各试验组雏鸭病死率结果见表 2。攻毒给药治疗后,截至96 h各试验组雏鸭停止死亡。空白组雏鸭全部存活,病死率为0;病毒组雏鸭全部死亡,病死率100%;高剂量组雏鸭病死率为71.1%;中剂量组和低剂量组雏鸭病死率分别为93.3%和97.8%,高剂量组雏鸭病死率显著低于病毒组(P < 0.05)。
|
|
表 2 各试验组雏鸭病死率 Table 2 The mortality rate of ducklings in each group |
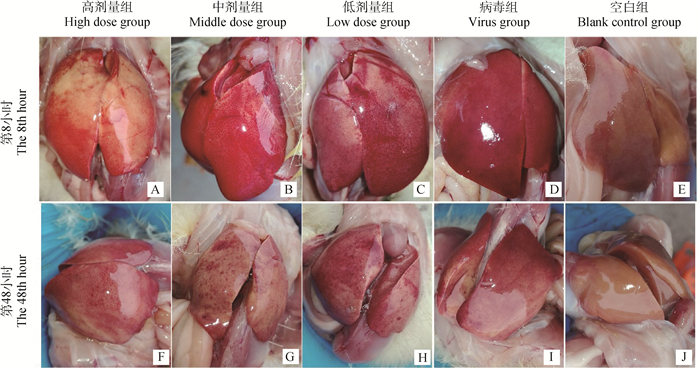
给药治疗第8小时(图 1A~E),高剂量组(A)肝局部区域出血,出血灶不密集;中剂量组(B)肝肿大,表面弥漫性出血;低剂量组(C)肝肿胀,大面积出血点,颜色稍暗红;病毒组(D)肝肿胀,颜色暗红,表面密布大小不等的点状或斑状出血点或坏死灶;空白组(E)肝呈褐色,色泽均匀、质地柔软,无病理性损伤。
|
图 1 给药治疗第8、48小时肝病理剖检变化 Figure 1 Pathological change of liver at the 8th and 48th hour after drug treatment |
给药治疗第48小时(图 1F~J),高剂量组(F)肝出血点少,仅有少数淤血斑;中剂量组(G)、低剂量组(H)肝表面无弥漫性出血点,局部区域有少量淤血斑;病毒组(I)肝颜色暗红,表面有大面积密集出血点;空白组(J)肝色泽正常,无病理损伤变化。
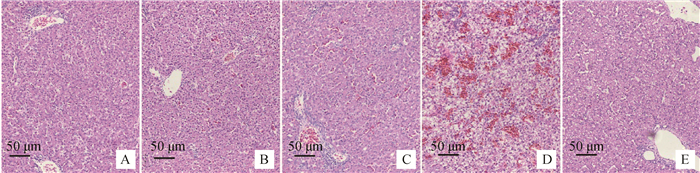
2.3 肝病理组织学分析各试验组雏鸭给药治疗第48小时肝病理切片结果见图 2。高剂量组(A)肝出血较少,无炎性细胞浸润;中剂量组(B)肝小叶之间有少量出血点,肝窦周围有炎性细胞浸润;低剂量组(C)肝小叶之间有中等程度出血点;病毒组(D)肝弥漫性出血,炎性细胞浸润;空白组(E)肝无明显病理损伤。
|
A.高剂量组;B.中剂量组;C.低剂量组;D.病毒组;E.空白组 A. High dose group; B. Middle dose group; C. Low dose group; D. Virus group; E. Blank control group 图 2 给药治疗第48小时肝病理切片 Figure 2 Pathological section of liver at the 48th hour after drug treatment |
各试验组雏鸭肝功能生化指标AST、ALT、ALB、TP、GLO含量动态变化结果见表 3。
|
|
表 3 各试验组肝功能生化指标变化结果(x±sx) Table 3 The results of hepatic function biochemical indexes in each group(x±sx) |
在给药治疗第4、8和48小时,病毒组AST含量均显著高于空白组(P < 0.05),高、中、低3个剂量组AST含量均显著低于病毒组(P < 0.05),显著高于空白组(第48小时高剂量组AST含量除外)(P < 0.05)。
在给药治疗第4、8和48小时,病毒组ALT含量均显著高于空白组(P < 0.05);高剂量组显著低于病毒组(P < 0.05),中剂量组和低剂量组与病毒组差异不显著(P>0.05)。
在给药治疗第4、8和48小时,病毒组ALB含量均显著低于空白组(P < 0.05);高、中、低3个剂量组ALB含量均显著高于(P < 0.05)或高于病毒组,均显著低于空白组(P < 0.05)。
在给药治疗第4、8和48小时,病毒组TP含量显著低于空白组(P < 0.05);第8和48小时,高剂量组和中剂量组TP含量均显著高于病毒组(P < 0.05);第4、8小时,高剂量组TP含量显著高于中剂量组和低剂量组(P < 0.05),中剂量组和低剂量组TP含量差异不显著(P>0.05);第48小时,高剂量组和中剂量组TP含量显著高于低剂量组(P < 0.05),与空白组接近。在给药治疗第4小时,病毒组GLO含量显著低于空白组(P < 0.05),高剂量组GLO含量显著高于病毒组(P < 0.05)。
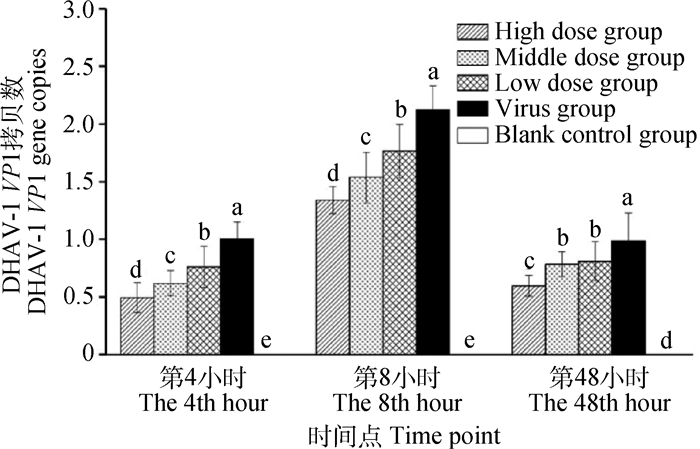
2.5 血液中DHAV-1 VP1基因拷贝数的变化各试验组雏鸭血液中DHAV-1 VP1基因拷贝数结果见图 3。空白组未检测出DHAV-1 VP1基因表达,将病毒组第4小时DHAV-1 VP1基因拷贝数设为1。在给药治疗第4、8和48小时,病毒组呈先升高后下降趋势,3个剂量组和病毒组变化趋势相一致。第4、8小时,3个剂量组均显著低于病毒组(P < 0.05),高剂量组显著低于中剂量组和低剂量组(P < 0.05),中剂量组显著低于低剂量组(P < 0.05);第48小时,与第8小时相比,各试验组DHAV-1 VP1基因拷贝数均显著大幅降低(P < 0.05),高剂量组显著低于其余各试验组(P < 0.05),中、低剂量组均显著低于病毒组(P < 0.05)。
|
同一时间点字母相异表示差异显著(P < 0.05),字母相同表示差异不显著(P>0.05) Different letters in the bars at the same time mean significant difference between the treatments (P < 0.05), same letter in the bars at the same time means no significant difference between treatments (P>0.05) 图 3 各试验组雏鸭血液中DHAV-1 VP1基因拷贝数结果 Figure 3 The results of duck relative blood DHAV-1 VP1 gene copies number in each group |
各试验组雏鸭血清中IL-2、IL-6、IL-8、IFN-β含量动态变化结果见表 4。
|
|
表 4 各试验组血清中细胞因子含量动态变化(x±sx) Table 4 The variation of serum cytokine content in each group(x±sx) |
在给药治疗第4、8和48小时,病毒组IL-2含量显著高于空白组(P < 0.05),高剂量组IL-2含量显著高于病毒组(P < 0.05);高、中、低3个剂量组IL-2含量均高于病毒组;第8小时,高剂量组IL-2含量显著高于低剂量组(P < 0.05);3个时间点,各剂量组均显著高于空白组(P < 0.05)。
在给药治疗第4、8和48小时,病毒组IL-6含量显著低于空白组(P < 0.05),高、中、低3个剂量组显著高于病毒组和空白组(P < 0.05);3个时间点,高、中、低3个剂量组均呈升高趋势,但各剂量组间无显著性差异(P>0.05)。
在给药治疗第4和8小时,病毒组IL-8含量显著低于空白组(P < 0.05);除第48小时低剂量组外,3个时间点各剂量组均显著高于病毒组(P < 0.05);高、中、低3个剂量组IL-8含量随着芩藿饮剂量不同而有所差异,第48小时,高剂量组显著高于低剂量组(P < 0.05)。
在给药治疗第4、8和48小时,病毒组IFN-β含量均低于空白组;第4和48小时,高剂量组IFN-β含量显著高于病毒组(P < 0.05);3个时间点,高剂量组IFN-β含量显著高于低剂量组(P < 0.05),与空白组接近。
3 讨论 3.1 芩藿饮对感染鸭肝炎病毒雏鸭肝及肝生化指标的影响肝是机体最大的药物代谢和解毒器官,担负着机体重要的生理功能。肝一旦损伤,必然导致肝细胞功能受损,影响新陈代谢的正常进行。病理剖检是对动物进行系统性全身病理检查和疾病诊断的基本手段,病理切片则是观察组织微细病理变化的常用技术[13],两者都能直观显示组织损伤或修复情况。
肝中ALT、AST是评估肝功能或肝损伤常用的2种酶。正常生理条件下,ALT主要分布在肝细胞细胞质内,血清中ALT含量极少;肝细胞损伤时细胞膜破裂,ALT从细胞中释放到血液,血清中ALT含量急剧增高,是反映肝损伤的一项敏感指标[14-15]。AST在肝中主要分布于细胞质和线粒体,其中80%分布在线粒体。肝细胞受损时,线粒体膜和细胞膜破裂,AST释放入血液,血清中AST含量迅速升高,是反映肝细胞坏死程度的重要指标[16]。ALB是血液系统重要成分,具有维持胶体渗透压、抗氧化等功能。肝合成ALB后释放入血液,其含量多少能够反映肝合成蛋白质功能的强弱[17]。一定浓度ALB可以减轻肝水肿,降低肝损伤程度;此外,ALB可以增高血浆胶体渗透压使血管内液体不溢出血管外,避免机体因血容量降低而导致休克、死亡。研究表明,雏鸭感染DHAV-1后,血清中TP和ALB含量会降低[18]。GLO是体内重要的一种免疫球蛋白,参与机体免疫反应,一定程度上反映机体的免疫状况[19]。TP由ALB和GLO组成,肝细胞受损时,肝合成蛋白质减少,其含量高低能够反映肝合成蛋白质的能力。
本试验结果表明,DHAV-1侵入雏鸭体内致使肝不同程度出血水肿,肝细胞大量破坏导致血清中ALT、AST含量急剧升高;ALB、TP、GLO含量降低。给予芩藿饮治疗后,随着药物作用时间延长,肝出血显著减少、肿胀减轻;血清中ALT、AST含量与空白组接近,ALB、TP、GLO含量逐渐恢复至正常水平;说明芩藿饮能够抑制DHAV-1对肝细胞破坏,保护肝细胞结构与功能的完整性。
3.2 芩藿饮对感染鸭肝炎病毒雏鸭血液中DHAV-1 VP1基因拷贝数的影响雏鸭血液中DHAV-1 VP1基因拷贝数可以反映体内DHAV-1的数量。体内病毒数量越多,肝细胞破坏越严重,则肝功能受损越严重。研究表明,DHAV-1属于小RNA病毒科,完成一个复制周期需要6~8 h;病毒感染早期,雏鸭体内主要是药物的直接抗病毒作用而非体液免疫抵御病毒[20-21]。本试验中,在疾病初期,病毒可能未完成一个复制周期;其次,芩藿饮抑制病毒的复制和释放;两者都影响病毒在体内的数量;因此,3个剂量组DHAV-1 VP1基因拷贝数均显著低于病毒组。病毒完成复制后,3个剂量组和病毒组DHAV-1迅速增殖,病毒组DHAV-1 VP1基因拷贝数显著高于3个剂量组。在疾病后期,雏鸭通过体液免疫、细胞免疫等自我清除机制及芩藿饮共同发挥抗病毒作用,故3个剂量组和病毒组DHAV-1 VP1基因拷贝数快速下降。本试验结果表明,芩藿饮能够抑制病毒在体内复制,有效降低病毒数量,减轻肝细胞损伤,从而使感染雏鸭肝出血肿胀显著减轻,肝功能生化指标恢复至接近正常水平。
3.3 芩藿饮对感染鸭肝炎病毒雏鸭血清细胞因子的影响白细胞介素类细胞因子可作用于多种病毒,一方面刺激机体产生抗病毒蛋白;另一方面通过免疫调节,有效地抑制病毒复制、抵抗病毒感染[22]。IL-2由激活的T淋巴细胞产生,具有诱导T细胞增殖,促进B细胞分化及分泌抗体,增强单核细胞、NK细胞杀伤活性等功能,在机体免疫反应中具有重要的免疫调节作用[23]。随着对中药免疫调节作用的研究,发现许多中药复方、单味中药对IL-2的产生及活性有明显影响。郑玲红等[24]研究发现猴头菇多糖能够显著促进MDRV感染番鸭IL-2的分泌。于学武[25]研究发现IL-2在抗AIV感染早期发挥极其重要的抗病毒作用。本试验结果表明,给与芩藿饮治疗后,3个剂量组IL-2含量显著高于病毒组,说明芩藿饮能够提高雏鸭血清中IL-2含量,即芩藿饮可作用于T细胞促进其分泌IL-2,从而促进雏鸭特异性免疫应答,增强机体免疫功能,这为芩藿饮作为治疗雏鸭病毒性肝炎有效药物的研发提供了理论依据。
IL-6是体内重要的白细胞介素,由活化的T细胞和成纤维细胞产生,参与机体抗炎症反应[26]。IL-8又称嗜中性粒细胞因子,是炎症性疾病的重要介质,在抗感染、免疫调节方面具有重要作用;IL-8对特异性和非特异性免疫细胞具有强烈的趋化作用[27],主要对嗜中性粒细胞趋化和激活作用。IL-6和IL-8在一定水平反映炎症反应的严重程度,也是消除炎症反应的因子;此外,两者高水平时也是炎症的刺激因子。本试验结果表明,雏鸭感染DHAV-1导致肝发生炎症性损伤,病毒组IL-6、IL-8含量低于空白组;给与芩藿饮治疗后,3个剂量组血清中IL-6、IL-8含量显著高于病毒组,说明芩藿饮促使机体分泌一定水平IL-6、IL-8消除炎症反应,限制炎症的扩散,对雏鸭病毒性肝炎引起的炎症感染有良好治疗作用。
IFN-β是由成纤维细胞和病毒核酸等干扰素诱生物质刺激所分泌的一种糖蛋白;具有广谱抗病毒作用,其抑制病毒增殖程度因病毒种类不同而有所差异;在病毒感染起始阶段、体液免疫和细胞免疫发生作用之前发挥重要作用[28]。与IFN-α相似,IFN-β不仅具有抗病毒作用,而且具有抗肿瘤、抗增殖和免疫调节等功能[29]。IFN-β诱导MHC-I类抗原表达从而促进CD8+T细胞应答;此外,IFN-β还诱导多种蛋白酶小体和渗透酶,参与病毒肽的降解和运输,有利于抗原处理和递呈[30]。本试验结果表明,感染雏鸭经芩藿饮治疗后,3个剂量组血清中IFN-β含量显著高于病毒组,说明芩藿饮促使机体分泌IFN-β,迅速调节免疫应答清除体内病毒,使病毒数量初期升高后期降低,对病毒复制有一定抑制作用,从而降低病毒对肝的损害。
3.4 芩藿饮对感染鸭肝炎病毒雏鸭病死率的影响中兽医理论认为,鸭病毒性肝炎是DHAV-1侵入雏鸭体内导致肝胆湿热、肝风内动而引起的疾病;临床症状主要表现为全身痉挛、抽搐和腹泻等;治疗原则为清热解毒、息风止痉、疏肝解郁、提高雏鸭机体免疫力[31]。黄芩,味苦,性寒,具有清热燥湿、泻火解毒功效;淫羊藿,味辛,性温,具有补肾助阳、祛风除湿功效。因此,根据中兽医辨证理论将上述中药配伍组成方剂治疗鸭病毒性肝炎。病死率是反映试验药物对靶动物是否真实有效最直接的指标。本试验结果表明,感染雏鸭给与芩藿饮治疗后,芩藿饮促使机体分泌IL-2、IL-6、IL-8、IFN-β抵御病毒感染,有效降低体内病毒数量;体内病毒数量降低使肝细胞损伤减轻,肝出血及肿胀程度明显减轻,ALT、AST等肝功能生化指标恢复至接近正常水平;结果显示,病毒组雏鸭病死率100%,高剂量组雏鸭病死率71.1%,病死率降低28.9%;说明芩藿饮能够有效提高感染雏鸭的存活数。这个效果虽然不及卵黄抗体,但本品使用方便简单,治疗范围广,并不局限于鸭病毒性肝炎,故仍然具有一定的开发利用前景。
4 结论芩藿饮能够有效降低感染雏鸭的病死率;显著降低雏鸭血液中DHAV-1 VP1基因拷贝数;修复DHAV-1对肝造成的损伤;降低血清中AST、ALT含量,增加TP、ALB、GLO蛋白含量;促进机体IL-2、IL-6、IL-8、IFN-β细胞因子分泌。高剂量芩藿饮对实验感染性鸭肝炎病毒雏鸭有一定的临床治疗作用。
| [1] | LEVINE P P, FABRICANT J. A hitherto-undescribed virus disease of ducks in North America[J]. Cornell Vet, 1950, 40(1): 71–86. |
| [2] | DING C Y, ZHANG D B. Molecular analysis of duck hepatitis virus type 1[J]. Virology, 2007, 361(1): 9–17. DOI: 10.1016/j.virol.2007.01.007 |
| [3] |
郝树果, 刘全忠. 抗鸭肝炎病毒血清抗体对鸭的治疗效果[J]. 中国畜牧兽医文摘, 2017, 33(3): 231, 213.
HAO S G, LIU Q Z. Therapeutic effect of anti-duck hepatitis virus serum antibody on ducks[J]. Chinese Abstracts of Animal Husbandry and Veterinary Medicine, 2017, 33(3): 231, 213. (in Chinese) |
| [4] | ZHANG Y Q, SUN Z A, LIU J G, et al. Flavone ingredients can synergistically inhibit NDV infecting cell and improve ND vaccine's protective rate[J]. Int J Biol Macromol, 2012, 51(3): 201–208. DOI: 10.1016/j.ijbiomac.2012.04.028 |
| [5] |
任志华, 邓惠丹, 邓俊良, 等. 复方中药禽康散对鸭瘟病毒感染鸭胚及成纤维细胞的保护效应[J]. 中国兽医学报, 2013, 33(7): 1095–1098.
REN Z H, DENG H D, DENG J L, et al. Protection of the Chinese herbal medicine Qinkangsan against duck plague virus in duck embryo and duck embryo fibroblasts[J]. Chinese Journal of Veterinary Science, 2013, 33(7): 1095–1098. (in Chinese) |
| [6] |
周广生. 中药金丝桃素口服液治疗鸭病毒性肝炎的试验研究[J]. 中国畜牧兽医, 2008, 35(12): 128–129.
ZHOU G S. Experimental Study on the Treatment of duck virus hepatitis with Hypericin oral liquid[J]. China Animal Husbandry & Veterinary Medicine, 2008, 35(12): 128–129. (in Chinese) |
| [7] |
吴舒渊. 鸭肝康防治鸭病毒性肝炎的试验研究[D]. 福州: 福建农林大学, 2012.
WU S Y. Study on the testing of duck viral hepatitis by Yagankang[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10389-1013125531.htm |
| [8] |
辛文妤, 宋俊科, 何国荣, 等. 黄芩素和黄芩苷的药理作用及机制研究进展[J]. 中国新药杂志, 2013(6): 647–653.
XIN W Y, SONG J K, HE G R, et al. Progress in pharmacological study and the underlying mechanism of Baicalein[J]. Chinese Journal of New Drugs, 2013(6): 647–653. (in Chinese) |
| [9] |
范曾丽, 权秋梅. 淫羊藿的药理研究进展[J]. 安徽农业科学, 2012, 40(17): 9264–9266.
FAN Z L, QUAN Q M. Research advances in the pharmacological effects of herbal epimedium[J]. Journal of Anhui Agricultural Sciences, 2012, 40(17): 9264–9266. DOI: 10.3969/j.issn.0517-6611.2012.17.030 (in Chinese) |
| [10] |
刘家国, 曾玲, 徐美云, 等. 一种抗鸭病毒性肝炎中药提取物复方: ZL201410103689. 0[P]. 2016-08-17.
LIU J G, ZENG L, XU M Y, et al. A traditional Chinese medicine extract compound for resisting duck virus hepatitis: ZL201410103689. 0[P]. 2016-08-17. (in Chinese) |
| [11] |
于可响, 沙明利, 黄兵, 等. 鸭病毒性肝炎多价卵黄抗体的研制[J]. 山东农业科学, 2008(1): 104–105.
YU K X, SHA M L, HUANG B, et al. Development of polyvalent yolk antibody in duck viral hepatitis[J]. Shandong Agricultural Sciences, 2008(1): 104–105. (in Chinese) |
| [12] |
刘彦礼, 李旭, 苏振成, 等. 动力学模型在荧光定量PCR数据处理中的优势[J]. 生物技术通报, 2013, 1(2): 157–162.
LIU Y L, LI X, SU Z C, et al. Advantages of the dynamic model in real-time pcr data processing[J]. Biotechnology Bulletin, 2013, 1(2): 157–162. (in Chinese) |
| [13] |
陈宏智, 何书海, 张振华, 等. 雏鸭病毒性肝炎的病理学诊断与防控措施[J]. 中国兽医杂志, 2014, 50(8): 91–93.
CHEN H Z, HE S H, ZHANG Z H, et al. Pathological diagnosis and prevention measures of duck hepatitis virus[J]. Chinese Journal of Veterinary Medicine, 2014, 50(8): 91–93. (in Chinese) |
| [14] | OKDA F A, YASSEIN S, AHMED A R, et al. Some haematological and biochemical investigations on duck virus hepatitis following administration of glycyrrhizin[J/OL]. ISRN Pharmacol, 2013, 2013: 849412. [2018-03-07]. https://www.hindawi.com/journals/isrn/2013/849412/. |
| [15] | LI Z W, KUANG Y, TANG S N, et al. Hepatoprotective activities of antrodia camphorata and its triterpenoid compounds against CCl4 induced liver injury in mice[J]. J Ethnopharmacol, 2017, 206: 31–39. DOI: 10.1016/j.jep.2017.05.020 |
| [16] | KIM H C, NAM C M, JEE S H, et al. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study[J]. BMJ, 2004, 328(7446): 983–986. DOI: 10.1136/bmj.38050.593634.63 |
| [17] |
张英霞, 张云. 血清白蛋白的功能及应用[J]. 海南大学学报, 2007, 25(3): 315–320.
ZHANG Y X, ZHANG Y. Thefunctions of album in serum and its applications[J]. Journal of Hainan University, 2007, 25(3): 315–320. (in Chinese) |
| [18] | AHMED A A, EIABDIN Y Z, HAMZA S, et al. Effect of experimental duck virus hepatitis infection on some biochemical constituents and enzymes in the serum of white Peking ducklings[J]. Avian Dis, 1975, 19(2): 305–310. DOI: 10.2307/1588984 |
| [19] | GUO A, ZHENG M H, QING C L, et al. The protective effect of total phenolics from oenanthe javanica on acute liver failure induced by D-galactosamine[J]. J Ethnopharmacol, 2016, 186: 53–60. DOI: 10.1016/j.jep.2016.03.024 |
| [20] | LI J Y, HUANG H, FENG M Q, et al. In vitro and in vivo anti-hepatitis B virus activities of a plant extract from Geranium carolinianum L[J]. Antivir Res, 2008, 79(2): 114–120. DOI: 10.1016/j.antiviral.2008.03.001 |
| [21] | CHEN Y, XIONG W, ZENG L, et al. Comparison of Bush Sophora Root polysaccharide and its sulfates anti-duck hepatitis A virus activity and mechanism[J]. Carbohyd Polym, 2014, 102(1): 333–340. |
| [22] |
祝小红, 胡小鹏, 于甜, 等. 白细胞介素类抗病毒细胞因子研究进展[J]. 现代免疫学, 2013(6): 522–526.
ZHU X H, HU X P, YU T, et al. Research progress of antiviral cytokines of interleukin[J]. Current Immunology, 2013(6): 522–526. (in Chinese) |
| [23] | CHEN Y, WU Y, XIAN L T, et al. Effects of Bush Sophora Root polysaccharide and its sulfate on immuno-enhancing of the therapeutic DVH[J]. Int J Biol Macromol, 2015, 80: 217–224. DOI: 10.1016/j.ijbiomac.2015.06.029 |
| [24] |
郑玲红, 吴异健, 廖加磊, 等. 猴头菇多糖MDRV感染番鸭血清中细胞因子及激素水平的影响[J]. 中国兽医科学, 2017, 47(2): 249–256.
ZHENG L H, WU Y J, LIAO J L, et al. Effect of hericium polysaccharide on partial cytokines and hormones in muscovy ducks infected with muscovy duck reovirus[J]. Chinese Veterinary Science, 2017, 47(2): 249–256. (in Chinese) |
| [25] |
于学武. 禽流感病毒感染雏鸭免疫器官免疫功能变化及IL-2 mRNA的表达[D]. 哈尔滨: 东北农业大学, 2008.
YU X W. Changes of immunologic function and IL-2 mRNA expression in immune organs of ducks infected with Avian influenza virus [D]. Harbin: Northeast Agricultural University, 2008. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10224-2008145235.htm |
| [26] | ROSE J S. IL-6 trans-signaling via the soluble IL-6 receptor: importance for the pro-inflammatory activities of IL-6[J]. Int J Biol Sci, 2012, 8(9): 1237–1247. DOI: 10.7150/ijbs.4989 |
| [27] | KOENSGEN D, BRUENNERT D, UNGUREANU S, et al. Polymorphism of the IL-8 gene and the risk of ovarian cancer[J]. Cytokine, 2015, 71(2): 334–338. DOI: 10.1016/j.cyto.2014.07.254 |
| [28] |
涂浩, 赵星灿, 杨占娜, 等. 猪重组IL-2、IL-4和IFN-γ对口蹄疫合成肽疫苗的免疫增强作用研究[J]. 畜牧兽医学报, 2015, 46(8): 1390–1399.
TU H, ZHAO X C, YANG Z N, et al. Immunological enhancement of recombinant Porcine IL-2, IL-4 and IFN-γ Food-and-Mouth disease synthetic Peptide vaccine[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1390–1399. (in Chinese) |
| [29] |
王赛, 周李, 康莲莲, 等. 抗病毒中药复方制剂对雏鸡IFN-γ水平影响的研究[J]. 西南民族大学学报, 2014, 40(1): 27–31.
WANG S, ZHOU L, KANG L L, et al. Research on the effect of the Chinese antiviral herbal compound on IFN-γ level of the chickens[J]. Journal of Southwest University for Nationalities, 2014, 40(1): 27–31. (in Chinese) |
| [30] | ELIKE W, DANIELA S, FEDOR H, et al. Interferon-β increases the stimulatory capacity of monocyte-derived dendritic cells to induce IL-13, IL-5 and IL-10 in autologous T-cells[J]. J Neuroimmunol, 2002, 123(1-2): 160–169. DOI: 10.1016/S0165-5728(01)00482-9 |
| [31] |
吴桂银, 周广生. 中药蟾甘口服液对鸭病毒性肝炎的防治试验[J]. 安徽农业科学, 2010, 38(20): 10700–10701.
WU G Y, ZHOU G S. Effect of ChanGan oral liquid on duck viral hepatitis[J]. Journal of Anhui Agricultural Sciences, 2010, 38(20): 10700–10701. DOI: 10.3969/j.issn.0517-6611.2010.20.083 (in Chinese) |



