口蹄疫(foot-and-mouth disease virus, FMDV)和水泡性口炎(vesicular stomatitis virus, VSV)是两种牛常见高度急性病毒传染病,一般呈暴发性流行,一旦暴发会给养牛业造成巨大的经济损失,被世界动物卫生组织(OIE)列为法定上报动物疫病[1-2]。FMDV和VSV引起的临床病状非常相似,难以区分,均表现为流涎,发烧,跛行,口腔、乳头和蹄部冠状带等处发生水泡及溃疡[3-5]。因此急需建立口蹄疫和水泡性口炎的快速鉴别检测技术,为我国FMDV和VSV的防控提供技术支持。
目前FMDV分为7个血清型:A、O、C、SAT1、SAT2、SAT3、AsiaⅠ型,每个型又可以进一步分为不同的亚型。我国流行的是A、O和AsiaⅠ型。VSV分为新泽西型(NJ型)和印第安型(IND型),在引起家畜发病的血清型中,NJ型占多数。在我国,VSV通常呈点状散发,一般不广泛流行[6]。
目前OIE推荐的检测FMDV和VSV的分子生物学方法主要是RT-PCR和荧光RT-PCR方法[7-8]。但RT-PCR和荧光RT-PCR都有一些自身的局限性,如RT-PCR敏感性较低,荧光RT-PCR成本较高,需要昂贵的仪器设备等。环介导的体外等温扩增检测技术(loop-mediated isothermal amplification,LAMP)是在PCR方法上发展起来的新兴核酸检测技术,突破了恒温扩增的技术难点,6条引物同时扩增,敏感性高,特异性好,已在多种疾病的检测上得到应用[9-13]。目前国内虽然已有多位学者建立了多重LAMP检测方法,但这些方法都有一定的局限性,不能确定具体到底是哪一种病原所引起的阳性结果,不是真正意义上的鉴别诊断。本研究首次在LAMP方法中引入了荧光基团,拟建立检测FMDV和VSV的二重荧光RT-LAMP方法,通过颜色观察同时鉴别检测FMDV和VSV。
1 材料与方法 1.1 毒株与菌株口蹄疫灭活疫苗A型、O型、AsiaⅠ型购自中国农业科学院兰州兽医研究所,口蹄疫灭活病毒O型、A型、AsiaⅠ型,水泡性口炎灭活病毒新泽西型(NJ型)和印第安型(IND型),蓝舌病灭活病毒(4型、8型、9型、15型、17型、18型),小反刍兽疫(PPRV)灭活病毒由云南出入境检验检疫局惠赠。4株牛病毒性腹泻病毒(BVDV)参考毒株,2株牛轮状病毒(BRV)参考毒株,1株牛传染性鼻气管炎病毒(IBRV)参考毒株购自中国兽医药品监察所,3株产肠毒大肠杆菌(ETEC),3株牛支原体(MB)广西分离株由广西兽医研究所分离保存。
1.2 主要试剂及仪器LAMP RNA扩增试剂盒,Loopamp LA-320C实时浊度仪购自日本荣研公司;RNA,DNA抽提试剂盒购自北京全式金公司;反转录PCR试剂盒,质粒抽提试剂盒,pGM-T载体购自北京天根公司;T7体外转录试剂盒购自Fermentas公司;NanoDrop 2000核酸测定仪购自美国ThermoFisher Scientific公司;多色荧光成像分析系统购自美国BIO-RAD公司。
1.3 DNA/RNA的提取按全式金RNA抽提试剂盒说明书,抽提FMDV、VSV、BTV、BVDV、BRV、PPRV的RNA,-70 ℃保存;用DNA抽提试剂盒抽提ETEC、MB、IBRV的DNA,-20 ℃保存,备用。
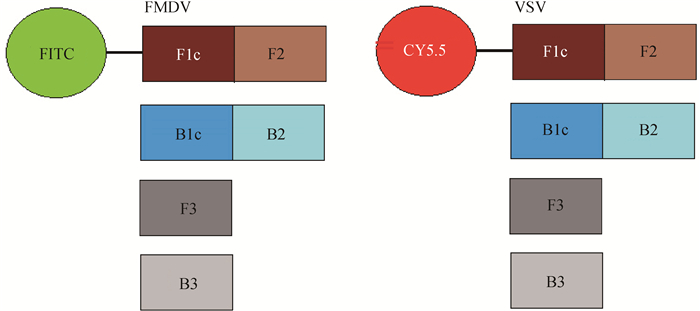
1.4 引物设计根据GenBank中FMDV(O型、A型、Asia Ⅰ型)3D基因和VSV(NJ型和IND型)N基因的保守序列,利用DNAStar MegAlign和PrimerexploreV4软件,设计2套LAMP引物。每套引物各针对6个位点,包括4条引物:外引物F3和B3,内引物FIP(F1c+F2)和BIP(B1c+B2),在每条内引物的5′端标记荧光基团:FMDV FIP引物标记FITC,在520 nm波长下呈黄绿色,VSV FIP引物标记CY5.5,在694 nm波长下呈大红色。所有引物由大连宝生物公司合成,引物示意图见图 1,引物序列见表 1。
|
图 1 二重荧光RT-LAMP引物设计示意图 Figure 1 Schematic diagrams of duplex RT-LAMP primers |
|
|
表 1 二重荧光RT-LAMP引物序列 Table 1 The primer sequences of duplex RT-LAMP |
25 μL反应体系:1 μL RNA模板,2.5 μL 10×buffer [成分为200 mmol·L-1 Tris-HCl(pH8.8),100 mmol·L-1 KCl,80 mmol·L-1 MgSO4,100 mmol·L-1 (NH4)2SO4,1%Tween20,8 mol·L-1 betaine和14 mmol·L-1 dNTPs],酶溶液1 μL(含15 U Bst DNA聚合酶,10 U AMV逆转录酶),内引物各40 pmol·L-1(FMDV-FIP、FMDV-BIP、VSV-FIP和VSV-BIP),外引物各5 pmol·L-1(FMDV-F3、FMDV-B3、VSV-B3和VSV-F3)。各组分混合均匀,置恒温仪或水浴锅62 ℃反应105 min,最后80 ℃作用5 min终止反应。
1.6 二重荧光RT-LAMP结果判定二重荧光RT-LAMP与普通LAMP方法一样,可通过肉眼观察白色沉淀,加染料观察颜色变化,实时浊度仪监测浊度的方法判断扩增结果。此外,可使用2%的琼脂糖凝胶进行电泳(100 V, 40 min),内引物FIP上标记有荧光基团,可在特定的荧光通道下显示不同颜色。FMDV阳性扩增产物在520 nm通道下显示黄绿色,VSV在670 nm通道下显示大红色,且两荧光通道相互独立无干扰,即在520 nm通道下不能观察到VSV的扩增条带,在670 nm通道下不能观察到FMDV的扩增条带,结果独立、准确。
1.7 标准品制备分别用反转录PCR扩增FMDV外引物(FMDV-B3、FMDV-F3)片段186 bp和VSV外引物(VSV-F3、VSV-B3)片段199 bp,用琼脂糖凝胶回收纯化,连入pGM-T载体,筛选阳性重组菌,用质粒试剂盒提取阳性重组菌的质粒。参照T7体外转录试剂盒说明书将DNAs酶切线性化,用DNA酶消除其中DNA的污染,体外转录为RNA,用OD260 nm测定RNA浓度,根据阿弗加德罗常数换为拷贝数:拷贝数(copies·μL-1)=质粒浓度(g·μL-1)×10-9×6.02×1023/660×3 000, 将两种体外转录RNA等量混合,梯度稀释制备标准品,-70 ℃保存备用。
1.8 特异性试验按照所建立的口蹄疫和水泡性口炎二重荧光RT-LAMP方法,检测FMDV(A、O和Asia Ⅰ型)、VSV(NJ型、IND型)、蓝舌病病毒、小反刍兽疫病毒、牛病毒性腹泻病毒、牛轮状病毒的RNA,以及产肠毒大肠杆菌、牛支原体、牛传染性鼻气管炎的DNA,验证二重荧光RT-LAMP方法的特异性。
1.9 敏感性试验将“1.7”制备的FMDV和VSV体外反转录RNA模板等浓度混合并以10倍梯度系列稀释,保证每种模板浓度为1×108~1拷贝·μL-1,作为标准样品,用二重荧光RT-LAMP检测,重复3次。
1.10 干扰性试验将FMDV和VSV标准样品按不同浓度进行组合,制备不同浓度模拟混合感染样品:样品1 FMDV(106拷贝·μL-1)+ VSV(102拷贝·μL-1),样品2 FMDV(107拷贝·μL-1)+ VSV(104拷贝·μL-1),样品3 FMDV(102拷贝·μL-1)+ VSV(106拷贝·μL-1),样品4 FMDV (104拷贝·μL-1)+VSV(107拷贝·μL-1)。用二重荧光RT-LAMP检测,确定高浓度模板是否会抑制低浓度模板的扩增效率。
1.11 临床样品检测10份可疑牛样品(水泡皮和水泡液拭子)采集自广西某地区,均来自口腔出现水泡样溃烂的牛。用二重荧光RT-LAMP对10份可疑牛样品进行检测,并将结果与OIE推荐的方法进行比较,验证本方法的可靠性[7-8]。
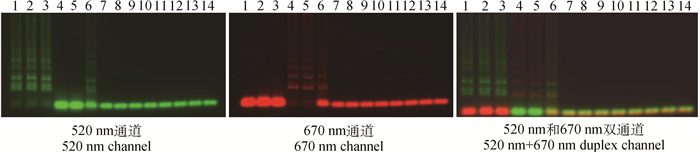
2 结果 2.1 特异性试验特异性试验结果显示,该方法只扩增FMDV和VSV核酸,以及FMDV和VSV混合模板(图 2)。FMDV阳性呈黄绿色,仅在520 nm通道下能看到;VSV阳性呈大红色,仅在670 nm通道下能看到;FMDV和VSV混合模板呈红绿混合色,且在520 nm和670 nm通道下都能观察到。而对其他牛病毒和阴性对照均无扩增,部分电泳结果见图 2,全部特异性试验结果见表 2,可见该方法特异性好。
|
1. FMDV A型;2. FMDV O型;3. FMDV Asia Ⅰ型;4. VSV NJ型;5. VSV IND型;6. FMDV A型和VSV NJ型;7~13. BTV 4型、PPRV、BVDV、BRV、IBRV、MB、ETEC;14.阴性对照 1. FMDV A; 2. FMDV O; 3. FMDV Asia Ⅰ; 4. VSV NJ; 5. VSV IND; 6. FMDV A and VSV NJ; 7-13. BTV 4, PPRV, BVDV, BRV, IBRV, MB, ETEC, respectively; 14. Negative control 图 2 二重荧光RT-LAMP特异性试验电泳结果 Figure 2 Agarose-gel electrophoresis of specificity results of the duplex RT-LAMP for FMDV and VSV |
|
|
表 2 二重荧光RT-LAMP特异性试验结果 Table 2 Specificity results of the duplex RT-LAMP for FMDV and VSV |
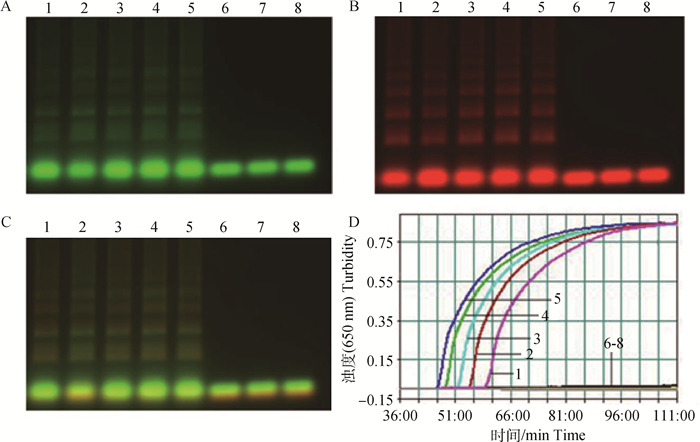
用建立的二重荧光RT-LAMP检测FMDV和VSV混合RNA标准品, 结果表明二重荧光RT-LAMP灵敏度可达100个拷贝混合模板·反应-1,结果见图 3,A、B、C是电泳图,D是实时浊度仪loopamLA-320C监测副产物焦磷酸镁曲线图,可见该方法灵敏性高。
|
1~7. 106~100拷贝·μL-1 (FMDV和VSV体外转录RNA混合模板标准品);8.阴性对照;A.520 nm通道下电泳图; B.670 nm通道图; C.520 nm和670 nm双通道下电泳图; D.实时浊度仪650 nm监测副产物焦磷酸镁曲线图 1-7. 106-1 copies·μL-1(standards of equivalent reverse transcript ssRNA containing target sequences); 8. Negative control. A. 520 nm channel; B. 670 nm channel; C. 520 nm+670 nm duplex channel; D. By-products of magnesium pyrophosphate monitored by real-time turbidimeter (turbidity at 650 nm) 图 3 二重荧光RT-LAMP敏感性试验结果 Figure 3 Sensitivity results of the duplex RT-LAMP for FMDV and VSV |
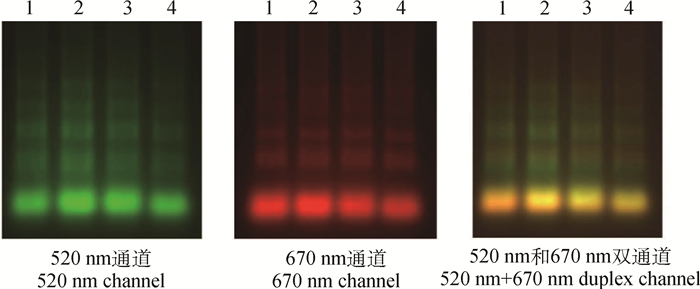
对不同浓度模拟混合感染样品的检测发现,当一个模板浓度高而另一个模板浓度较低时,二重荧光RT-LAMP仍然可同时检测到两个模板(图 4),不影响彼此扩增效率,干扰性小。
|
1. FMDV(106拷贝·μL-1)+ VSV(102拷贝·μL-1);2. FMDV(107拷贝·μL-1)+ VSV(104拷贝·μL-1);3. FMDV(102拷贝·μL-1)+ VSV(106拷贝·μL-1);4. FMDV (104拷贝·μL-1)+ VSV(107拷贝·μL-1) 1. FMDV (106 copies·μL-1)+ VSV (102 copies·μL-1); 2. FMDV(107copies·μL-1)+ VSV(104copies·μL-1); 3. FMDV(102copies·μL-1)+ VSV(106copies·μL-1); 4. FMDV (104copies·μL-1)+ VSV(107copies·μL-1) 图 4 二重RT-LAMP检测方法干扰性试验结果 Figure 4 Interference results of the duplex RT-LAMP for FMDV and VSV |
对10份可疑牛样品进行检测,二重荧光RT-LAMP和OIE推荐引物同时检测到7份FMDV阳性样品,3份FMDV阴性样品,0份VSV阳性样品(图 5)。该二重荧光RT-LAMP方法与OIE推荐方法检测符合率100%,临床效果好。
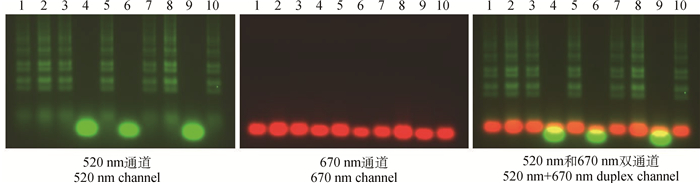
|
1、2、3、5、7、8、10. FMDV阳性样品;4、6、9.阴性样品 1, 2, 3, 5, 7, 8, 10. FMDV positive samples; 4, 6, 9. Negative samples 图 5 临床样品检测结果 Figure 5 The results of clinical detection |
LAMP是2000年T.Notomi等[9]开发出的一种新型核酸扩增方法,它恒温扩增,操作简便,反应快速,成本低,已广泛应用在疾病诊断和基因筛选上[11-12]。但由于LAMP最终结果的判定中,电泳全部是梯状条带,与PCR特异性目的条带不同,沉淀物观察、肉眼观察颜色变化、紫外观察颜色变化,LAMP检测无论是单重还是多重,阳性结果反映出来的结果都是一样,不能确定具体到底是哪一种病原所引起的阳性结果,所以进行多重区分比较困难[13-14]。
目前国内已有许多多重LAMP检测方法的报道,但都有各自局限性,不能很好地应用于临床检测。这些多重LAMP主要分为三种技术路线:①将多套LAMP引物放入同一反应管反应,只能检测样品是否为阳性,但不能区分具体是何种病原感染,检测结果不明确[15-18]。②仅借助LAMP的反应体系和反应条件,但仍依赖荧光定量PCR仪进行反应,在反应后使用熔解曲线分析扩增产物,通过熔解曲线峰出现的范围不同判断病原,对仪器设备要求高,耗时长[19-23]。③对LAMP扩增产物进行限制性内切酶酶切,电泳检测酶切产物,观察目的片段大小的方法来进行进一步的判断病原,方法步骤复杂,污染大,耗时长[24-25]。本研究采取的是一种新的技术路线,首次借助荧光基团,通过荧光基团所显示颜色的不同判断结果,能准确判断病原[26]。其优点如下,①继承了LAMP的优点:反应条件要求低,仅需一台水浴锅即可完成;反应时间短,全程110 min即可,避免传统PCR中反复升温降温所需在时间消耗;灵敏性好,多条引物同时扩增,扩增效率高,更灵敏;②有效抑制假阳性结果:由于荧光基团镶嵌在内引物FIP上,扩增过程中比普通引物更需要消耗能量,引物与模板DNA分子碰撞要求高,可以有效抑制假阳性;③结果准确:本研究使用了两种新型荧光基团,FITC和CY5.5, 这两种荧光基团的激发光和吸收光均不同,因此可呈现不同的颜色,FITC吸收波为520 nm,呈黄绿色,CY5.5吸收波为694 nm(但本研究在670 nm通道下观察,依然准确,不影响结果判断),呈大红色。不同的荧光基团,仅能在特定的通道下观察到,即在520 nm通道下只能观察到FITC显色,无法观察到CY5.5显色。比仅凭沉淀物观察、加染料肉眼观察颜色变化等方式更准确,是第一次实现了真正意义上的二重LAMP鉴别检测。
本研究旨在鉴别检测FMDV和VSV,若临床使用中只要求检测阳性不合格样品不需要区分这两种病毒,可以使用加染料后,凭肉眼观察颜色变化的方法判断结果。在染料中,我们推荐使用钙黄绿素为指示剂,钙黄绿素原理:反应前钙黄绿素与氯化锰离子结合处于猝灭状态,LAMP反应的副产物焦磷酸离子与锰离子结合释放钙黄绿素,猝灭状态解除,发出黄绿色光。钙黄绿素、锰离子的浓度及两者的比例对显色效果影响较大,本研究经试验推荐将300 μmol·L-1氯化锰与25 μmol·L-1钙黄绿素按1:10混匀作荧光染料工作液,每个反应取1 μL荧光染料工作液与反应试剂一起反应,避免开盖污染。由于LAMP反应产物是长度不等的DNA片段,呈现大量梯状条带,Marker对这些片段的指示无意义,考虑成本原因,二重RT-LAMP电泳时不需要使用Marker。
4 结论设计了多套引物,优化筛选特异性引物组合,最终成功建立了在同一反应管鉴别口蹄疫病毒和水泡性口炎病毒的二重荧光RT-LAMP检测方法。二重荧光RT-LAMP方法特异性好,能高效扩增目的基因,而对其他病原核酸无扩增,敏感性好,最低能检测到100个混合模板拷贝·反应-1。建立的FDMV和VSV二重荧光RT-LAMP方法是一种简便,快速,低成本的诊断方法,适用于大规模的流行病学调查。
| [1] | DIVERS T J, PEEK S F. Rebhun's diseases of dairy cattle[M]. 2nd ed. Beijing: China Agricultural University Press, 2009. |
| [2] | BRITO B P, RODRIGUEZ L L, HAMMOND J M, et al. Review of the global distribution of Foot-and-Mouth disease virus from 2007 to 2014[J]. Transbound Emerg Dis, 2017, 64(2): 316–332. DOI: 10.1111/tbed.2017.64.issue-2 |
| [3] | MEYER R F, KNUDSEN R C. Foot-and-mouth disease:A review of the virus and the symptoms[J]. J Environ Health, 2001, 64(4): 21–23. |
| [4] | WERNERY U, KINNE J. Foot and mouth disease and similar virus infections in camelids:A review[J]. Rev Sci Tech, 2012, 31(3): 907–918. DOI: 10.20506/rst.issue.31.3.51 |
| [5] | FERNÁNDEZ J, AGVERO M, ROMERO L, et al. Rapid and differential diagnosis of Foot-and-Mouth disease, swine vesicular disease, and vesicular stomatitis by a new multiplex RT-PCR assay[J]. J Virol Methods, 2008, 147(2): 301–311. DOI: 10.1016/j.jviromet.2007.09.010 |
| [6] |
王永连, 徐立波. 牛水疱性口炎的流行、诊断和防控措施[J]. 饲料博览, 2017(4): 66–67.
WANG Y L, XU L B. Epidemic, diagnosis and control measures of bull vesicular stomatitis[J]. Feed Review, 2017(4): 66–67. (in Chinese) |
| [7] | OIE. NB: Foot and mouth disease[M/OL]//OIE Terrestrial Manual, 2012: 145-173. |
| [8] | OIE. NB: Vesicular stomatitis[M/OL]//OIE Terrestrial Manual, 2015: 1-14. |
| [9] | NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63. DOI: 10.1093/nar/28.12.e63 |
| [10] | JIANG Y S, BHADRA S, LI B L, et al. Robust strand exchange reactions for the sequence-specific, real-time detection of nucleic acid amplicons[J]. Anal Chem, 2015, 87(6): 3314–3320. DOI: 10.1021/ac504387c |
| [11] | FAN Q, XIE Z X, XIE L J, et al. A reverse transcription loop-mediated isothermal amplification method for rapid detection of bovine viral diarrhea virus[J]. J Virol Methods, 2012, 186(1-2): 43–48. DOI: 10.1016/j.jviromet.2012.08.007 |
| [12] |
庞耀珊, 谢芝勋, 谢丽基, 等. 对虾白斑综合征病毒可视化环介导等温扩增(LAMP)检测技术的建立与应用[J]. 农业生物技术学报, 2013, 21(8): 1002–1008.
PANG Y S, XIE Z X, XIE L J, et al. Development and application of visual loop mediated isothermal amplification (LAMP) assay for shrimp (Penacus orientalis) White spot syndrome virus[J]. Journal of Agricultural Biotechnology, 2013, 21(8): 1002–1008. (in Chinese) |
| [13] | ZHAO Y X, CHEN F, LI Q, et al. Isothermal amplification of nucleic acids[J]. Chem Rev, 2015, 115(22): 12491–12545. DOI: 10.1021/acs.chemrev.5b00428 |
| [14] |
林文慧, 邹秉杰, 宋沁馨, 等. 多重环介导等温扩增技术研究进展[J]. 遗传, 2015, 37(9): 899–910.
LIN W H, ZOU B J, SONG Q X, et al. Progress in multiplex loop-mediated isothermal amplification technology[J]. Hereditas (Beijing), 2015, 37(9): 899–910. (in Chinese) |
| [15] |
赵军, 陈泽平, 李桢, 等. 二重LAMP检测鸡蛋污染致病菌[J]. 食品工业科技, 2016, 37(4): 107–110, 116.
ZHAO J, CHEN Z P, LI Z, et al. Multiplex LAMP method for the detection of pathogenic bacteria in eggs[J]. Science and Technology of Food Industry, 2016, 37(4): 107–110, 116. (in Chinese) |
| [16] |
刘宁伟, 邹大阳, 董德荣, 等. 多重环介导等温扩增快速检测沙门菌、副溶血弧菌和单核细胞增生性李斯特菌方法的建立[J]. 军事医学, 2016, 40(9): 767–772.
LIU N W, ZOU D Y, DONG D R, et al. Development of multiplex loop-mediated isothermal amplification (mLAMP) for detection ofSalmonella, Vibrio parahaemolyticus and Listeria monocytogenes[J]. Military Medical Sciences, 2016, 40(9): 767–772. (in Chinese) |
| [17] |
陈兵, 孙洁, 陈书琨, 等. 三种家禽病毒多重RT-LAMP检测方法的建立与应用[J]. 上海畜牧兽医通讯, 2016(1): 2–5.
CHEN B, SUN J, CHEN S K, et al. The development of duplex RT-LAMP assay for detection three poultry viruses[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2016(1): 2–5. (in Chinese) |
| [18] | YAMAZAKI W, MIOULET V, MURRAY L, et al. Development and evaluation of multiplex RT-LAMP assays for rapid and sensitive detection of foot-and-mouth disease virus[J]. J Virol Methods, 2013, 192(1-2): 18–24. DOI: 10.1016/j.jviromet.2013.03.018 |
| [19] |
姜侃, 张水峰, 张慧, 等. 两种致病性弧菌二重LAMP-熔解曲线检测方法的建立[J]. 现代食品科技, 2016, 32(10): 246–251.
JIANG K, ZHANG S F, ZHANG H, et al. Development of a multiplex LAMP-dissociation curve method for the detection of two pathogenicvibrio species[J]. Modern Food Science and Technology, 2016, 32(10): 246–251. (in Chinese) |
| [20] | KOUGUCHI Y, FUJIWARA T, TERAMOTO M, et al. Homogenous, real-time duplex loop-mediated isothermal amplification using a single fluorophore-labeled primer and an intercalator dye:Its application to the simultaneous detection of Shiga toxin genes 1 and 2 in Shiga toxigenic Escherichia coli isolates[J]. Mol Cell Probes, 2010, 24(4): 190–195. DOI: 10.1016/j.mcp.2010.03.001 |
| [21] | MAHONY J, CHONG S, BULIR D, et al. Multiplex loop-mediated isothermal amplification (M-LAMP) assay for the detection of influenza A/H1, A/H3 and influenza B can provide a specimen-to-result diagnosis in 40 min with single genome copy sensitivity[J]. J Clin Virol, 2013, 58(1): 127–131. DOI: 10.1016/j.jcv.2013.06.006 |
| [22] | NURUL NAJIAN A B, ENGKU NUR SYAFIRAH E A, ISMAIL N, et al. Development of multiplex loop mediated isothermal amplification (m-LAMP) label-based gold nanoparticles lateral flow dipstick biosensor for detection of pathogenic Leptospira[J]. Anal Chim Acta, 2016, 903: 142–148. DOI: 10.1016/j.aca.2015.11.015 |
| [23] | KUBOTA R, JENKINS D M. Real-time duplex applications of loop-mediated amplification (LAMP) by assimilating probes[J]. Int J Mol Sci, 2015, 16(3): 4786–4799. DOI: 10.3390/ijms16034786 |
| [24] |
王彩霞, 冯春燕, 王巧黎, 等. 同时检测贝类派琴虫和包纳米虫的双重LAMP方法的建立[J]. 中国畜牧兽医, 2015, 42(8): 1935–1942.
WANG C X, FENG C Y, WANG Q L, et al. Establishment of duplex loop-mediated isothermal amplification method for simultaneous detection of shellfish infected withPerkinsus and Bonamia[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(8): 1935–1942. (in Chinese) |
| [25] | ISEKI H, ALHASSAN A, OHTA N. Development of a multiplex loop-mediated isothermal amplification (mLAMP) method for the simultaneous detection of bovineBabesia parasites[J]. J Microbiol Methods, 2007, 71(3): 281–287. DOI: 10.1016/j.mimet.2007.09.019 |
| [26] | AONUMA H, YOSHIMURA A, KOBAYASHI T, et al. A single fluorescence-based LAMP reaction for identifying multiple parasites in mosquitoes[J]. Exp Parasitol, 2010, 25(1): 179–183. |



