2. 江苏省种猪繁育和健康养殖工程技术研究中心, 扬州 225009
2. Jiangsu Engineering Research Center for the Reproduction and Healthy Breeding of Boar, Yangzhou 225009, China
Toll样受体(Toll-like receptors, TLRs)是机体对病原体侵袭产生先天性免疫应答信号通路的一类受体,在宿主免疫反应及炎症过程中起重要作用[1-2]。TLR5属于TLRs家族成员,具有模式识别受体的功能,同时它也是机体识别革兰氏阴性菌鞭毛蛋白的受体,可以介导机体针对病原菌的先天性免疫及炎症反应[3-5]。KEGG数据库(http://www.genome.jp/kegg/pathway.html)显示,TLR5主要参与了髓样分化因子88(Myeloid differentiation factor 88, MyD88)介导的Toll-like信号通路(Toll-like receptor signaling pathway)以及炎症性肠病信号通路(Inflammatory bowel disease, IBD)、致病性大肠杆菌感染信号通路(Pathogenic Escherichia coli infection)、沙门氏菌感染信号通路(Salmonella infection)和军团菌病信号通路(Legionellosis)。猪的TLR5基因全长22 359 bp,开放阅读区(ORF)长2 571 bp,编码的蛋白包括胞外区(LRR结构域)、跨膜区和胞内区(TIR结构域),具有典型的TLR家族结构特征[6]。猪TLR5分子在肾、肝、肺、小肠、脾和胸腺等组织均有表达[6],并且具有较好的免疫反应性[7]。有研究表明,猪TLR5分子可识别猪霍乱沙门氏菌等细菌的鞭毛蛋白[8-9],并且TLR5基因的特异单倍型与猪丹毒抗体免疫应答有关[10]。M.A.Dominguez等[11]通过扫描猪TLR5基因的启动子序列,鉴定了启动子序列中7个单核苷酸多态性和两个Indel变异,其中一个Indel由在—581~—559处核苷酸位置的23 bp插入组成,产生另外的STAT结合位点,从而调控TLR5的表达。本课题组前期对中国地方猪品种梅山猪F18大肠杆菌抗性型和敏感型断奶仔猪十二指肠进行转录组测序分析,筛选并初步确定TLRs信号通路可对断奶仔猪大肠杆菌抗性具有重要调控作用[12]。上述研究表明,猪TLR5基因在针对外源抗原的固有免疫应答中确实发挥了重要的调控作用。同时其作为Toll-like家族一员不仅本身在菌毛蛋白识别中具有重要作用,而且在断奶仔猪大肠杆菌抗性调控中也发挥重要功能。
在真核生物中,DNA甲基化是一种重要的表观遗传修饰形式,它通过影响染色质的结构、DNA的构象、染色体的稳定性以及DNA和蛋白质的相互作用而调节基因表达,最终影响生物学功能[13]。已有研究表明,DNA甲基化在植物抗逆性以及动物的抗病性等方面发挥了重要作用[14-16]。鉴于猪TLR5基因重要的生物学功能,本研究利用生物信息学分析和双荧光素酶报告系统检测确定TLR5基因核心启动子区、CpG岛及其作用元件,进而分析TLR5基因核心启动子区甲基化修饰与断奶仔猪对F18大肠杆菌抗性的关系,以期为揭示TLR5基因调控断奶仔猪大肠杆菌抗性的分子机制提供一定的理论基础。
1 材料与方法 1.1 试验动物试验猪来自于课题组前期建立的苏太猪F18大肠杆菌病抗性型和敏感型资源群体,在3个苏太猪抗性型和敏感型资源家系中根据课题组建立的V型分泌系统展呈功能性黏附素和受体结合试验技术[17],筛选出确证的抗性型和敏感型个体各3头(在相同环境下饲养,初生重、断奶重、体形和毛色等性状基本一致)。在仔猪断奶前后,也是最易感染E. coli F18而表现出腹泻症状的35日龄阶段,屠宰后采集十二指肠和空肠组织样,现场液氮保存,然后转移至—70 ℃冰箱保存备用。
1.2 主要试验试剂胎牛血清FBS、培养液DMEM/F12(DF)、胰酶Trypsin-EDTA Solution、细胞培养皿和培养板均购自Gibco公司(美国);RNA提取试剂Trizol购自Invitrogen公司(美国);反转录试剂盒和荧光定量试剂盒购自南京诺唯赞生物科技有限公司(中国,南京);总蛋白提取试剂盒和BCA蛋白检测试剂盒购自南京凯源科技发展有限公司(中国南京);兔源一抗TLR5(1:400)和β-actin(1:4 000)购自Abcam(Cambridge,UK);抗兔二抗(IgG-HRP,1:3 000)购自Jackson(PA,USA)。猪小肠上皮细胞系(IPEC-J2)由美国宾夕法尼亚大学惠赠;BW23473感受态细胞购自成都传世科为生物技术有限公司;pCpGL-basic载体由中国农业大学友情提供;双荧光素酶报告基因检测试剂盒购自美国Promega公司;EpiTect Fast DNA Bisulfite Kit试剂盒和PyroMark系列试剂盒均购自德国QIAGEN公司;切胶回收试剂盒、无内毒素质粒抽提试剂盒购自天根生物技术有限公司(北京,中国)。
1.3 引物设计及序列合成根据TLR5基因编码序列(GenBank登录号:AB208697.2)设计TLR5基因qPCR引物,以GAPDH为内参对目的基因的表达进行均一化。同时设计TLR5基因编码序列和启动子区的PCR扩增引物,确定核心启动子区的截短型引物以及进行甲基化检测的BSP引物。引物的具体信息见表 1,所有引物由上海生工生物工程技术服务有限公司合成。
|
|
表 1 扩增序列引物信息 Table 1 The primer information of amplification sequences |
严格按照说明书,使用Trizol试剂提取F18大肠杆菌抗性型和敏感型苏太断奶仔猪十二指肠和空肠组织的总RNA。并以1%甲醛变性凝胶电泳和NanoDrop-1000微量核酸测定仪检测总RNA的纯度和浓度,-70 ℃保存待用。以RNA为模板进行cDNA合成:10 μL的反应体系中含5×qRT SuperMix Ⅱ 2 μL,总RNA 500 ng,RNase free ddH2O补足至10 μL。反应条件:25 ℃ 10 min,50 ℃ 30 min,85 ℃ 5 min,4 ℃保存。
1.4.2 实时荧光定量PCR实时荧光定量PCR反应体系:模板cDNA 2.0 μL,上下游引物(10 μmol·L-1)各0.4 μL,2 × SYBR Premix ExTapTM Ⅱ 10 μL,50 × ROX Reference Dye Ⅱ 0.4 μL,RNase free ddH2O补至20 μL,每个样本设置3个重复。扩增程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,共40个循环;为了分析扩增产物的特异性,在PCR扩增结束后采集多个信息点,进行熔解曲线的分析,具体程序:95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s。利用2-ΔΔCt方法计算相对表达量[18]。
1.4.3 Western blot分析严格按照说明书,使用总蛋白提取试剂盒提取组织总蛋白,使用BCA试剂盒标准化蛋白质水平,SDS-PAGE(聚丙烯酰胺电泳)条件:10 μL蛋白样品液上样至10%浓度凝胶,120 V电压电泳90 min。Blotting(蛋白印记):蛋白转移到PVDF膜(聚丙烯二氟乙烯膜),与相关抗体进行免疫印迹,按约0.1 m·cm-2的量加入封闭液和适量一抗TLR5(1:400)和β-actin抗体(1:4 000)。HRP抗体作为二抗(辣根过氧化酶标记抗体,二抗用封闭液1:3 000稀释),β-actin蛋白作为参照。
1.5 TLR5启动子区确定和作用元件分析首先根据TLR5基因组序列(GenBank登录号:NC_010452.4)截取转录起始位点上游2 000 bp序列作为模板,通过设计截短型引物(表 1)在3′末端对序列进行截短以扩增不同区段的启动子片段。将PCR扩增产物进行电泳检测,条带正确的送测序验证。对确证的6对不同引物的PCR产物进行回收纯化,然后和pCpGL-basic载体进行双酶切(Spe Ⅰ与Nco Ⅰ)。酶切体系:PCR产物/载体1.0 μg,10×Cutsmart buffer 5.0 μL,Spe Ⅰ 1.0 μL,Nco Ⅰ 1.0 μL,ddH2O补至50 μL。37 ℃酶切4 h,利用PCR回收试剂盒纯化酶切产物,通过T4连接酶进行连接反应,反应条件为16 ℃过夜,连接产物转化感受态细胞BW23473,用无抗生素的低盐LB培养液220 r·min-1复苏培养1 h,涂布含博来霉素的抗性平板,37 ℃培养过夜。挑取单克隆摇菌5 h,进行菌液PCR,将电泳条带正确的菌液进行双向测序,测序载体上游引物5′→3′F:CTCTTTGTTCAGCTCTCTGTTT。下游引物为相应PCR扩增的下游引物,对确证的重组菌液进行纯化培养和质粒抽提,分别命名为—2 000 bp-pCpGL、—1 500 bp-pCpGL、—1 000 bp-pCpGL、—750 bp-pCpGL、-500 bp-pCpGL、—250 bp-pCpGL和—100 bp-pCpGL。
IPEC-J2细胞用含10%胎牛血清的DF培养液培养在12孔板中,培养条件为含5% CO2的37 ℃恒温培养箱,待生长至80%密度,将7种重组载体分别和海肾荧光素酶TLK载体共转染细胞,48 h后进行双荧光素酶检测,操作步骤严格按照试剂盒说明书进行。对双荧光素酶活性有显著差异的区段,通过BDGP软件(http://www.fruitfly.org/seq_tools/promoter.html)预测TLR5基因启动子区的核心启动子区,利用Alibaba2软件(http://gene-regulation.com/pub/programs/alibaba2/index.html)对猪TLR5基因核心启动子区进行转录因子结合域的分析。
1.6 TLR5启动子区CpG岛甲基化和mRNA相关性分析利用MethPrimer软件(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)预测分析猪TLR5基因启动子区的CpG岛,预测总片段为1 000 bp,预测参数设定:CpG岛指序列长度至少100 bp,GC含量大于50%,CpGo/e大于0.6。为了检测TLR5基因启动子区甲基化水平及其与mRNA表达相关性,以苏太抗性型和敏感型个体空肠组织DNA为试验材料,先利用EpiTect Fast DNA Bisulfite Kit试剂盒对基因组进行亚硫酸盐转化,然后利用MethPrimer软件,基于原序列经亚硫酸盐转化后的序列,设计PCR引物,利用PyroMark PCR Kit试剂盒进行PCR扩增,总体系为25 μL:PyroMark PCR Master Mix 2 × 12.5 μL,CoraLoad Concentrate 10 × 2.5 μL,MgCl2(25 mmol·L-1) 2 μL,Q-solution 5 × 5 μL,Primer F/R各0.5 μL,亚硫酸盐转化后的DNA液2 μL。PCR反应程序:95 ℃预变性15 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共循环45次;最后72 ℃ 10 min。用1%的琼脂糖凝胶鉴定PCR扩增产物后用切胶回收试剂盒回收目的片段,纯化后与T载体连接、转化,每个样本挑取20个阳性克隆菌液送上海生工生物有限公司测序。将经甲基化引物扩增的序列和原始DNA序列以及转化序列比对,找出发生甲基化的CG位点。分别以单个位点甲基化程度与mRNA表达进行相关性分析,利用GraphPad Prism 6绘制关联图谱。
1.7 统计分析使用2-ΔΔCt方法计算基因表达的相对水平,并用内参基因GAPDH来标准化基因表达水平[18]。用SPSS 16.0软件提供的独立样本t检验分析TLR5基因在抗性型和敏感型个体中的表达差异,用单因素方差分析方法(ANOVA)分析启动子区不同区段双荧光素酶的活性差异。每个处理设计3个重复,结果用“平均数±标准差(x±SD)”表示。
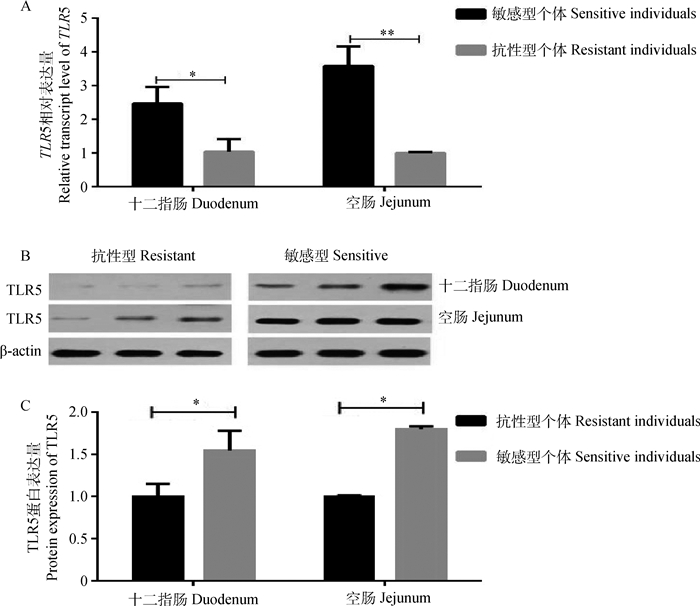
2 结果 2.1 TLR5在苏太仔猪不同E.coli F18抗性个体小肠组织中的表达差异分析利用qPCR检测了TLR5基因在苏太断奶仔猪抗性组与敏感组肠道组织中的表达情况,结果发现,十二指肠中敏感组个体TLR5基因的mRNA表达水平显著高于抗性组(P < 0.05),在空肠组织中敏感组极显著高于抗性组(P < 0.01)(图 1A);Western blot结果表明,敏感组中的TLR5蛋白表达水平也明显高于抗性组(图 1B),通过Image J对蛋白条带灰度面积进行统计,以TLR5蛋白与内参β-actin的比值作为灰度值,并把抗性个体灰度值的平均值定义为单位1,对蛋白进行相对定量分析,发现十二指肠和空肠中敏感组个体TLR5基因的蛋白表达水平均显著高于抗性组(P < 0.05)(图 1C)。
|
A. mRNA表达水平;B.蛋白免疫印迹;C.蛋白相对表达水平。*. P < 0.05,**. P < 0.01,下同 A.The mRNA expression level; B.Western blot; C. The relative protein expression. *. P < 0.05, **. P < 0.01, the same as below 图 1 苏太猪肠道组织中TLR5基因(蛋白)在抗性组和敏感组中的表达 Figure 1 The expression of TLR5 gene (protein) in intestinal tissues of E. coli F18-resistant and sensitive Sutai piglets |
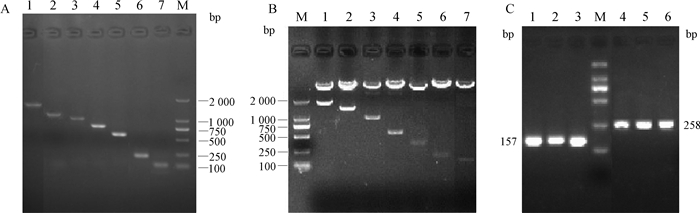
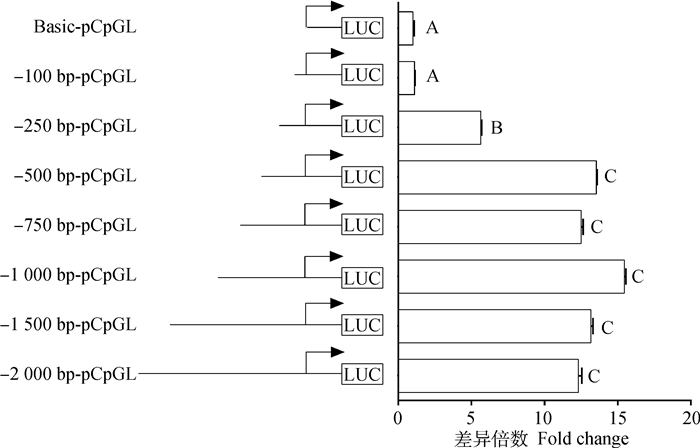
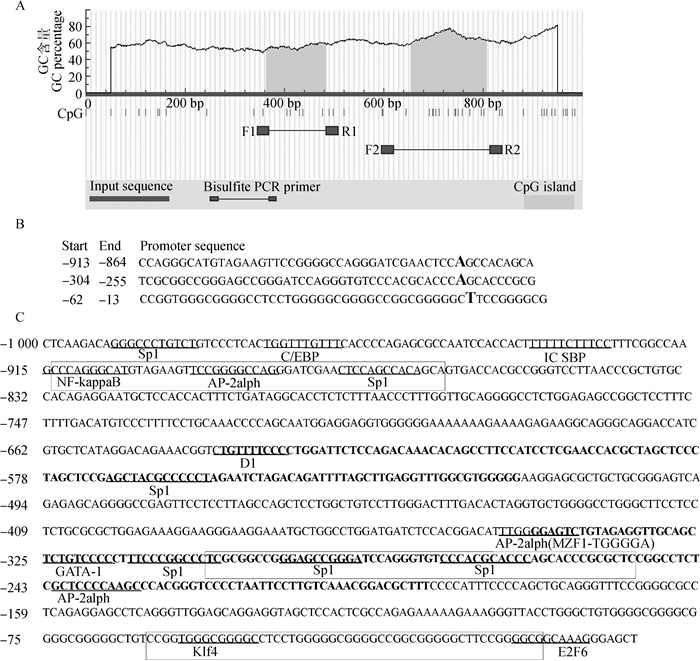
本研究首先结合双荧光素酶报告系统和核心启动子预测软件确定TLR5基因的启动子区和启动子区CpG岛以及作用元件。启动子扩增和甲基化扩增结果见图 2,启动子区所有截短型引物均扩增正确,重组载体酶切正确,2个CpG区段扩增正确。荧光素酶活性检测结果见图 3,启动子-2 000 bp区段启动子活性极显著高于对照组,且-1 000 bp处活性增加,但差异不显著;而-500~-250 bp和-250~-100 bp处,启动子活性显著降低,说明-500~-250 bp和-250~-100 bp区域内均存在调控元件,对转录影响很大,因此重点关注-1 000 bp区段的启动子区域。在线软件预测了3段TLR5基因的核心启动子区,分别位于转录起始位点上游13~62 bp、上游255~304 bp和上游864~913 bp,包含2个CpG岛,16个作用元件(图 4)。
|
A.截短型引物扩增的结果;B.重组质粒酶切结果;C.甲基化引物扩增结果,其中1~3代表CpG1,4~6代表CpG2。M. DNA相对分子质量标准 A.The amplification result of promoter fragments; B. The digestion result of recombinant plasmid; C.Amplification results of methylation primers, in which 1-3 represent amplification of CpG1, 4-6 represent amplification of CpG2. M. DL2000 marker 图 2 启动子和甲基化扩增结果 Figure 2 Amplification results of promoter and methylation sequences |
|
以萤火虫荧光素酶Rn活性/海肾素荧光素酶Ff活性的值作为荧光素酶活性。其中横坐标代表启动子区荧光素酶活性相对于对照质粒Basic-pCpGL的差异倍数,纵坐标代表不同截短的区段对应的质粒,不同大写字母表示差异极显著(P < 0.01) The luciferase activity was calculated as the ratio of the activity of firefly luciferase (Rn)/the activity of perineurin luciferase (Ff). The abscissa represents fold change in the luciferase activity of the promoter region compared to the control plasmid Basic-pCpGL. The ordinate represents the plasmids corresponding to the different truncated segments. Different capital letters indicate very significant differences (P < 0.01) 图 3 TLR5基因启动子区不同区段双荧光素酶活性检测 Figure 3 Detection of dual luciferase activity in different regions of TLR5 gene promoter region |
|
A.转录起始位点上游1 000 bp处的CpG岛预测;B.基于BDGP软件的核心启动子区预测;C.启动子区作用元件分析,其中带框碱基代表核心启动子区,加粗碱基代表CpG岛,下划线代表作用元件结合位点 A. CpG island prediction at 1 000 bp upstream of the transcription start site; B.Prediction of the core promoter region based on BDGP software; C. The analysis of acting elements in promoter region, in which the bases with box represent the core promoter region, bold bases represent CpG island sequences and the underlined bases represent the binding sites of acting elements 图 4 TLR5基因核心启动子区和CpG岛预测以及作用元件分析 Figure 4 Prediction of TLR5 gene core promoter region and CpG island and analysis of acting elements |
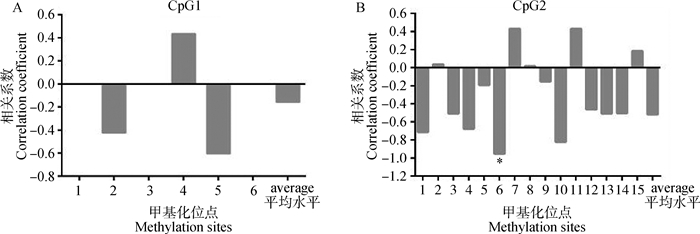
在确定TLR5基因的核心启动子区域和作用元件后,通过对图 4C所在的启动子区CpG岛甲基化分析发现,CpG1共有6个CG位点,但是发生甲基化的位点只有3个,并且各位点的甲基化与mRNA表达量并无显著相关;CpG2总共有15个CG位点,各位点均发生了不同程度的甲基化,并且第6个CG位点的甲基化与mRNA表达有显著负相关(P < 0.05)(图 5和图 6),且该位点位于核心启动子区Sp1转录因子结合位点上。

|
图 5 TLR5基因启动子区CpG岛甲基化程度分析 Figure 5 The methylation analysis of CpG islands in TLR5 gene promoter region |
|
图 6 TLR5基因启动子区CpG岛甲基化程度与mRNA表达的相关性分析 Figure 6 The correlation analysis between methylation degree of CpG islands in TLR5 gene promoter region and mRNA expression |
研究表明,Toll样受体TLRs家族能够识别保守的微生物结构(如细菌脂多糖)并激活信号通路,从而导致由微生物感染引起的免疫应答[19]。TLRs能够感应肠道中的微生物群体,并启动促炎信号通路来抵抗微生物病原体的入侵[20]。与人源类似,猪源TLRs信号通路也主要分为4种:MyD88依赖通路、TICAM1依赖通路、小GTP酶通路和磷脂酰肌醇(PIPs)通路[21-24]。所有的TLRs均包含TIR结构域,MyD88的TIR结构域都可与之结合;MyD88依赖通路是除TLR3外所有TLRs的共同通路,因此TLR5信号通路属于MyD88依赖通路,它可以最终激活核因子-κB(Nuclear factor-κB, NF-κB),导致许多目的基因表达上调[25]。本课题组前期对中国地方猪品种梅山断奶仔猪E. coli F18抗性型和敏感型全同胞个体十二指肠组织进行了转录组学分析,并最终筛选出重要的免疫通路——TLRs信号通路可能与断奶仔猪大肠杆菌抗性有关[12]。在本研究中,我们检测了苏太猪F18大肠杆菌抗性型和敏感型个体小肠组织中TLR5基因的表达水平,发现TLR5基因在苏太断奶仔猪F18大肠杆菌抗性型十二指肠组织中的表达显著低于在敏感型中的表达(P < 0.05),其在抗性型空肠组织中的表达极显著低于在敏感型中的表达(P < 0.01),说明TLR5基因的表达水平确实和大肠杆菌的抗性有关,并且进一步推断其低表达可能有利于断奶仔猪抵抗大肠杆菌侵染。本试验结果与TLR5作为细菌受体的生物学功能是一致的,其作为Toll-like家族一员不仅本身在菌毛蛋白识别中具有重要作用,并且在断奶仔猪大肠杆菌抗性调控中也发挥着重要功能。至于TLR5基因的表达是通过什么途径来调控大肠杆菌抗性的,有必要对TLR5基因调控大肠杆菌的分子机制进行进一步分析。
基因表达调控的方式有很多种,其中启动子区DNA甲基化是调节基因功能的重要手段。Z.Z.Xiao等[26]对猪LYN基因启动子区甲基化状态及基因表达水平进行了分析,结果显示,甲基化对猪LYN基因的转录起着重要作用。L.Sun等[27]证实了猪BPI启动子区mC-15位点的甲基化可以抑制C/EBPβ与启动子结合的能力,并影响其表达。因此,我们对TLR5基因启动子开展了一系列研究。我们首先根据双荧光素酶活性检测和软件预测了TLR5基因的核心启动子区和CpG岛,利用BSP克隆测序分析了启动子区的2个CpG岛各位点的甲基化程度,并与mRNA表达水平进行相关性分析,发现启动子区第2个CpG岛第6个CG位点甲基化水平对TLR5基因的表达具有一定的调控作用。而这个CG位点位于转录因子Sp1结合域,因此我们推测TLR5基因启动子区第2个CpG岛第6个CG位点甲基化阻碍了转录因子Sp1的结合,从而抑制TLR5基因的表达,并最终影响大肠杆菌的抗性。本研究结果表明,TLR5基因启动子区存在调控TLR5基因表达的CpG岛(第2个CpG岛),其中存在转录调控元件(SP1)结合的重要CG位点(mC-6)。我们推测,当仔猪受到F18大肠杆菌侵袭时,TLR5基因启动子区第2个CpG岛第6个CG位点发生甲基化阻碍了转录因子Sp1的结合,进而抑制TLR5基因的表达,并最终表现出对大肠杆菌的抗性。下一步将在细胞水平进一步验证TLR5基因的调控功能,并结合免疫共沉淀或凝胶迁移试验等技术深入研究转录因子对核心启动子的调控作用,以期为TLR5基因的表观遗传修饰作用提供更完整的试验依据。
4 结论本研究首先通过组织和蛋白表达水平初步确定TLR5表达与大肠杆菌抗性的关系,发现猪TLR5基因的表达水平确实和F18大肠杆菌的抗性有关,其低表达可能有利于F18大肠杆菌抗性。然后通过启动子区CpG岛甲基化分析,预测并确定了TLR5核心启动子区和甲基化位点,发现启动子区第2个CpG岛第6个CG位点甲基化水平和TLR5基因的表达存在显著负相关。由此推测TLR5基因启动子区第2个CpG岛第6个CG位点甲基化能够显著抑制TLR5基因的表达,并最终影响断奶仔猪对大肠杆菌的抗性。
| [1] | DE NARDO D. Toll-like receptors:Activation, signalling and transcriptional modulation[J]. Cytokine, 2015, 74(2): 181–189. DOI: 10.1016/j.cyto.2015.02.025 |
| [2] | KANURI G, LADURNER R, SKIBOVSKAYA J, et al. Expression of toll-like receptors 1-5 but not TLR 6-10 is elevated in livers of patients with non-alcoholic fatty liver disease[J]. Liver Int, 2015, 35(2): 562–568. DOI: 10.1111/liv.2015.35.issue-2 |
| [3] | KRAVCHENKO V V, KAUFMANN G F. Bacterial inhibition of inflammatory responses via TLR-independent mechanisms[J]. Cell Microbiol, 2013, 15(4): 527–536. DOI: 10.1111/cmi.2013.15.issue-4 |
| [4] | MILLER A H, VAYTTADEN S J, AL-KHODOR S, et al. Assay development for image-based quantification of intracellular bacterial replication and analysis of the innate immune response to infection[J]. Assay Drug Dev Technol, 2015, 13(9): 515–528. DOI: 10.1089/adt.2015.664 |
| [5] | ADIB-CONQUY M, SCOTT-ALGARA D, CAVAILLON J M, et al. TLR-mediated activation of NK cells and their role in bacterial/viral immune responses in mammals[J]. Immunol Cell Biol, 2014, 92(3): 256–262. DOI: 10.1038/icb.2013.99 |
| [6] | SHINKAI H, TANAKA M, MOROZUMI T, et al. Biased distribution of single nucleotide polymorphisms (SNPs) in porcine Toll-like receptor 1 (TLR1), TLR2, TLR4, TLR5, and TLR6 genes[J]. Immunogenetics, 2006, 58(4): 324–330. DOI: 10.1007/s00251-005-0068-z |
| [7] |
孙小林, 潘志明, 方强, 等. 我国地方品种姜曲海猪TLR5基因的克隆、表达及鉴定[J]. 细胞与分子免疫学杂志, 2012, 28(4): 436–438.
SUN X L, PAN Z M, FANG Q, et al. Cloning, expression and identification of TLR5 gene from native Chinese variety Jiangquhai pigs[J]. Chinese Journal of Cellular and Molecular Immunology, 2012, 28(4): 436–438. (in Chinese) |
| [8] | DEVRIENDT B, STUYVEN E, VERDONCK F, et al. Enterotoxigenic Escherichia coli (K88) induce proinflammatory responses in porcine intestinal epithelial cells[J]. Dev Comp Immunol, 2010, 34(11): 1175–1182. DOI: 10.1016/j.dci.2010.06.009 |
| [9] | SHINKAI H, SUZUKI R, AKIBA M, et al. Porcine Toll-like receptors:recognition of Salmonella enterica serovar Choleraesuis and influence of polymorphisms[J]. Mol Immunol, 2011, 48(9-10): 1114–1120. DOI: 10.1016/j.molimm.2011.02.004 |
| [10] | SHINKAI H, ARAKAWA A, TANAKA-MATSUDA M, et al. Genetic variability in swine leukocyte antigen class Ⅱ and Toll-like receptors affects immune responses to vaccination for bacterial infections in pigs[J]. Comp Immunol Microbiol Infect Dis, 2012, 35(6): 523–532. DOI: 10.1016/j.cimid.2012.05.003 |
| [11] | DOMINGUEZ M A, LANDI V, MARTíNEZ A, et al. Identification and functional characterization of novel genetic variations in porcine TLR5 promoter[J]. DNA Cell Biol, 2014, 33(7): 469–476. DOI: 10.1089/dna.2013.2318 |
| [12] | WU Z C, LIU Y, DONG W H, et al. CD14 in the TLRs signaling pathway is associated with the resistance to E. coli F18 in Chinese domestic weaned piglets[J]. Sci Rep, 2016, 6: 24611. DOI: 10.1038/srep24611 |
| [13] | BAUER A P, LEIKAM D, KRINNER S, et al. The impact of intragenic CpG content on gene expression[J]. Nucleic Acids Res, 2010, 38(12): 3891–3908. DOI: 10.1093/nar/gkq115 |
| [14] |
刘利, 高雪, 高会江, 等. DNA甲基化在奶牛金黄色葡萄球菌性乳房炎中的调控[J]. 畜牧兽医学报, 2012, 43(10): 1554–1558.
LIU L, GAO X, GAO H J, et al. Regulation of DNA Methylation during Staphylococcus aureus mastitis in dairy cattle[J]. Acta Veterinaria et Zootechnia Sinica, 2012, 43(10): 1554–1558. (in Chinese) |
| [15] | SHA A H, LIN X H, HUANG J B, et al. Analysis of DNA methylation related to rice adult plant resistance to bacterial blight based on methylation-sensitive AFLP (MSAP) analysis[J]. Mol Genet Genomics, 2005, 273(6): 484–490. DOI: 10.1007/s00438-005-1148-3 |
| [16] | LUO J, YU Y, CHANG S, et al. DNA methylation fluctuation induced by virus infection differs between MD-resistant and -susceptible chickens[J]. Front Genet, 2012, 3: 20. |
| [17] |
包文斌, 潘章源, 朱璟, 等. 猪TLR4基因在F18大肠杆菌抗性型和敏感型资源群体间的差异表达分析[J]. 畜牧兽医学报, 2011, 42(2): 278–283.
BAO W B, PAN Z Y, ZHU J, et al. Differentiation of porcine TLR4 Gene mRNA expression between resistant and sensitive resource populations to ETEC F18[J]. Acta Veterinaria et Zootechnia Sinica, 2011, 42(2): 278–283. (in Chinese) |
| [18] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [19] | BARTON G M, MEDZHITOV R. Toll-like receptor signaling pathways[J]. Science, 2003, 300(5625): 1524–1525. DOI: 10.1126/science.1085536 |
| [20] | BAILEY M. The mucosal immune system:Recent developments and future directions in the pig[J]. Dev Comp Immunol, 2009, 33(3): 375–383. DOI: 10.1016/j.dci.2008.07.003 |
| [21] | LIN S C, LO Y C, WU H. Helical assembly in the MyD88-IRAK4-IRAK2 complex in TLR/IL-1R signalling[J]. Nature, 2010, 465(7300): 885–890. DOI: 10.1038/nature09121 |
| [22] | SU X Q, LI S, MENG M, et al. TNF receptor-associated factor-1 (TRAF1) negatively regulates Toll/IL-1 receptor domain-containing adaptor inducing IFN-β (TRIF)-mediated signaling[J]. Eur J Immunol, 2006, 36(1): 199–206. DOI: 10.1002/(ISSN)1521-4141 |
| [23] | MANUKYAN M, NALBANT P, LUXEN S, et al. RhoA GTPase activation by TLR2 and TLR3 ligands:connecting via Src to NF-κB[J]. J Immunol, 2009, 182(6): 3522–3529. DOI: 10.4049/jimmunol.0802280 |
| [24] | ZHAO X L, XIAO S Y, BERK S, et al. Structural basis of Phosphoinositide (PIP) recognition by the TIRAP PIP-binding motif[J]. Biophys J, 2015, 108(2): 93a. |
| [25] | BROWN J, WANG H, HAJISHENGALLIS G N, et al. TLR-signaling networks:an integration of adaptor molecules, kinases, and cross-talk[J]. J Dent Res, 2011, 90(4): 417–427. DOI: 10.1177/0022034510381264 |
| [26] | XIAO Z Z, WANG C, MO D L, et al. Promoter CpG methylation status in porcine Lyn is associated with its expression levels[J]. Gene, 2012, 511(1): 73–78. DOI: 10.1016/j.gene.2012.08.050 |
| [27] | SUN L, WANG J, YIN X M, et al. Identification of a 5-methylcytosine site that may regulate C/EBPβ binding and determine tissue-specific expression of the BPI gene in piglets[J]. Sci Rep, 2016, 6: 28506. DOI: 10.1038/srep28506 |



