2. 武汉轻工大学动物科学与营养工程学院, 武汉 430023
2. School of Animal Science and Nutritional Engineering, Wuhan Polytechnic University, Wuhan 430023, China
副猪嗜血杆菌(Haemophilus parasuis,Hps)被公认为是对保育猪乃至肥育猪和母猪构成严重威胁的重大细菌性病原体之一[1];也是猪呼吸道疾病综合征(porcine respiratory disease complex, PRDC)的一种主要原发性病原[2]。Hps感染可导致败血症以及全身系统性炎症,其中以格拉瑟氏病(Glässer's disease)为典型特征;Hps存在于世界各主要养猪国家,感染的发病率和死亡率较高(隐性群中可达75%)且疾病流行正呈上升趋势[1]。针对该细菌,依赖抗生素的治疗策略已不符合行业发展趋势,预防使用的灭活疫苗存在很大弊端,而新型疫苗的开发研究仍面临诸多挑战[3]。抗病育种有助于促进猪场疫病净化,《全国畜禽遗传资源保护和利用“十三五”规划》中也已将抗病型新品种/配套系的分子育种作为今后的重点研究方向。
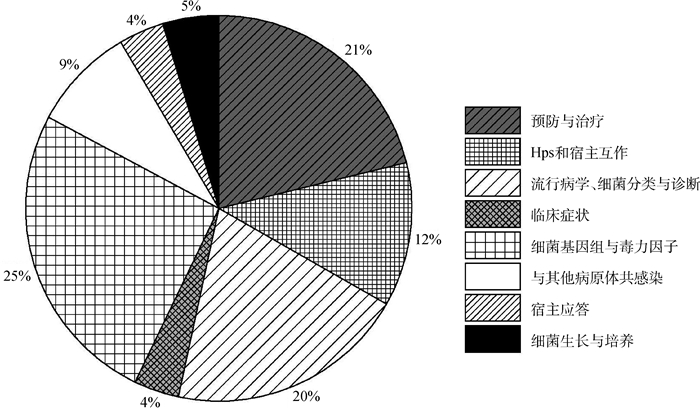
笔者根据PubMed(www.ncbi.nlm.nih.gov/pubmed)和GoPubmed®(www.gopubmed.org)检索、分析,结果显示,我国Hps研究全球居首,相关文献总量超过25%(截至2017年8月),这也从侧面反映了我国目前针对该菌感染流行所面临的严峻形势。目前Hps感染的致病机制研究相对较少,总体上,“宿主-病原互作”(12%)和“宿主应答”(4%)合计占到总文献数量的16%(图 1);尤其是部分研究层面仍缺乏深入和系统解析。尽管有结果表明不同猪对该菌存在抗性差异[4],但其分子遗传机制不甚清楚,相关致因突变尚不明确。笔者课题组前期研究发现,Hps感染可引起肺部等器官中产生大量替代激活的巨噬细胞(即Ⅱ型MΦ)并伴随细胞膜糖蛋白CD163分子的显著上调表达[5];最近研究表明,强毒力Hps菌株感染后猪肺泡巨噬细胞(PAM)表面CD163的高表达以及可溶性sCD163脱落(至外周血中)是区别于无毒力菌株感染的最主要特征[6]。然而,MΦ/sCD163对Hps感染的影响及其调控宿主免疫应答的分子机制还不清楚。针对这一重要生物学现象,本文拟通过深入、系统综述相关研究进展,进一步理清Hps感染致病的核心脉络;旨在探讨病原-宿主互作过程中细菌免疫逃避对宿主细胞的重要影响,展望将来需要研究的关键问题;在对猪分子抗病育种迫切需求的现实背景下为Hps抗性品质改善提供遗传基础。
|
图 1 副猪嗜血杆菌感染相关研究的文献分类(文献数据根据PubMed数据库搜索结果整理) Figure 1 Literature searching and classification on Hps infection (data from: PubMed) |
Hps(以下“Hps”除非特别说明均指毒力或者强毒力菌株)传播主要是通过与易感动物或者病猪接触发生,而疾病暴发通常与单一流行的菌株密切有关[1]。Hps早期在仔猪上呼吸道定居期间可表达一种IgA蛋白酶,从而破坏猪IgA重链结构以逃避宿主黏膜免疫[7],这为细菌入侵提供了有利条件。J. L. Vahle等[8]对仔猪经鼻腔接种后围绕细菌入侵的动态特征进行了分析,发现可最早从肺中分离出细菌,暗示:突破肺部防御是Hps系统性扩散的必经之路。PAM是肺部防御中第一道防线,Hps侵入肺期间毫无例外地会与之发生“交锋”。遗憾的是,尽管有少量毒力菌株被PAM吞噬并杀灭,但与无毒菌株相比,PAM吞噬毒力Hps细菌的效率很低,表现出对PAM存在较强的吞噬抗性,细菌荚膜以及其他未知蛋白成分可能在吞噬抗性中发挥一定作用[9];有研究发现,VtaA8、VtaA9是Nagasaki菌株抵抗PAM吞噬的重要毒力因子[10]。最终结果是:Hps对于PAM具有吞噬抗性,这为细菌在肺泡内大量增殖提供了重要窗口期。
一般认为,病原体感染会导致组织微环境中发生局部炎症反应,从而促使感染部位毛细血管壁通透性增加,并募集吞噬细胞。尽管肺炎并非Hps感染的典型症状,但是我们之前利用普通仔猪[11]和禁食初乳(colostrum-deprived, CD)仔猪[12]进行的体内感染试验已多次证实确有肺炎发生。体内感染试验显示,Hps导致PAM中一些参与炎症反应基因显著上调[13],这与在易感猪肺中观察到的结果类似[14]。而且,我们研究发现,在Hps感染的炎症部位可能会于募集的吞噬细胞中通过S100钙粒蛋白家族成员介导的TLR4-NF-κB/ERK或/和RAGE-ERK信号形成强烈的促炎反应正反馈[15]。如前面所述,毒力Hps菌株对PAM具有吞噬抗性;而我们利用CD仔猪经气管内攻毒后第3天成功从外周血中分离出了Hps[12],由此证明:炎症反应期间募集而来的吞噬细胞未能对Hps实施有效杀灭。所以,由Hps与PAM“交锋”而引发的局部组织炎症其实是打开了细菌进入血流的门户。尽管我们以及其他课题组曾发现Hps感染可导致补体级联中相关基因被显著上调[11, 13],但有证据表明,Hps某些毒力因子可通过阻止补体分子结合抑制经典补体级联激活途径[16],Hps菌体荚膜的存在也不利于补体分子充分发挥对细菌的调理[17],补体介导的Ⅱ型吞噬作用也以失败告终。总之,血清/补体抗性是Hps的一种重要毒力机制[18],为细菌通过血液循环向重要组织部位的入侵提供了保证。
基于以上分析可以初步得出结论:Hps沉积到下呼吸道之后,肺是病菌引发全身性感染的原发性侵入位点,而这归咎于宿主PAM免疫保护失败以及由PAM引发的炎症反应。
2 Hps感染导致肺中MΦ替代激活MΦ是哺乳动物免疫应答体系中重要的免疫细胞类型。但同时,MΦ还是诸多细菌性病原体逃避宿主免疫防御的靶细胞,尤其是那些具备系统性扩散特点的细菌[19]。较早的研究显示,强毒力Hps一旦被PAM内化便不可能在其中存活,因此认为:Hps被MΦ内化并非该细菌的侵入机制[9]。对此结论,我们并不完全赞同。理由如下:体外感染试验证明,Hps可通过抑制PAM中活性氧(ROS)的产生阻止PAM呼吸爆发[20];此外,体内感染导致PAM中CORONIN1A基因显著下调,暗示Hps可能通过抑制溶酶体传递以利于其在细胞内的存活[13];B. Bello-Orti等[21]发现,体内感染后4 d能够成功从肺部吞噬细胞(MΦ和嗜中性粒细胞)以及肺细胞中检出强毒力Hps,而无毒菌株感染后不能从这些细胞中检出,其具体分子机制尚有待研究。以上结果表明,吞噬细胞对强毒力Hps的杀灭是无效的,也与我们前面得出的结论一致。
组织微环境中,MΦ的功能依赖其不同的活化状态,尽管这在不同物种之间可能存在一定差别;基本上讲,经典激活可由IFN-γ和LPS诱导产生CAMs(即Ⅰ型MΦ,M1),对病原体杀灭能力强,主要分泌促炎细胞因子(如IL-1β、TNF、IL-6、IL-12和IL-23)以及强氧化物质(如NO);替代激活可由IL-4和IL-13诱导产生AAMs(即Ⅱ型MΦ,M2),对病原体杀灭能力差,主要通过分泌胞外基质成分以利于组织损伤修复;另外,其他类型的AAMs可由IL-10等因子诱导,但与通常所说的Ⅱ型MΦ在细胞表型上存在一定差别,主要发挥抗炎反应作用[22]。我们对本课题组以及其他研究小组的基因芯片数据进行了深入整合分析,结果发现Hps感染导致MΦ替代激活的一系列标志基因显著上调,其中就有Ⅱ型MΦ标志基因CD163[5]。笔者利用QPCR和IHC技术对肺组织中相关基因分别从转录和蛋白水平进行分析后发现:Hps感染的MΦ替代激活依赖STAT3和STAT6;值得一提的是,笔者还发现个别Ⅱ型MΦ标志基因(如FN1和IRF4)于感染后下调表达,而促炎细胞因子IL-8显著上调(未发表数据);华南农业大学廖明老师课题组利用毒力菌株SC096外膜蛋白OmpP2对PAM细胞系3D4/31免疫刺激后同样发现IL-8等促炎细胞因子被显著上调[23],与前面所提Y. Wang等[13]的研究工作一致。这表明:Hps感染过程中虽然MΦ以替代激活为主,但同时也可能兼有Ⅰ型MΦ产生。血液中单核细胞是MΦ的前体细胞,与Hps感染类似,B. Saha等[24]发现丙型肝炎病毒(HCV)刺激人的单核细胞后导致其朝Ⅱ型MΦ激活为主,但同时也有少量Ⅰ型MΦ产生;令人惊讶的是,他们发现阻断IL-1β受体IL1RA之后Ⅱ型MΦ激活竟然被同步抑制(伴随抗炎细胞因子TGF-β下调)。人们研究证明,Ⅱ型MΦ表面标志CD163已被证明是诸多G+和G-细菌激活机体(单核/巨噬细胞)先天免疫应答的感受器,可导致较强烈的局部炎症反应;但与TLRs(Toll-like receptors)仅识别细菌破裂后被释放出的PAMP(pathogen-associated molecular pattern)成分(如脂多糖LPS)不同,CD163是通过识别完整的菌体而达到促炎效应的[25]。我们推测MΦ经典激活与替代激活并非完全意义上的“对抗”关系,还存在“协作”机制;而CD163被证明是炎症反应的感受器启发我们需要深入认识猪中Ⅱ型MΦ对于Hps的感染调控。一项重要研究发现,Hps经体内感染后第2天猪肺中CD163highPAM急剧增多,随后第3—4天于血清中检测到了高水平的sCD163和IL-8,并伴随更加严重的临床感染表现(如败血症),是区别于无毒力Hps感染的典型特征[6]。血液中高水平sCD163已被证明与人的多种疾病有关,其中就包括与Hps感染类似的菌血症、败血症和关节炎[26]。所以,这极可能代表了感染后期单核/巨噬细胞面对严重炎症反应而做出的一种免疫关闭机制。
以上分析进一步表明,肺作为Hps的原发性侵入位点,其PAM并不能对细菌实施有效杀灭。再者,由于利用Hps体外直接感染PAM并不能重复体内感染的试验结果[6],我们怀疑,肺中PAM在接触到Hps后极可能是通过其表面的CD163于局部组织处引发最初的炎症反应,随后募集而来的嗜中性粒细胞将炎症信号进一步放大,随着大量单核细胞募集至感染部位,Hps-单核细胞互作诱导单核细胞向Ⅱ型MΦ活化,而此间形成的少量Ⅰ型MΦ非但不足以杀灭细菌,还有可能在Ⅱ型MΦ产生的过程中起到“协助”作用;最终导致大量单核细胞源性CD163highPAM的产生,并促成后续的严重感染。
3 巨噬细胞-γδT细胞免疫轴在Hps感染中的作用尽管疫苗预防存在诸多不足[3],但Hps灭活苗或部分开发中的亚单位疫苗具有较好的免疫保护效果,表现为猪外周血中CD4+CD8α- Th细胞、CD3ε+CD8α+CD8β+ CTL细胞以及CD21+αIgM+ B细胞的显著增多和较高的抗体(IgG)水平[27-29];此外,与补体介导的Ⅱ型吞噬作用相比,抗体介导的Ⅰ型吞噬作用更加有效[4],说明:体液免疫对于控制细菌感染是必须的。但是在不实施免疫预防的条件下,毒力Hps菌株感染后不仅导致先天免疫“全线失守”(见前述),而且体液免疫应答也不能被有效激活,那么这其中的原因是什么呢?我们曾最早对Hps感染后宿主免疫应答的转录组变化(脾)进行了研究,首次发现感染可导致猪Ⅰ类和Ⅱ类抗原递呈分子(SLA)显著下调表达[11]。对此,后来又有研究在肺、PAM、外周血单核细胞中进一步证实[6, 13-14, 29]。这表明:Hps感染可削弱宿主免疫细胞的抗原提呈功能并可能严重影响体液免疫应答。
如前面所述,因为MΦ/sCD163(或者PAM/CD163)可能是Hps引起宿主免疫应答的原发性信号,那么,这对于宿主体液免疫应答有无影响?细胞膜糖蛋白CD163隶属富含半胱氨酸结构域的清道夫受体(SRCR)家族,几乎在MΦ和单核细胞中特异表达;是触珠蛋白-血红蛋白(Hp-Hb)的胞吞受体和有核红细胞的黏附受体,在氧化损伤、红细胞生成以及介导“完整”细菌触发先天免疫应答中具有重要作用[25]。人和鼠中研究表明,CD163可被抗炎细胞因子IL-10上调表达,而被促炎细胞因子(如TNFα、IFN-γ等)下调表达,这种免疫调节也说明CD163主要存在于Ⅱ型MΦ[26];与之对应,我们前期研究发现伴随Hps感染导致巨噬细胞发生替代激活,CD163负调控因子IFN-γ在肺中被显著下调(未发表数据)。CD163由9个胞外SRCR结构域和一个连有胞质尾区的短跨膜区组成,现已证明其9个胞外SRCR蛋白结构域在功能上有所区别[25]。与CD163相比,sCD163包含所有9个胞外SRCR蛋白结构域,由细胞上CD163脱落后形成;炎症状态下,MΦ和单核细胞中金属蛋白酶ADAM17/TACE被激活后可将CD163从细胞膜上“切掉”导致血浆中可溶性sCD163显著升高;组织金属蛋白酶抑制因子3(TIMP-3)则是sCD163脱落的抑制因子[26]。最近发现,Hps感染后肺组织中金属蛋白酶ADAMTS17被显著上调[30],但Hps感染后期血浆中sCD163急剧升高[6]是否与该基因之间存在调控关系尚不得而知。
目前sCD163的具体功能还不清楚,在人的研究表明血浆中sCD163可抑制T淋巴细胞增殖与活化[31],具体机制不详。我们发现,Hps感染CD仔猪后1~3 d外周血总淋巴细胞数急剧下降,对感染前后(第0、1、3天)外周血总白细胞利用RNA-Seq分析表明淋巴细胞的增殖与活化功能(含T细胞)被显著抑制,并且与巨噬细胞替代激活信号Jak/stat (STAT3)密切关联(未发表数据)。与此对应,R. Frandoloso等[29]发现Hps感染1和2 d后猪外周血中CD3+γδTCR+细胞分别减少31.8%和74.3%。以上研究表明,宿主细胞免疫应答中γδT细胞极可能是细菌感染的主要靶细胞。猪γδT细胞的具体功能我们还知之甚少[32],人和鼠中研究表明,该类型细胞在免疫记忆、抗原递呈(依赖MHC和不依赖MHC)、细胞毒性等免疫调节方面均发挥重要作用,参与病毒、真菌等一系列病原微生物的免疫防御;鼠中γδT细胞缺乏表现出对沙门菌明显易感[33]。需要特别指出,人和鼠外周血T淋巴细胞中γδT细胞仅占0.5%~5%,而猪属于“高γδT细胞物种”,外周血中γδT细胞占总T淋巴细胞的70%以上,占总淋巴细胞(PBL)的30%~85%,具体含量因日龄而异,尤其在新生仔猪中最高;此外,哺乳母猪初乳中γδT细胞含量也很高,占外周血淋巴细胞(PBL)的15%[34]。
4~8周龄仔猪是Hps的主要易感猪群,鉴于感染导致γδT细胞含量急剧下降,我们怀疑,Hps感染可能通过某种机制严重破坏γδT细胞介导的幼龄仔猪免疫功能;伴随γδT细胞下降,T淋巴细胞增殖活化潜在抑制因子sCD163水平却急剧升高。暗示:巨噬细胞/sCD163可能通过与下游γδT细胞形成一个关系紧密的“巨噬细胞/sCD163-γδT细胞”免疫轴调节宿主对Hps的抗性。
4 CD163是调控猪对Hps抗性的候选基因?围绕前面对巨噬细胞/sCD163-γδT细胞免疫轴的剖析,我们推测CD163可能是影响猪对Hps抗性的候选基因。此外,以下事实也可为该推测提供旁证:第一,如前所述Hps感染后CD163是显著差异表达基因,尤其CD163highPAM于感染后显著增多以及随后血浆中sCD163急剧上升是区别于无毒菌株感染的最明显特征[6];第二,我们分析发现CD163在人和猪中高度保守,其中细菌结合功能域[25]相似性达89%,暗示猪单核/巨噬细胞表面CD163可能是Hps引发炎症反应的重要受体。一方面,Hps感染导致单核细胞向Ⅱ型MΦ活化并上调表达CD163,另一方面sCD163抑制猪γδT细胞增殖活化,二者在免疫应答过程中紧密衔接、逐层推进,最终导致宿主免疫防御失败,因此CD163可能也是宿主“巨噬细胞/sCD163-γδT细胞”免疫轴上调控Hps感染的关键点;第三,研究表明,CD163与猪的其他重大感染性疾病密切相关,如口蹄疫病毒(FMDV)、胸膜肺炎放线杆菌(APP)、猪链球菌(S. suis 2)感染[35-37]。再者,美国Iowa州立大学C. K. Tuggle教授团队证明CD163是猪沙门菌感染的抗性基因,其SNP位点与粪便和组织中细菌含量显著相关[38];而且,猪CD163基因3′-UTR区一SNP位点还与血液IgG抗体水平显著相关[39]。P. X. Niu等[40]发现,CD163中一SNP与PRRSV感染后11 d核衣壳蛋白特异性抗体滴度显著相关,利用CRISPR/Cas9基因编辑技术将猪巨噬细胞CD163中编码SRCR5的功能域序列敲除后表现出对PRRSV感染的完全抗性[41]。这表明,CD163是猪病原体感染的重要候选基因。
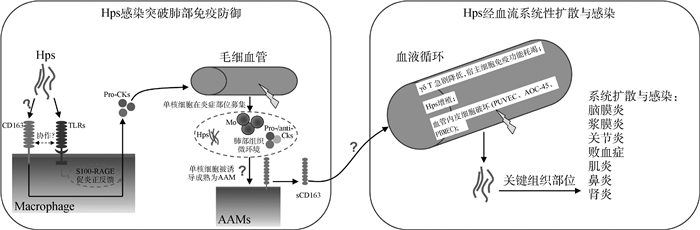
5 展望综上所述,猪“巨噬细胞/sCD163-γδT细胞”可能是调控Hps感染的关键免疫轴:PAM通过其表面CD163在原发性侵入位点肺中引发炎症反应,随后被募集的单核细胞在Hps感染下发生Ⅱ型MΦ替代激活并引发其表面CD163脱落为sCD163,sCD163导致外周血中γδ T增殖活化被抑制,最终严重发病(图 2)。迄今为止,我们已经证实Hps感染可导致巨噬细胞发生替代激活,但诸多问题仍亟需进一步研究。鉴于不同Hps毒力菌株与宿主之间的互作存在一定的特殊性,深入探讨CD163介导Hps感染的促炎机制、明确Hps诱导单核细胞发生替代激活以及导致sCD163脱落的分子机制、分析sCD163对γδ T细胞的免疫抑制都是今后需要着重解决的问题,这将有助于我们深入理解Hps致病的分子机制,为猪抗病育种的遗传改良提供分子标记筛选新视角。
|
图 2 巨噬细胞-γδ T细胞免疫轴在猪格拉瑟氏病发病机制中的作用 Figure 2 The proposed MΦ-γδ T immune axis in the pathogenesis of Glässer's disease |
| [1] |
ZIMMERMAN J J, KARRIKER L A, RAMIREZ A, 等. 猪病学[M]. 10版. 赵德明, 张仲秋, 周向梅, 等译. 北京: 中国农业大学出版社, 2014.
ZIMMERMAN J J, KARRIKER L A, RAMIREZ A, et al. Diseases of swine[M]. 10th ed. ZHAO D M, ZHANG Z Q, ZHOU X M, et al, trans. Beijing: China Agricultural University Press, 2014. (in Chinese) |
| [2] | CHEONG Y, OH C, LEE K, et al. Survey of porcine respiratory disease complex-associated pathogens among commercial pig farms in Korea via oral fluid method[J]. J Vet Sci, 2017, 18(3): 283–289. DOI: 10.4142/jvs.2017.18.3.283 |
| [3] | LIU H S, XUE Q, ZENG Q Y, et al. Haemophilus parasuis vaccines[J]. Vet Immunol Immunopathol, 2016, 180: 53–58. DOI: 10.1016/j.vetimm.2016.09.002 |
| [4] | BLANCO I, CANALS A, EVANS G, et al. Differences in susceptibility to Haemophilus parasuis infection in pigs[J]. Can J Vet Res, 2008, 72(3): 228–235. |
| [5] |
陈洪波. 副猪嗜血杆菌感染:宿主免疫应答模型与巨噬细胞活化[J]. 畜牧兽医学报, 2015, 46(1): 1–11.
CHEN H B. Haemophilus parasuis infection: model for the host immune response and the macrophage activation[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 1–11. (in Chinese) |
| [6] | COSTA-HURTADO M, OLVERA A, MARTINEZ-MOLINER V, et al. Changes in macrophage phenotype after infection of pigs with Haemophilus parasuis strains with different levels of virulence[J]. Infect Immun, 2013, 81(7): 2327–2333. DOI: 10.1128/IAI.00056-13 |
| [7] | MULLINS M A, REGISTER K B, BAYLES D O, et al. Haemophilus parasuis exhibits IgA protease activity but lacks homologs of the IgA protease genes of Haemophilus influenzae[J]. Vet Microbiol, 2011, 153(3-4): 407–412. DOI: 10.1016/j.vetmic.2011.06.004 |
| [8] | VAHLE J L, HAYNES J S, ANDREWS J J. Experimental reproduction of Haemophilus parasuis infection in swine: clinical, bacteriologic, and morphologic findings[J]. J Vet Diagn Invest, 1995, 7(4): 476–480. DOI: 10.1177/104063879500700409 |
| [9] | OLVERA A, BALLESTER M, NOFRARÍAS M, et al. Differences in phagocytosis susceptibility in Haemophilus parasuis strains[J]. Vet Res, 2009, 40(3): 24. DOI: 10.1051/vetres/2009007 |
| [10] | COSTA-HURTADO M, BALLESTER M, GALOFRÉ-MILÀ N, et al. VtaA8 and VtaA9 from Haemophilus parasuis delay phagocytosis by alveolar macrophages[J]. Vet Res, 2012, 43(1): 57. DOI: 10.1186/1297-9716-43-57 |
| [11] | CHEN H B, LI C C, FANG M D, et al. Understanding Haemophilus parasuis infection in porcine spleen through a transcriptomics approach[J]. BMC Genomics, 2009, 10: 64. DOI: 10.1186/1471-2164-10-64 |
| [12] |
陈洪波, 程蕾, 向敏, 等. 副猪嗜血杆菌感染禁食初乳仔猪实验动物模型的构建[J]. 家畜生态学报, 2015, 36(6): 53–62.
CHEN H B, CHENG L, XIANG M, et al. Establishment of experimental model for colostrum-deprived piglets infected by Haemophilus parasuis[J]. Acta Ecologiae Animalis Domastici, 2015, 36(6): 53–62. (in Chinese) |
| [13] | WANG Y, LIU C, FANG Y, et al. Transcription analysis on response of porcine alveolar macrophages to Haemophilus parasuis[J]. BMC Genomics, 2012, 13: 68. DOI: 10.1186/1471-2164-13-68 |
| [14] | WILKINSON J M, SARGENT C A, GALINA-PANTOJA L, et al. Gene expression profiling in the lungs of pigs with different susceptibilities to Glässer's disease[J]. BMC Genomics, 2010, 11: 455. DOI: 10.1186/1471-2164-11-455 |
| [15] | CHEN H B, LUNNEY J K, CHENG L, et al. Porcine S100A8 and S100A9: molecular characterizations and crucial functions in response to Haemophilus parasuis infection[J]. Dev Comp Immunol, 2011, 35(4): 490–500. DOI: 10.1016/j.dci.2010.11.017 |
| [16] | ZHOU S M, XU C G, ZHANG B, et al. Natural IgG antibodies in normal rabbit serum are involved in killing of the ompP2 mutant of Haemophilus parasuis SC096 strain via the classical complement pathway[J]. Vet J, 2013, 196(1): 111–113. DOI: 10.1016/j.tvjl.2012.09.007 |
| [17] | CELLI J, FINLAY B B. Bacterial avoidance of phagocytosis[J]. Trends Microbiol, 2002, 10(5): 232–237. DOI: 10.1016/S0966-842X(02)02343-0 |
| [18] | CERDÀ-CUÉLLAR M, ARAGON V. Serum-resistance in Haemophilus parasuis is associated with systemic disease in swine[J]. Vet J, 2008, 175(3): 384–389. DOI: 10.1016/j.tvjl.2007.01.016 |
| [19] | ROSENBERGER C M, FINLAY B B. Phagocyte sabotage: disruption of macrophage signalling by bacterial pathogens[J]. Nat Rev Mol Cell Biol, 2003, 4(5): 385–396. DOI: 10.1038/nrm1104 |
| [20] | KAVANOVÁ L, PRODĚLALOVÁ J, NEDBALCOVÁ K, et al. Immune response of porcine alveolar macrophages to a concurrent infection with porcine reproductive and respiratory syndrome virus and Haemophilus parasuis in vitro[J]. Vet Microbiol, 2015, 180(1-2): 28–35. DOI: 10.1016/j.vetmic.2015.08.026 |
| [21] | BELLO-ORTI B, COSTA-HURTADO M, MARTINEZ-MOLINER V, et al. Time course Haemophilus parasuis infection reveals pathological differences between virulent and non-virulent strains in the respiratory tract[J]. Vet Microbiol, 2014, 170(3-4): 430–437. DOI: 10.1016/j.vetmic.2014.01.011 |
| [22] | SINGLETON H, GRAHAM S P, BODMAN-SMITH K B, et al. Establishing porcine monocyte-derived macrophage and dendritic cell systems for studying the interaction with PRRSV-1[J]. Front Microbiol, 2016, 7: 832. |
| [23] | ZHOU S M, HE X H, XU C G, et al. The outer membrane protein P2 (OmpP2) of Haemophilus parasuis induces proinflammatory cytokine mRNA expression in porcine alveolar macrophages[J]. Vet J, 2014, 199(3): 461–464. DOI: 10.1016/j.tvjl.2013.12.010 |
| [24] | SAHA B, KODYS K, SZABO G. Hepatitis C virus-induced monocyte differentiation into polarized M2 macrophages promotes stellate cell activation via TGF-β[J]. Cell Mol Gastroenterol Hepatol, 2016, 2(3): 302–316. DOI: 10.1016/j.jcmgh.2015.12.005 |
| [25] | FABRIEK B O, VAN BRUGGEN R, DENG D M, et al. The macrophage scavenger receptor CD163 functions as an innate immune sensor for bacteria[J]. Blood, 2009, 113(4): 887–892. DOI: 10.1182/blood-2008-07-167064 |
| [26] | MØLLER H J. Soluble CD163[J]. Scand J Clin Lab Invest, 2012, 72(1): 1–13. DOI: 10.3109/00365513.2011.626868 |
| [27] | MARTÍNEZ-MARTÍNEZ S, FRANDOLOSO R, RODRÍGUEZ-FERRI E F, et al. A vaccine based on a mutant transferrin binding protein B of Haemophilus parasuis induces a strong T-helper 2 response and bacterial clearance after experimental infection[J]. Vet Immunol Immunopathol, 2016, 179: 18–25. DOI: 10.1016/j.vetimm.2016.07.011 |
| [28] | FRANDOLOSO R, MARTÍNEZ-MARTÍNEZ S, CALMETTES C, et al. Nonbinding site-directed mutants of transferrin binding protein B exhibit enhanced immunogenicity and protective capabilities[J]. Infect Immun, 2015, 83(3): 1030–1038. DOI: 10.1128/IAI.02572-14 |
| [29] | FRANDOLOSO R, MARTÍNEZ-MARTÍNEZ S, YUBERO S, et al. New insights in cellular immune response in colostrum-deprived pigs after immunization with subunit and commercial vaccines against Glässer's disease[J]. Cell Immunol, 2012, 277(1-2): 74–82. DOI: 10.1016/j.cellimm.2012.05.010 |
| [30] | MARTÍNEZ-MARTÍNEZ S, RODRÍGUEZ-FERRI E F, FRANDOLOSO R, et al. Molecular analysis of lungs from pigs immunized with a mutant transferrin binding protein B-based vaccine and challenged with Haemophilus parasuis[J]. Comp Immunol Microbiol Infect Dis, 2016, 48: 69–78. DOI: 10.1016/j.cimid.2016.08.005 |
| [31] | TIMMERMANN M, BUCK F, SORG C, et al. Interaction of soluble CD163 with activated T lymphocytes involves its association with non-muscle myosin heavy chain type A[J]. Immunol Cell Biol, 2004, 82(5): 479–487. DOI: 10.1111/imcb.2004.82.issue-5 |
| [32] | WILLIAMS A R, FRYGANAS C, REICHWALD K, et al. Polymerization-dependent activation of porcine γδ T-cells by proanthocyanidins[J]. Res Vet Sci, 2016, 105: 209–215. DOI: 10.1016/j.rvsc.2016.02.021 |
| [33] | ISHIGAMI M, NISHIMURA H, YOSHIOKA K, et al. The role of intrahepatic γδ-T cells for liver injury induced by Salmonella infection in mouse[J]. Microbiol Immunol, 1999, 43(5): 461–469. DOI: 10.1111/mim.1999.43.issue-5 |
| [34] | TAKAMATSU H H, DENYER M S, STIRLING C, et al. Porcine γδ T cells: possible roles on the innate and adaptive immune responses following virus infection[J]. Vet Immunol Immunopathol, 2006, 112(1-2): 49–61. DOI: 10.1016/j.vetimm.2006.03.011 |
| [35] | STENFELDT C, PACHECO J M, BORCA M V, et al. Morphologic and phenotypic characteristics of myocarditis in two pigs infected by foot-and mouth disease virus strains of serotypes O or A[J]. Acta Vet Scand, 2014, 56: 42. DOI: 10.1186/s13028-014-0042-6 |
| [36] | ONDRACKOVA P, NECHVATALOVA K, KUCEROVA Z, et al. Porcine mononuclear phagocyte subpopulations in the lung, blood and bone marrow: dynamics during inflammation induced by Actinobacillus pleuropneumoniae[J]. Vet Res, 2010, 41(5): 64. DOI: 10.1051/vetres/2010035 |
| [37] | LIU M L, FANG L R, TAN C, et al. Understanding Streptococcus suis serotype 2 infection in pigs through a transcriptional approach[J]. BMC Genomics, 2011, 12: 253. DOI: 10.1186/1471-2164-12-253 |
| [38] | UTHE J J, BEARSON S M D, QU L, et al. Integrating comparative expression profiling data and association of SNPs with Salmonella shedding for improved food safety and porcine disease resistance[J]. Anim Genet, 2011, 42(5): 521–534. DOI: 10.1111/age.2011.42.issue-5 |
| [39] | WANG F L, QIU H F, ZHANG Q D, et al. Association of two porcine reproductive and respiratory syndrome virus (PRRSV) receptor genes, CD163 and SN with immune traits[J]. Mol Biol Rep, 2012, 39(4): 3971–3976. DOI: 10.1007/s11033-011-1177-4 |
| [40] | NIU P X, SHABIR N, KHATUN A, et al. Effect of polymorphisms in the GBP1, Mx1 and CD163 genes on host responses to PRRSV infection in pigs[J]. Vet Microbiol, 2016, 182: 187–195. DOI: 10.1016/j.vetmic.2015.11.010 |
| [41] | BURKARD C, LILLICO S G, REID E, et al. Precision engineering for PRRSV resistance in pigs: Macrophages from genome edited pigs lacking CD163 SRCR5 domain are fully resistant to both PRRSV genotypes while maintaining biological function[J]. PLoS Pathog, 2017, 13(2): e1006206. DOI: 10.1371/journal.ppat.1006206 |



