2. 河北农业大学动物科技学院, 保定 071001
2. College of Animal Science and Technology, Hebei Agricultural University, Baoding 071001, China
猪丁型冠状病毒(porcine deltacoronavirus,PDCoV)属冠状病毒属,是一种以腹泻、脱水为临床症状的猪肠道传染病,各年龄段的猪均易感,其中新生仔猪最易发病[1]。本病于2012年首次于我国香港发现,2014年于美国大面积暴发,后在韩国、加拿大均检出此病毒[2-4]。国内一些学者研究发现PDCoV的感染率为20%~30%,个别地区高达40%[5-7],使猪场腹泻形势更加严峻。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是目前我国引起仔猪腹泻的主要病原,自1976年传至我国以来,给养猪业造成了严重的效益损失,2010年由于PEDV流行毒株的变异,导致中国南方十余个省份上亿头仔猪死亡[8-9]。由于感染PDCoV的动物临床症状与感染PEDV的动物临床症状相似,且PDCoV常与PDEV等发生混合感染,导致确诊困难,因此,建立一种快速、准确而又灵敏的检测手段对于仔猪腹泻病的确诊、监控及分子流行病学调查等均具有重要意义。
目前用于PDCoV和PEDV检测RT-PCR方法较多,有单一RT-PCR也有多联RT-PCR的方法,但无论PDCoV还是PEDV,一旦发病,肠道内的病原数量不稳定,常规RT-PCR有可能由于敏感性低出现较高的假阴性较多,并且不能进行准确的定量,且由于后续需要电泳才能观察结果,存在安全问题;荧光定量RT-PCR检测方法因具有快速,简便,安全,灵敏度高,且可定量等优点,是一种更适用于临床检测的检测方法。
本研究根据PDCoV和PEDV的保守基因序列设计了两对特异性引物,分别扩增其保守区基因并将其克隆至pMD19-T载体,以梯度稀释的混合重组质粒为标准品,利用SYBR Green Ⅰ染料的非特异性与PDCoV和PEDV的cDNA分别进行结合,并利用RT-PCR中扩增片段的Tm值的不同进行核酸片段的区分,构建了检测PDCoV和PEDV的双重荧光定量RT-PCR方法。为仔猪腹泻病的诊断及分子流行病学调查提供了一种快速、定量检测方法。
1 材料与方法 1.1 病毒猪丁型冠状病毒(PDCoV)HB-BD株(N基因GenBank登陆号KY129986),猪流行性腹泻病毒(PEDV)HB/HS株(M基因登录号:JF690779)、猪伪狂犬病毒(PRV)、猪博卡病毒(PBoV)、猪传染性胃肠炎病毒(TGEV)、猪圆环病毒Ⅱ型(PCV2)均由河北农业大学动物医学院动物传染病实验室分离并保存。
1.2 临床样品2016—2017年在河北省保定市、石家庄市、邯郸市以及张家口市等地区,发生腹泻病新生仔猪的肠道内容物130份,-80 ℃保存备用。
1.3 主要试剂RNA提取试剂盒和Top Green qPCR Super Mix为TransStart公司产品;反转录试剂盒、DL2000 DNA Marker、pMD19-T载体等为TaKaRa公司产品;罗氏96型荧光定量PCR仪为罗氏诊断产品(上海)有限公司产品;Nanodrop 2000为美国Thermo Scientific公司产品。
1.4 引物的设计根据GenBank中登陆的PDCoV基因序列设计了一对特异性引物,对PDCoV的N基因保守序列进行扩增。上游引物NF1:5′-TACTGGTGCCAATGTCGGCTCTG-3′,下游引物NR1:5′-AGTTGGTTTGGTGGGTGGCTCAT -3′由三博远志公司合成。根据GenBank登录的PEDV的M基因序列,设计荧光定量RT-PCR引物,PEDVF1:5′-GGTGGTCTTTCAATCCTG-3′,PEDVF2:5′-GCAACCTTATAGCCCTCT-3′。引物由三博远志公司合成。
1.5 病毒cDNA的获取按照RNA提取试剂盒说明书进行病毒核酸的提取,将提取的核酸产物通过反转录试剂盒进行反转录,获得cDNA。
1.6 荧光定量RT-PCR方法的建立 1.6.1 标准品的制备将PDCoV和PEDV的cDNA分别使用特异性引物进行PCR扩增,扩增体系含有模板cDNA 4 μL,dNTP 3 μL,10×Buffer (2.5 μmol·L-1)2.5 μL,上、下游引物(20 μmol·L-1)各1 μL,Taq酶(5 U·μL-1) 0.5 μL。PDCoV的反应程序:94 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸5 min。PEDV反应程序:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸5 min。将扩增的目的基因片段与载体pMD19-T连接并转化至大肠杆菌DH5α。重组质粒经PCR鉴定并送至上海生工生物工程技术服务有限公司测序。测序结果与GenBank序列比对无误后,通过Nanodrop 2000测定质粒的OD值,用公式转换成拷贝数,作为标准品。
1.6.2 单一荧光定量RT-PCR的反应将制备的标准品分别进行10倍梯度稀释后进行PCR扩增。每个梯度做三个重复,对扩增结果进行分析,建立各自的标准曲线。同时对其熔解曲线进行分析,以排除引物二聚体及非特异性扩增的干扰。反应体系为SYBR Green Ⅰ Mix 7.5 μL,ROX Ⅱ 0.2 μL,上下游引物各(20 μmol·L-1)0.6 μL,模板1.5 μL,去离子水4.6 μL。PDCoV的反应条件:95 ℃ 5 min;95 ℃ 20 s,59 ℃ 20 s,72 ℃ 20 s,35个循环;PEDV的反应条件:95 ℃ 5 min;95 ℃ 20 s,53 ℃ 20 s,72 ℃ 20 s,35个循环。同时设置无菌水为阴性对照。
1.6.3 多重荧光定量RT-PCR的反应对多重荧光定量RT-PCR的反应温度,反应体系进行优化,确定反应条件。以梯度稀释的标准品为模板,反应体系为SYBR Green Ⅰ Mix 7.5 μL,ROX Ⅱ 0.2 μL,PDCoV上下游引物(20 μmol·L-1)各0.2 μL,PEDV上下游引物(20 μmol·L-1)各0.6 μL,PEDV模板1.2 μL,PDCoV模板0.4 μL,去离子水4.4 μL。反应条件:95 ℃ 5 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 20 s,35个循环。同时设置无菌水为阴性对照。
1.6.4 敏感度试验用有限稀释法对标准品进行稀释,用已经建立的反应条件进行定量检测,确定其敏感度。
1.6.5 特异性试验提取病毒PCV2、PRV、PBoV、TGEV的核酸(其中TGEV的RNA提取后,经反转录得到cDNA),按本试验所建立的检测方法进行扩增,同时设置无菌水作为阴性对照,PDCoV和PEDV的混合重组质粒阳性对照,检测该方法的特异性。
1.6.6 重复性试验将同一批不同稀释度的标准品按建立的方法重复3次进行组内重复试验,对3次不同时间段稀释的同一浓度的标准品进行组间重复试验,对试验结果进行统计,分析此方法的重复性。同时设置无菌水为阴性对照。
1.7 临床样品的检测对收集的130份临床样品进行检测,以本实验室建立的PDCoV和PEDV的双重SYBR Green Ⅰ荧光定量RT-PCR检测方法与普通RT-PCR检测方法进行同步检测,以掌握河北省腹泻病猪中PDCoV和PEDV的感染情况。
2 结果 2.1 标准品的制备用设计的特异性引物对提取的核酸进行特异性扩增,得到PDCoV(262 bp)和PEDV(145 bp)的预期大小基因片段。将PDCoV (262 bp)的片段与PEDV(145 bp)的片段分别克隆至pMD19-T载体后,经序列测定分析,与GenBank相应序列完全一致。重组质粒经Nanodrop 2000测定,PDCoV质粒的浓度为165 μg·mL-1,通过公式换算得到重组质粒的拷贝数为5.1×1010拷贝·μL-1,PEDV质粒的浓度为100 μg·mL-1,通过公式换算得到重组质粒的拷贝数为3.2×1010拷贝·μL-1。图 1为重组质粒PCR鉴定图。
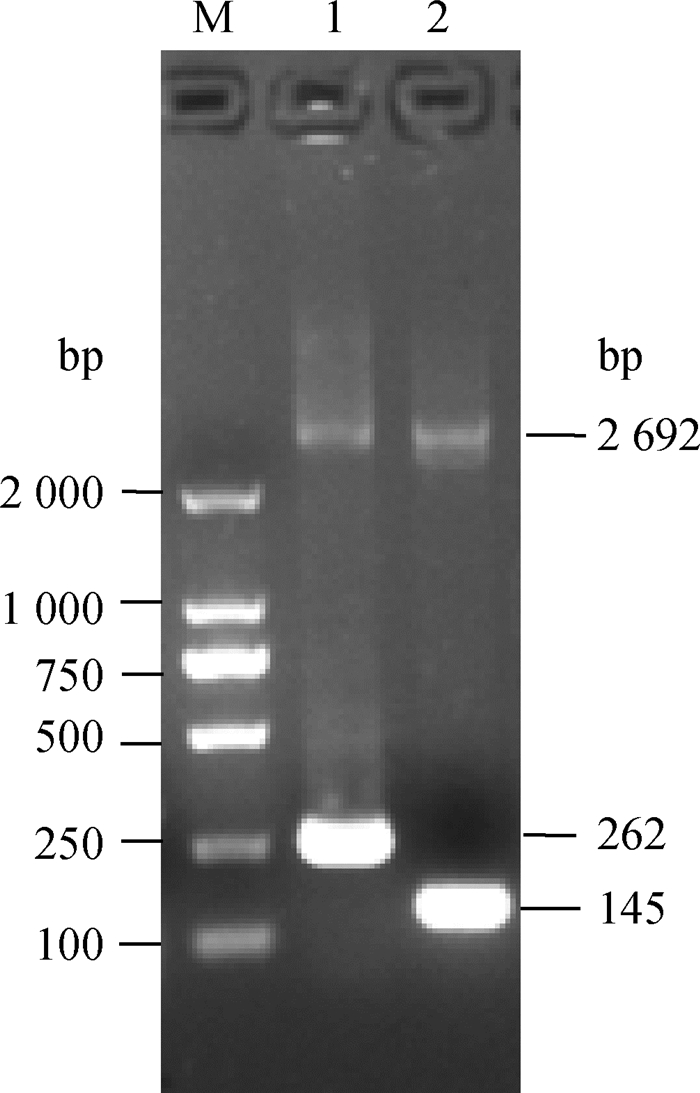
|
M. DL2000相对分子质量标准;1. PDCoV N基因条带;2. PEDV M基因条带 M. DL2000 marker; 1. PDCoV N gene stripe; 2. PEDV M gene stripe 图 1 重组质粒PCR鉴定 Figure 1 PCR identification of recombinant plasmid |
将制备的标准品10倍梯度稀释后进行荧光定量RT-PCR扩增,通过系统自动分析软件分析,可以得到以拷贝数的对数为纵坐标,Ct值为横坐标绘制荧光定量RT-PCR的标准曲线(图 2)。由图 2可知,在101~108拷贝·μL-1的范围内,构建的2个标准品的标准曲线均呈现良好的线性关系,扩增效率均大于90%,相关系数R2均在0.99以上。标准曲线比较理想。
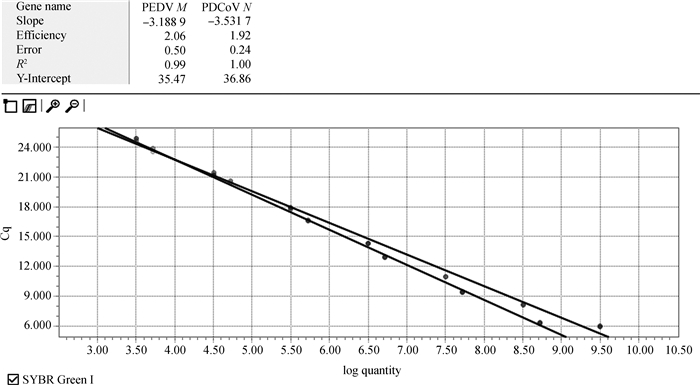
|
图 2 荧光定量标准曲线 Figure 2 Fluorometric standard graph |
标准品各个稀释度的熔解曲线有且仅有一个峰值,没有杂峰出现,其中PEDV M基因的熔解温度约为85 ℃,PDCoV N基因的熔解温度约为87 ℃(如图 3A所示)。双重荧光定量熔解曲线图如图 3B所示,熔解曲线有两个特异性峰值,分别为85和87 ℃,阴性对照没有峰值。
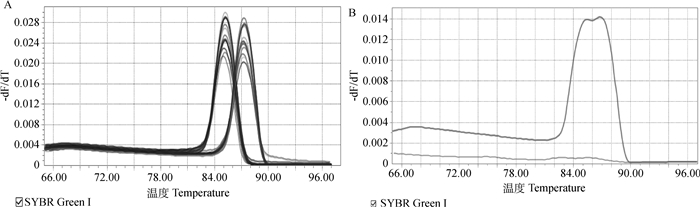
|
A.标准品的熔解曲线;B.双重荧光定量熔解曲线 A. The melting curve of the standard product; B. Two fluorescence quantitative melting curves 图 3 熔解曲线的分析 Figure 3 Analysis of the melting curve |
将标准品进行10倍梯度稀释,按照所建立的条件,进行荧光定量RT-PCR扩增。结果表明,双重的荧光定量RT-PCR最低可以检出含51拷贝·μL-1的PDCoV的样品,含32拷贝·μL-1的PEDV的样品。
2.5 特异性分析利用建立的荧光定量RT-PCR方法对PBoV、TGEV、PCV2和PRV进行特异性检测,并选取PDCoV和PEDV的混合重组质粒以作为阳性对照,以去离子水作阴性对照,结果如图 4所示,除阳性对照外,其他病毒与阴性对照均没有出现特异性扩增曲线,表明该检测方法的特异性较好。
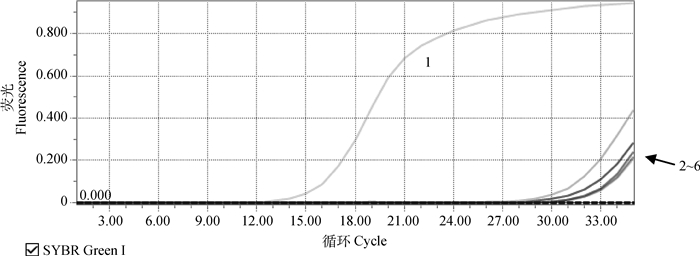
|
1.PDCoV和PEDV的混合重组质粒; 2~6. PBoV、TGEV、PCV2、PRV和水 1.PDCoV and PEDV recombinant plasmid; 2-6. PBoV, TGEV, PCV2, PRV, and water 图 4 特异性检测 Figure 4 Specificity detection |
为验证所建立的检测方法的重复性,对同一批稀释的标准品按建立的方法重复3次进行组内重复试验,并对3次不同时间稀释的同一浓度的标准品进行组间重复试验,结果显示,组内检测的变异系数为0.327%~1.901%,组间检测的变异系数为0.622%~2.858%,表明该方法具有较高的可重复性。
2.7 临床样品的检测用本试验所建立的PDCoV和PEDV的双重荧光定量RT-PCR检测方法,与普通RT-PCR检测方法分别对来自河北省不同地区的130份临床样本进行检测。检测结果显示,普通RT-PCR检测方法检出率较双重荧光定量RT-PCR检测方法检出率低,双重荧光定量RT-PCR检测方法PDCoV的检出率为16.9%(22/130),PEDV的检出率为66.2%(86/130),二者同时感染的检出率为2.3%(3/130),普通RT-PCR检测方法的PDCoV检出率为11.5%(15/130),PEDV的检出率为60.8%(79/130),二者同时感染的检出率为0.8%(1/130),结果提示这两年引起仔猪腹泻的主要病原仍为猪流行性腹泻病毒。
3 讨论PDCoV又称δ冠状病毒,是继α冠状病毒属的PEDV和猪传染性胃肠炎病毒(TGEV)之后,发现的又一能引起猪腹泻的冠状病毒,可引起各个年龄段猪的呕吐和腹泻,以及哺乳仔猪的脱水和死亡[10]。猪流行性腹泻是由PEDV引起仔猪腹泻、呕吐的一种高致死性的肠道传染病[11]。两者发病率均较高,给我国养猪业造成了巨大的经济损失,目前二者并没有有效的药物进行防治,且在发病症状,病理变化上均无明显差异,又易发生混合感染,因此,建立一种快速、准确而又灵敏的检测手段,对PDCoV和PEDV进行多重检测,是非常有必要的。
近年来,多重RT-PCR的诊断方法已被很多学者用于病原混合感染的鉴别诊断。传统的检测方法(如细胞分离培养、酶联免疫吸附试验等)虽能对病原鉴别诊断,但其具有耗时长、检测灵敏度低的缺点。而多重荧光定量RT-PCR技术是目前鉴别诊断二者的最为快速、灵敏的方法。胡慧等建立了PDCoV和TGEV的多重RT-PCR检测引物及检测方法,其对PDCoV和TGEV的最低检测量分别为40.5和547拷贝·μL-1 [12];任玉鹏等建立一种同时检测PEDV、TGEV、PDCoV的多重RT-PCR方法,其最低检测量分别为60.96、102.69和58.85 pg[13];陈小芬建立了一种检测PEDV、TGEV和PDCoV三重RT-PCR检测方法,检出PEDV、TGEV、PDCoV的最低含量分别为33.4、28.56、322.3 pg[14]。本研究建立了一种检测PDCoV和PEDV的双重SYBR Green Ⅰ荧光定量PCR方法,与以上学者的结果相比,结果更为灵敏,敏感度更好一些。
SYBR Green Ⅰ染料是一种非特异性染料,可以与DNA小沟进行结合,但其在多重PCR反应中并非均一结合,而会与某些片段优先结合[15],这就需要对其反应体系进行优化,本试验就对反应体系进行了优化,并最终确定了PDCoV和PEDV之间的比例。特异性试验结果显示,本试验建立的PDCoV和PEDV的双重SYBR Green Ⅰ荧光定量RT-PCR方法,能特异的扩增PDCoV和PEDV的靶基因片段,并利用熔解曲线的特异性峰值进行区分,而PBoV、TGEV、PCV2、PRV及去离子水均未见特异的扩增曲线,提示该方法具有良好的特异性。对2016年至2017年在河北省不同地区收集的130份临床样本进行PDCoV检测,结果显示,PDCoV的检出率为16.9%,PEDV的检出率为66.2%,二者同时感染的检出率为2.3%,提示这两年引起仔猪腹泻的主要病原仍为PEDV,但河北省猪群中存在PDCoV的感染,应加强该病的防控。
4 结论建立了一种快速检测猪丁型冠状病毒(PDCoV)与猪流行性腹泻病毒(PEDV)的双重SYBR Green Ⅰ荧光定量RT-PCR方法,其对PDCoV和PEDV的最低检测量分别为51和32拷贝·μL-1,与PBoV、TGEV、PRV、PCV2无交叉反应,特异性较好。用其检测130份仔猪腹泻样本,PDCoV检出率为16.9%,PEDV检出率为66.2%,二者同时感染的检出率为2.3%。为PDCoV和PEDV的诊断及分子流行病学调查提供了一种快速、定量检测方法。
| [1] |
方谱县, 方六荣, 董楠, 等. 猪δ冠状病毒的研究进展[J]. 病毒学报, 2016, 32(2): 243–248.
FANG P X, FANG L R, DONG N, et al. Research advances in the porcine deltacoronavirus[J]. Chinese Journal of Virology, 2016, 32(2): 243–248. (in Chinese) |
| [2] | WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel Mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus[J]. J Virol, 2012, 86(7): 3995–4008. DOI: 10.1128/JVI.06540-11 |
| [3] | WANG L Y, BYRUM B, ZHANG Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerg Infect Dis, 2014, 20(7): 1227–1230. |
| [4] |
陈建飞, 王潇博, 焦贺勋, 等. 国内首株猪德尔塔冠状病毒(Porcine deltacoronavirus)的分离鉴定[J]. 中国预防兽医学报, 2016, 38(3): 171–174.
CHEN J F, WANG X B, JIAO H X, et al. Isolation and identification of the first Porcine deltacoronavirus strain in China[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(3): 171–174. (in Chinese) |
| [5] |
逄凤娇, 俞正玉, 何孔旺, 等. 猪Deltacoronavirus RT-PCR检测方法的建立及其应用[J]. 中国预防兽医学报, 2015, 37(9): 683–686.
PANG F J, YU Z Y, HE K W, et al. Development and application of a RT-PCR assay for detection of porcine Deltacoronavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(9): 683–686. (in Chinese) |
| [6] |
王逸雯. 猪丁型冠状病毒感染率调查、全基因组克隆及进化分析[D]. 杭州: 浙江大学, 2016.
WANG Y W. Detection、full Length genomic cDNA cloning and phylogenetic analysis of porcine Deltacoronavirus in China[D]. Hangzhou: Zhejiang University, 2016. (in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3111307 |
| [7] |
张利卫, 曹贝贝, 张云飞, 等. 猪δ冠状病毒SYBR Green Ⅰ荧光定量RT-PCR检测方法的建立及初步应用[J]. 农业生物技术学报, 2017, 25(6): 969–975.
ZHANG L W, CAO B B, ZHANG Y F, et al. Development and application of SYBR Green Ⅰ real-time Reverse Transcription-PCR assay for detection of Porcine deltacoronavirus[J]. Journal of Agricultural Biotechnology, 2017, 25(6): 969–975. (in Chinese) |
| [8] | SUN R Q, CAI R J, CHEN Y Q, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J]. Emerg Infect Dis, 2012, 18(1): 161–163. DOI: 10.3201/eid1801.111259 |
| [9] | CHEN J F, LIU X Z, SHI D, et al. Complete genome sequence of a porcine epidemic diarrhea virus variant[J]. J Virol, 2012, 86(6): 3408. DOI: 10.1128/JVI.07150-11 |
| [10] | SONG D, ZHOU X, PENG Q, et al. Newly emerged porcine Deltacoronavirus associated with diarrhoea in swine in China: identification, prevalence and full-length genome sequence analysis[J]. Transbound Emerg Dis, 2015, 62(6): 575–580. DOI: 10.1111/tbed.2015.62.issue-6 |
| [11] |
甘孟侯, 杨汉春.
中国猪病学[M]. 北京: 中国农业出版社, 2005.
GAN M H, YANG H C. Chinese swine epidemiology[M]. Beijing: China Agriculture Press, 2005. (in Chinese) |
| [12] |
胡慧, 梁秀丽, 曹贝贝, 等. 猪德尔塔冠状病毒和猪传染性胃肠炎病毒多重RT-PCR检测引物及检测方法: 中国, CN105400910A[P]. 2016-03-16.
HU H, LIANG X L, CAO B B, et al. Porcine Deltacoronavirus and swine transmissible gastroenteritis virus multiplex RT-PCR detection primer and detection method: CN105400910A[P]. 2016-03-16. (in Chinese) |
| [13] |
任玉鹏, 张斌, 汤承, 等. 同时检测PEDV和TGEV及PDCoV的多重RT-PCR方法的建立及初步应用[J]. 中国兽医科学, 2016, 46(6): 756–762.
REN Y P, ZHANG B, TANG C, et al. Development and application of a multiplex RT-PCR for detecting PEDV, TGEV and PDCoV[J]. Chinese Veterinary Science, 2016, 46(6): 756–762. (in Chinese) |
| [14] |
陈小芬. PEDV/TGEV/PDCoV快速检测方法的建立及PEDV COE基因和ORF3基因遗传变异研究[D]. 广州: 华南农业大学, 2016.
CHEN X F. The Establishment of differential detection method to three different porcine diarrheal pathogene and gene sequence analysis to COE and ORF3 of PEDV[D]. Guangzhou: South China Agricultural University, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10564-1016922265.htm |
| [15] | GIGLIO S, MONIS P T, SAINT C P. Demonstration of preferential binding of SYBR Green Ⅰ to specific DNA fragments in real-time multiplex PCR[J]. Nucleic Acids Res, 2003, 31(22): e136. DOI: 10.1093/nar/gng135 |



