粉碎是饲料加工过程的重要工序,对饲料的生产能耗、颗粒质量和动物的生产性能、肠道健康都有很大的影响[1-3]。粉碎粒度过大,饲料在消化道内的消化率低,动物排泄的氮、磷等增加,污染环境的同时造成资源的极大浪费;而粒度过细,饲料能耗增加,同时容易造成动物胃肠道疾病,损害机体的健康。饲料粉碎粒度对家禽的影响与多种因素有关,如粉碎机类型(锤片式或对辊式)、饲料类型(玉米型或小麦型)、饲料物理形态(颗粒料或粉料)、饲粮的复杂度、家禽肠道发育情况等[4]。随着小麦在饲粮中使用量的增加,小麦型饲粮中非淀粉多糖的问题被酶制剂减弱后,人们更关注如何通过饲料加工技术科学合理的使用小麦,而适宜的粉碎粒度是关键的问题之一。
关于小麦粉碎粒度对家禽的影响研究相对较少。本研究主要考察在添加木聚糖酶的情况下,颗粒饲料中不同小麦粉碎粒度对肉鸡生产性能和肠道屏障功能的影响,为小麦型饲粮在肉鸡中的合理应用提供参考。
1 材料与方法 1.1 试验设计试验采用单因子设计,小麦通过5种孔径的筛片2、4、6、8、10 mm粉碎成5种粉碎粒度,共5个处理,每个处理7个重复,每个重复11只鸡,共选用385只艾拔益加(AA)肉公鸡。试验期42 d,分1~21 d和22~42 d两个阶段。
1.2 试验饲粮试验采用小麦-豆粕型饲粮。饲粮营养水平参照中国鸡饲养标准(2004),肉用仔鸡营养需要结合生产中实际饲粮营养水平设定。试验用豆粕粉碎过4 mm筛片。冷压制粒。饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及与营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
试验在四川农业大学动物营养研究所试验场进行。试验肉鸡均采用网上平养(高0.5 m×宽1 m×长1 m)。入雏前24 h将鸡舍升温至32~35 ℃,此后温度每周降低2~3 ℃,直至保持在22~24 ℃为止。采用连续光照、自然通风、自由采食和自由饮水的管理方式。定期打扫圈舍卫生,常规免疫。
1.4 测定指标及方法 1.4.1 生产性能测定分别于试验第22和43天提前12 h断料,以重复为单位称重,空腹称量肉鸡体重和剩余料重,计算阶段体增重(BWG)、阶段采食量(FI)和料肉比(F/G)。
1.4.2 空肠肠道形态观察及测定鸡屠宰后,分离空肠,在空肠中段处剪下约1 cm的肠段,用0.9%的生理盐水洗净后放入4%甲醛固定液中固定。将固定好的空肠修理后用乙醇脱水,二甲苯透明,石蜡包埋进行切片,然后用苏木精-伊红(HE)染色、光学显微镜下观察。测量空肠绒毛高度、隐窝深度、肠黏膜厚度,并计算绒毛高度/隐窝深度比(绒隐比)。
1.4.3 空肠黏膜紧密连接蛋白和炎性因子基因相对表达量检测使用总RNA试剂盒(TaKaRa)RNAiso试剂盒(TaKaRa,中国大连)提取空肠黏膜总RNA。cDNA的合成采用primeScript RT试剂盒(TaKaRa,中国大连),real-time PCR采用SYBR Premix Ex Taq(TaKaRa,中国大连)。采用Applied Biosystems 7900HT Real Time PCR系统(Applied Biosystems,CA)进行PCR扩增反应,扩增体系:SYBRGreenMix 10.0 μL,上、下游引物各0.5 μL,双蒸水8 μL,cDNA模板1.0 μL,总体积为20.0 μL。扩增条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火30 s,40个循环。基因表达水平的计算参考K.J.Livak和T.D.Schmittgen[5]的方法。采用384孔板,每个样品测定3个平行。基因相对表达量采用2-△△CT法分析,内参基因选用GAPDH。以6 mm的小麦粉碎粒度为对照组,引物设计使用Primer3.0软件。基因引物序列如表 2所示。
|
|
表 2 扩增目的基因和内参基因的引物序列 Table 2 The primer sequences amplifying target genes and house-keeping gene |
使用RT-PCR Taqman探针法(表 3)测定盲肠微生物数量。取肉鸡盲肠食糜样品,保存于液氮中,采用Bio-Rad公司CFX96实时定量PCR仪,乳酸杆菌、沙门氏菌、产气荚膜梭菌及大肠杆菌数量应用Taqman探针进行荧光定量PCR反应,使用SuperReal MaterMix试剂盒(TIANGEN,中国,北京)进行测定,采用10 μL反应体系:包括2×SuperRealpreMix 5 μL,上下游引物各0.3 μL,探针0.2 μL,ddH2O 3.2 μL和1 μL的DNA模板。总菌使用SYBR Premix Ex TaqTM II (Tli RNaseH Plus)试剂盒(TIANGEN,中国,北京)进行荧光定量PCR反应,采用20 μL反应体系:包括SYBR Premix Ex Taq Ⅱ10 μL,上、下游引物各0.8 μL,50×ROX Reference Dye 0.4 μL,ddH2O 6 μL和2 μL的DNA模板。
|
|
表 3 肉鸡盲肠微生物检测引物及探针序列 Table 3 Sequences of the primer and probe for the detection specific for cecal bacterias in broiler |
乳酸杆菌、大肠杆菌、产气荚膜梭菌及沙门氏菌数量采用Taqman探针法PCR扩增标准程序。大肠杆菌:95 ℃预变性15 min;95 ℃ 3 s,60 ℃ 30 s,共40个循环。大肠杆菌、产气荚膜梭菌和沙门氏菌分别共40个循环,乳酸杆菌共50个循环。
总菌采用SYBR法PCR扩增标准程序:95 ℃预变性10 s;95 ℃ 5 s,59.5 ℃ 25 s,共40个循环;熔解曲线条件为65 ℃ 5 s,95 ℃ 1 min,95 ℃ 10 s。
结果用每克内容物中细菌数量的常用对数表示[lg (copies·g-1)]。总细菌引物序列参考N.Fierer等[6]的方法;乳酸杆菌属及大肠杆菌属引物和探针序列参考葛忠源[7]的研究;沙门氏菌属引物和探针序列参考S.H.Lee等[8]的研究;产气荚膜梭菌属引物序列参考石玉玲等[9]的研究。
1.5 数据处理与统计采用SPSS21.0对数据进行单因素方差分析(one-way ANOVA)及线性(Linear)和二次(Quadratic)相关分析,差异显著者采用LSD法进行多重比较。分析结果用“平均值±SEM”表示,P<0.05表示差异显著。
2 结果 2.1 肉鸡颗粒饲料中的小麦粉碎粒度锤片粉碎机分别用孔径为2、4、6、8、10 mm的筛片进行粉碎,对应筛片粉碎小麦实测几何平均粒度分别为460、580、760、880、1 100 μm。具体粒度分布见图 1。
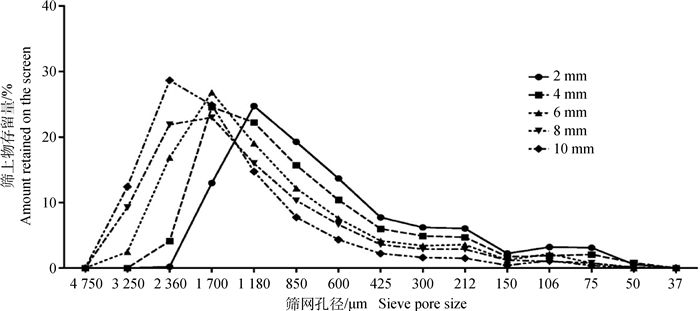
|
图 1 5种不同孔径筛片粉碎的小麦粒度分布 Figure 1 Particle size distribution of wheat with 5 different screen sizes |
从表 4可知,小麦粉碎粒度显著影响肉鸡1~21 d平均阶段增重(BWG)和采食量(FI),当粒度为4 mm时,BWG显著高于2、8、10 mm组(P<0.05),且BWG与小麦粉碎粒度呈显著的二次曲线关系(P<0.05);1~21 d当粒度为4和6 mm时,FI显著高于粒度为2 mm组(P<0.05),与其余各组没有显著差异;小麦粉碎粒度对22~42 d和1~42 d BWG和FI均无显著影响(P>0.05);小麦粉碎粒度显著影响肉鸡各阶段料肉比(F/G)(P<0.05),粒度为6 mm时,1~21 d肉鸡的F/G显著低于2、8、10 mm组(P<0.05);粒度为10 mm时,22~42 d和1~42 d肉鸡的F/G显著高于其余各组(P<0.05),且F/G与小麦粉碎粒度呈显著的线性相关(P<0.05)。
|
|
表 4 小麦粉碎粒度对肉鸡生产性能的影响 Table 4 Effects of wheat grinding particle size on growth performance of broilers |
从表 5可以看出,小麦粉碎粒度对肉鸡21和42 d的空肠肠道形态存在显著的影响(P<0.05)。21 d时,4、6 mm组空肠绒毛高度显著高于2、8 mm组(P<0.05),与10 mm组差异不显著(P>0.05);与2 mm组相比,4、6、8、10 mm组空肠隐窝深度显著降低(P<0.05),绒隐比显著增加(P<0.05),二者与小麦粉碎粒度呈显著的二次曲线关系(P<0.05);8 mm组空肠黏膜厚度显著低于4、6、10 mm组(P<0.05)。42 d时,绒毛高度、黏膜厚度和绒隐比呈显著的线性增加(P<0.05);4 mm组隐窝深度显著低于2、6、10 mm组,且隐窝深度与小麦粉碎粒度呈显著的二次曲线关系(P<0.05)。
|
|
表 5 小麦粉碎粒度对肉鸡空肠肠道形态的影响 Table 5 Effects of wheat grinding particle size on jejunum morphology of broilers |
由表 6可知,随着小麦粉碎粒度的增加,21 d时,肉鸡空肠黏膜ZO-1、occludin和claudin-1的mRNA表达量也相应提高,10 mm组occludin的mRNA表达量显著高于2、4和6 mm组(P<0.05),且ZO-1和occludin的mRNA表达量呈显著的线性增加(P<0.05);但42 d时,各组间没有显著差异(P>0.05)。
|
|
表 6 小麦粉碎粒度对肉鸡空肠黏膜紧密连接蛋白mRNA相对表达量的影响 Table 6 Effects of wheat grinding particle size on the relative expression of tight joint protein mRNA of broilers |
由表 7可知,21 d时,与2 mm组相比,随着小麦粉碎粒度的增加,肉鸡空肠黏膜IL-4的mRNA表达量显著提高(P<0.05),且呈显著的线性增加(P<0.05);对TNF-α、IL-6和IL-1β mRNA表达量没有显著影响(P>0.05)。42 d时,各组间无显著差异(P>0.05)。
|
|
表 7 小麦粉碎粒度对肉鸡空肠黏膜炎性因子mRNA相对表达量的影响 Table 7 Effects of wheat grinding particle size on mRNA expression for inflammatory factors of jejunum in broiler |
由表 8可知,随着小麦粉碎粒度的增加,肉鸡盲肠食糜中乳酸杆菌的数量显著增加(P<0.05),呈显著的线性增加(P<0.05),沙门氏菌、大肠杆菌、产气荚膜梭菌的数量显著降低(P<0.05),呈显著的线性降低(P<0.05),而总菌数量与小麦粉碎粒度呈显著的二次曲线关系(P<0.05)。
|
|
表 8 小麦粉碎粒度对肉鸡盲肠微生物数量的影响 Table 8 Effects of wheat grinding particle size on microbial count in caecum of broilers |
大量研究表明,饲料原料的粉碎粒度对肉鸡生长性能有着很重要的影响,粉碎粒度过大或者过小都不利于肉鸡的生长。同时,粉碎粒度对生产性能的影响与料型有很大关系。经过制粒后,粉碎粒度就主要取决于颗粒饲料在嗉囊内溶化破碎后的粒度[10]。有研究表明,不同粉碎粒度的玉米型日粮、小麦型日粮和玉米-小麦型日粮均不影响肉鸡的采食量、体增重和饲料转化率[11-13]。但本研究表明,小麦粉碎粒度与肉鸡体增重和采食量呈二次曲线关系,而与前期料肉比呈显著的二次曲线关系,与后期和全期料肉比呈显著的线性关系,这和A.M. Amerah等[14]得到的颗粒料中粗粉碎(7 mm孔径)相对中等粉碎(3 mm孔径)的料肉比要低的结果一致。同时也有报道认为,粉碎粒度较小的玉米日粮提高了肉鸡的体增重和饲料转化率[15],这与本试验中粉碎较小的小麦型饲粮对肉鸡生产性能的影响作用也是一致的。且I. Nir等[10]研究报道,肉鸡饲料谷物的粉碎粒度为中粒度即700~900 μm时,肉鸡的生长性能最佳;有关研究报道,粉碎粒度从0.9 mm增加到1.47~1.75 mm,肉仔鸡的增重及饲料转化率明显降低。本试验结果也表明,4~6 mm孔径(几何粒径为580~760 μm)时,肉鸡的生产性能最佳,当粒径再增加时生产性能降低,这与前人结果基本一致。但在W.A.Dozier等[16]的研究中发现,料肉比和玉米粉碎粒度没有显著关系。P.M.Clark等[17]也发现,饲喂玉米型饲粮时,料肉比随粉碎粒度增大而递减。张现玲等[18]在玉米-豆粕型饲粮中,谷物通过1.5、2.0、2.5和3 mm 4个不同的筛片孔径粉碎,在相同调质温度下,随着粒度的增加,体重和采食量也显著增加,但对料肉比没有显著影响。说明,颗粒饲料中粉碎粒度对肉鸡生产性能仍然有一定的影响,这种影响可能与谷物种类,谷物特性以及试验动物品种都有一定的关系。
研究发现,在1~21 d肉鸡中,小麦粒度不影响肉鸡生产性能,添加酶制剂也不影响体增重和采食量,但饲料粒度和酶制剂在料肉比上存在显著的互作效应,粗粒度(7 mm孔径)饲粮添加酶制剂降低了料肉比[14]。本试验饲粮类型为小麦-豆粕型,所以在饲粮中添加了相同剂量的木聚糖酶。从本试验结果来看,小麦通过4~6 mm孔径(几何粒径为580~760 μm)时,肉鸡的生产性能最佳,当粒径再增加时生产性能却出现降低。这与前人的研究结果一致。说明不同粉碎粒度小麦对肉鸡生产性能的影响与饲粮中木聚糖酶的添加也有一定关系。
3.2 颗粒饲料中小麦粉碎粒度对肉鸡空肠机械屏障的影响机械屏障又称物理屏障,在肠道屏障中尤为重要,它是由肠黏膜上皮细胞及其紧密连接等组成的完整的彼此紧密连接的肠道上皮结构[19]。空肠是营养物质吸收的重要部位,其上皮细胞发育状况直接影响营养代谢和生长性能。张春兰等[20]在蛋鸡上的研究发现,十二指肠绒毛高度、绒隐比随玉米粒度的增加而增加,而隐窝深度相应降低(P < 0.05)。田玉民等[21]发现,饲喂粗粉碎粒度的肉鸡空肠绒毛较高,而空肠肌层厚度较薄。本研究表明,肉鸡空肠绒毛高、黏膜层厚和绒隐比都随粉碎粒度的增大线性递增及先增大后减小的二次曲线关系。这与前人的研究结果一致。可能是由于粒度大的饲粮在消化道中流通时间较长,对肠绒毛及肠腺的刺激作用导致的。G.G.Zhang等[22]得到类似结论。但也有不一致的报道,有研究报道表明,粉碎粒度对肉鸡肠道形态没有显著影响[23]。I.Rhe等[24]研究发现,无论是粉料还是破碎料,细粉碎组的绒毛均高于粗粉碎组。造成这种不一致可能是试验阶段及饲粮类型不同所导致的。
紧密连接主要由跨膜蛋白(Occludin、claudins、Junctional adhesion molecules、Tricellulin和Nectin)、胞质蛋白ZO(Zonula occludens proteins)家族和细胞骨架结构共同构成的复合物。J. W.Zhao等[25]发现,occludin和claudin能够通过影响紧密连接通透性维持来调节肠道物理屏障功能。本研究表明,饲喂颗粒料21 d,ZO-1、occludin和claudin mRNA相对表达量均随小麦粉碎粒度的增大呈线性递增。42 d时ZO-1、occludin和claudin1相对表达量没有显著影响。说明在1~21 d增大粉碎粒度有利于维持空肠黏膜机械屏障的完整性,利于肠道健康,但不是越大越好。关于饲料粉碎粒度对肠道紧密连接蛋白基因表达的研究目前未见报道。有研究表明,肠道上皮细胞紧密连接蛋白的基因表达量与肠道细菌的代谢产物有关[26]。有害微生物黏附于肠道上皮细胞,会引起肠黏膜功能紊乱,紧密连接屏障被破坏[27]。饲料粉碎粒度可能通过影响肠道微生物进而影响肠道黏膜紧密连接蛋白的基因表达,但其具体作用机理还需进一步研究。
3.3 颗粒饲料中小麦粉碎粒度对空肠免疫屏障功能的影响肠道作为动物体中最大的免疫器官承担着耐受饲粮抗原和免疫防御的双重任务。白介素(Interteukin, IL)对免疫细胞分化及免疫应答的调节有重要作用[28]。IL-1、IL-6为促炎细胞因子,参与细胞免疫反应;而IL-4为抗炎细胞因子,参与体液免疫[29]。IL-1β和IL-6能激活多种免疫和炎症细胞,引起肠道炎症反应及组织破坏,其mRNA的表达与肠道炎症的发生密切相关[30]。D.C. Baumgart和S.R. Carding[31]研究证实,动物肠道黏膜免疫功能常与细胞因子调控的炎症反应有关。关于饲料粉碎粒度对肠道免疫屏障功能的影响目前未见报道。本试验结果表明,随着小麦粉碎粒度的增加,21 d时肉鸡空肠黏膜IL-4的mRNA表达量显著提高(P<0.05),呈显著的线性递增,但小麦粉碎粒度对TNF-α、IL-6和IL-1β mRNA表达量没有显著影响。鉴于肠道健康与细胞因子间的关系,可以推测,粉碎粒度可能通过影响肠道健康进而影响细胞因子的表达量,小麦粉碎粒度较大,有利于肠道健康。而肠道健康与肠道微生物有密切关系。研究表明,在肉仔鸡饲粮中添加鲍氏酵母菌和枯草芽孢杆菌可显著增加occludin、claudin-2、claudin-3的mRNA表达,并显著增加小肠绒毛高度、宽度、杯状细胞数量,显著改善肠道的白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)等的含量[32]。饲料粉碎粒度可促进肠道乳酸杆菌等有益菌的生长[33-34]。粉碎粒度对肠道免疫屏障功能的影响还有待进一步的研究。
3.4 颗粒饲料中小麦粉碎粒度对盲肠微生物屏障的影响肠道微生物屏障是一个由肠道共生菌与宿主的微空间结构形成的微生态系统。肠道微生物对宿主的作用有两面性,正常情况下可帮助宿主消化难以吸收的物质,并转化为宿主所能利用的养分,如氨基酸、挥发性脂肪酸等;当微生态失去平衡时,则可能转化为潜在危害。有研究表明,细粉碎的饲料能增加禽类盲肠内病原微生物的数量,危害宿主健康[35]。G. Glünder[36]研究表明,饲料中添加整粒的谷物能增加肠道乳酸杆菌并减少大肠杆菌数。C. Jacobs等[33]在21 d肉鸡上的研究发现,乳酸杆菌数随粉碎粒度的增大而递增(玉米粉碎粒度为557、858、1 210、1 387 μm)。Y. Singh等[34]发现,随着玉米粉碎粒度的增加,乳酸杆菌呈线性递增,而总菌则呈线性递减。本研究表明,21和42 d乳酸杆菌都随粉碎粒度的增大而呈线性递增或二次曲线变化;沙门氏菌、大肠杆菌和产气荚膜梭菌随粉碎粒度的增大线性递减。这与前人的报道一致。其原因可能是较大粒度促进肌胃发育,增加胃酸的分泌及进入肠道,降低肠道pH而有益于乳酸杆菌的生长,不利于沙门氏菌、大肠杆菌等有害微生物的生长[37-38]。但Z. Bao等[39]研究发现,在猪上大肠杆菌数量随粉碎粒度的增加先降低后增加,而乳酸杆菌数量随玉米粉碎粒度的增大先增高后降低(玉米粉碎粒度为330、430、450、470、580和670 μm)。张春兰等[20]在蛋鸡上的研究发现,乳酸杆菌随玉米粉碎粒度的增大呈先增高后降低的趋势,而对大肠杆菌数影响不显著。C. Jacobs等[33]得到类似结果,即玉米粉碎粒度对肉鸡大肠杆菌数影响不显著。导致研究结果不完全一致的原因可能与饲料类型、原料种类及动物种类不同有关;也可能与不同粒度原料在通过前肠消化后,到达后肠时食糜中的组分不同以及食糜的表面结构不同进而影响微生物的增殖有关。
4 结论本试验条件下,小麦粉碎粒度显著影响肉鸡1~21 d的生产性能,以中细粉碎粒度较为适宜。小麦粉碎粒度显著改善21 d肉鸡空肠形态和空肠黏膜occludin和IL-4 mRNA的表达量,显著增加肉鸡盲肠食糜中乳酸杆菌的数量,降低沙门氏菌、大肠杆菌、产气荚膜梭菌的数量,以中粗粉碎粒度效果更好。综合考虑,在肉鸡颗粒饲粮(含木聚糖酶)中小麦通过4~6 mm筛片粉碎时较适宜。
| [1] | DEATON J W, LOTT B D, SIMMONS J D. Hammer mill versus roller mill grinding of corn for commercial egg layers[J]. Poult Sci, 1989, 68(10): 1342–1344. DOI: 10.3382/ps.0681342 |
| [2] | AMERAH A M, RAVINDRAN V, LENTLE R G, et al. Influence of particle size and xylanase supplementation on the performance, energy utilisation, digestive tract parameters and digesta viscosity of broiler starters[J]. Br Poult Sci, 2008, 49(4): 455–462. DOI: 10.1080/00071660802251749 |
| [3] | RAVINDRAN V, WU Y B, THOMAS D G, et al. Influence of whole wheat feeding on the development of gastrointestinal tract and performance of broiler chickens[J]. Aust J AgricRes, 2006, 57(1): 21–26. DOI: 10.1071/AR05098 |
| [4] | AMERAH A M, RAVINDRAN V, LENTLE R G, et al. Feed particle size: implications on the digestion and performance of poultry[J]. World's Poult Sci J, 2007, 63(3): 439–455. DOI: 10.1017/S0043933907001560 |
| [5] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [6] | FIERER N, JACKSON J A, VILGALYS R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Appl Environ Microbiol, 2005, 71(7): 4117–4120. DOI: 10.1128/AEM.71.7.4117-4120.2005 |
| [7] |
葛忠源. 荧光定量PCR检测DPV弱毒免疫鸭消化道和呼吸道大肠杆菌、葡萄球菌、乳酸杆菌及其数量变化规律的研究[D]. 成都: 四川农业大学, 2006.
GE Z Y. Establishment of real-time fluorescence quantitative PCR(FQ-PCR)for Escherichia, Staphylococcus, Lactobacillus and analysis quantity change rule of the microflora in enteron and respiratory system for Cherry-valley duck immuned with Low Duck-Plague-Virus(DPV)[D]. Chengdu: Sichuan Agricultural University, 2006. (in Chinese) |
| [8] | LEE S H, JUNG B Y, RAYAMAHJI N, et al. A multiplex real-time PCR for differential detection and quantification of Salmonella spp., Salmonella enterica serovar Typhimurium and Enteritidis in meats[J]. J Vet Sci, 2009, 10(1): 43–51. DOI: 10.4142/jvs.2009.10.1.43 |
| [9] |
石玉玲, 曾兰兰, 陈丽丹, 等. 产气荚膜梭菌实时荧光PCR方法的建立[J]. 生物技术通讯, 2010, 21(3): 389–392.
SHI Y L, ZENG L L, CHEN L D, et al. Establishment of Real-Time PCR method for detection of Clostridium perfringens[J]. Letters in Biotechnology, 2010, 21(3): 389–392. (in Chinese) |
| [10] | NIR I, HILLEL R, PTICHI I, et al. Effect of particle size on performance. 3. Grinding pelleting interactions[J]. Poult Sci, 1995, 74(5): 771–783. DOI: 10.3382/ps.0740771 |
| [11] | REECE F N, LOTT B D, DEATON J W. Effects of environmental temperature and corn particle size on response of broilers to pelleted feed[J]. Poult Sci, 1986, 65(4): 636–641. DOI: 10.3382/ps.0650636 |
| [12] | PRESTON C M, MCCRACKEN K J, MCALLISTER A. Effect of diet form and enzyme supplementation on growth, efficiency and energy utilisation of wheat-based diets for broilers[J]. Br Poult Sci, 2000, 41(3): 324–331. DOI: 10.1080/713654933 |
| [13] |
张亮, 杨在宾, 杨维仁, 等. 不同料型和粉碎粒度对肉鸡生产性能、屠宰性能和消化道发育的影响[J]. 山东农业大学学报:自然科学版, 2016, 47(1): 139–146.
ZHANG L, YANG Z B, YANG W R, et al. Effect of diet form and size on the growth, slaughter performance and development of digestive tract[J]. Journal of Shandong Agricultural University: Natural Science Edition, 2016, 47(1): 139–146. (in Chinese) |
| [14] | AMERAH A M, RAVINDRAN V, LENTLE R G, et al. Influence of feed particle size on the performance, energy utilization, digestive tract development, and digesta parameters of broiler starters fed wheat-and corn-based diets[J]. Poult Sci, 2008, 87(11): 2320–2328. DOI: 10.3382/ps.2008-00149 |
| [15] | KILBURN J, EDWARDS H M Jr. The response of broilers to the feeding of mash or pelleted diets containing maize of varying particle sizes[J]. Br Poult Sci, 2001, 42(4): 484–492. DOI: 10.1080/00071660120070578 |
| [16] | DOZIER W A, BEHNKE K, KIDD M T, et al. Effects of the addition of roller mill ground corn to pelleted feed on pelleting parameters, broiler performance, and intestinal strength[J]. J ApplPoult Res, 2006, 15(2): 236–244. |
| [17] | CLARK P M, BEHNKE K C, FAHRENHOLZ A C. Effects of feeding cracked corn and concentrate protein pellets on broiler growth performance[J]. J Appl Poult Res, 2009, 18(2): 259–268. DOI: 10.3382/japr.2007-00040 |
| [18] |
张现玲, 段海涛, 倪海球, 等. 调质温度和粉碎粒度对肉鸡生长性能及养分表观利用率的影响[J]. 动物营养学报, 2015, 27(7): 2052–2059.
ZHANG X L, DUAN H T, NI H Q, et al. Effects of steam conditioning temperature and particle size on nutrient apparent utilization and growth performance of broilers[J]. Chinese Journal of Animal Nutrition, 2015, 27(7): 2052–2059. (in Chinese) |
| [19] | VICENTE Y, DAROCHA C, YU J K, et al. Architecture and function of the gastroesophageal barrier in the piglet[J]. Digest Dis Sci, 2001, 46(9): 1899–1908. DOI: 10.1023/A:1010631030320 |
| [20] |
张春兰, 张克英, 丁雪梅, 等. 玉米粒度对蛋鸡消化道生理及饲料流通速率的影响[J]. 动物营养学报, 2010, 22(5): 1271–1278.
ZHANG C L, ZHANG K Y, DING X M, et al. Effects of corn grains particle size on gastrointestinal physiology and feed passage rate of laying hens[J]. Chinese Journal of Animal Nutrition, 2010, 22(5): 1271–1278. (in Chinese) |
| [21] |
田玉民, 王军. 饲粮粒度对肉仔鸡生产性能及消化道发育的影响[J]. 粮食与饲料工业, 2010(3): 44–46.
TIAN Y M, WANG J. Effect of feed particle size on production performance and digestive tract development of broilers[J]. Cereal & Feed Industry, 2010(3): 44–46. (in Chinese) |
| [22] | ZHANG G G, YANG Z B, WANG Y, et al. Effects of Astragalus membranaceus root processed to different particle sizes on growth performance, antioxidant status, and serum metabolites of broiler chickens[J]. Poult Sci, 2013, 92(1): 178–183. DOI: 10.3382/ps.2012-02432 |
| [23] | ZANG J J, PIAO X S, HUANG D S, et al. Effects of feed particle size and feed form on growth performance, nutrient metabolizability and intestinal morphology in broiler chickens[J]. Asian-Australas J Anim Sci, 2009, 22(1): 107–112. DOI: 10.5713/ajas.2009.80352 |
| [24] | RÖHE I, RUHNKE I, KNORR F, et al. Effects of grinding method, particle size, and physical form of the diet on gastrointestinal morphology and jejunal glucose transport in laying hens[J]. Poult Sci, 2014, 93(8): 2060–2068. DOI: 10.3382/ps.2013-03783 |
| [25] | ZHAO J W, BENAKANAKERE M R, HOSUR K B, et al. Mammalian target of rapamycin (mTOR) regulates TLR3 induced cytokines in human oral keratinocytes[J]. Mol Immunol, 2010, 48(1-3): 294–304. DOI: 10.1016/j.molimm.2010.07.014 |
| [26] | MIYAUCHI E, MORITA M, ROSSI M, et al. Effect of D-alanine in teichoic acid from the Streptococcus thermophilus cell wall on the barrier-protection of intestinal epithelial cells[J]. Biosci Biotechol Biochem, 2012, 76(2): 283–288. DOI: 10.1271/bbb.110646 |
| [27] |
姜伟炜, 张文远. 紧密连接蛋白与炎症性肠病[J]. 国际消化病杂志, 2010, 30(2): 99–100, 114.
JIANG W W, ZHANG W Y. Tight junction and inflammatory bowel disease[J]. International Journal of Digestive Diseases, 2010, 30(2): 99–100, 114. (in Chinese) |
| [28] |
徐永莉, 王红宁, 黄勇, 等. 鸡白介素的分子生物学和应用研究进展[J]. 动物医学进展, 2007, 28(6): 57–60.
XU Y L, WANG H N, HUANG Y, et al. Advance and application of chicken interleukin[J]. Progress in Veterinary Medicine, 2007, 28(6): 57–60. (in Chinese) |
| [29] |
崔玉芳, 徐菡, 安小霞, 等. T辅助细胞亚群与炎症性肠病的关系[J]. 世界华人消化杂志, 2005, 13(20): 2464–2468.
CUI Y F, XU H, AN X X, et al. Relationship between T-helper-cell subgroups and inflammatory intestinal diseases[J]. World Chinese Journal of Digestology, 2005, 13(20): 2464–2468. DOI: 10.3969/j.issn.1009-3079.2005.20.013 (in Chinese) |
| [30] |
魏思忱, 李春英. 细胞因子与溃疡性结肠炎治疗的研究进展[J]. 国际消化病杂志, 2008, 28(5): 380–382.
WEI S C, LI C Y. Research progress on cytokines in treatment of ulcerative colitis[J]. International Journal of Digestive Diseases, 2008, 28(5): 380–382. (in Chinese) |
| [31] | BAUMGART D C, CARDING S R. Inflammatory bowel disease: cause and immunobiology[J]. The Lancet, 2007, 369(9573): 1627–1640. DOI: 10.1016/S0140-6736(07)60750-8 |
| [32] | RAJPUT I R, LI L Y, XIN X, et al. Effect of Saccharomyces boulardii and Bacillus subtilis B10 on intestinal ultrastructure modulation and mucosal immunity development mechanism in broiler chickens[J]. Poult Sci, 2013, 92(4): 956–965. DOI: 10.3382/ps.2012-02845 |
| [33] | JACOBS C, UTTERBACK P, PARSONS C M. Effects of corn particle size on growth performance and nutrient utilization in young chicks[J]. Poult Sci, 2010, 89(3): 539–544. DOI: 10.3382/ps.2009-00434 |
| [34] | SINGH Y, RAVINDRAN V, WESTER T J, et al. Influence of feeding coarse corn on performance, nutrient utilization, digestive tract measurements, carcass characteristics, and cecal microflora counts of broilers[J]. Poult Sci, 2014, 93(3): 607–616. DOI: 10.3382/ps.2013-03542 |
| [35] | BJERRUM L, PEDERSEN K, ENGBERG R M. The influence of whole wheat feeding on Salmonella infection and gut flora composition in broilers[J]. Avian Dis, 2005, 49(1): 9–15. DOI: 10.1637/7223-061504R |
| [36] | GLVNDER G. Influence of diet on the occurrence of some bacteria in the intestinal flora of wild and pet birds[J]. Dtsch Tierarztl Wochenschr, 2002, 109(6): 266–270. |
| [37] | SANTOS F B O, SHELDON B W, SANTOS Jr A A, et al. Influence of housing system, grain type, and particle size on Salmonella colonization and shedding of broilers fed triticale or corn-soybean meal diets[J]. Poult Sci, 2008, 87(3): 405–420. DOI: 10.3382/ps.2006-00417 |
| [38] | GABRIEL I, MALLET S, LECONTE M, et al. Effects of whole wheat feeding on the development of the digestive tract of broiler chickens[J]. Anim Feed Sci Technol, 2008, 142(1-2): 144–162. DOI: 10.1016/j.anifeedsci.2007.06.036 |
| [39] | BAO Z, LI Y, ZHANG J, et al. Effect of particle size of wheat on nutrient digestibility, growth performance, and gut microbiota in growing pigs[J]. Livest Sci, 2016, 183: 33–39. DOI: 10.1016/j.livsci.2015.11.013 |



