2. 北京市华都峪口禽业有限责任公司, 北京 101206
2. Beijing Huadu Yukou Poultry Industry Co. LTD., Beijing 101206, China
鸡蛋作为一种物美价廉、营养全面的畜禽产品,深受世界各地消费者的喜爱。近年来,随着我国人民生活水平的提高和蛋鸡养殖技术的进步,消费者对鸡蛋品质和安全变得越来越关注。蛋壳胶护膜是蛋壳最外层的一层膜,在阻挡外界细菌侵入和保证鸡蛋新鲜度等方面发挥着重要的作用[1-2]。它形成于鸡蛋产出前1.5~2 h[3],是由子宫部的无纤毛细胞分泌的一种颗粒聚集物,颗粒直径小于1 μm,厚度约为0.5~12.8 μm[4-5]。蛋壳胶护膜是由内层钙化结构和外层的非钙化水不溶层组成[6],内层为一层薄薄的羟基磷灰石,外侧的非钙化层主要由一些大分子组成,包括糖蛋白、多聚糖、脂肪和一些无机磷,其中糖蛋白占90%以上[7],大约包含47种蛋白质[8-9],大多是水不溶性蛋白质。胶护膜参与蛋壳矿化的终止[10],同时通过覆盖在气孔表面,调节鸡蛋内外的水气交换[10],此外它还是鸡蛋内容物的天然抑菌屏障,能够有效的减少细菌等病原微生物的附着和渗透[11-12]。研究表明,将蛋壳表面的胶护膜去除后,鸡蛋被细菌入侵的机率明显上升,被沙门氏菌入侵的机率可增加20%~60%[13]。随着保存时间增加,蛋壳表面细菌中的糖酵素和真菌也会逐渐溶解蛋壳胶护膜,入侵鸡蛋造成污染[14-15]。因此,鸡蛋胶护膜在保证鸡蛋的新鲜度、防止细菌入侵和品质安全等方面发挥着重要的作用。
目前蛋壳胶护膜品质的评估方法主要依据1973年R.G.Board和N.A.Halls[16]构建的MST蓝染液法,后人在此基础上进行了不断的修改和完善。MST蓝染液是蛋壳表面胶护膜的一种可靠的指示剂,它可对胶护膜着色但不影响蛋壳颜色。该方法操作简便,将完整鸡蛋在MST蓝染料中浸泡后清水冲洗,自然晾干后观察。R.G.Board和N.A.Halls[16]根据染色深浅从感官上将胶护膜品质分为12个等级,1级染色最浅胶护膜品质最差,12级染色最深胶护膜品质最好。随着技术水平的提高,S.Leleu等[17]使用CM-2600d分光测色仪对MST染色深浅进行数字化测量,定义胶护膜品质参数△E,计算公式为
洛岛红是蛋鸡标准品种之一,常用于褐壳/粉壳蛋鸡配套系的培育。本研究所选取的洛岛红蛋鸡群体来自北京市华都峪口禽业有限责任公司核心育种场,试验期间每只鸡收集第36周龄鸡蛋一个,对其胶护膜品质、蛋壳颜色(L*、a*、b*)、蛋壳厚度和蛋壳强度等蛋壳品性状进行测定。本研究通过对洛岛红蛋鸡纯系的胶护膜品质及其它蛋壳品质指标进行评价,在阐述该性状的重要性及遗传特性的同时分析它与其它蛋壳品质的遗传和表型关联,以期为我国褐壳/粉壳蛋鸡品种的胶护膜性状优化选育、鸡蛋自身抗菌性能的强化提高提供理论支持。
1 材料与方法 1.1 试验群体试验鸡群来自北京市华都峪口禽业有限责任公司饲养的洛岛红蛋鸡纯系第14代群体,共包含120个公鸡家系3 283只母鸡个体。所有试验鸡只均为个体单笼饲养,光照时间、饲养环境和饲料日粮完全相同。鸡群第36周龄时连续2 d收集鸡蛋,确保每只母鸡个体收集一个鸡蛋用于蛋品质性状的测定。
1.2 试剂仪器MST蓝染液:英国M.S.科技有限公司;ISP-REF反射用积分球:美国海洋光学公司;CM-700d分光测色仪:日本柯尼卡美能达公司;蛋壳强度测定仪:日本Robotmation公司;螺旋测微仪:日本富士公司。
1.3 性状的测定 1.3.1 蛋壳胶护膜品质测定使用MST蓝染料对蛋壳进行染色,使用ISP-REF反射用积分球测定染色前后660 nm处反射率的差值。鸡蛋浸入MST蓝染料染色1 min,清水冲去残留染液,自然晾干24 h。染色前后反射率均为鸡蛋的钝、中、锐3处均值。
1.3.2 蛋壳颜色测定使用颜色分光测色仪(CM-700d)进行蛋壳颜色(L*、a*、b*)的测定,每个鸡蛋均为钝、中、锐3处L*、a*、b*值的均值。
1.3.3 蛋壳强度测定使用蛋壳强度测定仪进行蛋壳强度的测定,鸡蛋钝端朝上垂直放置,记录强度数值。
1.3.4 蛋壳厚度测定使用螺旋测微仪进行蛋壳厚度测定。蛋壳打破后将内外壳膜拨离,测量蛋壳钝、中、锐3处厚度求均值。
1.4 数据处理和统计分析将各性状测试结果以及系谱信息导入到DMU软件中,使用DMUAI模块分别计算性状的描述统计量,估计各性状的遗传力、遗传相关和表型相关等参数。
DMUAI应用约束性最大似然法(Restricted maximum likelihood,REML)估计方差组分,并估计模型里所有的效应值。该方法使用的算法为平均信息算法(Average information, AI)结合期望最大化算法(Expectation maximization, EM),即AI迭代过程跳出参数空间时使用EM纠正。本研究估计各性状遗传参数使用的动物模型:
| $ y = X\beta + Za + e $ |
其中,a~N(0,A
图 1为洛岛红鸡蛋胶护膜品质评价结果的示意图。1~6号蛋染色前后的反射率差值分别为45.12%、32.82%、26.16%、20.78%、11.21%和4.01%,对应的胶护膜品质从优到劣。
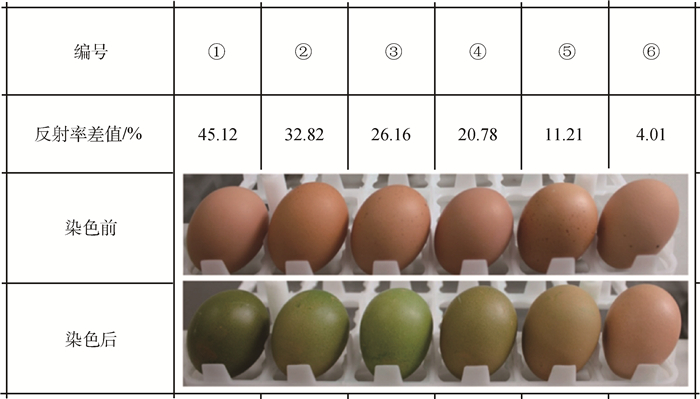
|
图 1 蛋壳MST染色前后对比 Figure 1 Comparison of eggshell color before and after MST staining |
表 1给出了本研究测定的洛岛红纯系的蛋品质性状的描述性统计量,包括蛋壳胶护膜品质、蛋壳颜色(L*、a*、b*)、蛋壳强度和蛋壳厚度,它们的值分别为(24.24±9.13)%、(61.45±4.91)、(17.79±2.34)、(30.59±2.50)、(3.22±0.75) kg·cm-2和(324.85±42.37) μm。其中胶护膜品质的变异系数最大,为37.56%;蛋壳颜色(L*、a*、b*)、蛋壳强度和蛋壳厚度的变异系数相对较小,分别为7.99%、13.13%、8.14%、23.44%和13.04%。
|
|
表 1 洛岛红鸡蛋壳胶护膜品质和其它蛋壳品质性状的描述性统计 Table 1 Descriptive statistics of cuticle and other eggshell quality traits in Rhode Island Red hens |
表 2列出了该洛岛红群体胶护膜品质、蛋壳颜色(L*、a*、b*)、蛋壳强度和蛋壳厚度的遗传力和各性状间的表型相关和遗传相关。其中蛋壳胶护膜品质遗传力为0.40,为中等遗传力。蛋壳颜色L*、a*值的遗传力分别为0.33、0.39,为中等或中等偏下的遗传力。蛋壳颜色b*值、蛋壳强度和蛋壳厚度的遗传力分别为0.20、0.25和0.17,属于低遗传力。
|
|
表 2 蛋壳胶护膜品质与其它蛋壳品质性状的遗传参数估计 Table 2 Estimation of genetic parameters in cuticle and other eggshell quality traits |
本研究测定的蛋壳品质性状间的遗传相关和表型相关呈现相同的特征趋势。胶护膜品质与蛋壳颜色(L*、a*、b*)3个指标之间分别表现出了不同的遗传相关,其中胶护膜品质与L*值、b*值之间都表现出负相关,相关系数分别是-0.49和-0.27,但与a*值表现出正相关,相关系数是0.43。胶护膜品质与蛋壳强度、蛋壳厚度之间呈弱的遗传相关,相关系数分别为0.02和0.13。蛋壳颜色(L*、a*、b*)与蛋壳厚度、蛋壳强度之间的相关系数范围在-0.03到0.25。蛋壳强度和蛋壳厚度之间遗传相关和表型相关均较高,分别为0.72和0.57。表现出蛋壳越厚,强度就越高。
3 讨论胶护膜品质、蛋壳颜色等作为常规蛋品质性状中重要的蛋壳品质,国外研究者已对其遗传规律和遗传参数估计开展了部分研究。从表 3对比的结果可以看出,不同研究之间所得数据总体差异不大。对于性状遗传力的估计,本研究估计胶护膜品质的遗传力为0.40,M.M.Bain等[18]对洛岛红父系的估计结果为0.27,而母系估计结果为0.54,差异可能是研究群体遗传结构不同造成的。此外,由于不同研究的品种、群体和周龄不尽相同,本研究与其它研究者对各性状间遗传相关虽然存在一定差异,但总体相近。
|
|
表 3 本次试验结果与其它研究者研究结果的对比 Table 3 Comparison of the results in this experiment with other researches |
本研究检测洛岛红群体的胶护膜品质离散度较大,变异系数高达37.56%,其原因是该洛岛红群体从未对胶护膜品质性状进行过选育,因此数据离散度较大。而其它蛋壳品质性状则属于该洛岛红群体的常规选育性状,经过数代选择,变异系数较小。本研究中蛋壳颜色(L*、a*、b*)、蛋壳强度和蛋壳厚度的变异系数(7.99%、13.13%、8.14%、23.44%和13.04%)与本试验前期对该洛岛红蛋鸡纯系第12和13世代测定的这些性状的变异系数相近(6.84%、13.11%、8.23%、20.85%和8.71%,常规监测数据,未发表)。
研究测得,胶护膜品质性状的遗传力为0.40,为中等遗传力,对该性状进行直接选择可以获得较快的育种进展。胶护膜品质与蛋壳颜色的L*、a*、b*值表现出了不同程度的遗传相关,其中与L*、b*值的相关系数分别是-0.49和-0.27,都呈现出负相关,但与a*值显示出了较高的正相关,相关系数为0.43。L*值是代表颜色亮度的指标,该值越大表明蛋壳就越白越亮;a*值代表样品颜色的红绿度,a*值大代表蛋壳颜色偏红。b*值代表样品颜色的黄蓝度,b*值小代表蛋壳颜色偏蓝[23-24];结合本研究结果而言,洛岛红群体中胶护膜品质较好的鸡蛋,其蛋壳亮度较暗、颜色呈偏深。该结果与W.Messens等[25]的研究结果相同,他在比较褐壳蛋和白壳蛋的胶护膜品质时,发现前者要好于后者。但本研究与W.Messens等[25]的研究对象不同,本试验比较的是同一品种、同一颜色类型鸡蛋的胶护膜品质,所以胶护膜品质与不同品种、不同颜色鸡蛋间的具体规律还需要进一步的试验探究。
研究表明,胶护膜品质会随着鸡只周龄发生变化,随着母鸡周龄的增加胶护膜品质逐渐变差[26-27]。S.Samiullah等[28]研究发现,笼养鸡的蛋壳胶护膜品质优于散养鸡,特别是在产蛋后期差异尤为明显。此外,笼养密度、鸡舍噪音[29]等环境因素也会对胶护膜品质产生影响。产蛋前应激(比如触摸、惊吓等)会导致母鸡产蛋前肾上腺素的减少[9, 30],使蛋壳腺胶护膜分泌发生延迟或终止,影响胶护膜的形成。鸡蛋的保存时间和保存温度也会对胶护膜品质产生影响。有研究发现,鸡蛋的保存时间越长,胶护膜品质就趋于变差,并且保存时外界环境温度越高,胶护膜品质也会越差[31]。除了胶护膜品质影响因素、常规选育、遗传特性和遗传参数方面研究,其蛋白和基因水平的探索也在不断推进。I.C.Dunn等[32]在胶护膜中分析得到6种主要蛋白质,分别是ovocleidin-17、ovocleidin-116 (MEPE)、ovocalyxin-36 (BPIFB8)、ovocalyxin-32 (RARRES1)、ovalbumin (OVAL)和estrogen receptor 1 (ESR1),还研究得到了控制这些蛋白生成的基因位点,分别为Oc116_310、Oc116_1336、Ovocal36、Ovocal32_626、OVAL和ESR1_2571,这些基因有的是在蛋壳中被发现,有的已经被证明参与了鸡蛋的形成过程。M.M.Bain等[18]通过EDTA萃取同样在胶护膜中得到了这6种主要蛋白质,并且还进一步发现Oc116_310和ESR1_2571这两个基因位点与胶护膜蛋白形成有着密切的关系,如果在蛋鸡群体中这两个基因位点被固定,那么群体中胶护膜品质的平均值将会分别提高1%和8%。
对胶护膜品质与蛋壳强度、蛋壳厚度之间的相关分析发现,胶护膜品质与蛋壳强度、蛋壳厚度之间的相关系数分别为0.02和0.13,遗传相关较小,说明在选择蛋壳胶护膜性状时不会对蛋壳强度和厚度性状产生明显影响。本研究估计蛋壳强度和蛋壳厚度的遗传力分别为0.25和0.17,都为低遗传力性状,与张龙超[21]的研究结果0.24和0.26基本一致。本研究中蛋壳强度和蛋壳厚度这两个性状的遗传相关为0.72,与A.Ali[20]研究所得结果相同,说明这两种蛋壳性状彼此存在着较大关联,鸡蛋的蛋壳越厚,蛋壳强度就越强。但由于遗传力较低,对这两个性状的常规选育进展可能较为缓慢,通过开展分子标记辅助育种,能够缩短选育时间并且提高选育的准确性,快速实现低遗传力性状的分子选育。
目前国产蛋鸡育种核心群基本未对胶护膜品质性状进行过选育,因而表型变异较大。本研究中,蛋壳胶护膜品质的遗传力为0.40,运用常规育种方法有望取得较快育种进展。由于胶护膜品质优劣影响着鸡蛋的抗菌能力,所以对实际育种工作有着一定的生产价值,在蛋鸡育种工作中可以把该性状作为一个重要指标考虑到育种值的计算之中。此外,该性状与蛋壳颜色存在一定遗传相关,意味着对常规蛋壳颜色的选育工作可实现对胶护膜品质的间接选育。由于胶护膜品质与蛋壳厚度和强度相关较弱,所以选育工作对除颜色外的其它的蛋壳品质无明显影响。
4 结论 4.1洛岛红群体的胶护膜品质为中等遗传力,可以对该性状开展直接选育工作,实现较快的遗传进展。
4.2胶护膜品质与蛋壳颜色有一定的相关性。对洛岛红群体来说,蛋壳颜色越深,胶护膜品质相对就越好。在蛋壳颜色的选育工作中可以实现胶护膜品质性状的间接筛选,反之也可以。
4.3胶护膜品质与蛋壳强度、蛋壳厚度之间的相关系数较小,对胶护膜品质的选育不会对这两个性状产生明显影响。
| [1] | MUÑOZ A, DOMINGUEZ-GASCA N, JIMENEZ-LOPEZ C, et al. Importance of eggshell cuticle composition and maturity for avoiding trans-shell Salmonella contamination in chicken eggs[J]. Food Control, 2015, 55: 31–38. DOI: 10.1016/j.foodcont.2015.02.028 |
| [2] | WELLMAN-LABADIE O, PICMAN J, HINCKE M T. Antimicrobial activity of the Anseriform outer eggshell and cuticle[J]. CompBiochem Physiol Part BBiochem Mol Biol, 2008, 149(4): 640–649. DOI: 10.1016/j.cbpb.2008.01.001 |
| [3] | HINCKE M, GAUTRON J, RODRIGUEZ-NAVARRO A B, et al. The eggshell: structure and protective function[M]//NYS Y, BAIN M, VAN IMMERSEEL F. Improving the safety and quality of eggs and egg products: Egg chemistry, production and consumption. London: Prentice Hall, Inc., 2011: 151-182. |
| [4] | WILSON P W, SUTHER C S, BAIN M M, et al. Understanding avian egg cuticle formation in the oviduct: a study of its origin and deposition[J]. Biol Reprod, 2017, 97(1): 39–49. DOI: 10.1093/biolre/iox070 |
| [5] | WHITTOW G C. Sturkie's avian physiology[M]. 5th ed. SanDiego: Academic Press, 2000. |
| [6] | PARSONS A H. Structure of the eggshell[J]. Poult Sci, 1982, 61(10): 2013–2021. DOI: 10.3382/ps.0612013 |
| [7] | MANN K. Proteomic analysis of the chicken egg vitelline membrane[J]. Proteomics, 2008, 8(11): 2322–2332. DOI: 10.1002/(ISSN)1615-9861 |
| [8] | ROSE-MARTEL M, DU J W, HINCKE M T. Proteomic analysis provides new insight into the chicken eggshell cuticle[J]. J Proteomics, 2012, 75(9): 2697–2706. DOI: 10.1016/j.jprot.2012.03.019 |
| [9] | SAMIULLAH S, ROBERTS J R. The eggshell cuticle of the laying hen[J]. World's Poult Sci J, 2014, 70(4): 693–707. DOI: 10.1017/S0043933914000786 |
| [10] | KAGE-NAKADAI E, KOBUNA H, KIMURA M, et al. Two very long chain fatty acid acyl-CoA synthetase genes, acs-20 and acs-22, have roles in the cuticle surface barrier in Caenorhabditis elegans[J]. PLoS One, 2010, 5(1): e8857. DOI: 10.1371/journal.pone.0008857 |
| [11] | D'ALBA L, TORRES R, WATERHOUSE GIN, et al. What does the eggshell cuticle do? A functional comparison of avian eggshell cuticles[J]. Physiol Biochem Zool, 2017, 90(5): 588–599. DOI: 10.1086/693434 |
| [12] | DOMINGUEZ-GASCA N, MUÑOZ A, RODRIGUEZ-NAVARRO A B. Quality assessment of chicken eggshell cuticle by infrared spectroscopy and staining techniques: a comparative study[J]. Br Poult Sci, 2017, 58(5): 517–522. DOI: 10.1080/00071668.2017.1342219 |
| [13] | BIALKA K L, DEMIRCI A, KNABEL S J, et al. Efficacy of electrolyzed oxidizing water for the microbial safety and quality of eggs[J]. Poult Sci, 2004, 83(12): 2071–2078. DOI: 10.1093/ps/83.12.2071 |
| [14] | GOLE V C, ROBERTS J R, SEXTON M, et al. Effect of egg washing and correlation between cuticle and egg penetration by various Salmonella strains[J]. Int J Food Microbiol, 2014, 182-183: 18–25. DOI: 10.1016/j.ijfoodmicro.2014.04.030 |
| [15] | LOCK J L, BOARD R G. Persistence of contamination of hens' egg albumen in vitro with Salmonella serotypes[J]. Epidemiol Infect, 1992, 108(3): 389–396. DOI: 10.1017/S095026880004989X |
| [16] | BOARD R G, HALLS N A. The cuticle-a barrier to liquid and particle penetration of the shell of the hen's egg[J]. Br Poult Sci, 1973, 14(1): 69–97. DOI: 10.1080/00071667308415999 |
| [17] | LELEU S, MESSENS W, DE REU K, et al. Effect of egg washing on the cuticle quality of brown and white table eggs[J]. J Food Prot, 2011, 74(10): 1649–1654. DOI: 10.4315/0362-028X.JFP-11-013 |
| [18] | BAIN M M, MCDADE K, BURCHMORE R, et al. Enhancing the egg's natural defence against bacterial penetration by increasing cuticle deposition[J]. Anim Genet, 2013, 44(6): 661–668. DOI: 10.1111/age.12071 |
| [19] | CAVERO D, SCHMUTZ M, ICKEN W, et al. Attractive eggshell color as a breeding goal[J]. Lohmann Inform, 2012, 47(2): 15–21. |
| [20] | ALI A. The relationship between eggshell colour and egg quality traits in table eggs[J]. Indian J Anim Res, 2014, 48(3): 290–294. DOI: 10.5958/j.0976-0555.48.3.061 |
| [21] |
张龙超. 鸡蛋品质性状遗传参数及相关候选基因研究[D]. 北京: 中国农业大学, 2007.
ZHANG L C. Study on genetic parameters for and candidate genes associated with egg quality traits in chickens[D]. Beijing: China Agricultural University, 2007. (in Chinese) |
| [22] |
刘文博. 鸡产蛋和蛋品质性状全基因组关联分析研究[D]. 北京: 中国农业大学, 2009.
LIU W B. Genome-wide association studies for egg production and quality traits in egg-type chickens[D]. Beijing: China Agricultural University, 2009. (in Chinese) |
| [23] | INGRAM D R, HATTEN Ⅲ L F, HOMAN K D. A study on the relationship between eggshell color and eggshell quality in commercial broiler breeders[J]. Int J Poult Sci, 2008, 7(7): 700–703. DOI: 10.3923/ijps.2008.700.703 |
| [24] | MERTENS K, VAESEN I, LOFFEL J, et al. The transmission color value: A novel egg quality measure for recording shell color used for monitoring the stress and health status of a brown layer flock[J]. Poult Sci, 2010, 89(3): 609–617. DOI: 10.3382/ps.2009-00261 |
| [25] | MESSENS W, GRIJSPEERDT K, REU K, et al. Eggshell penetration of various types of hens' eggs by Salmonella enterica serovar Enteritidis[J]. J Food Prot, 2007, 70(3): 623–628. DOI: 10.4315/0362-028X-70.3.623 |
| [26] | HASIAK R J, VADEHRA D V, BAKER R C. Lipid composition of the eggexteriors of the chicken (Gallus gallus)[J]. Comp Biochem Physiol, 1970, 37(3): 429–435. DOI: 10.1016/0010-406X(70)90571-2 |
| [27] | RODRÍGUEZ-NAVARRO A B, DOMÍNGUEZ-GASCA N, MUÑOZ A, et al. Change in the chicken eggshell cuticle with hen age and egg freshness[J]. Poult Sci, 2013, 92(11): 3026–3035. DOI: 10.3382/ps.2013-03230 |
| [28] | SAMIULLAH S, ROBERTS J R. The location of protoporphyrin in the eggshell of brown-shelled eggs[J]. Poult Sci, 2013, 92(10): 2783–2788. DOI: 10.3382/ps.2013-03051 |
| [29] | WALKER A W, HUGHES B O. Eggshell colour is affected by laying cage design[J]. BrPoult Sci, 1998, 39(5): 696–699. |
| [30] | SAMIULLAH, CHOUSALKAR K K, ROBERTS J R, et al. Effects of egg shell quality and washing on Salmonella Infantis penetration[J]. Int J Food Microbiol, 2013, 165(2): 77–83. DOI: 10.1016/j.ijfoodmicro.2013.05.002 |
| [31] | LIU Y C, CHEN T H, WU Y C, et al. Effects of egg washing and storage temperature on the quality of eggshell cuticle and eggs[J]. Food Chem, 2016, 211: 687–693. DOI: 10.1016/j.foodchem.2016.05.056 |
| [32] | DUNN I C, JOSEPH N T, BAIN M, et al. Polymorphisms in eggshell organic matrix genes are associated with eggshell quality measurements in pedigree Rhode Island Red hens[J]. Anim Genet, 2009, 40(1): 110–114. DOI: 10.1111/age.2009.40.issue-1 |

 图 1(Figure 1)
图 1(Figure 1)


