P-糖蛋白(P-glycoprotein,P-gp)是ATP结合转运家族(ATP-binding cassette transporter)的重要成员,含有12个跨膜区,每6个形成1个疏水性跨膜域,另外还含有2个细胞质内核苷酸结合域,可借助ATP水解提供的能量将外源化合物泵出胞外[1]。P-gp不仅可以介导肿瘤细胞的耐药性,而且在人和动物的肝、肾和小肠等组织中均有表达,分布广泛,限制了外源化合物的吸收和体内分布[2]。因其对部分药物的体内过程产生作用,可导致药物的生物利用度发生变化或介导药物间的相互作用,故近年来引起了众多药剂学研究者的关注,相关研究也已成为该领域的热点[3]。P-gp的表达和功能可受众多外源化合物的影响,如L. Jetté等[4]研究发现SDZ-PSC 833 (PSC)可以通过改变药物结合位点的方式消除环孢霉素A和维拉帕米对小鼠组织P-gp功能的影响。T. Chen等[5]在乳腺癌MCF-7细胞的研究上发现,达沙替尼可以通过抑制ERK信号通路,下调P-gp表达,从而达到逆转多药耐药的效果。近年来还有些结果显示一些中草药或植物成分对P-gp的表达和功能也有显著影响。如萨础拉等[6]采用大鼠外翻肠囊模型研究了三七皂苷有效组分中人参皂苷Rg1、Rb1和三七皂苷R1,发现其具有明显的P-gp底物转运特性并可竞争性抑制P-gp底物外排。安息香醛、香草醛和β-细辛醚对P-gp的外排功能有明显抑制作用,可显著促进Caco-2细胞对Rho-123的摄取[7]。
槲皮素,又名栎精,广泛存在于众多植物的花、叶和果实中,是一种具有生物活性的多羟基黄酮类化合物[8]。研究显示槲皮素具有较多的生物功能,不仅具有抗肿瘤活性[9],还具有防辐射、保护心血管[10]和抗病毒[11-12]等直接作用。尤其近年来一系列的试验证实槲皮素对肿瘤细胞P-gp的表达和功能产生影响,如钟华等[13]证实较高浓度的槲皮素(100 μmol·L-1)可下调K562/A02细胞mdr1基因的表达从而逆转肿瘤细胞的耐药性。单保恩等[14]的研究显示槲皮素能通过下调肿瘤细胞多药耐药基因mdr1及其编码蛋白P-gp的表达,增加人子宫内膜癌耐药细胞B-MD-C1(ADR+/+)内ADM的浓度,从而达到逆转耐药的效果。但也有研究结果显示低剂量的槲皮素可显著诱导P-gp的表达从而影响P-gp底物药物的体内过程[15]上述体外细胞研究结果提示槲皮素可以影响P-gp的表达和功能,但是与处理剂量相关,表现出双相作用。自然界多种植物中均含有槲皮素,故当植物性饲料用于动物时,是否会对动物的代谢和吸收器官(肝和小肠)中的P-gp产生作用从而影响P-gp底物药物的生物利用度或介导药物间相互作用的发生尚不清楚。基于此,本试验首先以实验动物大鼠为研究模型,通过体内实验初步探讨槲皮素对动物组织中P-gp表达和功能的影响,进一步挖掘其介导药物间相互作用的理论基础,该研究结果可为兽医临床合理用药提供指导。
1 材料与方法 1.1 主要试剂和药物RNAisoTM Plus,Prime ScriptTM Kit,SYBR Premix(TaKaRa);乙腈(TEDIA,色谱纯)、三乙胺(Enox,分析纯),伊维菌素(SIGMA),槲皮素(上海紫一试剂厂,ZY140216),ATPase试剂盒(南京建成A070-1),ATP含量测定试剂盒(碧云天,S0026)。Kreb-Ringer′s灌流液制备:7.8 g NaCl,0.35 g KCl,1.37 g NaHCO3,0.02 g MgCl2,0.22 g NaH2PO4和1.48 g葡萄糖溶解1 000 mL三蒸水中,用1 mol·L-1 HCl或NaOH调节pH至6.5。伊维菌素肠道灌流液:用Kreb-Ringer′s配制浓度5 μg·mL-1进行灌流。
1.2 细胞及其处理分组Caco-2细胞株购于中国科学院上海生命科学研究院细胞资源中心,培养条件为37 ℃,5% CO2,95%湿度,于本实验室传代培养保存。
Caco-2细胞复苏,经传代培养长至致密单层时,分为对照组和处理组共7组。其中处理组细胞分为用低浓度槲皮素(5 μmol·L-1)和高浓度槲皮素(25 μmol·L-1)分别处理6、12和24 h。于各时间点收集样品后用于后续ATPase活性分析。
1.3 实验动物和分组清洁级雄性SD大鼠,40日龄,体重(280±20)g,购自江苏南京青龙山动物养殖基地,适应饲养7 d后用于试验。动物分组及处理见表 1。
|
|
表 1 动物分组与处理方法 Table 1 The groups and treatment of the animals in this study |
槲皮素处理组大鼠分别处理5和15 d后断头处死。取空肠和肝组织置于-80 ℃保存。取100 mg组织用组织破碎仪进行破碎,按照说明书用Trizol法提取组织总RNA。测定样品OD260 nm/OD280 nm比值,确定RNA的浓度和纯度,用琼脂糖凝胶电泳检测RNA完整性。用反转录试剂盒将RNA反转为cDNA于-20 ℃保存备用。利用premier 5.0软件设计大鼠mdr1a、mdr1b、PXR、CAR和看家基因Gapdh引物序列(由上海捷瑞生物公司合成)。参照SYBR Premix Ex TaqTM说明书,实时荧光定量PCR检测上述基因mRNA转录水平。结果采用相对定量分析,用ΔCt法计算基因的相对表达量。引物序列见表 2。
|
|
表 2 荧光定量PCR基因引物序列 Table 2 Primers used in real-time RT-PCR |
取100 mg肝和空肠组织剪碎,加入RIPA裂解液,用组织匀浆器匀浆至无明显肉眼可见组织块。4 ℃,10 000 r·min-1条件下离心15 min。将上清吸入另一预冷的干净离心管,得到组织总蛋白。用BCA法测定蛋白质含量,加入Loading Buffer煮沸5 min,得到蛋白质样品并保存。按照不同蛋白质浓度上样,进行SDS-PAGE电泳,半干转印仪转印至PVDF膜上,室温封闭2 h,4 ℃一抗孵育过夜,然后室温二抗孵育1 h,曝光。Image J软件分析蛋白质表达量。
1.4.3 SABC免疫组织化学方法检测肝和空肠P-gp的定位和蛋白质表达各组大鼠处死后迅速采集肝和空肠组织。用生理盐水冲洗血液及肠道内容物后,放入4%多聚甲醛中固定超过48 h。常规制备5 μm厚石蜡切片(载玻片预先用APES处理),37 ℃恒温箱中过夜烘干,冰箱中保存。按照试剂盒步骤进行SABC免疫组织化学方法染色,将切片常规脱蜡至水,用3% H2O2于室温作用15 min,进行抗原热修复后用5% BSA封闭。用稀释过的P-gp抗体于4 ℃孵育过夜,用PBS洗涤,二抗继续孵育45 min,用PBS洗涤干净。滴加SABC于37 ℃作用30 min后进行DAB显色,用苏木素轻度复染。保存切片并用显微镜进行拍照。
1.5 槲皮素对伊维菌素的大鼠空肠渗透性的影响 1.5.1 大鼠空肠单向在体灌流模型的建立参考I. Lozoya-Agullo等[16]的质量差法略作修改,建立大鼠空肠单向在体灌流方法。对照组和槲皮素预处理15 d组的大鼠,腹腔注射40%的乌拉坦溶液(0.5 mL·kg-1,按体重给药)进行麻醉。待大鼠麻醉后将其固定于手术台上。于左侧后腹部打开腹腔2~3 cm,精确量取10 cm空肠肠段作为灌流肠段。沿空肠肠生理蠕动方向插入并结扎供液和收液灌流管。用K-R缓冲液(37 ℃)以0.2 mL·min-1冲洗肠段约30 min后,更换含有伊维菌素的K-R灌流液平衡30 min。平衡后,每隔15 min更换一次已知质量的供液管和集液管,试验持续时间为105 min。最后,将大鼠处死,剪下灌流肠段,测量其长度和内径,同时精确称量供液瓶和集液管的质量,迅速将收集的灌流样品于-20 ℃保存至待测。
1.5.2 样品处理将样品在4 ℃融化,涡旋混匀,取200 μL 12 000 r·min-1离心20 min过滤后,取100 μL上清加入样品瓶中待测。
1.5.3 伊维菌素HPLC方法建立参考《中华人民共和国兽药典》2010版[17]方法,采用高压液相方法测定伊维菌素浓度。色谱条件如下,色谱柱:XDB-C18柱(5 μm,25 cm × 4.6 mm,Agilent);检测波长:紫外检测254 nm;流动相:V(乙腈):V(甲醇):V(水)=50:41:9;流速:1 mL·min-1;柱温:30 ℃;进样量:20 μL。
1.5.4 伊维菌素标准曲线、检测限和定量限的测定将空白K-R灌流液12 000 r·min-1,离心20 min后,取上清。配制浓度为2、2.5、5、10、12.5、20、25、50、100 μg·mL-1的伊维菌素标准溶液,每个浓度设有5个平行重复。以伊维菌素浓度(X)对峰面积(Y)计算,得标准曲线及回归方程。以信噪比S/N>3时伊维菌素的浓度为检测限,以信噪比S/N>10时伊维菌素的浓度为定量限。
1.5.5 计算伊维菌素吸收速率常数(Ka)和药物表观渗透系数(Papp)Ka和Papp分别采用下述公式进行计算:
| $ {K_{\rm{a}}} = \left( {1-\frac{{{C_{{\rm{out}}}}{Q_{{\rm{out}}}}}}{{{C_{{\rm{in}}}}{Q_{{\rm{in}}}}}}} \right)\frac{Q}{V}\;\;{P_{{\rm{app}}}} = \frac{{-{Q_{{\rm{In}}}}\left( {\frac{{{C_{{\rm{out}}}}{Q_{{\rm{out}}}}}}{{{C_{{\rm{in}}}}{Q_{{\rm{in}}}}}}} \right)}}{{2\pi rl}} $ |
式中Qin和Qout分别为空肠进出口灌流液的体积(mL);Cin和Cout分别为空肠进出口灌流液的质量浓度(μg·mL-1);Q为灌流速度(0.2 mL·min-1);V为灌流肠段的容积;r和l分别为肠段的半径和长度(cm);计算药物Ka和Papp。
1.6 槲皮素对Caco-2细胞ATPase活性的影响按“1.2”中所示方法处理细胞后,用预冷的PBS洗3遍。用细胞刮直接将细胞刮下,然后细胞悬液冰水浴超声破碎:功率300 W,3~5 s·次-1,间隔30 s,重复3~5次。取制备好的匀浆液按照ATPase试剂盒(南京建成)说明书测定蛋白质浓度和ATP酶活性。
1.7 数据处理与统计所有数据结果以x±sx表示。利用统计分析软件SPSS 18.0处理数据,当P < 0.05时判定具有显著性差异。用Imagepro-plus软件对免疫组化结果进行半定量分析,分析累积光密度(IOD)和阳性反应面积(Area)。
2 结果 2.1 槲皮素对大鼠组织mdr1a、mdr1b、PXR和CAR mRNA表达量的影响 2.1.1 槲皮素对大鼠肝组织mdr1a、mdr1b、PXR和CAR mRNA表达量影响结果如图 1所示。大鼠经60 mg·kg-1槲皮素处理5和15 d后,肝中mdr1a和mdr1b mRNA表达量较对照组显著(P < 0.05)或极显著(P < 0.01)升高;经15 mg·kg-1的槲皮素处理15 d后,mdr1a和mdr1b mRNA表达量极显著(P < 0.01)或显著(P < 0.05)升高,但处理5 d时mdr1a和mdr1b mRNA表达量均未见显著变化(P>0.05)。槲皮素处理大鼠的PXR mRNA表达量比对照组显著(P < 0.05)或极显著(P < 0.01)升高,高剂量槲皮素长时间处理后,CAR mRNA表达量较对照组变化则更为显著。经相关性分析,肝mdr1a、mdr1b和CAR mRNA表达量之间存在显著的相关性(P < 0.05)。
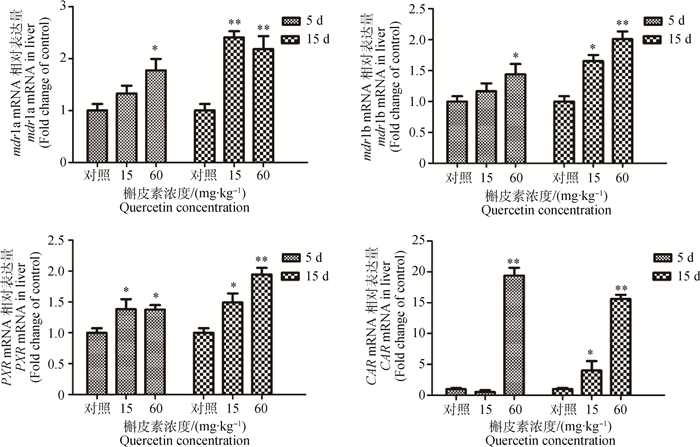
|
与对照组比较,*.P < 0.05; **.P < 0.01 Compared with control, *. P < 0.05; **. P < 0.01 图 1 槲皮素对大鼠肝组织mdr1a、mdr1b、PXR和CAR mRNA表达量影响 Figure 1 mdr1a, mdr1b, PXR and CAR mRNA expression in rats liver after treated by quercetin |
60 mg·kg-1槲皮素预处理大鼠,空肠组织的mdr1a、mdr1b和CAR mRNA表达量均显著(P < 0.05)或极显著(P < 0.01)升高。而当槲皮素处理浓度高达60 mg·kg-1处理15 d后,空肠中PXR mRNA表达量才会显著上升(P < 0.05)。经相关性分析,空肠mdr1a、mdr1b和CAR mRNA表达量之间存在显著的相关性(P < 0.05)。结果如图 2所示。
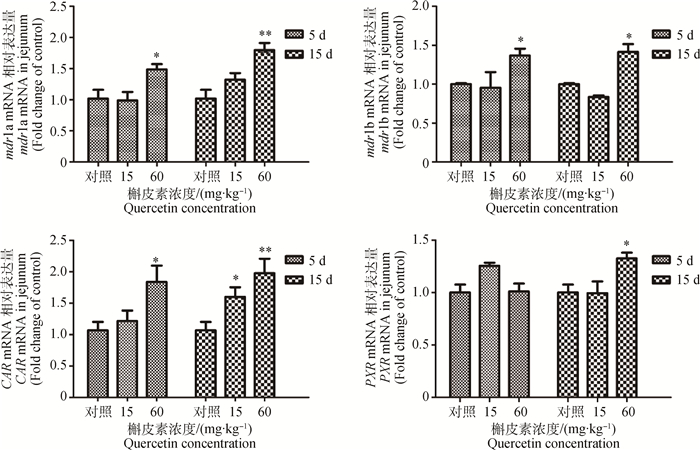
|
与对照组比较,*.P < 0.05; **.P < 0.01 Compared with control, *. P < 0.05; **. P < 0.01 图 2 槲皮素对大鼠空肠组织mdr1a、mdr1b、PXR和CAR mRNA表达量影响 Figure 2 mdr1a, mdr1b, PXR and CAR mRNA expression in rats jejunum after treated by quercetin |
上述结果显示60 mg·kg-1的槲皮素对各基因的mRNA表达量影响较大,故研究蛋白质水平变化时采用该剂量进行分析。结果表明槲皮素处理大鼠5 d后,肝和空肠P-gp蛋白表达量就会显著上升(P < 0.05),处理时间延长至15 d时,肝和空肠P-gp蛋白表达量极显著上升(P < 0.01)。蛋白质水平的变化与上述mRNA水平变化一致。结果见图 3。
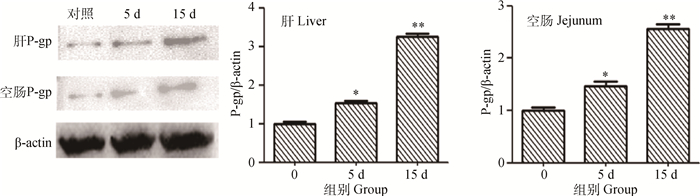
|
与对照组比较,*.P < 0.05; **.P < 0.01 Compared with control, *. P < 0.05; **. P < 0.01 图 3 60 mg·mL-1槲皮素对大鼠肝和空肠组织P-gp蛋白表达量影响 Figure 3 P-gp expression in rat liver and jejunum after treated by 60 mg·mL-1 quercetin |
免疫组化结果显示,槲皮素处理并未改变P-gp在肝和空肠中的定位,但对其蛋白的表达量产生显著影响。如图 4A~C所示,P-gp在肝主要定位于肝细胞间的胆小管膜上;如图 4D~F所示,在大鼠空肠主要分布于小肠绒毛上皮细胞顶端和小肠腺靠近腔面细胞的顶端。
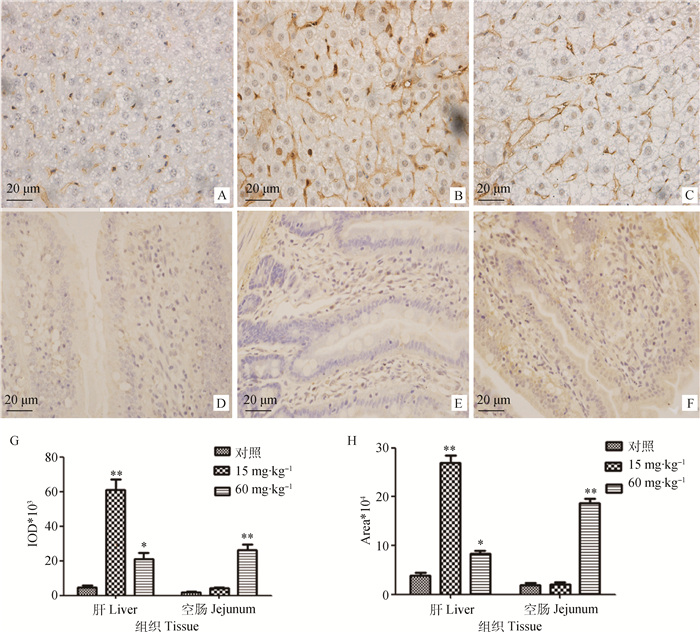
|
A.对照组大鼠肝;B. 15 mg·kg-1槲皮素处理组大鼠肝;C. 60 mg·kg-1槲皮素处理组大鼠肝;D.对照组大鼠空肠;E. 15 mg·kg-1槲皮素处理组大鼠空肠;F. 60 mg·kg-1槲皮素处理组大鼠空肠;G、H.大鼠肝和空肠组织中P-gp的半定量分析。与对照组比较,*.P < 0.05; **. P < 0.01 A. Liver of control rats; B. Liver of rats treated by 15 mg·kg-1 quercetin; C. Liver of rats treated by 60 mg·kg-1 quercetin; D. Jejunum of control rats; E. Jejunum of rats treated by 15 mg·kg-1 quercetin; F. Jejunum of rats treated by 60 mg·kg-1 quercetin; G and H. Semi-quantification of P-gp in rats liver and jejunum, respectively. Compared with control, *.P < 0.05; **. P < 0.01 图 4 大鼠肝和空肠中P-gp的定位及表达量分析 Figure 4 Immunohistochemical staining for P-gp in the rats liver and jejunum |
用Imagepro-plus软件,以Area和IOD作为衡量表达量的指标,对对照组和槲皮素处理组的肝和空肠P-gp表达量进行半定量分析。结果如图 4G、H所示。与对照组相比,15 mg·kg-1槲皮素处理大鼠15 d后,可极显著增加肝中P-gp的表达量(P < 0.01),且作用强于高剂量的槲皮素;60 mg·kg-1槲皮素处理组可极显著增加P-gp在空肠的表达量(P < 0.01),作用较15 mg·kg-1的槲皮素更强,结果与肝存在一定差异。总体来讲,免疫组化方法检测的肝和空肠组织中P-gp表达变化与Western blot的结果相一致,再次证实一定剂量的槲皮素可诱导P-gp的表达。
2.4 槲皮素对伊维菌素在大鼠小肠渗透性的影响 2.4.1 伊维菌素的色谱行为和标准曲线采用上述方法中色谱条件,测定空白K-R灌流液,在0~20 min内基线平稳且无干扰峰出现,添加20 μg·mL-1伊维菌素后,可检测到目标峰,峰形良好,无干扰峰,平均保留时间约为16.18 min。以峰面积(A)对药物浓度(C, μg·mL-1)进行线性回归,得到伊维菌素的线性回归方程:y = 0.357 3x + 0.128 9。在该检测条件下,浓度与峰面积线性关系良好,R2=0.999。检测限为2 μg·mL-1,定量限为2.5 μg·mL-1。
2.4.2 大鼠空肠中伊维菌素浓度变化取经60 mg·kg-1槲皮素处理15 d的大鼠进行空肠单向在体灌流试验。结果可见处理组收集液中伊维菌素浓度较对照组有增加趋势,如图 5所示。伊维菌素的吸收速率常数(Ka)和表观渗透系数(Papp)见表 3。与空白对照组相比,伊维菌素的Ka未发生显著变化(P>0.05),但Papp显著下降(P < 0.05)。
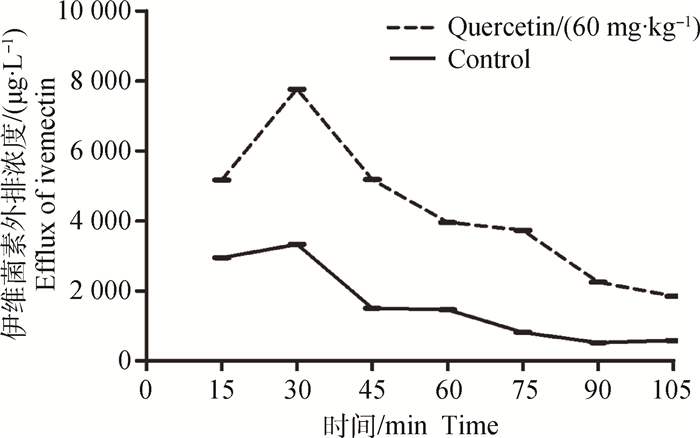
|
图 5 大鼠空肠灌流液中伊维菌素的浓度变化曲线 Figure 5 Effect of quercetin on ivermectin concentration in rats jejunum |
|
|
表 3 大鼠空肠中伊维菌素的Ka和Papp值(x±sx,n=6) Table 3 Ka and Papp of ivermectin in rats jejunum(x±sx, n=6) |
按“1.2”中所述方法对Caco-2细胞进行预处理,检测槲皮素对Caco-2细胞ATP酶活性的影响。结果如图 6所示,不同浓度的槲皮素处理6、12和24 h后均可极显著增加Caco-2细胞的ATP酶活性(P < 0.01),且存在一定的剂量依赖性。
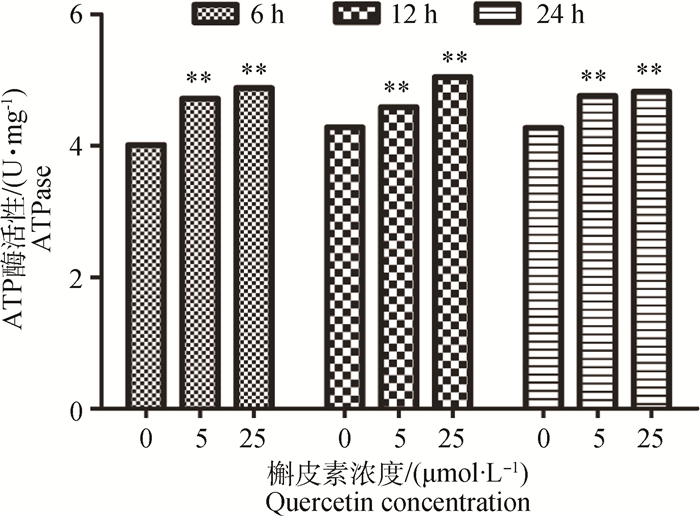
|
**. P < 0.01 图 6 槲皮素对Caco-2细胞ATP酶活性影响 Figure 6 Effect of quercetin on Caco-2 ATPase |
槲皮素是一种来源广泛的黄酮类化合物,常被用于食品中的抗氧化剂。研究显示,槲皮素具有免疫调节、抗炎、抗氧化的作用[18-19]。对MCF-7细胞的研究发现,槲皮素还具有阻滞细胞周期的作用,并可通过线粒体通路激活caspase级联反应,诱导MCF-7细胞凋亡等[20]。有研究显示槲皮素可以通过诱导凋亡而抑制HepG2细胞生长,若通过抑制MDR1 mRNA的表达而抑制P-gp的表达,可以提高细胞内抗癌药物浓度,改善化疗疗效[21]。但有研究称槲皮素对P-gp的调节有双向作用,表现为高剂量抑制作用,而低剂量为诱导作用,可能与其不同的作用位点、底物及浓度有关[22]。但上述研究仅限于体外细胞,且主要探讨其在肿瘤细胞耐药方面的作用及其机制,未涉及其在口服药物吸收和药物间相互作用方面的影响。因槲皮素在植物中存在广泛,故植物源性饲料中存在的槲皮素若长期给予动物后是否会引起动物不同组织中P-gp的表达和功能发生变化,并进一步影响到口服药物的吸收和药物间相互作用发生,仍未进行系统研究。故本试验首先以实验动物大鼠为研究对象,初步探讨了槲皮素对大鼠肝和空肠中P-gp表达和功能的影响,为临床合理用药提高口服药物的生物利用度和避免药物间相互作用提供一定参考,并为后续在养殖动物中开展相关研究奠定基础,故具有较好的理论和临床实践指导意义。
啮齿动物中,P-糖蛋白由mdr1的两个亚型mdr1a和mdr1b编码[23]。核受体——孕烷X受体(pregnane X receptor,PXR)和组成型雄甾烷受体(constitutive androstane receptor,CAR)是调节P-gp表达的重要因子[24-25]。研究表明mdr1的启动子上含有DR4/ER6应答元件,可以被PXR/RXR二聚体识别结合,从而调控mdr1基因的表达[26-27]。还有研究显示与PXR类似的CAR也可与mdr1基因增强子上不同核受体反应元件相结合进而激活mdr1的转录,而外源性化合物即可通过激活PXR或CAR通路调控mdr1的转录[28]。本研究采用real-time RT-PCR、免疫组化和Western blot方法证实槲皮素会导致大鼠肝和空肠P-gp在mRNA和蛋白质水平均发生显著上调的现象,并且其在mRNA水平的变化与CAR mRNA的上调表达存在较为显著的相关作用,佐证了前人的研究结果,即外源性化合物可以通过激活核受体调控mdr1的表达。但因本试验中未筛选到有效的CAR和PXR抗体,故对大鼠肝和空肠中PXR和CAR蛋白表达水平未能进行检测。后续研究中,将继续选择有效抗体或利用PXR和CAR抑制剂在此方面进行深入研究。
P-gp蛋白为ATP依赖性外排蛋白,其外排功能的实现依赖于ATP水解提供的能量,所以本试验又进一步探究了槲皮素对ATP酶活性的影响。本试验初期拟检测槲皮素对大鼠肠组织中ATP酶活性的影响,但在测定中发现体内影响因素较多,未能取得较好的试验结果,而Caco-2细胞来源于人结肠癌上皮细胞,体外培养条件下,能分化形成致密的单分子细胞层,与小肠上皮的结构和生化作用相似,不仅具有微绒毛结构,还能表达多种蛋白载体和酶,也是FDA推荐用于研究P-gp外排功能及药物跨膜转运的优秀细胞之一[29],故本试验选择了Caco-2细胞研究了槲皮素对其ATP酶活性的影响。结果也显示不同浓度的槲皮素处理Caco-2细胞后,ATP酶活性均极显著升高,由此提示槲皮素不仅可通过增加P-gp的表达,而且可通过提高ATP酶活性促进ATP水解提供更多能量来协同增加P-gp对底物的外排功能,该现象也会通过动物体内试验进一步验证。
槲皮素可增加大鼠空肠P-gp的表达,但P-gp的外排功能是否也随表达量增加而增强?为证实该假设,本研究又进一步采用大鼠空肠单向在体灌流方法验证槲皮素处理大鼠对P-gp底物药物渗透性的影响。已有研究显示伊维菌素为P-gp的底物,如J. Griffin等[29]证实伊维菌素是人和犬P-gp的底物,M. B. Molento等[30]发现当伊维菌素与P-gp抑制剂维拉帕米联合用药后,伊维菌素在山羊体内的峰浓度Cmax显著升高。故本试验选用伊维菌素作为P-gp底物进行试验,结果显示伊维菌素在空肠的Papp显著下降,与槲皮素显著增加空肠P-gp表达的结果非常一致,因此证实一定剂量的槲皮素不仅可增加P-gp的表达水平,同时可增加其外排功能。
4 结论采用real-time RT-PCR、免疫组化和Western blot方法证实槲皮素会导致大鼠肝和空肠P-gp在mRNA和蛋白质水平均显著上调,并且其在mRNA水平的变化与CAR mRNA的上调表达存在显著的相关作用。槲皮素处理Caco-2细胞后,ATP酶活性均极显著升高,单向在体肠灌流试验表明槲皮素处理大鼠对伊维菌素的肠渗透性显著降低,提示槲皮素可通过提高ATP酶活性促进ATP水解提供更多能量来协同增加P-gp对底物的外排功能。
| [1] | HENNESSY M, SPIERS J P. A primer on the mechanics of P-glycoprotein the multidrug transporter[J]. Pharmacol Res, 2007, 55(1): 1–15. DOI: 10.1016/j.phrs.2006.10.007 |
| [2] | XIE J, LI D W, CHEN X W, et al. Expression and significance of hypoxia-inducible factor-1α and MDR1/P-glycoprotein in laryngeal carcinoma tissue and hypoxic Hep-2 cells[J]. Oncol Lett, 2013, 6(1): 232–238. DOI: 10.3892/ol.2013.1321 |
| [3] | ZHANG Y C, ZHANG Y K, WANG Y J, et al. Esters of the marine-derived triterpene Sipholenol A reverse P-GP-mediated drug resistance[J]. Mar Drugs, 2015, 13(4): 2267–2286. |
| [4] | JETTÉ L, MURPHY G F, BÉLIVEAU R. Drug binding to P-glycoprotein is inhibited in normal tissues following SDZ-PSC 833 treatment[J]. Int J Cancer, 1998, 76(5): 729–737. DOI: 10.1002/(ISSN)1097-0215 |
| [5] | CHEN T, WANG C Y, LIU Q, et al. Dasatinib reverses the multidrug resistance of breast cancer MCF-7 cells to doxorubicin by downregulating P-gp expression via inhibiting the activation of ERK signaling pathway[J]. Cancer Biol Ther, 2015, 16(1): 106–114. DOI: 10.4161/15384047.2014.987062 |
| [6] |
萨础拉, 吕航, 姜艳艳, 等. 三七皂苷在大鼠外翻肠囊中的吸收及与P-糖蛋白相互作用研究[J]. 北京中医药大学学报, 2011, 34(12): 836–842.
SA C L, LV H, JIANG Y Y, et al. Absorption of panax notoginseng saponins in rat everted gut sac and interaction between it and P-glycoprotein[J]. Journal of Beijing University of Traditional Chinese Medicine, 2011, 34(12): 836–842. (in Chinese) |
| [7] |
杨洋, 王世祥, 房敏峰, 等. 安息香醛、香草醛和β-细辛醚对P-糖蛋白功能的影响[J]. 中成药, 2012, 34(7): 1364–1366.
YANG Y, WANG S X, FANG M F, et al. The effects of benzoic aldehyde, vanillin and beta-siocin on P-glycoprotein function[J]. Chinese Traditional Patent Medicine, 2012, 34(7): 1364–1366. (in Chinese) |
| [8] | BOOTS A W. Health effects of quercetin: from mechanism to nutraceutical[D]. Maastricht: Universitaire Pers Maastricht, 2006. |
| [9] | VAN HOPPE S, SPARIDANS R W, WAGENAAR E, et al. Breast cancer resistance protein (BCRP/ABCG2) and P-glycoprotein (P-gp/ABCB1) transport afatinib and restrict its oral availability and brain accumulation[J]. Pharmacol Res, 2017, 120: 43–50. DOI: 10.1016/j.phrs.2017.01.035 |
| [10] |
林蓉, 刘俊田, 李旭, 等. 槲皮素对血管内皮细胞损伤的保护作用[J]. 中国循环杂志, 2000, 15(5): 304–305.
LIN R, LIU J T, LI X, et al. Protection of vascular endothelial cells from hydrogen peroxide-induced injury by quercetin[J]. Chinese Circulation Journal, 2000, 15(5): 304–305. (in Chinese) |
| [11] | SCAMBIA G, PANICI P B, RANELLETTI F O, et al. Quercetin enhances transforming growth factor β1, secretion by human ovarian cancer cells[J]. Int J Cancer, 1994, 57(2): 211–215. DOI: 10.1002/(ISSN)1097-0215 |
| [12] | BOERS F, DENG B L, LEMIÈRE G, et al. An improved synthesis of the anti-picornavirus flavone 3-O-methylquercetin[J]. Arch Pharm (Weinheim), 1997, 330(9-10): 313–316. DOI: 10.1002/(ISSN)1521-4184 |
| [13] |
钟华, 顾春红, 滕晔, 等. 槲皮素对K562/A02细胞多药耐药基因及糖蛋白表达的影响[J]. 上海医学, 2004, 27(1): 20–21.
ZHONG H, GU C H, TENG Y, et al. Study of the effect of quercetin on expression of multidrug resistant gene and protein in K562/A02 cells[J]. Shanghai Medical Journal, 2004, 27(1): 20–21. (in Chinese) |
| [14] |
单保恩, 杨俊玲. 槲皮素对人子宫内膜癌耐药细胞株B-MD-C1(ADR+/+)多药耐药基因mdr1及P-gp蛋白表达的影响[J]. 癌变畸变突变, 2009, 21(5): 353–357.
SHAN B E, YANG J L. Mechanisms of multidrug resistance reversal on B-MD-C1(ADR+/+)by quercetin[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2009, 21(5): 353–357. (in Chinese) |
| [15] | MITSUNAGA Y, TAKANAGA H, MATSUO H, et al. Effect of bioflavonoids on vincristine transport across blood-brain barrier[J]. Eur J Pharmacol, 2000, 395(3): 193–201. DOI: 10.1016/S0014-2999(00)00180-1 |
| [16] | LOZOYA-AGULLO I, ZUR M, BEIG A, et al. Segmental-dependent permeability throughout the small intestine following oral drug administration:single-pass vs. Doluisio approach to in-situ rat perfusion[J]. Int J Pharm, 2016, 515(1-2): 201–208. DOI: 10.1016/j.ijpharm.2016.09.061 |
| [17] |
张海燕, 邬伟魁, 宋民宪, 等. 《中国药典》2010年版药用辅料标准探讨[J]. 中国实验方剂学杂志, 2011, 17(11): 289–291.
ZHANG H Y, WU W K, SONG M X, et al. Standard of pharmaceutical excipients in 《Chinese Pharmacopoeia》 2010 edition[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(11): 289–291. DOI: 10.3969/j.issn.1005-9903.2011.11.086 (in Chinese) |
| [18] |
王旭, 张爽. 槲皮素对卵巢癌细胞HO-8910增殖的抑制作用及机制[J]. 山东医药, 2010, 50(6): 12–14.
WANG X, ZHANG S. Inhibitory effect and mechanism of quercetin on ovarian cancer cells Ho-8910 proliferation[J]. Shandong Medical Journal, 2010, 50(6): 12–14. (in Chinese) |
| [19] |
张继红, 梁力建, 黄洁夫. bcl-2基因表达变化在槲皮素抑制肝细胞癌生长中的作用[J]. 中国普外基础与临床杂志, 2009, 16(6): 455–459.
ZHANG J H, LIANG L J, HUANG J F. Role of bcl-2 gene expression in inhibiting the growth of hepatocellular carcinoma of nude mice by quercetin[J]. Chinese Journal of Bases and Clinics in General Surgery, 2009, 16(6): 455–459. (in Chinese) |
| [20] | CHU C C, YANG J S, LU H F, et al. Quercetin-mediated cell cycle arrest and apoptosis involving activation of a caspase cascade through the mitochondrial pathway in human breast cancer MCF-7 cells[J]. Arch Pharm Res, 2010, 33(8): 1181–1191. DOI: 10.1007/s12272-010-0808-y |
| [21] |
陈华, 郑军. 槲皮素对HepG2细胞的抑制作用及对耐药基因和P-糖蛋白的影响[J]. 检验医学与临床, 2010, 7(9): 791–794.
CHEN H, ZHENG J. The effect of quercetin on the inhibition of the growth of HepG2 and the expression of MDR1 and P-gp[J]. Laboratory Medicine and Clinic, 2010, 7(9): 791–794. (in Chinese) |
| [22] |
翟莺莺, 周蕾, 赖永洪. 槲皮素抗肿瘤作用的研究[J]. 现代临床医学生物工程学杂志, 2005, 11(1): 18–20.
ZHAI Y Y, ZHOU L, LAI Y H. Research of quercetin on Antitumour activit[J]. Journal of Modern Clinical Medical Bioengineering, 2005, 11(1): 18–20. (in Chinese) |
| [23] |
刘正清, 姚启盛, 杨勇, 等. 靶向mdr1b/mdr1a基因siRNA逆转T24/ADM多药耐药性研究[J]. 海南医学院学报, 2012, 18(7): 865–868.
LIU Z Q, YAO Q S, YANG Y, et al. Effect of mdr1b/mdr1a siRNA on multidrug resistance of bladder carcinoma cell line T24/ADM[J]. Journal of Hainan Medical University, 2012, 18(7): 865–868. (in Chinese) |
| [24] | WILLSON T M, KLIEWER S A, WILLSON T M, et al. Pxr, car and drug metabolism[J]. Nat Rev Drug Discov, 2002, 1(4): 259–266. DOI: 10.1038/nrd753 |
| [25] | YAN J, XIE W. A brief history of the discovery of PXR and CAR as xenobiotic receptors[J]. Acta Pharm Sin B, 2016, 6(5): 450–452. |
| [26] | SONODA J, PEI L M, EVANS R M. Nuclear receptors:decoding metabolic disease[J]. FEBS Lett, 2008, 582(1): 2–9. DOI: 10.1016/j.febslet.2007.11.016 |
| [27] | GONG H B, SINZ M W, FENG Y, et al. Animal models of xenobiotic receptors in drug metabolism and diseases[J]. Methods Enzymol, 2005, 400: 598–618. DOI: 10.1016/S0076-6879(05)00034-0 |
| [28] |
王秀梅, 彭文兴, 文晓柯. MDR1调控的信号传导机制研究进展[J]. 中国医药指南, 2012, 10(30): 436–440.
WANG X M, PENG W X, WEN X K. Progress in signal transduction mechanisms for transcriptional regulation of the MDR1 gene[J]. Guide of China Medicine, 2012, 10(30): 436–440. DOI: 10.3969/j.issn.1671-8194.2012.30.346 (in Chinese) |
| [29] | GRIFFIN J, FLETCHER N, CLEMENCE R, et al. Selamectin is a potent substrate and inhibitor of human and canine P-glycoprotein[J]. J Vet Pharmacol Ther, 2010, 28(3): 257–265. |
| [30] | MOLENTO M B, LIFSCHITZ A, SALLOVITZ J, et al. Influence of verapamil on the pharmacokinetics of the antiparasitic drugs ivermectin and moxidectin in sheep[J]. Parasitol Res, 2004, 92(2): 121–127. DOI: 10.1007/s00436-003-1022-3 |



