2. 中国农业科学院兰州兽医研究所, 家畜疫病病原生物学国家重点实验室, 兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒感染引起(foot-and-mouth disease virus,FMDV)一种急性、高度传染性的偶蹄类动物疫病[1-3]。FMDV易染动物包括牛、猪、绵羊、山羊和超过70种的野生动物物种[4],严重妨碍了畜牧业健康发展[5]。目前,疫苗接种被广泛用于预防FMDV感染,但由于该病毒有七个血清型,在几个血清型之间缺乏交叉保护,血清型相同的不同毒株也可能没有相互的保护作用 [6],还没有其他有效的方法来阻止口蹄疫的流行[7]。因此应该加大力度研究防控该病。
自从RNAi技术被发明以来[8],RNAi技术被广泛的应用于抗病育种研究并且在抗病毒领域的研究中有了重大的突破,有望成为疾病预防的一种新型手段[9-11]。研究表明,利用RNAi技术靶向口蹄疫病毒的VP1、3D蛋白基因可以有效抑制FMDV在细胞内的复制,并且成功地生产了具有抗口蹄疫病毒的转基因动物[12-14]。目前利用RNAi技术靶向口蹄疫病毒的3C基因的研究比较少,本研究针对ON口蹄疫病毒的VP1、3C、3D基因,构建shRNA重组表达质粒,在细胞水平上挑选出能够高效抑制ON口蹄疫病毒的干扰片段,并成功制备含有慢病毒干扰载体的慢病毒,为后续抗口蹄疫病毒的转基因羊生产培育奠定实验基础。
1 材料与方法 1.1 材料 1.1.1 毒株、细胞和载体ON口蹄疫毒株由中国农业科学院兰州兽医研究所保存;DH5α感受态细胞购自全式金生物技术有限公司;仓鼠肾细胞BHK21、人肾上皮细胞293T、RNAi表达载体PLKO.1-TRC、慢病毒包装质粒pMD2.G和psPAX2均由本实验室保存。
1.1.2 主要试剂DMEM培养基、胰酶和胎牛血清均购自GIBCO公司;嘌呤霉素、Lipofectamine 2000 Transfection Reagent脂质体转染试剂盒、荧光定量PCR试剂盒、RNA提取试剂Trizol均购自Invitrogen公司;胶回收试剂盒和质粒提取试剂盒购自QIAGEN公司;AgeⅠ、EcoRⅠ、NcoⅠ、T4 DNA连接酶、DNA Ladder Marker等常用试剂购自从大连宝生物公司。
1.2 方法 1.2.1 引物设计根据siRNA的设计原则和引物设计的方法,通过Thermofisher在线辅助设计工具,合成shRNA对应的DNA序列(表 1)。这些序列由深圳华大基因有限公司合成。
|
|
表 1 合成shRNA所对应的DNA序列 Table 1 Synthesized DNA sequence correlated to shRNA |
根据PLKO.1-TRC的说明书进行,将合成的正义链和反义链DNA片段用去离子水溶解,终浓度为20 μmol·L-1,然后各取5 μL PCR仪上退火形成双链。对PLKO.1-TRC质粒载体经AgeⅠ和EcoRⅠ双酶切后得到7 kb的片段胶回收纯化,然后与退火生成的双链小片段连接,分别命名为PLKO.1-VP1-1、PLKO.1-VP1-2、PLKO.1-3C-1、PLKO.1-3C-2、PLKO.1-3D-1、PLKO.1-3D-2;连接产物转化感受态大肠杆菌,挑取阳性菌落,提取质粒经EcoRⅠ和NcoⅠ酶切鉴定,并送苏州金唯智生物科技有限公司测序,鉴定重组表达质粒是否构建成功。
1.2.3 病毒的复制和TCID50的测定用含有10%胎牛血清的DMEM培养基对BHK21细胞传代培养,至生长状态良好时弃掉培养基,加入100 μL的ON口蹄疫病毒与2 mL的DMEM培养1 h后,换液由含有2%胎牛血清的DMEM培养基继续培养,待细胞病变至80%左右收集病毒液,-80 ℃反复冻融3次并离心,收集上清。正常传代培养BHK21细胞至生长状态良好时,将细胞转移至96孔板,37 ℃,5% CO2培养箱中培养,待细胞长至90%左右,将病毒悬液进行10倍梯度稀释(10-1~10-10),每孔加入100 μL稀释好的病毒液,72 h后记录不同梯度出现的细胞病变孔数,然后按照Reed-Muench方法计算病毒的TCID50[15]。
1.2.4 重组表达质粒分别转染BHK21细胞后接毒并提取总的RNA正常传代培养BHK21细胞至生长状态良好时,将细胞转入6孔板中,待细胞长至70%左右,按照Lipofectamine 2000 Transfection Reagent脂质体转染说明书,将重组质粒PLKO.1-VP1-1、PLKO.1-VP1-2、PLKO.1-3C-1、PLKO.1-3C-2、PLKO.1-3D-1和PLKO.1-3D-2分别转入BHK21细胞中,转染48 h后,每孔加入200个TCID50的ON口蹄疫病毒。继续培养12 h后,收集细胞毒液,采用Trizol法提取BHK21细胞的总RNA,按照说明书方法操作提取RNA。将RNA保存至-80 ℃待用。
1.2.5 Real-time PCR检测细胞内病毒RNA选择FMDV基因组中3D基因的一段保守序列作为标准品序列设计引物和探针。序列如下:F:5′-ACTGGGTTTTAYAAACCTGTGATG-3′,R:5′-TCAACTTCTCCTGKATGGTCCCA-3′,探针5′-ATCCTCTCCTTTGCACGC-3′,其中标准品序列全长130 bp[16],然后建立标准曲线。将保存至-80 ℃的RNA取出,根据SuperScript Ⅲ Platinum one-Step Quantitative RT-PCR System说明书操作。反应体系如下:2×ReactionMix 12.5 μL,50 nmol·L-1 ROX Reference Dye,250 nmol·L-1探针,上、下游引物500 nmol·L-1,1 μL模板,最终用RNase-free water加至25 μL。qRT-PCR反应条件:50 ℃ 15 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,共40个循环。最后进行数据分析。
1.2.6 含重组质粒的细胞测定病毒TCID50正常传代培养BHK21细胞至生长状态良好时,将细胞转入6孔板中,待细胞长至70%左右,按照Lipofectamine 2000 Transfection Reagent脂质体转染说明书,将重组质粒PLKO.1-VP1-1、PLKO.1-VP1-2、PLKO.1-3C-1、PLKO.1-3C-2、PLKO.1-3D-1和PLKO.1-3D-2分别转入BHK21细胞中,转染48 h后,将含有重组质粒的细胞分别转移至96孔板,待细胞长至90%左右,将病毒悬液进行10倍梯度稀释(10-1~10-10),每孔加入100 μL稀释好的毒液,72 h后记录不同梯度出现的细胞病变孔数,然后按照Reed-Muench方法计算病毒的TCID50。最后进行数据分析。
1.2.7 慢病毒的制备和稳定细胞系的筛选正常传代培养293T至细胞生长状态良好时,将抑制病毒复制效果比较好的PLKO.1-VP1-2、PLKO.1-3D-1质粒分别与慢病毒包装载体psPAX2、pMD2.G用FuGENE® Transfection Reagent共转染于293T细胞,分别于36、60 h后收集细胞液,得到慢病毒。使用慢病毒感染BHK21细胞48 h后,用5 μg·mL-1的嘌呤霉素筛选细胞,鉴定慢病毒是否制备成功并且得到稳定的细胞系。
1.2.8 Real-time PCR检测慢病毒干扰载体对FMDV抑制效率对稳定筛选的细胞传代培养至细胞生长状态良好时,将细胞转入6孔板中,待细胞长至70%左右,每孔加入200个TCID50的ON口蹄疫病毒。收集培养12、18、24 h后的细胞毒液,采用Trizol法提取BHK21细胞的总RNA并使用Real-time PCR检测细胞内病毒RNA。最后进行数据分析。
1.2.9 含慢病毒干扰载体的细胞测定病毒的TCID50对稳定筛选的细胞传代培养至细胞生长状态良好时,将细胞转移至96孔板,37 ℃、5% CO2培养箱中培养,待细胞长至90%左右,将病毒悬液进行10倍梯度稀释(10-1~10-10),每孔加入100 μL稀释好的病毒液,72 h后记录不同梯度出现的细胞病变孔数,然后按照Reed-Muench方法计算病毒的TCID50。
2 结果 2.1 重组表达质粒的鉴定连接转化后,提取转化菌质粒DNA,经EcoRⅠ和NcoⅠ酶切鉴定,得到5和2 kb的两条带(图 1)。对重组表达质粒进行测序,结果证明成功构建了重组质粒,分别命名为PLKO.1-VP1-1、PLKO.1-VP1-2、PLKO.1-3C-1、PLKO.1-3C-2、PLKO.1-3D-1、PLKO.1-3D-2。

|
M. DL5000相对分子质量标准;1. PLKO.1-VP1-1;2.PLKO.1-VP1-2;3.PLKO.1-3C-1;4.PLKO.1-3C-2;5. PLKO.1-3D-1;6.PLKO.1-3D-2重组质粒双酶切鉴定 M.DL5000 marker; 1. PLKO.1-VP1-1;2.PLKO.1-VP1-2;3.PLKO.1-3C-1;4.PLKO.1-3C-2;5. PLKO.1-3D-1;6.PLKO.1-3D-2 double enzyme identification of recombinant plasmid 图 1 重组质粒双酶切鉴定 Figure 1 Double enzyme identification of recombinant plasmid |
使用正常的BHK21细胞测定病毒的TCID50为10-5.875·100 μL-1。将标准品进行10倍梯度稀释,并进行RT-PCR扩增。扩增结束后,根据起始的浓度值和循环CT值绘制标准曲线(图 2A),根据标准曲线可得知,扩增循环CT值与模板拷贝数的对数值呈良好的线性关系。相关系数R2=0.999,表明检测数据比较可靠。将含有重组质粒的细胞,每孔加入200个TCID50的ON口蹄疫病毒,12 h后收集细胞毒液,提取总RNA进行RT-PCR检测,并进行数据分析。重组质粒PLKO.1-VP1-1的抑制效率为86.06%、PLKO.1-VP1-2的抑制效率为93.2%、PLKO.1-3C-1的抑制效率为71.5%、PLKO.1-3C-2的抑制效率为84.1%、PLKO.1-3D-1的抑制效率为90.8%、PLKO.1-3D-2的抑制效率为87.3%(图 2B)。根据数据分析结果表明重组质粒可有效地抑制FMDV的复制。
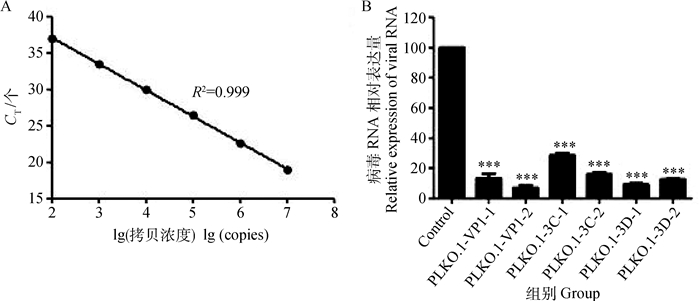
|
A. 3D标准曲线; B. FMDV RNA表达量的计算; ***. P < 0. 01 A. Standard curve FMDV 3D gene; B. The calculation FMDV RNA expression quantity; ***. P < 0.01 图 2 重组质粒转染BHK21细胞后FMDV RNA表达量 Figure 2 Recombinant plasmid transfection BHK21 cells after FMDV RNA expression quantity |
使用正常BHK21细胞和分别含有重组质粒的细胞测定病毒的TCID50,得到对照细胞测定病毒的TCID50为10-5.875·100 μL-1,含有重组质粒PLKO.1-VP1-1的细胞测定病毒的TCID50为10-5.041·100 μL-1、含有重组质粒PLKO.1-VP1-2的细胞测定病毒的TCID50为10-4.725·100 μL-1、含有重组质粒PLKO.1-3C-1的细胞测定病毒的TCID50为10-5.333·100 μL-1、含有重组质粒PLKO.1-3C-2的细胞测定病毒的TCID50为10-5.083·100 μL-1、含有重组质粒PLKO.1-3D-1的细胞测定病毒的TCID50为10-4.83·100 μL-1、含有重组质粒PLKO.1-3D-2的细胞测定病毒的TCID50为10-4.958·100 μL-1。结果表明,对照细胞测定的病毒TCID50无变化而转染重组质粒的细胞测定病毒的TCID50下降显著(图 3A),而且PLKO.1-VP1-1的抑制效率为85.3%、PLKO.1-VP1-2的抑制效率为92.9%、PLKO.1-3C-1的抑制效率为71.3%、PLKO.1-3C-2的抑制效率为84.1%、PLKO.1-3D-1的抑制效率为90.8%、PLKO.1-3D-2的抑制效率为87.8%(图 3B)。
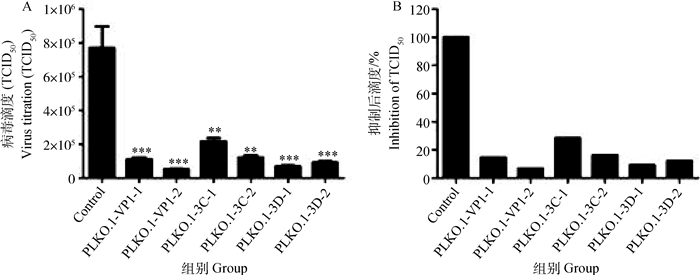
|
A.测定病毒的效价; B.计算对病毒复制的抑制;**. 0.01 < P < 0.05,***. P < 0.01 A. The determination of virus titer; B. The calculation of inhibition of viral replication; **. 0.01 < P < 0.05, ***. P < 0.01 图 3 重组质粒转染BHK21细胞后测定病毒的TCID50 Figure 3 The TCID50 of the virus was determined by the recombinant plasmid transfection BHK21 |
将收集得到的慢病毒感染BHK21细胞,使用5 μg·mL-1嘌呤霉素筛选。发现未感染慢病毒干扰载体的细胞4 d以后死亡,而试验组细胞正常存活,证明成功构建慢病毒。传代培养筛选出的细胞,得到稳定的细胞系。将筛选稳定的细胞转入6孔板中,每孔加入200个TCID50的ON口蹄疫病毒。观察12、18、24 h后细胞的病变情况并提取细胞的总RNA,进行RT-PCR检测,并进行数据分析。12 h慢病毒干扰载体PLKO.1-VP1-2的抑制效率为95.49%、PLKO.1-3D-1的抑制效率为92.4%;18 h慢病毒干扰载体PLKO.1-VP1-2的抑制效率为94.82%、PLKO.1-3D-1的抑制效率为89.9%;24 h慢病毒干扰载体PLKO.1-VP1-2的抑制效率为94.67%、PLKO.1-3D-1的抑制效率为88.3% (图 4)。数据分析结果表明慢病毒干扰载体可以有效地抑制FMDV的复制。
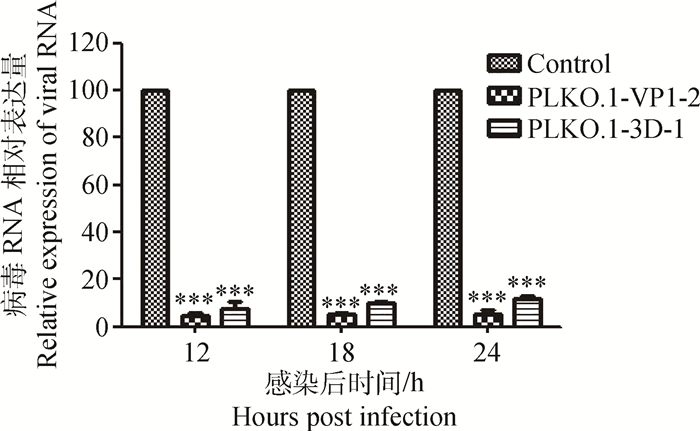
|
***. P < 0.01 图 4 BHK21稳定细胞系感染FMDV后FMDV RNA量 Figure 4 BHK21 stable cell line FMDV RNA expression amount after FMDV infection |
使用正常BHK21细胞和筛选稳定的细胞测定病毒的TCID50,得到对照细胞测定病毒的TCID50为10-5.875·100 μL-1,含有慢病毒干扰载体PLKO.1-VP1-2的细胞测定病毒的TCID50为10-4.542·100 μL-1、含有慢病毒干扰载体PLKO.1-3D-1的细胞测定病毒的TCID50为10-4.725·100 μL-1。结果表明对照细胞测定的病毒TCID50无变化而含有慢病毒干扰载体的细胞测定病毒的TCID50下降显著(图 5A)而且PLKO.1-VP1-2的抑制效率为95.3%、PLKO.1-3D-1的抑制效率为92.9%(图 5B)。
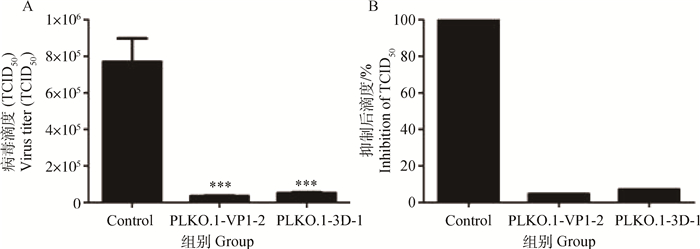
|
A.测定病毒的效价;B.计算对病毒的抑制;***.P < 0.01 A. The determination of virus titer; B. The calculation of Inhibition efficiency of virus; ***. P < 0.01 图 5 含慢病毒干扰载体的细胞测定病毒的TCID50 Figure 5 The TCID50 of the FMDV in cells with lentiviral vector |
FMDV复制速度快、周期短、传染力强,在全球大部分的地区流行,严重阻碍了世界畜牧业的发展,造成了严重的经济损失[17]。目前还没有特异针对该病的治疗方法,主要采用疫苗免疫接种的方法,但接种疫苗7 d后才能引起有效的保护反应,不能及时控制病毒的传播与复制,而且此种方法在生产过程中容易造成活病毒的逃逸或者免疫动物产生新的变异等弊端[18]。在之前的报道中,证实RNAi技术可以抑制FMDV在细胞内的复制并且取得了良好的效果[19]。3D、3C、VP1是口蹄疫病毒复制过程中的主要蛋白,均可选为RNAi的目标[20]。本研究使用RNAi干扰技术针对ON口蹄疫病毒3D、3C、VP1基因的高度保守区设计靶序列,从而有效地抑制ON口蹄疫病毒的复制。
现今抗病毒感染的有效方法之一就是利用RNAi技术在体内外抑制病毒的复制,并且该技术已经取得了深远的进步[21]。目前使用最多的是将人工设计合成的siRNA片段克隆到表达载体上,转入整合到宿主细胞基因组内让siRNA表达,引起相关的酶复合物与靶序列mRNA相结合,从而使特定的目的基因不表达或表达水平降低[22]。针对病毒靶基因的选择、针对病毒靶基因引物的设计合成对RNA干扰效果影响很大,因此靶基因的选择对干扰效果非常的重要[23]。本研究针对ON株口蹄疫病毒3D、3C、VP1基因的高度保守区设计了6对靶向shRNA,构建重组表达质粒转染至BHK21细胞,在细胞内通过沉默3D、3C、VP1基因的表达,从而抑制病毒蛋白的合成,最终降低了病毒的复制效率。通过RT-PCR和病毒TCID50的测定,结果表明含有重组质粒组与阳性对照相比其抑制率在71.5%~93.2%,其中PLKO.1-VP1-2和PLKO.1-3D-1的抑制效果最为明显。本研究成功构建了靶向ON口蹄疫病毒的重组表达质粒,并且能够有效的抑制FMDV在细胞内的增殖。
慢病毒载体的宿主细胞广泛、感染效率高、携带的目的基因导入宿主细胞内可以长期稳定的表达、同时可以容纳多个转录启动子和容纳大片段的外源基因[24]。其作为一种理想的基因转移工具,并应用于一些科学领域的研究,例如慢病毒载体成为一个高效实用的基因转移工具应用于RNAi研究领域[25]。目前,慢病毒载体与传统的转基因方法相结合,被广泛的用于制备转基因动物的研究[26]。本研究将干扰效果比较好的PLKO.1-VP1-2和PLKO.1-3D-1重组表达质粒包装成慢病毒,通过嘌呤霉素筛选得到稳定的细胞系,然后用ON FMDV去感染筛选的细胞系,收集12、18、24 h的细胞毒液提取RNA,做RT-PCR分析数据,结果表明含有慢病毒干扰载体组与阳性对照相比其抑制率在88.3%~95.49%。本研究表明慢病毒制备成功,为后续抗口蹄疫病毒转基因羊的生产培育奠定了基础。
4 结论采用RNAi技术在细胞水平上筛选出能够高效抑制ON口蹄疫病毒复制的PLKO.1-VP1-2和PLKO.1-3D-1重组质粒并成功制备慢病毒,为后续抗口蹄疫病毒转基因羊的生产培育奠定了基础。
| [1] | LEE S Y, KO M K, LEE K N, et al. Application of mouse model for effective evaluation of foot-and-mouth disease vaccine[J]. Vaccine, 2016, 34(33): 3731–3737. DOI: 10.1016/j.vaccine.2016.06.008 |
| [2] | RYAN E, HORSINGTON J, DURAND S, et al. Foot-and-mouth disease virus infection in young lambs:pathogenesis and tissue tropism[J]. Vet Microbiol, 2008, 127(3-4): 258–274. DOI: 10.1016/j.vetmic.2007.08.029 |
| [3] | YAN D, TENG Z D, SUN S Q, et al. Foot-and-mouth disease virus-like particles as integrin-based drug delivery system achieve targeting anti-tumor efficacy[J]. Nanomedicine, 2016, 13(3): 1061–1070. |
| [4] | QUAN M, MURPHY C M, ZHANG Z, et al. Influence of exposure intensity on the efficiency and speed of transmission of foot-and-mouth disease[J]. J Comp Pathol, 2009, 140(4): 225–237. DOI: 10.1016/j.jcpa.2008.12.002 |
| [5] | GLOSTER J, JONES A, REDINGTON A, et al. Airborne spread of foot-and-mouth disease-model intercomparison[J]. Vet J, 2010, 183(3): 278–286. DOI: 10.1016/j.tvjl.2008.11.011 |
| [6] | ORSEL K, DE JONG M C M, BOUMA A, et al. Foot and mouth disease virus transmission among vaccinated pigs after exposure to virus shedding pigs[J]. Vaccine, 2007, 25(34): 6381–6391. DOI: 10.1016/j.vaccine.2007.06.010 |
| [7] | CARRILLO C, LU Z, BORCA M V, et al. Genetic and phenotypic variation of foot-and-mouth disease virus during serial passages in a natural host[J]. J Virol, 2007, 81(20): 11341–11351. DOI: 10.1128/JVI.00930-07 |
| [8] | WANG L, ZHENG J, LUO Y Z, et al. Construction of a genomewide RNAi mutant library in rice[J]. Plant Biotechnol J, 2013, 11(8): 997–1005. DOI: 10.1111/pbi.12093 |
| [9] | ZHANG X X, ZHENG H X, XU M J, et al. Evaluation of a combinatorial RNAi lentivirus vector targeting foot-and-mouth disease virus in vitro and in vivo[J]. Mol Med Rep, 2015, 12(5): 6672–6678. DOI: 10.3892/mmr.2015.4246 |
| [10] | JIAO H W, DU L, HAO Y C, et al. Effective inhibition of mRNA accumulation and protein expression of H5N1 avian influenza virus NS1 gene in vitro by small interfering RNAs[J]. Folia Microbiol, 2013, 58(4): 335–342. DOI: 10.1007/s12223-012-0212-8 |
| [11] | CHEN C F, SHENG J L. Transgenic shRNA pigs reduce susceptibility to foot and mouth disease virus infection[J]. New Biotechnol, 2016, 33(Suppl 1): S213. |
| [12] | WANG H M, LIU X, WU J M, et al. Bovine fetal epithelium cells expressing shRNA targeting viral VP1 gene resisted against foot-and-mouth disease virus[J]. Virology, 2013, 439(2): 115–121. DOI: 10.1016/j.virol.2013.02.003 |
| [13] | WANG H M, WU J M, LIU X, et al. Identification of short hairpin RNA targeting foot-and-mouth disease virus with transgenic bovine fetal epithelium cells[J]. PLoS One, 2012, 7(8): e42356. DOI: 10.1371/journal.pone.0042356 |
| [14] | LI W T, WANG K J, KANG S M, et al. Tongue epithelium cells from shRNA mediated transgenic goat show high resistance to foot and mouth disease virus[J]. Sci Rep, 2015, 5: 17897. |
| [15] | VAREDI M, MOATTARI A, AMIRGHOFRAN Z, et al. Effects of hypo-and hyperthyroid states on herpes simplex virus infectivity in the rat[J]. Endocr Res, 2014, 39(2): 50–55. |
| [16] |
宋一鸣, 杨洋, 张志东. 针对Asia-1型FMDV的qRT-PCR终点法中和试验的建立及初步研究[J]. 黑龙江畜牧兽医, 2016(19): 42–47.
SONG Y M, YANG Y, ZHANG Z D. Establishment and preliminary study of a neutralization assay for Asia-1 type of FMDV using an end-point quantitative reverse transcription PCR[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(19): 42–47. (in Chinese) |
| [17] | DU J Z, GUO X B, GAO S D, et al. Induction of protection against foot-and-mouth disease virus in cell culture and transgenic suckling mice by miRNA targeting integrin αv receptor[J]. J Biotechnol, 2014, 187: 154–161. DOI: 10.1016/j.jbiotec.2014.07.001 |
| [18] | UDDOWLA S, HOLLISTER J, PACHECO J M, et al. A safe foot-and-mouth disease vaccine platform with two negative markers for differentiating infected from vaccinated animals[J]. J Virol, 2012, 86(21): 11675–11685. DOI: 10.1128/JVI.01254-12 |
| [19] | JOYAPPA D H, SASI S, ASHOK K C, et al. The plasmid constructs producing shRNA corresponding to the conserved 3D polymerase of foot and mouth disease virus protects guinea pigs against challenge virus[J]. Vet Res Commun, 2009, 33(3): 263–271. DOI: 10.1007/s11259-008-9174-3 |
| [20] | KIM S M, LEE K N, LEE S J, et al. Multiple shRNAs driven by U6 and CMV promoter enhances efficiency of antiviral effects against foot-and-mouth disease virus[J]. Antiviral Res, 2010, 87(3): 307–317. DOI: 10.1016/j.antiviral.2010.06.004 |
| [21] | DE LOS SANTOS T, WU Q H, DE AVILA BOTTON S, et al. Short hairpin RNA targeted to the highly conserved 2B nonstructural protein coding region inhibits replication of multiple serotypes of foot-and-mouth disease virus[J]. Virology, 2005, 335(2): 222–231. DOI: 10.1016/j.virol.2005.03.001 |
| [22] | LUO J H, DU J Z, GAO S D, et al. Lentviral-mediated RNAi to inhibit target gene expression of the porcine integrin αv subunit, the FMDV receptor, and against FMDV infection in PK-15 cells[J]. Virol J, 2011, 8: 428. DOI: 10.1186/1743-422X-8-428 |
| [23] | SLIVA K, SCHNIERLE B S. Selective gene silencing by viral delivery of short hairpin RNA[J]. Virol J, 2010, 7: 248. DOI: 10.1186/1743-422X-7-248 |
| [24] | ZHOU S, MA Z J, LU T H, et al. Mouse transplant models for evaluating the oncogenic risk of a self-inactivating XSCID lentiviral vector[J]. PLoS One, 2013, 8(4): e62333. DOI: 10.1371/journal.pone.0062333 |
| [25] | ZHANG S M, XIONG K, XIE Z R, et al. Stable silencing of β-lactoglobulin (BLG) gene by lentivirus-mediated RNAi in goat fetal fibroblasts[J]. Genet Mol Biol, 2012, 35(3): 680–685. DOI: 10.1590/S1415-47572012005000042 |
| [26] | RYU B Y, ORWIG K E, OATLEY J M, et al. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells[J]. J Androl, 2007, 28(2): 353–360. |



