2. 天津市畜牧兽医研究所, 天津 300381
2. Tianjin Institute of Animal Sciences, Tianjin 300381, China
在绵羊繁殖周期中,催乳素(Prolactin, PRL)与促性腺激素(Gonadotropins, Gn)释放模式之间呈负相关关系:夏季即非繁殖季节血浆中PRL浓度升高而促性腺激素分泌减弱,绵羊表现为休情[1-4];秋冬季节绵羊血浆中PRL浓度降低而促性腺激素分泌增加,表现出发情特征。与秋冬繁殖季节相比,非繁殖季节绵羊垂体中催乳素细胞(Lactotropes)和滤泡星状细胞(Folliculostellate cells, FSC)体积增大,且两种细胞之间的缝隙连接增多,暗示这种催乳素细胞和FSC形态学季节性变化与PRL的分泌相关[5]。多项研究表明,在受光周期调控的动物中,促性腺激素细胞(Gonadotropes)和催乳素细胞之间的相互作用以及FSC的调节作用均响应于不同光照周期条件下松果体分泌的褪黑激素(Melatonin, Mel)信号。Mel首先作用于垂体结节部(Pars tuberalis, PT),然后通过PT神经肽信号以光周期依赖方式传递到远侧部(Pars distalis, PD)区域,并刺激PRL的分泌[6]。绵羊PT组织存在可促进PRL分泌的速激肽前体1(Tachykinin precursor 1, TAC1)[7-9],且TAC1作为绵羊PT中将Mel信号传递至PD部位的神经肽信号,有强烈的光周期性,TAC1基因可编码速激肽物质P(Tachykinins substance P,SP)和神经激肽A (Neurokinin A,NKA),其中SP在肽链内切酶的作用下转化为有活性的SP1-7与NKA共同调节PRL的分泌[10]。
也有研究表明,在短光照条件下,夜间Mel长时间持续存在作用于PT组织中MEL敏感细胞,通过旁分泌抑制了PD区域PRL的分泌,PRL与促性腺细胞上的催乳素受体(Prolactin receptor,PRLR)结合减弱,减少了对促性腺细胞的抑制及对FSC的下调作用;同时,PRL分泌减少也抑制了下丘脑多巴胺(Dopamine, DA)网络的活化,由于DA能够抑制PRL分泌以及GnRH神经元活性,因此此时GnRH神经元的去抑制作用促进了GnRH释放,启动了繁殖季节的到来;GnRH分泌的增加也通过促性腺细胞旁分泌作用于催乳素细胞,这可能增加了两种细胞的相互作用以调控促性腺细胞响应于性腺反馈的信号。而长光照下,夜间Mel的短暂持续分泌不能抑制催乳素的分泌,PRL分泌突然增加,通过催乳素受体活化了DA神经元,导致GnRH分泌减少,通过FSC、催乳素细胞和DA调控网络活动的增强完全抑制了促性腺细胞,从而使动物表现休情特征[11]。综上,催乳素主要通过作用于垂体促性腺细胞和下丘脑神经元上的PRLR引起后续一系列生理变化[12-13]。
然而,PRL在动物季节性繁殖和繁殖时期转换中的详细调控机制尚不清楚,本研究针对PRL调控通路中的2个重要基因TAC1和PRLR在不同光照条件和不同繁殖时期绵羊垂体等组织中进行表达谱研究,并且分析由短光照变为长光照后2个基因的表达变化模式,为进一步揭示PRL在动物季节性繁殖和繁殖时期转换中的作用机制奠定基础。
1 材料与方法 1.1 动物材料随机选取2~3周岁健康、经产的空怀苏尼特母羊和小尾寒羊母羊,饲养于天津市畜牧兽医研究所试验羊场。所有羊只的饲养管理方式、饲料配方和环境一致。每天饲喂2次,时间分别为05:30和15:30,每天给每只羊提供2.4 kg全混合日粮(2 kg干草与0.4 kg精料)供其自由采食,羊舍内提供舔砖补充微量元素,自由饮水。
1.1.1 苏尼特羊表达谱试验:苏尼特羊在人工控光条件下短光照(光照时长8 h,SP)第21天和长光照(光照时长16 h,LP)第49天(每个光照处理条件各3只)处死并分别采集下丘脑、垂体、松果体、大脑、小脑、卵巢、子宫体、输卵管、肾、肾上腺等组织样品,采集到的组织样品经液氮速冻后-80 ℃保存。
短光照转为长光照的表达模式试验:苏尼特羊在天津市畜牧兽医研究所试验羊场摘除卵巢并埋植雌激素处理(OVX+E2),短光照42 d后转为长光照,并根据文献报道[14-17]与本课题组预试验结果,分别在短光照第21天(SP21D),长光照第3天(LP3D)、15天(LP15D)、21天(LP21D)、42天(LP42D)、49天(LP49D)上述每个时间点屠宰3只羊并采集上述组织,组织样品经液氮速冻后-80 ℃保存。
1.1.2 小尾寒羊用孕酮阴道栓(CIDR)对6只小尾寒羊进行处理,12 d后撤栓,撤栓之后第45小时为卵泡期,撤栓第10天为黄体期,在两个时期分别屠宰3只后,采取相应组织样品,样品经液氮速冻后-80 ℃保存。
1.2 RNA提取用Trizol和RNAprep pure动物组织总RNA提取试剂盒(天根生化科技北京有限公司)提取上述组织总RNA,提取过程中用RNase-free DNaseⅠ去除基因组DNA。利用NANODROP 2000检测总RNA浓度和纯度,OD值(A260 nm/A280 nm)为1.8~2.1,并用1%的琼脂糖凝胶对RNA进行电泳检测,无明显降解,置于-80 ℃冷冻备用。
1.3 cDNA合成(RT-PCR)使用PrimeScriptTM RT Reagent Kit反转录试剂盒(TaKaRa, Japan),按照说明书操作合成cDNA第一链。反转录产物稀释后,用持家基因β-actin进行PCR检测,可成功扩增。
1.4 定量引物设计根据NCBI公布的绵羊TAC1 mRNA序列(NM_001082596.1)以及PRLR mRNA序列(GenBank:Y10578.1),并结合本课题组RNA-seq序列结果设计引物。引物信息如表 1所示,由生工生物工程(上海)股份有限公司合成。
|
|
表 1 荧光定量引物信息 Table 1 The information of primer sequences for qPCR |
使用Roche Light Cycler 480Ⅱ荧光定量PCR仪和SYBR® Premix Ex TaqTM Ⅱ(TaKaRa, Japan)试剂盒对2个基因进行荧光检测,每个试验样品3个技术重复,β-actin作为内参基因,设置阴性对照(模板为H2O)。荧光定量PCR扩增体系:2×SYBR premix Ex Taq 10 μL,上下游引物各0.8 μL,RNase free H2O 6.4 μL,cDNA模板2 μL,反应体系总体积为20 μL。PCR程序:95 ℃预变性5 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。反应结束后进行熔解曲线分析。
1.6 统计分析采用2-ΔΔCT法计算目的基因相对表达量,数据差异显著性用SPSS 20进行统计学分析,组间比较用单因素方差分析(One-way ANOVA),用最小显著差异法(Least significant difference, LSD)进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。所有试验数据均用“平均值±标准误(Mean±SE)”表示。
2 结果 2.1 TAC1基因在不同光照条件下苏尼特羊和不同繁殖时期小尾寒羊的组织表达谱TAC1基因在长短光照条件下苏尼特羊组织中的表达情况总结如图 1,该基因在苏尼特羊下丘脑等10种组织中均有表达,其中下丘脑中的表达量明显高于其他组织,在性腺轴中的表达量相对较高。各组织在不同光照条件下的表达趋势基本一致,均为长光照条件下表达量高;其中长光照条件下苏尼特羊垂体和输卵管中TAC1的表达量显著高于短光照(P<0.05)。
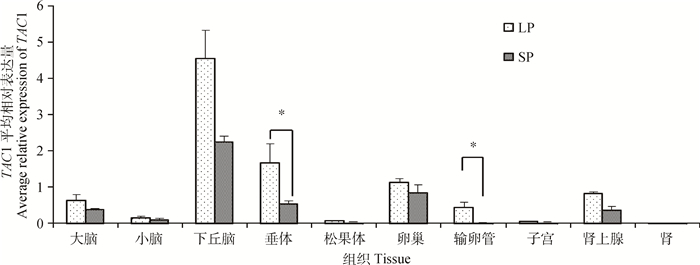
|
LP.长光照;SP.短光照。柱形上方“*”表示该基因在长光照与短光照苏尼特羊该组织中表达量差异显著(P<0.05)。图 4同 LP. Long photoperiod; SP. Short photoperiod. The "*" on the columns indicate the significant difference (P < 0.05) at the expression level of gene between the long photoperiod and the short photoperiod in tissues of Sunite sheep. The same as Figure 4 图 1 不同光照条件下苏尼特羊TAC1组织表达谱 Figure 1 Tissue expression of TAC1 in Sunite sheep under different photoperiods |
黄体期和卵泡期小尾寒羊组织表达谱结果如图 2所示,TAC1基因在小尾寒羊大脑等10种组织中均有表达,其中下丘脑中的表达量明显高于其他组织,在性腺轴中的表达量相对较高,且黄体期小尾寒羊大多数组织(肾上腺、垂体除外)中表达量均高于卵泡期,与TAC1在长短光照条件下苏尼特羊各组织的表达差异类似。
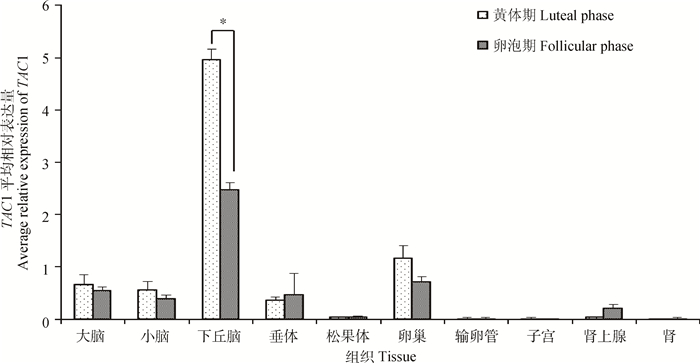
|
柱形上方“*”表示该基因在黄体期与卵泡期小尾寒羊该组织中表达量差异显著(P<0.05)。图 5同 The "*" on the column indicate the significant difference (P < 0.05) at the expression level of gene between the luteal phase and follicular phase in tissues of STH sheep. The same as Figure 5 图 2 不同繁殖时期小尾寒羊TAC1组织表达谱 Figure 2 Tissue expression of TAC1 in Small Tail Han sheep at different reproductive stages |
为了阐明TAC1基因在长光照后的表达变化模式,本研究对长光照后多个时间点苏尼特羊垂体进行TAC1基因表达分析(图 3),结果表明,短光照条件下苏尼特羊垂体TAC1基因表达量最低,转为长光照处理后,TAC1表达量在长光照的前42 d没有显著变化(P>0.05),但有缓慢上升趋势,而在LP49D时表达量显著升高并极显著高于其他时间点(P<0.01)。
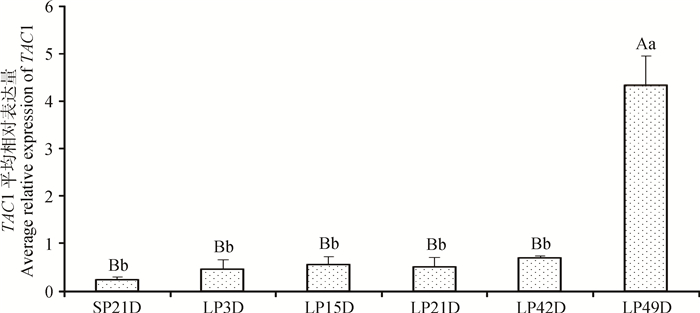
|
柱形上方不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。图 6、7同 Different letters above the column indicate significant differences (capital letter: P < 0.01, lowercase letter: P < 0.05), the same letter above the column indicate no significant difference (P > 0.05). The same as Figure 6, 7 图 3 短光照转变为长光照后苏尼特羊垂体TAC1基因的表达变化模式 Figure 3 The expression pattern of TAC1 during the transition from SP to LP in pituitary of Sunite sheep |
本研究检测了长短光照条件下苏尼特羊多个组织中PRLR基因的表达情况,结果如图 4所示。PRLR基因在各个组织中均有表达,在垂体、肾上腺中的表达量较高,其他组织中较低;其中肾上腺和垂体中的表达量明显高于其他组织。各组织不同光照条件下的表达趋势基本一致,均为长光照表达量高(小脑除外);其中长光照条件下下丘脑、输卵管和肾上腺中PRLR的表达量显著高于短光照下表达量(P<0.05)。
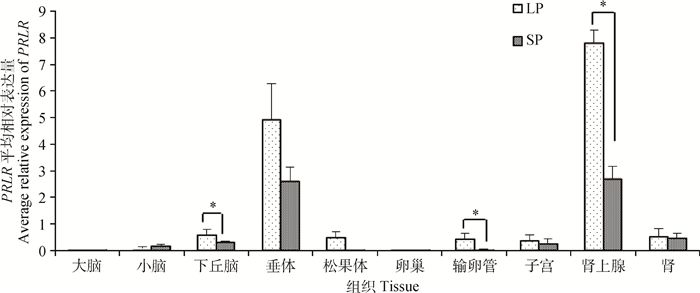
|
图 4 不同光照条件下苏尼特羊PRLR组织表达谱 Figure 4 Tissue expression of PRLR in Sunite sheep under different photoperiods |
本研究也检测了不同繁殖时期小尾寒羊PRLR基因的组织表达情况,结果如图 5所示。PRLR基因在小尾寒羊各组织中的表达情况与苏尼特羊几乎一致,在垂体、下丘脑、肾上腺、肾中表达较高,而其他组织中的表达水平较低。相对于黄体期,PRLR在卵泡期各组织(除小脑、输卵管和子宫)中的表达量均较低,其中卵泡期卵巢中该基因的表达量显著低于黄体期(P<0.05)。
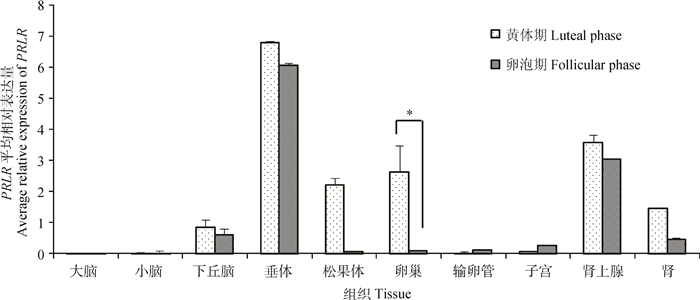
|
图 5 不同繁殖时期小尾寒羊PRLR组织表达谱 Figure 5 Tissue expression of PRLR in STH sheep at different reproductive stages |
如图 6所示,由短光照转为长光照第3天后,苏尼特羊垂体中PRLR基因表达量显著升高(P<0.05),至长光照21天时表达量达到峰值并显著高于其他时间点,LP42D和LP49D时表达量有所下降,但LP42D仍显著高于短光照时的表达量(P<0.05)。图 7表明,由短光照转为长光照时,苏尼特羊下丘脑中PRLR基因表达逐渐升高,且从LP15D开始其表达量显著高于短光照(P<0.05)。
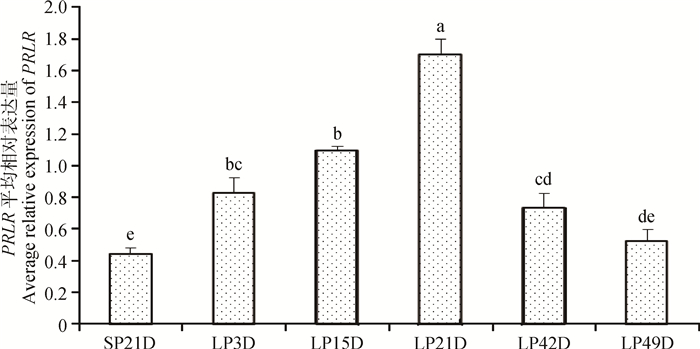
|
图 6 短光照转变为长光照后苏尼特羊垂体中PRLR基因的表达变化模式 Figure 6 The expression pattern of PRLR during the transition from SP to LP in pituitary of Sunite sheep |
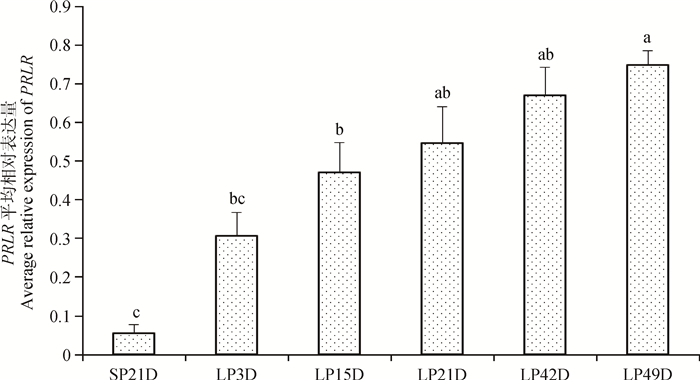
|
图 7 短光照转变为长光照后苏尼特羊下丘脑中PRLR基因的表达变化模式 Figure 7 The expression pattern of PRLR during the transition from SP to LP in hypothalamus of Sunite sheep |
本研究对TAC1基因在季节性发情绵羊品种苏尼特羊和常年发情品种小尾寒羊大脑等10个组织中做了表达量分析。TAC1基因在两个品种绵羊大脑等10个组织中均有表达,且组织表达特征基本一致,其在性腺轴组织和大脑中的表达量相对较高,暗示该基因在绵羊的这些组织中发挥主要作用,与繁殖性能密切相关。对人该基因的组织表达研究发现,它几乎在所有组织中都有表达,特别是脑部组织、心、大肠、脾以及乳腺表达较高,仅在非外周神经系统支配的胎盘组织中未发现表达[18-21]。在鲤鱼体内,TAC1基因主要表达于垂体、下丘脑、小脑、脊髓、鳃、心、肠、肝、肌肉和性腺组织中,在肾、血液和嗅球中没有检测到表达,将TAC1基因克隆于鲤鱼垂体中,发现其编码产物SP和NKA可以触发促黄体素(Luteinizing hormone,LH)和PRL的分泌[22]。TAC1基因编码的产物SP广泛分布于大脑中,在下丘脑中高度表达,与Kiss1和GnRH神经元密切接触,提示其可能与这些神经元存在相互作用[23-24],且研究显示,雄性小鼠TAC1基因敲除后青春期明显推迟[24],因此TAC1的表达对动物繁殖起着非常重要的作用。
本研究发现,长光照条件下苏尼特羊各个组织中该基因的表达量均高于短光照条件下表达量,黄体期小尾寒羊各组织中表达量几乎都高于卵泡期;这些结果表明,该基因可能在绵羊季节性繁殖和繁殖时期转换中扮演了一定角色。研究发现,小鼠下丘脑组织中TAC1基因的表达受雌激素抑制[25],本研究结果也显示卵泡期小尾寒羊下丘脑的TAC1基因表达量低于黄体期,暗示卵泡期绵羊下丘脑中该基因的表达可能受到高水平雌激素的调控。长短光照对比中,TAC1表达差异在垂体和输卵管组织中达到显著水平,暗示该基因最有可能在这2个组织中参与季节性繁殖的调控。由短光照转为长光照处理后,苏尼特羊垂体中TAC1基因表达量逐步上升,长光照49天时表达量达到最高值,并极显著高于其他光照时长处理组。S. M. Dupré等[10]的研究表明,TAC1基因在绵羊PT表达受光照调节,长光照处理时表达显著高于短光照。这些研究结果暗示TAC1是调节动物季节性繁殖的一个重要信号。
3.2 PRLR基因发挥作用的主要组织及对动物繁殖的影响目前已经确定PRLR是细胞因子受体超家族成员之一,催乳素受体信使RNA(mRNA)先后在大鼠、绵羊和马的垂体中得到鉴定[26-28]。本研究发现,PRLR基因在不同繁殖状态绵羊各个组织中均有表达,在垂体和下丘脑中的表达量较高,其中垂体PRLR表达量远高于其他各组织。这与赵强[29]通过免疫组化方法对成年小尾寒羊进行PRLR组织定位结果一致,他报道PRLR在绵羊的垂体、下丘脑、子宫和卵巢组织中均有阳性反应,且在垂体远侧端最为明显。另外,在绵羊其他部位如腹股沟窦[30]、脂肪[31]等组织中也存在该基因的表达。吴宪红等[32]发现,PRLR基因的mRNA在处于发情期的乐至黑山羊和藏山羊组织中广泛表达,并且垂体中的表达量高于肝、子宫内膜和卵巢。M. Hasiec等[33]用荧光定量方法研究了休情期哺乳母羊脑部若干组织中PRLR的表达量,发现该基因在视前区(Preoptic areas)、下丘脑视上核(Supraoptic nucleus)、室旁核(Paraventricular nucleus)、脉络丛(Choroid plexus)和垂体前叶(Anterior pituitary)均有表达。D. J. Tortonese等[27]报道,PRLR基因在绵羊促性腺激素细胞中选择性表达。以上研究表明绵羊PRLR基因主要在垂体和下丘脑中发挥作用。
研究表明,PRLR在动物机体不同组织中的表达存在差异并且其表达水平会随动物的繁殖周期变化而变化。本研究发现,PRLR基因在不同繁殖时期小尾寒羊和不同光照时长处理下苏尼特羊垂体等10个组织中均有不同程度的表达但存在差异,苏尼特羊在短光照条件下(繁殖季节)几乎所有组织中PRLR的表达量显著低于长光照条件下(休情季节)表达量,暗示该基因可能参与绵羊季节性繁殖的调控;小尾寒羊PRLR在卵泡期各组织中的表达量均显著低于黄体期,暗示该基因可能与绵羊繁殖时期转换有关。R. A. Picazo等[34]研究了PRLR在绵羊整个发情周期卵巢中的表达变化和细胞定位,发现在发情周期的第0、10和15天中PRLR在促性腺激素依赖性原始卵泡中的细胞定位是相似的,并且原始卵泡和初级卵泡中阳性信号最强,而在即将排卵的成熟卵泡颗粒细胞中几乎没有阳性信号,卵母细胞一直显示PRLR阳性免疫染色。对鸡颗粒细胞中PRLR表达的研究表明,该基因的转录物水平在直径小于2 mm的卵泡基质和壁细胞中最高,随着卵泡的成熟表达水平逐渐下降[35]。这表明,PRLR基因高表达可能对动物繁殖活动有抑制作用,或者发情和排卵可能抑制PRLR基因的表达。
在季节性繁殖的动物(如羊和马)中,GnRH和促性腺激素的分泌受季节性变化即日照时长控制。光周期信息由松果体夜间分泌褪黑激素的模式解码[36],脑垂体中高密度的褪黑激素受体被褪黑激素激活后可直接调控垂体内催乳素的分泌模式[37]。催乳素可能通过2种途径调控下游因子,一种途径是:绵羊下丘脑接收了催乳素信号后PRLR基因高表达,然后通过下丘脑-垂体-性腺轴进行繁殖信号的传递;另外一种途径是垂体内局部旁分泌机制:垂体前叶接收催乳素信号后PRLR基因高表达,抑制促性腺细胞分泌LH和FSH。苏尼特羊垂体中PRLR基因在短光照条件下表达量相对较低,转为长光照处理后逐步上升,长光照第21天时表达量达到最高值,并极显著高于其他光照处理组,长光照第42天和第49天时表达量有所下降,但仍高于短光照;由短光照条件下转为长光照处理后,下丘脑中PRLR基因表达量逐步增加,且从长光照15 d后开始显著高于短光照。S. Wood等[38]研究表明,绵羊短光照处理的12周内其血浆催乳素水平处于稳定低水平状态,而转为长光照后前2周明显升高,3周之后处于较高水平。本研究表明,催乳素受体是在长光照之后发生响应并与催乳素变化的趋势基本一致,而且在垂体和下丘脑中显示出不同的变化模式。
M. Gumułka等[39]对不同光照条件下雄性家鹅垂体和睾丸中PRLR基因mRNA表达进行研究,在短光照转变为长光照后,两种组织中PRLR表达量没有显著差异,仅在繁殖活动结束时睾丸PRLR mRNA增加,表明家鹅中该基因在季节性繁殖中的调控作用与绵羊不同。除了季节性繁殖,该基因的表达也与妊娠有关。绵羊垂体中PRLR mRNA表达随妊娠至分娩过程中呈动态变化,妊娠前和妊娠中期表达量很低仅为可检测水平,妊娠后期表达增加,产后早期达到最大值,随后在产后中期和后期阶段逐渐下降;相对于非怀孕期和怀孕阶段,在产后后期阶段PRLR mRNA表达仍较高;而且正常母性行为组的表达明显高于异常母性行为组[40]。曾献存等[41]研究发现,PRLR在成年中国美利奴羊下丘脑中的表达量显著高于其他组织,而在垂体组织中该基因表达量在羔羊30日龄时最高,之后急剧下降。综上可以看出,PRLR基因主要通过在垂体和下丘脑中的动态表达变化参与动物繁殖活动调控。
4 结论TAC1主要表达于性腺轴组织,PRLR基因主要在垂体和肾上腺中表达。这2个基因在不同光照条件和不同繁殖时期绵羊各组织中的表达差异暗示它们可能涉及绵羊季节性繁殖和繁殖时期转换的调控。由短光照转为长光照条件后PRLR基因在季节性发情绵羊的垂体和下丘脑中具有不同的响应模式,暗示存在不同的调控方式。
| [1] |
孙伟, 张向楠, 左其生, 等. 湖羊催乳素受体基因外显子10多态性及与其母性行为性状的关联分析[J]. 畜牧兽医学报, 2013, 44(5): 673–680.
SUN W, ZHANG X N, ZUO Q S, et al. Analysis on genetic polymorphism of exon 10 of PRLR gene and its association with distribution type of its maternal behavior in Hu sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(5): 673–680. (in Chinese) |
| [2] |
黄杨河, 王凭青, 杨力, 等. 促性腺激素释放激素受体(GnRHR)基因多态性及其与山羊产羔数的相关性分析[J]. 畜牧兽医学报, 2012, 43(1): 22–28.
HUANG Y H, WANG P Q, YANG L, et al. Polymorphism of gonadotropin releasing hormone receptor (GnRHR) Gene and its relationship with litter size in goats[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(1): 22–28. (in Chinese) |
| [3] | CURLEWIS J D. Seasonal prolactin secretion and its role in seasonal reproduction:a review[J]. Reprod Fertil Dev, 1992, 4(1): 1–23. |
| [4] | WALTON J S, MCNEILLY J R, MCNEILLY A S, et al. Changes in concentrations of follicle-stimulating hormone, luteinizing hormone, prolactin and progesterone in the plasma of ewes during the transition from anoestrus to breeding activity[J]. J Endocrinol, 1977, 75(1): 127–136. DOI: 10.1677/joe.0.0750127 |
| [5] | CHRISTIAN H C, IMIRTZIADIS L, TORTONESE D. Ultrastructural changes in lactotrophs and folliculo-stellate cells in the ovine pituitary during the annual reproductive cycle[J]. J Neuroendocrinol, 2015, 27(4): 277–284. DOI: 10.1111/jne.12261 |
| [6] | MORGAN P J. The pars tuberalis:the missing link in the photoperiodic regulation of prolactin secretion?[J]. J Neuroendocrinol, 2000, 12(4): 287–295. |
| [7] | GRAHAM E S, WEBSTER C A, HAZLERIGG D G, et al. Evidence for the biosynthesis of a prolactin-releasing factor from the ovine pars tuberalis, which is distinct from thyrotropin-releasing hormone[J]. J Neuroendocrinol, 2002, 14(12): 945–954. DOI: 10.1046/j.1365-2826.2002.00848.x |
| [8] | MORGAN P J, WEBSTER C A, MERCER J G, et al. The ovine pars tuberalis secretes a factor(s) that regulates gene expression in both lactotropic and nonlactotropic pituitary cells[J]. Endocrinology, 1996, 137(9): 4018–4026. DOI: 10.1210/endo.137.9.8756579 |
| [9] | STIRLAND J A, JOHNSTON J D, CAGAMPANG F R A, et al. Photoperiodic regulation of prolactin gene expression in the Syrian hamster by a pars tuberalis-derived factor[J]. J Neuroendocrinol, 2001, 13(2): 147–157. DOI: 10.1046/j.1365-2826.2001.00611.x |
| [10] | DUPRÉ S M, MIEDZINSKA K, DUVAL C V, et al. Identification of Eya3 and TAC1 as long-day signals in the sheep pituitary[J]. Curr Biol, 2010, 20(9): 829–835. DOI: 10.1016/j.cub.2010.02.066 |
| [11] | TORTONESE D J. Intrapituitary mechanisms underlying the control of fertility:key players in seasonal breeding[J]. Domest Anim Endocrinol, 2016, 56(Suppl 1): S191–S203. |
| [12] | BOLE-FEYSOT C, GOFFIN V, EDERY M, et al. Prolactin (PRL) and its receptor:actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice[J]. Endocr Rev, 1998, 19(3): 225–268. DOI: 10.1210/edrv.19.3.0334 |
| [13] | CLEVENGER C V, GADD S L, ZHENG J M. New mechanisms for PRLr action in breast cancer[J]. Trends Endocrinol Metab, 2009, 20(5): 223–229. DOI: 10.1016/j.tem.2009.03.001 |
| [14] | DARDENTE H, WYSE C A, BIRNIE M J, et al. A molecular switch for photoperiod responsiveness in mammals[J]. Curr Biol, 2010, 20(24): 2193–2198. DOI: 10.1016/j.cub.2010.10.048 |
| [15] | MASUMOTO K H, UKAI-TADENUMA M, KASUKAWA T, et al. Acute induction of Eya3 by late-night light stimulation triggers TSHβ expression in photoperiodism[J]. Curr Biol, 2010, 20(24): 2199–2206. DOI: 10.1016/j.cub.2010.11.038 |
| [16] | WOOD S, LOUDON A. Clocks for all seasons:unwinding the roles and mechanisms of circadian and interval timers in the hypothalamus and pituitary[J]. J Endocrinol, 2014, 222(2): R39–R59. DOI: 10.1530/JOE-14-0141 |
| [17] | TSUJINO K, NARUMI R, MASUMOTO K H, et al. Establishment of TSHβ real-time monitoring system in mammalian photoperiodism[J]. Genes Cells, 2013, 18(7): 575–588. DOI: 10.1111/gtc.2013.18.issue-7 |
| [18] | PAGE N M, BELL N J, GARDINER S M, et al. Characterization of the endokinins:human tachykinins with cardiovascular activity[J]. Proc Natl Acad Sci U S A, 2003, 100(10): 6245–6250. DOI: 10.1073/pnas.0931458100 |
| [19] | PAGE N M, WOODS R J, LOWRY P J. A regulatory role for neurokinin B in placental physiology and pre-eclampsia[J]. Regul Pept, 2001, 98(3): 97–104. DOI: 10.1016/S0167-0115(00)00239-1 |
| [20] | PINTO F M, ALMEIDA T A, HERNANDEZ M, et al. mRNA expression of tachykinins and tachykinin receptors in different human tissues[J]. Eur J Pharmacol, 2004, 494(2-3): 233–239. DOI: 10.1016/j.ejphar.2004.05.016 |
| [21] | LI W X, DAI S X, LIU J Q, et al. Integrated analysis of Alzheimer's disease and schizophrenia dataset revealed different expression pattern in learning and memory[J]. J Alzheimers Dis, 2016, 51(2): 417–425. DOI: 10.3233/JAD-150807 |
| [22] | HU G F, HE M L, KO W K W, et al. TAC1 gene products regulate pituitary hormone secretion and gene expression in prepubertal grass carp pituitary cells[J]. Endocrinology, 2017, 158(6): 1776–1797. DOI: 10.1210/en.2016-1740 |
| [23] | MAGUIRE C A, SONG Y B, WU M, et al. Tac1 signaling is required for sexual maturation and responsiveness of GnRH neurons to kisspeptin in the male mouse[J]. Endocrinology, 2017, 158(7): 2319–2329. DOI: 10.1210/en.2016-1807 |
| [24] | LASAGA M, DEBELJUK L. Tachykinins and the hypothalamo-pituitary-gonadal axis:an update[J]. Peptides, 2011, 32(9): 1972–1978. DOI: 10.1016/j.peptides.2011.07.009 |
| [25] | NAVARRO V M, BOSCH M A, LEÓN S, et al. The integrated hypothalamic tachykinin-kisspeptin system as a central coordinator for reproduction[J]. Endocrinology, 2015, 156(2): 627–637. DOI: 10.1210/en.2014-1651 |
| [26] | CHIU S, KOOS R D, WISE P M. Detection of prolactin receptor (PRL-R) mRNA in the rat hypothalamus and pituitary gland[J]. Endocrinology, 1992, 130(3): 1747–1749. |
| [27] | TORTONESE D J, BROOKS J, INGLETON P M, et al. Detection of prolactin receptor gene expression in the sheep pituitary gland and visualization of the specific translation of the signal in gonadotrophs[J]. Endocrinology, 1998, 139(12): 5215–5223. DOI: 10.1210/endo.139.12.6365 |
| [28] | HENDERSON H L, HODSON D J, GREGORY S J, et al. Gonadotropin-releasing hormone stimulates prolactin release from lactotrophs in photoperiodic species through a gonadotropin-independent mechanism[J]. Biol Reprod, 2008, 78(2): 370–377. DOI: 10.1095/biolreprod.107.064063 |
| [29] |
赵强. 绵羊PRLR, PRLH和PRLHR基因的克隆及其在下丘脑-垂体-性腺中表达的研究[D]. 兰州: 甘肃农业大学, 2015.
ZHAO Q. Molecular cloning of PRLR, PRLH and PRLHR gene in ovine and theirs expression in the hypothalamus, pituitary, uterus and ovary[D]. Lanzhou: Gansu Agricultural University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10733-1015975287.htm |
| [30] | ALEXANDRE-PIRES G, MARTINS C, GALVÃO A M, et al. Understanding the inguinal sinus in sheep (Ovis aries)-morphology, secretion, and expression of progesterone, estrogens, and prolactin receptors[J]. Int J Mol Sci, 2017, 18(7): 1516. DOI: 10.3390/ijms18071516 |
| [31] | PEARCE S, BUDGE H, MOSTYN A, et al. Prolactin, the prolactin receptor and uncoupling protein abundance and function in adipose tissue during development in young sheep[J]. J Endocrinol, 2005, 184(2): 351–359. DOI: 10.1677/joe.1.05732 |
| [32] |
吴宪红, 龙石太, 王永, 等. 催乳素受体基因(PRLR)在乐至黑山羊和藏山羊不同组织中的差异表达[C]//中国遗传学会第九次全国会员代表大会暨学术研讨会论文集. 哈尔滨: 中国遗传学会, 2013.
WU X H, LONG S T, WANG Y, et al. The differential expression of prolactin receptor gene (PRLR) in different tissues between the Lezhi black goat and Tibetan goat[C]//The 9th National Congress of Chinese Society of Genetics IE. Proceedings of Academic Symposium. Harbin: The Genetics Society of China, 2013. (in Chinese) |
| [33] | HASIEC M, SZLIS M, GÓRSKI K, et al. Prolactin receptors mRNA expression in selected brain regions of lactating sheep[C]//Proceedings of the 4th Winter Workshop of the Society for Biology of Reproduction "Central and Local Regulations of Reproductive Processes". Zakopane, Poland: Society for Biology of Reproduction, 2016. |
| [34] | PICAZO R A, GARCÍA RUIZ J P, SANTIAGO MORENO J, et al. Cellular localization and changes in expression of prolactin receptor isoforms in sheep ovary throughout the estrous cycle[J]. Reproduction, 2004, 128(5): 545–553. DOI: 10.1530/rep.1.00343 |
| [35] | HU S G, DUGGAVATHI R, ZADWORNY D. Regulatory mechanisms underlying the expression of prolactin receptor in chicken granulosa cells[J]. PLoS One, 2017, 12(1): e170409. |
| [36] | PEVET P, CHALLET E. Melatonin:both master clock output and internal time-giver in the circadian clocks network[J]. J Physiol Paris, 2011, 105(4-6): 170–182. DOI: 10.1016/j.jphysparis.2011.07.001 |
| [37] | LINCOLN G A, CLARKE I J. Photoperiodically-induced cycles in the secretion of prolactin in hypothalamo-pituitary disconnected rams:evidence for translation of the melatonin signal in the pituitary gland[J]. J Neuroendocrinol, 1994, 6(3): 251–260. DOI: 10.1111/jne.1994.6.issue-3 |
| [38] | WOOD S, CHRISTIAN H C, MIEDZINSKA K, et al. Binary switching of calendar cells in the pituitary defines the phase of the circannual cycle in mammals[J]. Curr Biol, 2015, 25(20): 2651–2662. DOI: 10.1016/j.cub.2015.09.014 |
| [39] | GUMUŁKA M, ROZENBOIM I. Effect of breeding stage and photoperiod on gonadal and serotonergic axes in domestic ganders[J]. Theriogenology, 2015, 84(8): 1332–1341. DOI: 10.1016/j.theriogenology.2015.07.012 |
| [40] | WANG L P. mRNA expression of prolactin receptor in sheep pituitary and its effect on maternal behavior[J]. Genet Mol Res, 2015, 14(3): 8650–8657. DOI: 10.4238/2015.July.31.13 |
| [41] |
曾献存, 陈韩英, 贾斌, 等. 中国美利奴羊PROP1和PRLR基因的表达分析[J]. 畜牧兽医学报, 2011, 42(8): 1057–1062.
ZENG X C, CHEN H Y, JIA B, et al. The expression analysis of PROP1 and PRLR genes in Chinese merino sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(8): 1057–1062. (in Chinese) |



