2. 中国农业科学院上海兽医研究所, 上海 200241;
3. 西北民族大学, 甘肃省动物细胞工程技术研究中心, 兰州 730030;
4. 西北民族大学生命科学与工程学院, 兰州 730030;
5. 江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室, 泰州 225300
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China;
3. Gansu Engineering Research Center for Animal Cell, Northwest Minzu University, Lanzhou 730030, China;
4. Faculty of Life Science and Engineering, Northwest Minzu University, Lanzhou 730030, China;
5. Jiangsu Key Laboratory of Veterinary Biotechnologic Drug, Jiangsu Agri-animal Husbandry Vocational College, Taizhou 225300, China
禽流感(avian influenza,AI)是由A型流感病毒(influenza virus A)引起的禽类传染疾病。禽流感病毒属正黏病毒科流感病毒属,单股、负链、分节段的RNA病毒[1]。禽流感病毒不仅可以感染野生鸟类、水禽和家禽,还感染人类及猫、猪、马、老虎等哺乳动物[2-3]。AI可致家禽产生高达100%的发病率和死亡率,并可感染人和出生致死病例,对世界养禽业和人类健康构成严重威胁[4-5]。新城疫(Newcastle disease,ND)又称亚洲鸡瘟或伪鸡瘟,是由新城疫病毒(Newcastle disease virus,NDV)引起的鸡和火鸡急性高度接触性传染病。新城疫病毒属于副黏病毒科禽腮腺炎病毒属,单股、负链、不分段的RNA病毒[6]。新城疫病毒主要是通过家禽个体间的直接传播和通过呼吸道的飞沫或粪便等间接传播方式传播,其感染率和病死率可达100%[7]。禽流感和新城疫被世界动物卫生组织列为必须报告的疾病,在我国被列为优先防治的一类动物疫病[8-9]。
家禽养殖过程中,多种病毒混合感染情况普遍存在。2000—2006年我国4个主要养鸡大省5种免疫抑制性病毒的流行病学调查结果显示鸡群中二重及多重混合感染的阳性率达31.73%,其中马立克病毒(MDV)和鸡传染性贫血病毒(CIAV)、MDV和禽白血病病毒的二重感染阳性率最高[10]。中国、伊朗、巴基斯坦等国家自1997年均报道过H9N2弱毒AIV感染导致大量鸡群死亡的事件,深入研究表明AIV与其他禽呼吸道疾病的共感染可能是导致鸡群大规模死亡的原因[11-12]。Haghighat-Jahromi等[13]研究表明传染性支气管炎病毒(infectious bronchitis virus, IBV)与AIV共感染能够显著增强AIV病毒释放,增强其致病性,导致鸡群死亡。
AIV属于正黏病毒科流感病毒属,NDV属于副黏病毒科禽腮腺炎病毒属;副黏病毒与正黏病毒均是负链RNA病毒,其成熟病毒粒子均通过从细胞膜表面出芽释放。AIV的核蛋白(nucleoprotein, NP)高度保守,在各亚型间的相似性达90%以上,是主要的型特异性抗原[12-13]。NDV的核蛋白对病毒基因组RNA及反基因组RNA的壳体包裹和病毒的复制至关重要。
全球范围内,野生水禽中多次检测到NDV和AIV的共感染[14]。然而这两种病毒共感染的机制、共感染病毒的复制和共感染的传播途径尚不明确。本试验研究了NDV和H9N2亚型AIV体外共感染鸡成纤维细胞DF-1对病毒复制的影响,为研究AIV和NDV共感染机制奠定了基础,并为临床上两种病毒的防控提供了新的线索。
1 材料与方法 1.1 毒株和细胞新城疫病毒Chicken/NL/Herts/33毒株由扬州大学刘秀梵院士惠赠,禽流感病毒A/HongKong/1073/99(H9N2)毒株由中国兽医药品监察所提供。鸡成纤维细胞(DF-1)、犬肾细胞(MDCK)购自美国标准生物品收藏中心(ATCC),在含10%胎牛血清的DMEM培养基中37 ℃培养。H9N2毒株和Herts/33毒株分别尿囊腔接种9日龄SPF鸡胚,37 ℃培养箱中培养,72 h后收集尿囊液,参照中华人民共和国兽用生物制品质量规程[15],用DF-1细胞和MDCK细胞计算Herts/33和H9N2的病毒滴度分别为106.5和104.7 TCID50·mL-1。
1.2 试剂DMEM培养基、细胞培养用磷酸盐缓冲液(PBS)、胎牛血清FBS购自美国Hyclone公司。兔源禽流感NP抗体(A01506-40)购自金斯瑞生物科技有限公司,β-actin单克隆抗体(monoclcnal anti-β-actin,A1978)购自美国Sigma公司;鼠源NDV-NP抗体由本实验室制备。辣根过氧化物酶(HRP)标记山羊抗鼠IgG和山羊抗兔IgG购自美国Jackson Immuno Research公司;预染蛋白质Marker购自NEB公司;NC膜购自GE公司;SDS-PAGE蛋白上样缓冲液购自碧云天生物技术研究所;TRIzol购自Thermo Fisher公司;M-MLV反转录酶购自Promega公司;SYBR Premix Ex Taq reagents购自TaKaRa公司;TBST为实验室自行配制。
1.3 病毒感染单独感染组:DF-1细胞复苏后盲传数代后接种至6孔培养板中,置37 ℃、5% CO2培养箱培养,细胞长至80%~90%密度时,弃去培养基,DMEM稀释1.0 MOI的NDV病毒液接种细胞,吸附1 h后弃上清,换1% FBS的DMEM继续培养,间隔4 h、共计6个时间点收取样品,进行后续试验。AIV感染DF-1细胞步骤同NDV,但在病毒吸附和维持过程中在培养基中加入TPCK胰酶至终浓度1 μg·mL-1。
共感染组:复苏培养的DF-1盲传数代后接种至6孔板中,置于37 ℃、5% CO2培养箱培养,细胞长至80%~90%密度时,弃去培养基。根据单独感染组1.0 MOI所需病毒含量,用不含FBS的DMEM稀释的NDV和AIV接种细胞,吸附1 h后弃上清,换1% FBS维持液继续培养,分别于12和24 h后收取样品,进行后续试验。
1.4 Western blotDF-1细胞复苏盲传数代后接种至6孔培养板中,感染病毒后指定时间收集细胞,使用SDS-PAGE蛋白上样缓冲液处理,样品经100 ℃水浴10 min,12 000 r·min-1离心后,-20 ℃保存。将处理后蛋白样品进行10% SDS-PAGE电泳分离并转印至0.2 μm NC膜,脱脂乳封闭2 h,TBST清洗后,NDV-NP抗体4 ℃孵育过夜,TBST清洗残留抗体后室温鼠源二抗孵育2 h,TBST清洗残余抗体后显色;使用一抗二抗去除液处理NC膜,进行β-actin抗体4 ℃孵育过夜,TBST清洗残留抗体后室温鼠源二抗孵育2 h,TBST清洗残余抗体后显色; AIV-NP抗体孵育步骤同NDV-NP抗体。
1.5 间接免疫荧光DF-1细胞复苏后盲传数代接种至6孔板中(6孔板中预先放入飞片),感染病毒后12和24 h收取细胞,用4%多聚甲醛固定,PBS清洗后4 ℃短期保存;将固定好的细胞用Triton X-100室温透化10 min,TBST清洗三遍后使用3% BSA、37 ℃封闭处理30 min,接种1: 250 PBS稀释的兔源AIV-NP抗体,37 ℃孵育1.5 h,TBST振荡清洗3次,每次5 min,避光条件下使用山羊抗兔的荧光二抗进行染色,30 ℃孵育30 min,TBST处理后3% BSA封闭30 min;使用鼠源NDV-NP抗体孵育,二抗使用山羊抗鼠的荧光抗体,步骤同AIV-NP抗体孵育;DAPI细胞核染色,封片,激光共聚焦扫描显微镜进行观察。
1.6 荧光定量PCRDF-1细胞复苏后盲传3代接种至6孔板中,感染病毒后指定时间收集细胞,在细胞中加入1 mL TRIzol,按TRIzol Reagents操作手册进行病毒RNA提取,运用M-MLV反转录酶依据通用引物:AGCAAAAGCAGG将RNA反转录成cDNA。分别使用编码新城疫病毒NP蛋白和禽流感病毒NP蛋白基因序列设计特异引物,β-actin基因引物作为内参(表 1)。利用SYBR Premix Ex Taq reagents进行相对定量荧光实时定量PCR,荧光定量PCR反应缓冲体系为20 μL:SYBR Premix Ex Taq(2×)10 μL,上游引物和下游引物各10 pmol,ROX Reference Dye(50×)0.4 μL,cDNA为模板20 ng,补ddH2O(灭菌蒸馏水)至20 μL。荧光定量PCR反应程序如下:95 ℃预变性30 s;(95 ℃ 5 s, 55 ℃ 30 s)×40个循环,最后加上熔解曲线反应以验证扩增产物特异性。mRNA的相对表达量以-ΔΔCT方法计算[16]。
|
|
表 1 AIV NP和NDV NP基因实时荧光定量PCR引物序列 Table 1 The primer sequences of AIV NP and NDV NP for real-time fluorescent quantitative PCR |
Western blot结果数据使用Image-Pro Plus进行蛋白灰度值分析:目的蛋白的灰度=目的蛋白IOD值/相对内参IOD值;间接免疫荧光实验数据使用Image-Pro Plus进行光密度值检测病毒蛋白表达丰度分析;数据结果通过GraphPad Prism6进行作图,Student’s test统计学分析(***代表P<0.001; **代表P<0.01, *代表P<0.05)。
2 结果 2.1 NDV/AIV单独感染后病毒蛋白表达NDV Herts/33感染DF-1细胞后12 h出现细胞病变,24 h细胞开始脱落;AIV感染DF-1细胞后也是12 h出现细胞病变,24 h细胞开始脱落。由于AIV和NDV的NP蛋白在各型之间保守且与病毒基因组复制密切相关,因此本试验运用Western blot通过检测NDV和AIV NP蛋白的表达量变化来研究病毒复制情况,并通过Image-Pro Plus进行蛋白灰度值分析(目的蛋白的灰度=目的蛋白IOD值/相对内参IOD值)。Western blot检测显示NDV和AIV均在感染后8 h左右进入对数复制期,NDV感染后16~24 h进入平台期,AIV感染后8~24 h处于对数复制期(图 1)。该结果与病毒诱导细胞病变时间一致,12 h左右出现细胞病变,24 h左右细胞开始脱落,因此,笔者选取病毒感染后12和24 h作为共感染的样品采集点。
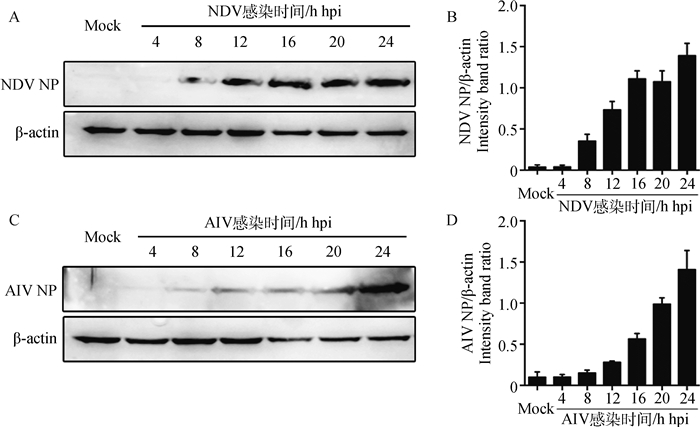
|
A. NDV感染后不同时间点NP蛋白表达;B. NDV NP蛋白灰度扫描结果;C. AIV感染后不同时间点NP蛋白表达;D. AIV NP蛋白灰度扫描结果 A. The NP expression at different time points post NDV infection; B. The intensity band ratio of NDV NP to β-actin; C. The NP expression at different time points post AIV infection; D. The intensity band ratio of AIV NP to β-actin 图 1 NDV/AIV单独感染不同时间点病毒蛋白Western blot检测 Figure 1 Western blot analysis of virus protein at different time points post NDV/AIV infection individually |
为了观察NDV和AIV的共感染对两种病毒复制的影响,通过Western blot对NDV和AIV的NP蛋白分别检测并对检测的病毒蛋白Western blot图进行Image-Pro Plus蛋白灰度值分析。结果显示两种病毒共感染时AIV-NP和NDV-NP蛋白表达明显受到了抑制(图 2A、2C)。与单独感染NDV相比,Western blot灰度值共感染12和24 h NDV NP蛋白的表达分别下调了70.6% (P<0.001)和45.7% (P<0.001)(图 2B);而共感染12和24 h AIV NP蛋白的表达分别下调了61.5%(P<0.001)和82.8%(P<0.001)(图 2D)。表明NDV和AIV的共感染能够极显著降低NDV和AIV病毒蛋白的表达。
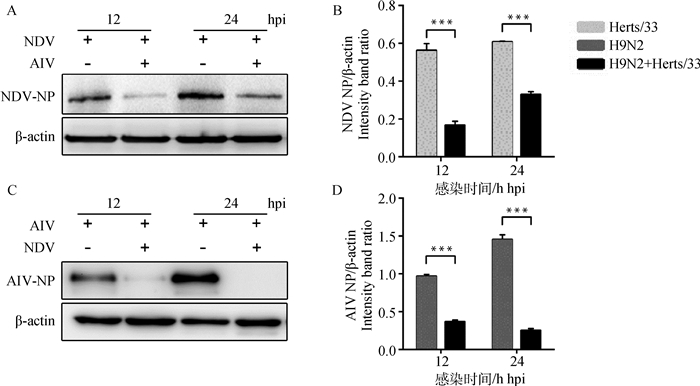
|
A. NDV-AIV共感染对NDV NP蛋白表达的影响;B. NDV NP蛋白灰度扫描结果;C. NDV-AIV共感染对AIV NP蛋白表达的影响;D. AIV NP蛋白灰度扫描结果 A. The impact of NDV-AIV co-infection in NDV NP expression; B. The intensity band ratio of NDV NP to β-actin; C. The impact of NDV-AIV co-infection in AIV NP expression; D. The intensity band ratio of AIV NP to β-actin 图 2 NDV-AIV共感染对病毒蛋白表达的影响 Figure 2 The impact of NDV-AIV co-infection in virus protein expression |
为了更直观地观察共感染对细胞中病毒复制水平的影响,通过对单独感染组和共感染试验组中病毒蛋白进行荧光标记,激光共聚显微镜观察细胞内的病毒蛋白分布,结果显示NDV/AIV单独感染12 h后,90%以上的细胞均显示病毒蛋白荧光,而共感染组中仅能观察到零星的红色或绿色荧光点;病毒感染后24 h,单独感染组中几乎所有细胞均有病毒蛋白荧光,而共感染组中病毒蛋白荧光点有一定程度降低(图 3A)。为更直观进行数据分析,对间接免疫荧光图进行Image-Pro Plus光密度值分析:与单独感染组相比,共感染组NDV和AIV的NP蛋白荧光密度值在感染12 h时间点分别下调81.1%(P<0.001)和65.5%(P<0.001)(图 3B、C),而24 h时则分别下调41.2%(P<0.05)和47.4%(P<0.001)(图 3B、C)。以上结果说明NDV-AIV共感染显著降低了细胞中病毒蛋白丰度,与病毒感染晚期(24 h)相比,病毒感染后12 h细胞中病毒蛋白丰度降低的更明显。
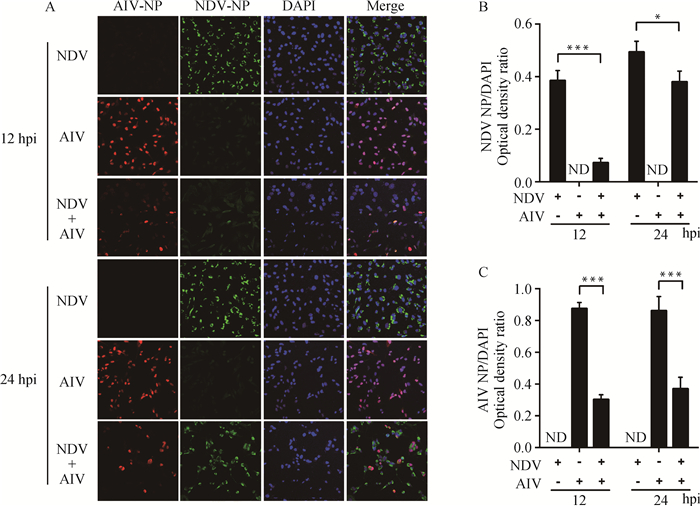
|
A. NDV-AIV共感染对NDV和AIV病毒蛋白丰度的影响;B. NDV NP光密度值计算结果;C. AIV NP光密度值计算结果 A. The impact of NDV-AIV co-infection in viral protein abundance in the cells; B. The optical intensity band ratio of NDV NP to DAPI; C. The optical intensity band ratio of AIV NP to DAPI 图 3 NDV-AIV共感染对细胞中病毒蛋白丰度的影响 Figure 3 The impact of NDV-AIV co-infection in viral protein abundance in the cell |
为了观察NDV-AIV共感染是否在基因水平也能抑制病毒的复制,收取病毒感染后的细胞样品,对NDV和AIV的NP mRNA进行实时荧光定量PCR检测。与单独感染NDV组相比,共感染12和24 h组NDV NP的mRNA水平分别下调了64.3% (P<0.001)和64.4% (P<0.05)(图 4A);而与单独感染AIV组相比,共感染12和24 h组AIV NP蛋白的表达分别下调了61.5%(P<0.001)和63.0%(P<0.001)(图 4B)。表明NDV-AIV共感染组中NDV和AIV的病毒基因mRNA水平均受到显著抑制。
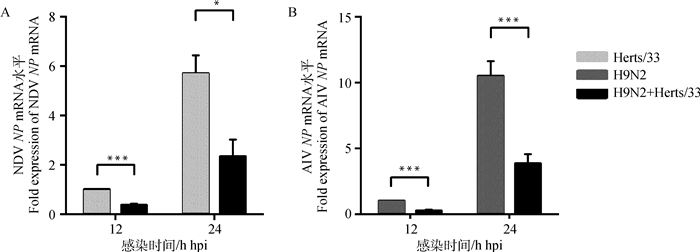
|
A.NDV-AIV共感染对NDV NP mRNA水平的影响;B.NDV-AIV共感染对AIV NP mRNA水平的影响 A.The impact of NDV-AIV co-infection in NDV NP mRNA level; B. The impact of NDV-AIV co-infection in AIV NP mRNA level 图 4 NDV-AIV共感染对病毒mRNA水平的影响 Figure 4 The impact of NDV-AIV co-infection in viral mRNA level |
NDV和AIV属于家禽养殖中最常见的两种病毒,因此NDV和AIV临床上发生共感染比较普遍。2008年美国明尼苏达和北达科他州7 260份水禽泄殖腔拭子的PCR检测结果显示大部分样品中都同时混有AIV和NDV,但将其接种鸡胚,结果仅NDV被分离出来[17],提示共感染过程中NDV对AIV的复制可能有抑制作用。2012年Ge等[18]的鸡胚接种试验表明AIV能够抑制NDV复制,但NDV不能抑制AIV复制,除非NDV首先接种,一定时间后再接种AIV,NDV才能够抑制AIV复制。体内试验结果显示,弱毒NDV能够延缓弱毒AIV病毒粒子的释放,反之亦然[19]。这些试验提示NDV与AIV之间存在互相干预,但都是基于流行病学调查数据或基因水平的检测[17-20],尚未有蛋白或病毒水平的研究报道。
NDV和AIV均有血凝素和神经氨酸酶蛋白,不能通过血凝试验从混合感染样本中分别检测NDV和AIV;同时,这两种病毒也有相似的细胞和鸡胚嗜性,难以通过细胞或鸡胚接种分别检测病毒的复制水平。本研究通过NDV和AIV NP蛋白特异性抗体以及实时荧光定量PCR引物可以区分NDV和AIV感染,具有很好的特异性。与单独感染组相比,共感染组NDV和AIV的NP蛋白荧光密度值在感染12 h时间点分别下调81.1%和65.5%,而24 h时则分别下调41.2%和47.4%;而共感染细胞中病毒NDV NP基因mRNA表达水平12和24 h分别下调了64.3%和64.4%,AIV NP基因mRNA表达分别下调了61.5%和63.0%。表明NDV-AIV共感染能够显著降低NDV和AIV NP蛋白与mRNA水平,在病毒感染对数生长期更明显。这与以往的体内试验结果一致,由于细胞水平的试验排除了诸如个体差异、组织亲嗜性等一些复杂因素的影响,因此,本研究为NDV与AIV之间相互抑制提供了更有力的证据。
AIV与NDV在体外与体内相互之间的干扰现象虽已被证实,但其机制尚未阐明。值得注意的是,本研究的间接免疫荧光中DF-1细胞中同时有NDV NP和AIV NP的荧光染色,证明两种病毒能够在同一个细胞中复制,这说明两种病毒能同时感染同一个细胞,这并不能作为两者之间相互干扰的解释。本研究基于鸡成纤维细胞模型,因此可以排除一些由特殊的免疫器官和免疫细胞介导的获得性免疫机制,先天性的抗病毒机制可能在其中发挥重要作用。一种最有可能的解释是,NDV或AIV感染产生的干扰素(IFN)和下游抗病毒分子能够抑制另一种病毒的复制,IFN-α/β能与Ⅰ型干扰素受体结合,通过活化JAK-STAT信号通路诱导达300多种干扰素刺激的基因的表达,其中包括抗病毒蛋白。目前已经得到证实的可以抑制病毒增殖的干扰素刺激基因有PKR、MX GTPase和RNase L等[21]。这些抗病毒分子可能在共感染过程中发挥协同抑制的作用。除了IFN之外,另一种可能是NDV和AIV的共感染过程中协同引起细胞凋亡信号通路的激活[22],从而抑制了两种病毒的复制。此外,细胞自噬[23]等其他先天性的抗病毒信号通路也可能参与其中。本研究证实了细胞水平上AIV与NDV的复制存在相互抑制现象,这为研究NDV和AIV的共感染机制奠定了基础,从另一角度为临床上两种病毒的防控提供了新的线索。
4 结论运用实时荧光定量PCR、Western blot和间接免疫荧光检测了H9N2亚型AIV和NDV单独感染与共感染DF-1细胞对两种病毒NP蛋白表达的相互影响。与单独感染组相比,NDV和AIV的共感染极显著降低了感染细胞中两种病毒核蛋白的表达水平和细胞中核蛋白的丰度;共感染组细胞中的病毒核蛋白基因mRNA表达水平也极显著降低。表明AIV与NDV的共感染在细胞水平上可引起病毒复制的相互抑制,为研究NDV和AIV的共感染机制在细胞水平上奠定了基础。
| [1] | YOON S W, WEBBY R J, WEBSTER R G. Evolution and ecology of influenza a viruses[M]//COMPANS R W, OLDSTONE M B A. Influenza Pathogenesis and Control-Volume Ⅰ. Cham: Springer, 2014: 359-375. |
| [2] | ENSERINK M, KAISER J., Virology. Avian flu finds new mammal hosts[J]. Science, 2004, 305(5689): 1385. |
| [3] | HORIMOTO T, KAWAOKA Y. Strategies for developing vaccines against H5N1 influenza A viruses[J]. Trends Mol Med, 2006, 12(11): 506–514. DOI: 10.1016/j.molmed.2006.09.003 |
| [4] | CLAAS E C J, OSTERHAUS A D M E, VAN BEEK R, et al. Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus[J]. Lancet, 1998, 351(9101): 472–477. DOI: 10.1016/S0140-6736(97)11212-0 |
| [5] | SUBBARAO K, KLIMOV A, KATZ J, et al. Characterization of an avian influenza A (H5N1) virus isolated from a child with a fatal respiratory illness[J]. Science, 1998, 279(5349): 393–396. DOI: 10.1126/science.279.5349.393 |
| [6] | CZEGLÉDI A, UJVÁRI D, SOMOGYI E, et al. Third genome size category of avian paramyxovirus serotype 1(Newcastle disease virus) and evolutionary implications[J]. Virus Res, 2006, 120(1-2): 36–48. DOI: 10.1016/j.virusres.2005.11.009 |
| [7] | MILLER P J, DECANINI E L, AFONSO C L. Newcastle disease:Evolution of genotypes and the related diagnostic challenges[J]. Infect Genet Evol, 2010, 10(1): 26–35. DOI: 10.1016/j.meegid.2009.09.012 |
| [8] | GOUGH R E. Newcastle disease, other avian paramyxoviruses and pneumovirus infections: Avian pneumoviruses[M]//SAIF Y M, BARNES H J, GLISSON J R. Diseases of poultry. 11th ed. Ames: Iowa State University Press, 2003. |
| [9] | LIU X F, WAN H Q, NI X X, et al. Pathotypical and genotypical characterization of strains of Newcastle disease virus isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001[J]. Arch Virol, 2003, 148(7): 1387–1403. |
| [10] |
韦平, 龙进学, 阳秀英, 等.传染性法氏囊病病毒快速检测与分型技术的研究[C]//中国畜牧兽医学会家畜传染病分会第十次学术研讨会论文集.苏州: 中国畜牧兽医学会, 2007.
WEI P, LONG J X, YANG X Y, et al. The rapid detection and classification of infectious bursa virus[C]//Chinese Animal Husbandry and Veterinary Society, the 10th Academic Seminar. Suzhou: Chinese Association of Animal Science and Veterinary Medicine, CAAV, 2007. (in Chinese) |
| [11] | NILI H, ASASI K. Avian influenza (H9N2) outbreak in Iran[J]. Avian Dis, 2003, 47(S3): 828–831. DOI: 10.1637/0005-2086-47.s3.828 |
| [12] | GUO Y J, KRAUSS S, SENNE D A, et al. Characterization of the pathogenicity of members of the newly established H9N2 influenza virus lineages in Asia[J]. Virology, 2000, 267(2): 279–288. DOI: 10.1006/viro.1999.0115 |
| [13] | HAGHIGHAT-JAHROMI M, ASASI K, NILI H, et al. Coinfection of avian influenza virus (H9N2 subtype) with infectious bronchitis live vaccine[J]. Arch Virol, 2008, 153(4): 651–655. DOI: 10.1007/s00705-008-0033-x |
| [14] | ALEXANDER D J. The epidemiology and control of avian influenza and Newcastle disease[J]. J Comp Pathol, 1995, 112(2): 105–126. DOI: 10.1016/S0021-9975(05)80054-4 |
| [15] |
中国兽医药品监察所.
兽用生物制品质量标准汇编-2011[M]. 北京: 中国农业出版社, 2012.
China Institute of Veterinary Drugs Control. A compilation of quality standards for animal products 2011[M]. Beijing: China Agriculture Press, 2012. (in Chinese) |
| [16] | SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protoc, 2008, 3(6): 1101–1108. DOI: 10.1038/nprot.2008.73 |
| [17] | EL ZOWALATY M E, CHANDER Y, REDIG P T, et al. Selective isolation of Avian influenza virus (AIV) from cloacal samples containing AIV and Newcastle disease virus[J]. J Vet Diagn Invest, 2011, 23(2): 330–332. DOI: 10.1177/104063871102300222 |
| [18] | GE S Q, ZHENG D X, ZHAO Y L, et al. Evaluating viral interference between Influenza virus and Newcastle disease virus using real-time reverse transcription-polymerase chain reaction in chicken eggs[J]. Virol J, 2012, 9(1): 128. DOI: 10.1186/1743-422X-9-128 |
| [19] | COSTA-HURTADO M, AFONSO C L, MILLER P J, et al. Virus interference between H7N2 low pathogenic avian influenza virus and lentogenic Newcastle disease virus in experimental co-infections in chickens and turkeys[J]. Vet Res, 2014, 45(1): 1. DOI: 10.1186/1297-9716-45-1 |
| [20] | PANTIN-JACKWOOD M J, COSTA-HURTADO M, MILLER P J, et al. Experimental co-infections of domestic ducks with a virulent Newcastle disease virus and low or highly pathogenic avian influenza viruses[J]. Vet Microbiol, 2015, 177(1-2): 7–17. DOI: 10.1016/j.vetmic.2015.02.008 |
| [21] |
丁德平, 韩瑛, 陈悦. 干扰素诱生及其抗病毒信号通路研究进展[J]. 中西医结合肝病杂志, 2013, 23(2): 121–123.
DING D P, HAN Y, CHEN Y. Research progress of interferon induced and antiviral signaling pathway[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2013, 23(2): 121–123. (in Chinese) |
| [22] | WULLAERT A, HEYNINCK K, BEYAERT R. Mechanisms of crosstalk between TNF-induced NF-κB and JNK activation in hepatocytes[J]. Biochem Pharmacol, 2006, 72(9): 1090–1101. DOI: 10.1016/j.bcp.2006.07.003 |
| [23] |
孟春春, 仇旭升, 张向乐, 等. 细胞自噬与病毒感染关系的研究进展[J]. 中国预防兽医学报, 2013, 35(11): 950–954.
MENG C C, QIU X S, ZHANG X L, et al. The research progress of relationship between cell autophagy and virus infection[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(11): 950–954. DOI: 10.3969/j.issn.1008-0589.2013.11.22 (in Chinese) |



