2. 上海市农业科学院农产品质量标准与检测技术研究所, 上海 201403
2. Institute for Agri-food Standard and Testing Technology, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China
蛋鸡在产蛋高峰每天需补充大量的钙质以满足蛋壳钙化的需要,每个鸡蛋含钙2~3 g,年产300枚以上的现代商品蛋鸡,钙的消耗是其体内钙总量的30倍[1-2]。肠道作为蛋壳钙源的主要来源必须保持高效的运转以满足这种连续高产的要求,一旦发生肠道钙离子转运障碍,极易引起蛋鸡产蛋率下降,诱发骨质疏松等疾病。多年来,科研人员一直致力于蛋鸡肠道内钙离子高效转运的机制探索。研究发现,肠道上皮细胞钙离子转运包括两种有效途径:不饱和旁细胞转运和饱和跨细胞转运,其中以瞬时性受体电位通道香草酸受体6(transient receptor potential vanilloid receptor 6, TRPV6)为限速步骤的跨细胞转运途径在动物肠道钙离子转运过程起重要作用。主要包括以下三个步骤:首先通过TRPV6跨膜通道把钙离子转运至细胞内;然后进入细胞内的钙离子与calbindin-D28K(CaBP-D28K为禽类主要形式)和(或)calbindin-D9K(CaBP-D9K)结合并扩散至基底膜;最后,通过膜上的钠-钙交换蛋白1(NCX1)、ATP依赖的细胞膜钙离子ATP泵(PMCA 1b)把钙离子转运到细胞外[3]。研究表明,这些蛋白主要承担维持机体钙离子平衡,保障钙离子参与的生理活动:骨形成、肌肉收缩、程序化细胞凋亡、细胞增殖过程、离子代谢、凝血等[4]。TRPV6是瞬时性受体电位通道(transient receptor potential,TRP)超家族中的成员,是专门的上皮样钙离子“门控”通道,在兔、鼠和人的胰腺、十二指肠、空肠、结肠、骨组织等与钙离子跨细胞转运功能有关的器官都有表达[5-8]。在敲除小鼠的TRPV6基因后,肠道呈现严重的钙离子吸收异常,以及肾重吸收障碍[6],表明TRPV6在调控肠道钙离子转运方面具有重要意义。实验室的前期研究发现,TRPV6在蛋鸡肠道上皮细胞也存在高表达,并且十二指肠表达量显著高于其他肠段[9]。其他研究显示,在禽类组织,钙的吸收几乎局限在十二指肠和空肠,回肠和结肠几乎没有吸收[10],故推测TRPV6在蛋鸡肠道钙离子转运过程发挥重要作用。目前,关于产蛋高峰期TRPV6在肠道钙离子转运中的作用还未曾报道。因此,本项目拟采用RNA干扰(RNAi)技术,体外构建TRPV6的RNAi干扰质粒,注入产蛋鸡体内,采用基因沉默手段研究TRPV6对小肠内钙离子跨细胞转运调节作用,旨在阐明TRPV6在蛋鸡肠道内调控钙离子转运的作用机制,为蛋鸡肠道钙离子转运障碍及骨代谢异常致病机制及防治提供理论依据。
1 材料与方法 1.1 材料与仪器重组pSIREN-TRPV6-3质粒(由本实验室保存)。E. coli Competent Cells DH5α、限制性内切酶MluⅠ、Trans 2KTMPlusⅡDNA Marker、Mini BEST Plasmid Purification Kit质粒小提试剂盒、SYBR Prime Script PR-PCR Kit、SYBR Premix Ex Taq Kit均购自大连宝生物工程有限公司(TaKaRa,日本)。无内毒素质粒大提取试剂盒购自美国OMEGA。TRPV6兔抗人多克隆抗体购自以色列Alamone Labs(ACC-036),CaBP-D28K鼠单克隆抗体购自武汉博士德生物工程有限公司,GAPDH鼠克隆抗体购自上海康城生物技术有限公司(KC-5G4)。鸡源甲状旁腺素(PTH)ELISA测定试剂盒购自南京建成生物科技有限公司。
台式离心机(Eppendorf,德国),-80 ℃超低温冰箱,高速冷冻离心机(Eppendorf,德国),数显恒温水浴锅(国华电器有限公司,中国),核酸蛋白检测仪(Eppendorf,德国),凝胶成像系统(TanonGIS-2500,上海),DNA电泳仪(Bio-Rad,美国),实时荧光定量PCR仪ABI 7300(ABI,美国)等。
1.2 方法 1.2.1 质粒的提取、酶切鉴定与测序携带质粒pSIREN-TRPV6-3的大肠杆菌由本实验室保存。选取阳性克隆菌,在含有氨苄青霉素(AMP)100 μg·mL-1的LB培养基上37 ℃培养18 h。使用TaKaRa Mini BEST Plasmid Purification Kit(按照说明书操作)提取质粒DNA,然后用MluⅠ酶切。将酶切产物在1.5%的琼脂糖凝胶电泳。提取到的重组质粒pSIREN-RetroQ-ZsGreen-TRPV6-siRNA寄往上海英骏生物技术公司进行序列测定以鉴定TRPV6-shRNA是否插入正确,pSIREN序列引物为5'-ATGGACTATCATATGCTTACCGTA-3'。
1.2.2 重组质粒注射液准备根据N/P比值计算公式[11]:N/P=PEI (μg)/DNA(μg)×7.75进行计算。按照N/P比值为10,将重组质粒与聚乙烯亚胺(PEI)混合,溶于生理盐水,振荡混匀,静置15 min,在30 min内注射入蛋鸡左侧大腿肌肉,每只蛋鸡注射相应质粒200 μg(0.5 mL)。
1.2.3 动物饲料管理及样品采集64羽220日龄精神状况良好、体重一致的伊莎高产蛋鸡,随机分为对照组和试验组,每组32只。试验组一次性肌内注射0.5 mL质粒注射液(生理盐水稀释),对照组注射生理盐水做空白对照,预试期1周,连续观察28 d。
同舍饲养于阶梯式蛋鸡笼,依笼编号,按照集约化蛋鸡养殖场常规方法饲养管理,鸡舍采用自然光与人工补充光照16: 8(L/D)。试验鸡自由饮水,按照标准日粮饲喂。分别于注射后第7、14、21及28天翅静脉采血5 mL,1%肝素抗凝,离心,血浆保存于EP管中,-20 ℃保存。然后每组选择8只鸡断头处死,采集十二指肠、空肠、股骨及胫骨。去除肠系膜及脂肪组织。纵向将肠管剖开,4 ℃预冷DEPC(焦磷酸二乙酯)配制PBS(pH7.4)缓冲液冲洗肠内容物,吸水纸吸干水分。将样品迅速装入冻存管,液氮速冻,后转入-80 ℃冰箱保存。
1.2.4 十二指肠和空肠中TRPV6转染质量鉴定使用DNA提取试剂盒提取十二指肠和空肠中总DNA。PCR步骤按试剂盒说明进行,PCR产物用1.0%琼脂糖凝胶电泳鉴定,产物长度为700 bp。设计重组质粒绿色荧光蛋白ZsGreen引物,F: 5'-AAGGAGATGACCATGAAGTACCG-3',R: 5'-AAACT-AGAGCCTGGACCACTGA-3',由上海Invitrogen生物技术有限公司合成。
1.2.5 实时荧光定量PCR按照RNAiso Plus试剂盒说明提取组织中总RNA,RNA浓度用nanodrop微量分光度计测定。使用TaKaRa反转录试剂盒,按说明配制20 μL反转录体系,37 ℃反应15 min,85 ℃灭活5 s,cDNA样品置-20 ℃保存备用。
采用SYBR Green Ⅰ荧光定量PCR试剂盒,按说明书冰上配制20 μL扩增体系。目的基因扩增条件见表 1。熔解曲线条件:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s;60 ℃ 15 s。每个样品重复3次,设空白作为对照。通过TRPV6、CaBP-D28K、NCX1、PMCA1b和β-actin基因在荧光信号到达阈值时所经历循环数Ct值。用2-△△ Ct法以鸡β-actin为内参基因对有效的数据进行统计分析,算出TRPV6、CaBP-D28K、NCX1和PMCA1b基因在十二指肠与空肠的相对表达水平。
1.2.6 引物设计与合成根据本实验室已设计的鸡TRPV6、CaBP-D28K、NCX1、PMCA1b引物序列及文献报道的内参基因β-actin引物序列见表 1,由上海Invitrogen生物技术有限公司合成引物。
|
|
表 1 Real-time PCR目的基因引物序列 Table 1 Primer sequences of Real-time PCR target genes |
取组织100 mg于1 mL裂解液中冰上匀浆,静置30 min,待裂解完全,离心30 min (4 ℃,25 000 g)。取上清BCA法测定蛋白含量,按上样缓冲液、样品体积比1: 4混合,沸水加热5 min,12 000 g离心5 min,取上清。每个样品的上样量为40~80 μg,在100 V、25~50 mA条件下进行SDS-PAGE电泳。对照蛋白Marker,将胶条、硝酸纤维素膜切割至合适大小做好的“三明治”夹子放入转印槽中,4 ℃、100 V条件下转印80 min。后将NC膜置5%脱脂奶粉中室温封闭2 h。弃封闭液,TBST洗膜。一抗孵育:加入按比例稀释的抗体(用5%脱脂奶粉分别将TRPV6、CaBP-D28K、β-actin抗体以1: 200、1: 200、1: 10 000比例稀释),4 ℃过夜。TBST洗膜,重复5次。二抗孵育:加入辣根过氧化物酶偶联的二抗(TRPV6二抗为羊抗兔IgG,1: 5 000稀释;CaBP-D28K和β-actin二抗为羊抗鼠IgG,1: 10 000稀释),室温孵育2 h。TBST洗膜,将ECL试剂盒内的试剂A与试剂B等体积混合后,均匀滴在硝酸纤维素膜上,5 min后将硝酸纤维素膜和X线片同时置于暗盒中,压片,根据荧光强弱决定曝光时间,显影、定影。扫描仪拍照Western blot结果,用软件检测分析灰度值,并计算样品中目的蛋白的相对表达量。
1.2.8 血钙、血磷浓度及PTH水平测定血液自动生化分析仪测定血钙、血磷浓度,ELISA试剂盒测定血浆PTH浓度。
1.2.9 骨密度测定剔净附着在股骨和胫骨上的软组织,与16级铝阶一同置于暗盒上拍片。胫骨和股骨采用前后位放置。拍摄条件:焦点焦片距(FFD)80 cm,球管电压45 kV,2.5 mAs。在测定前,根据图像情况进行预处理,用NIH Image J图像软件处理,建立铝阶的厚度和灰度曲线,根据曲线,将测得的灰度信息转化成铝阶厚度。骨密度以毫米铝阶厚度(mmAl)表示。
1.3 数据统计与分析所有数据采用SPSS 17.0软件进行统计分析。差异显著性检验采用单因子方差分析(one-way ANOVA),LSD进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,所有结果均以平均值±标准误表示。
2 结果 2.1 pSIREN-TRPV6-3质粒酶切鉴定与测序小量提取质粒后进行酶切鉴定,用Mlu Ⅰ酶切消化,1.5%琼脂糖凝胶电泳检测,可见酶切后的质粒只存在单一条带,与未酶切质粒存在差异,说明shRNA片段连接在载体(图 1)。测序结果显示,重组质粒pSIREN-TRPV6-3中目的片段序列与设计的shRNA序列一致(图 2)。
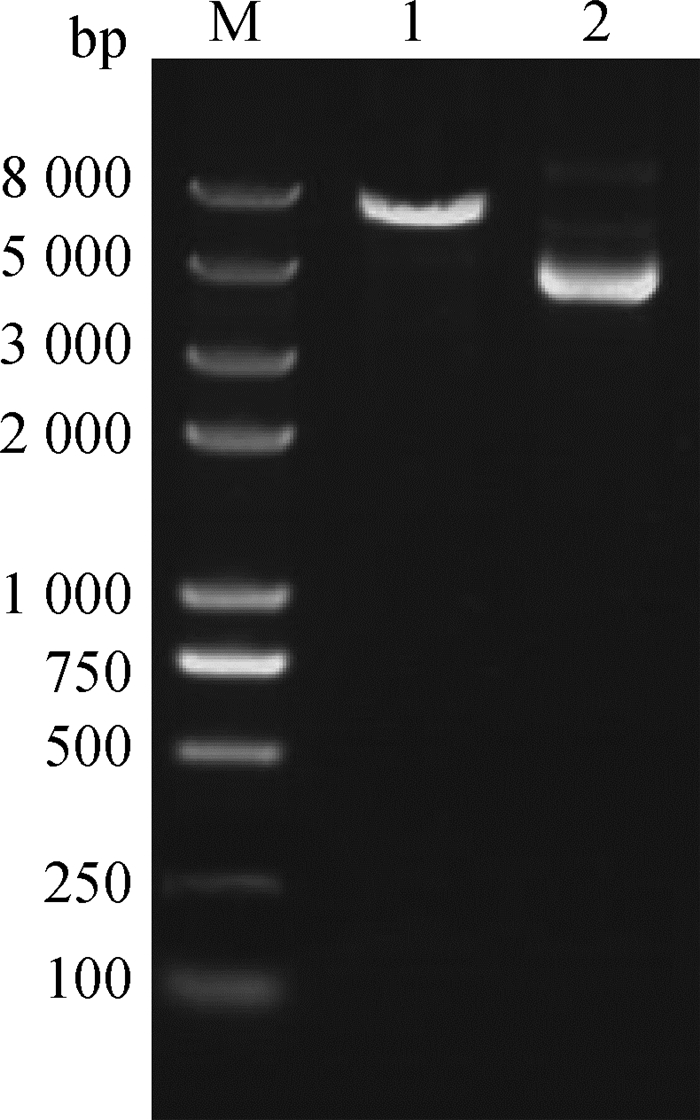
|
1.酶切的pSIREN-TRPV6-3质粒;2.未酶切的pSIREN-TRPV6-3质粒;M. Trans2KTM PlusⅡDNA相对分子质量标准 1. Digested pSIREN-TRPV6-3 plasmid; 2. Undigested pSIREN-TRPV6-3 plasmid; M. Trans2KTM PlusⅡ DNA marker 图 1 重组质粒酶切鉴定 Figure 1 Restriction analysis of recombinant plasmid |
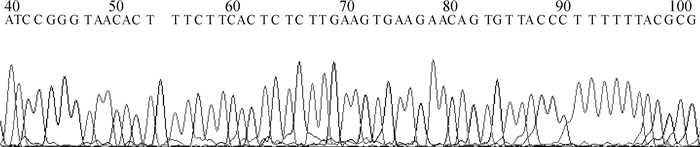
|
图 2 重组质粒测序结果 Figure 2 Sequencing results of recombinant plasmid |
图 3结果显示,在第7、14及21天的十二指肠和空肠中均扩增到重组质粒中绿色荧光蛋白ZsGreen的表达,表明肌内注射质粒在十二指肠与空肠中均成功转染。
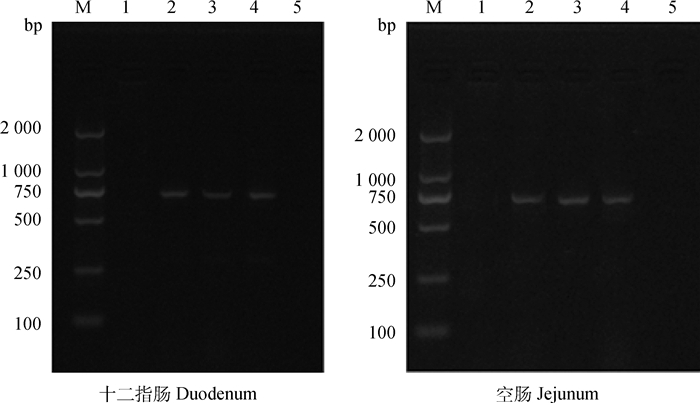
|
1~5.空白对照、第7、14、21、28天;M. DL2000 DNA相对分子质量标准 1-5. The control, the 7th, 14th, 21st and 28th day, respectively; M. DL2000 marker 图 3 重组质粒十二指肠和空肠基因组扩增结果 Figure 3 Results of amplification of genome from duodenum and jejunum after transfection of pSIREN-TRPV6-3 |
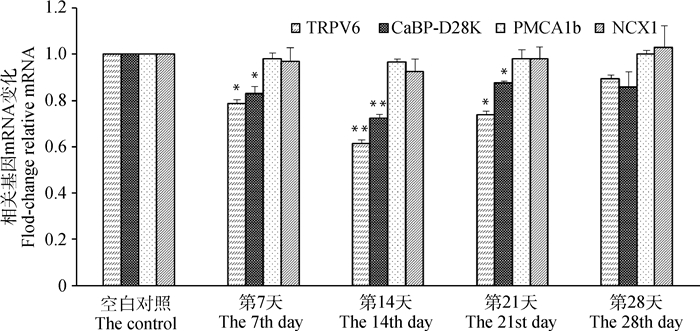
图 4和图 5结果显示,在注射重组质粒pSIREN-TRPV6-3后,与对照组比较,试验第7、14及21天十二指肠、空肠中TRPV6和CaBP-D28K mRNA表达水平显著降低(P<0.05),其中第14天差异极显著(P<0.01),第28天TRPV6表达有降低趋势,但统计学差异不显著(P>0.05)。但是,PMCA1b和NCX1 mRNA的表达无明显差异(P>0.05),结果表明TRPV6基因沉默严重干扰了肠道中TRPV6和CaBP-D28K的表达。
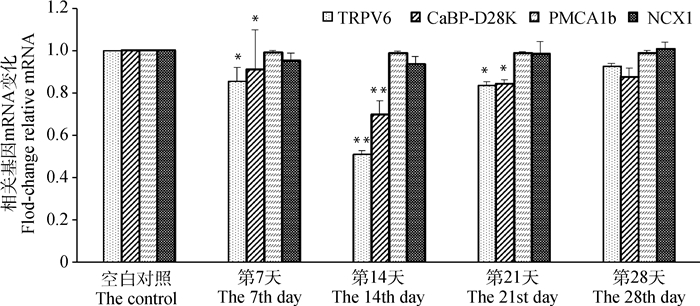
|
与对照组相比,*.P<0.05,**.P<0.01。下同 Compared with the control group, *.P < 0.05, **.P < 0.01.The same as below 图 4 pSIREN-TRPV6-3转染后十二指肠钙离子转运相关蛋白mRNA表达变化 Figure 4 The mRNA expression of relative proteins in duodenum calcium transport genes after transfection of pSIREN-TRPV6-3 plasmid |
|
图 5 pSIREN-TRPV6-3转染后空肠钙离子转运相关蛋白mRNA表达变化 Figure 5 The mRNA expression of relative proteins in jejunum calcium transport genes after transfection of pSIREN-TRPV6-3 plasmid |
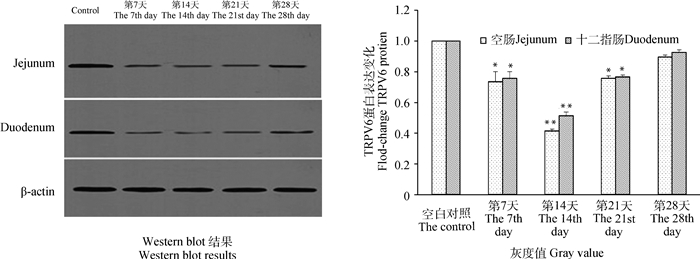
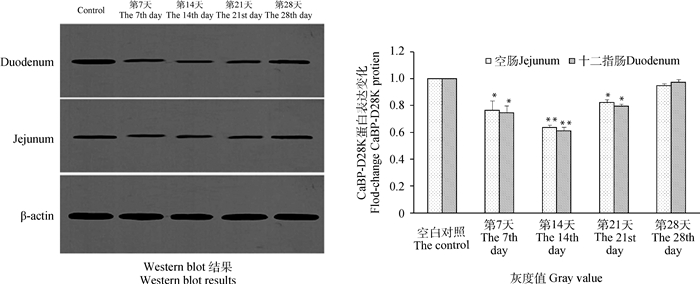
图 6和图 7结果显示,在注射重组质粒pSIREN-TRPV6-3后,与对照组比较,试验第7、14及21天十二指肠和空肠中TRPV6和CaBP-D28K的蛋白表达水平显著降低(P<0.05),其中第14天差异极显著(P<0.01),第28天表达有降低趋势,但差异不显著(P>0.05),结果与mRNA表达水平一致。
|
图 6 十二指肠与空肠TRPV6蛋白表达 Figure 6 Expression of TRPV6 protein in duodenum and jejunum |
|
图 7 十二指肠与空肠CaBP-D28K蛋白表达 Figure 7 Expression of CaBP-D28K protein in duodenum and jejunum |
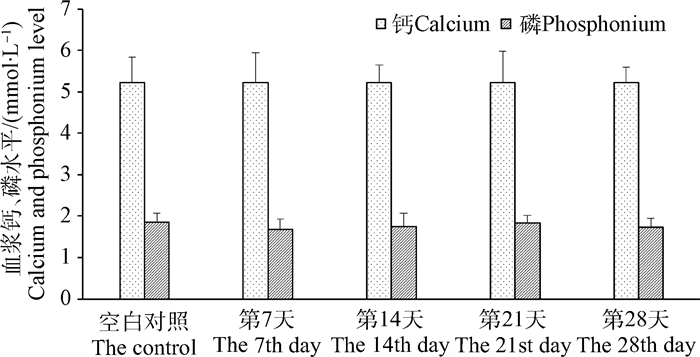
图 8结果显示,与空白对照组比较,TRPV6基因沉默组在不同时间点血浆中钙、磷浓度均无显著差异(P>0.05)。
|
图 8 血浆钙、磷浓度的变化 Figure 8 The changes of calcium and phosphonium concentration in plasma |
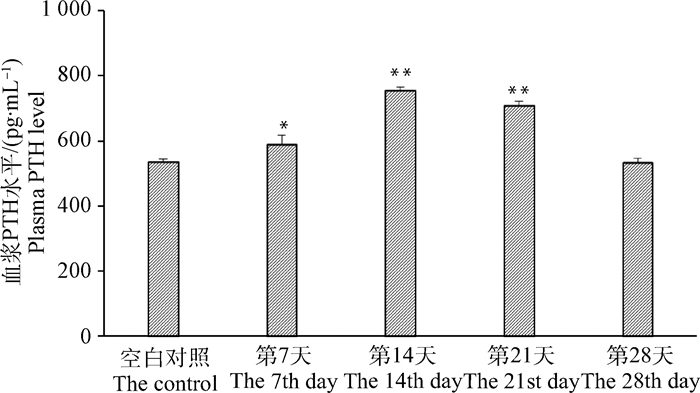
图 9结果显示,TRPV6基因沉默组在转染后第7天血浆PTH水平显著上升(P<0.05),在第14、21天极显著高于对照组(P<0.01)。
|
图 9 血浆PTH浓度变化 Figure 9 The change of PTH level in plasma |
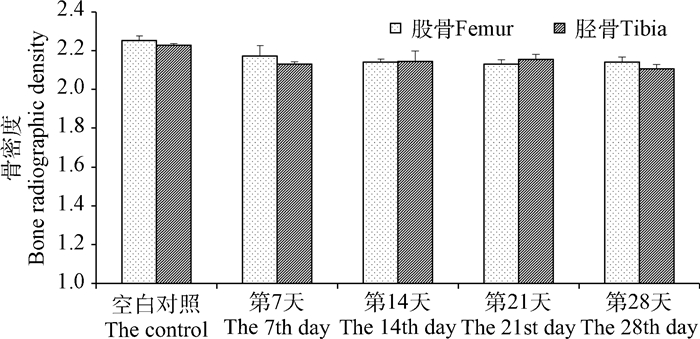
图 10结果显示,与对照组相比,注射重组质粒pSIREN-TRPV6-3后,试验组蛋鸡股骨和胫骨骨密度有降低趋势,但统计学差异并不显著(P>0.05)。
|
图 10 各组股骨和胫骨放射骨密度 Figure 10 Bone radiographic density of the tibia and femur in different groups |
新型钙离子通道TRPV6一直被认为是钙离子跨细胞转运的重要通道。本实验室前期发现TRPV6可以在产蛋鸡小肠、肾及蛋壳腺中发现TRPV6的表达,且十二指肠TRPV6的表达最为丰富[9],提示TRPV6可能是肠钙吸收的重要通道。
3.1 pSIREN-TRPV6-3质粒酶切鉴定及肠道内转染验证RNA干扰技术是通过小RNA片段进入体内,促使mRNA快速降解,从而抑制相应蛋白的合成,特异性阻断基因表达。资料显示,RNA干扰技术可用于某些疾病的治疗,特别是微生物、线虫、动植物等生物体功能基因的验证[12]。本实验室在前期研究中已成功构建了TRPV6的RNA干扰质粒pSIREN-TRPV6-3,本试验对pSIREN-TRPV6-3进行酶切与测序鉴定,结果理想,表明重组质粒扩培成功,这为下一步研究体内干扰TRPV6表达提供了可能。
目前,国内外对病毒方式的基因转染的改进做了大量的研究,但病毒载体如腺病毒载体,已证实存在安全性问题,特别是免疫原性和细胞毒性方面[13]。相比较而言,非病毒载体无细胞毒性和免疫原性,是体内转染较理想的方式。基因转染需要一定的转染试剂作为载体进入细胞。目前应用最为广泛的是阳离子脂质体和阳离子聚合物,它们可透过细胞屏障,将目的基因转入细胞内。但是,阳离子脂质体在体内试验中,会被快速清除,并诱发抗炎反应,从而使其使用受到限制[11]。阳离子聚合物聚乙烯亚胺(PEI),因其分子结构特点可稳定地与DNA结合,并可透过细胞膜进入细胞,安全性高[14],并且PEI相对于阳离子脂质体来说价格便宜,有利于大量的体内试验,故笔者选择更为安全的PEI作为转染载体。试验结果表明,重组质粒与PEI混合溶液注射蛋鸡后,在第7天就可在十二指肠和空肠检测到较高水平的重组质粒的表达,且可稳定地持续至第21天。结果充分表明,本试验采用PEI转染试剂和重组质粒转染效率较高,为研究TRPV6在蛋鸡肠道功能的作用夯实了基础。
3.2 TRPV6基因沉默对十二指肠和空肠钙离子转运相关蛋白表达的影响家禽的肠钙吸收主要发生在小肠前段即十二指肠和空肠段[15]。本课题组前期研究中,成功地在蛋鸡小肠组织中扩增出TRPV6、CaBP-D28K及PMCA1b,且TRPV6的表达量在十二指肠最高,其次是空肠,而CaBP-D28K和PMCA1b在十二指肠、空肠、回肠段表达量均较高[9],这表明小肠是蛋鸡钙离子转运的主要部位。同时NCX1作为钙离子排出细胞的第二转运系统,主要分布于小肠等钙转运相关组织。本试验结果表明,注射pSIREN-TRPV6-3干扰质粒,十二指肠和空肠中的TRPV6、CaBP-D28K基因和蛋白表达均显著降低,且在第14天抑制效果最高,PMCA1b和NCX1表达量不发生改变。表明TRPV6可以调控肠道中CaBP-D28K的表达,但不影响PMCA1b和NCX1的表达。体外研究表明TRPV6对钙离子的转运作用有限[16]。实验室前期研究表明,转染TRPV6基因沉默质粒成骨细胞TRPV6和CaBP-D28K表达降低,PMCA1b和NCX1的表达未受影响,与本研究结果一致。其他研究表明,CaBP-D9K和TRPV6单或双敲除的小鼠,十二指肠和肾中PMCA1b表达无显著变化[8]。综合这些研究表明在小肠段TRPV6对CaBP-D28K具有调控作用,但是PMCA1b和NCX1表达变化不显著。
3.3 TRPV6基因沉默对蛋鸡血浆钙、磷浓度、PTH水平及骨密度的影响肠道对钙离子的吸收并不能满足蛋壳钙化的大量钙的需求。研究显示,在腺胃中的食糜离开腺胃后在约75~78 min内,大部分的钙离子在肠道前段被吸收[17-18]。在蛋鸡肠道内钙离子几乎排空的情况下,蛋壳钙化所需的钙离子主要是来自髓质骨中钙离子的转换。这部分钙占蛋壳总沉积钙的20%~40%[19]。髓质骨中缺失的钙,主要是由肠道从日粮中吸收钙来补充。故高产蛋鸡每天蛋壳钙化需要的钙离子主要是来自肠道吸收。甲状旁腺激素(PTH)是甲状旁腺细胞分泌的,可对小肠、肾和骨等组织器官产生效应,其主要作用是保持体内钙的平衡,调节蛋壳形成和神经肌肉收缩等机能。本研究注射pSIREN-TRPV6-3干扰质粒,血浆钙、磷浓度未发生改变,PTH水平升高,与肠道TRPV6和CaBP-D28K表达正好相反,在第14天显著降低,表明肠道TRPV6基因沉默后,机体通过动员PTH等钙调激素分泌,作用于肾和骨骼的代偿机制可保证正常的血钙水平。蛋壳钙一部分来源于白天肠道对日粮钙的吸收,一部分来源于夜间髓质骨中钙离子的转换,而髓质骨中缺失的钙,也主要是由肠道从日粮中吸收钙来补充,而一旦肠道钙离子吸收障碍,极易导致髓质骨中钙含量下降,骨质疏松、骨折等疾病的发生,本研究中股骨和胫骨密度没有变化,提示以TRPV6为“门控”通道的钙离子跨细胞转运可能不是调控蛋鸡肠道钙离子吸收的主要途径,但其确切机制有待进一步研究。
4 结论高产蛋鸡在肌肉注射pSIREN-TRPV6-3干扰质粒后,在十二指肠和空肠部位成功转染,显著抑制肠道TRPV6和CaBP-D28K的表达,在转染后第14天到达作用顶峰,但不影响肠道PMCA1b和NCX1表达及血钙、血磷浓度,血液PTH水平代偿性提高。综合分析,TRPV6能调控肠道CaBP-D28K蛋白表达,但在正常日粮钙水平条件下,沉默TRPV6通道蛋白不影响蛋鸡体内正常的钙转运。
| [1] | MILLER S C. Calcium homeostasis and mineral turnover in the laying hen[M]//WHITEHEAD C C. Bone Biology and Skeletal Disorders in Poultry. Abingdon: Carfax, 1992. |
| [2] | SUGIYAMA T, KUSUHARA S. Avian calcium metabolism and bone function[J]. Asian-Aust J Anim Sci, 2001, 14: 82–90. DOI: 10.5713/ajas.2001.82 |
| [3] | VAN ABEL M, HOENDEROP J G J, BINDELS R J. The epithelial calcium channels TRPV5 and TRPV6:Regulation and implications for disease[J]. Naunyn-Schmiedeberg's Arch Pharmacol, 2005, 371(4): 295–306. DOI: 10.1007/s00210-005-1021-2 |
| [4] |
杨震, 秦大明, 谷贵山. 新型钙通道TRPV与骨代谢的关系[J]. 吉林大学学报:医学版, 2005, 31(4): 645–648.
YANG Z, QIN D M, GU G S. Relationship of calcium channel TRPV and bone metabolism[J]. Journal of Jilin University:Medicine Edition, 2005, 31(4): 645–648. (in Chinese) |
| [5] | PANSU D, BELLATON C, ROCHE C, et al. Duodenal and ileal calcium absorption in the rat and effects of vitamin D[J]. Am J Physiol, 1983, 244(6): G695–G700. |
| [6] | KAHR H, SCHINDL R, FRITSCH R, et al. CaT1 knock-down strategies fail to affect CRAC channels in mucosal-type mast cells[J]. J Physiol, 2004, 557(Pt 1): 121–132. |
| [7] | CUI M, ZHAO Y, HANCE K W, et al. Effects of MAPK signaling on 1, 25-dihydroxyvitamin D-mediated CYP24 gene expression in the enterocyte-like cell line, Caco-2[J]. J Cell Physiol, 2009, 219(1): 132–142. DOI: 10.1002/jcp.v219:1 |
| [8] |
杨俊花.TRPV6在蛋鸡不同组织的表达分布及其在蛋壳腺钙离子转运中的作用[D].南京: 南京农业大学, 2010.
YANG J H. Expression and localization of TRPV6 in different tissues of laying hens and its effect on the calcium ion transport in eggshell gland[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese) |
| [9] | YANG J H, HOU J F, FARQUHARSON C, et al. Localisation and expression of TRPV6 in all intestinal segments and kidney of laying hens[J]. Br Poult Sci, 2011, 52(4): 507–516. DOI: 10.1080/00071668.2011.596994 |
| [10] | BAR A. Calcium transport in strongly calcifying laying birds:Mechanisms and regulation[J]. Comp Biochem Physiol A Mol Integr Physiol, 2009, 152(4): 447–469. DOI: 10.1016/j.cbpa.2008.11.020 |
| [11] |
曹慧玲, 滕凤猛, 汪小蓉, 等. PEI与脂质体介导基因转染的比较研究[J]. 国际检验医学杂志, 2015, 36(3): 328–330.
CAO H L, TENG F M, WANG X R, et al. Comparison of gene transfection reagents between PEI and lipofectamine[J]. International Journal of Laboratory Medicine, 2015, 36(3): 328–330. DOI: 10.3969/j.issn.1673-4130.2015.03.018 (in Chinese) |
| [12] | ZHANG X, LIU X, MA J, et al. Silencing of cytochrome P450CYP6B6 gene of cotton bollworm (Helicoverpa armigera) by RNAi[J]. Bull Entomol Res, 2013, 103(5): 584–591. DOI: 10.1017/S0007485313000151 |
| [13] | RAPER S E, CHIRMULE N, LEE F S, et al. Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer[J]. Mol Genet Metab, 2003, 80(1-2): 148–158. DOI: 10.1016/j.ymgme.2003.08.016 |
| [14] | GODBEY W T, WU K K, MIKOS A G. Poly(ethylenimine) and its role in gene delivery[J]. J Control Release, 1999, 60(2-3): 149–160. DOI: 10.1016/S0168-3659(99)00090-5 |
| [15] | HURWITZ S, HARRISON H C, HARRISON H E. Effect of vitamin D3 on the in vitro transport of calcium by the chick intestine[J]. J Nutr, 1967, 91(3): 319–323. |
| [16] |
崔军, 孟波, 张丽, 等. 钙离子通道TRPV6在破骨细胞中的表达及功能[J]. 广东医学, 2015, 36(14): 2133–2135.
CUI J, MENG B, ZHANG L, et al. Expression and function of calcium channel TRPV6 in osteoclasts[J]. Guangdong Medical Journal, 2015, 36(14): 2133–2135. (in Chinese) |
| [17] | HURWITZ S, BAR A, KATZ M, et al. Absorption and secretion of fatty acids and bile acids in the intestine of the laying fowl[J]. J Nutr, 1973, 103(4): 543–547. DOI: 10.1093/jn/103.4.543 |
| [18] | BAR A, VAX E, STRIEM S. Relationships among age, eggshell thickness and vitamin D metabolism and its expression in the laying hen[J]. Comp Biochem Physiol A Mol Integr Physiol, 1999, 123(2): 147–154. DOI: 10.1016/S1095-6433(99)00039-2 |
| [19] | BAR A, STRIEM S, ROSENBERG J, et al. Egg shell quality and cholecalciferol metabolism in aged laying hens[J]. J Nutr, 1988, 118(8): 1018–1023. DOI: 10.1093/jn/118.8.1018 |



