2. 洛阳职业技术学院, 洛阳 471003;
3. 河南省农业科学院动物免疫学重点实验室, 农业部动物免疫学重点实验室, 河南省动物免疫学重点实验室, 郑州 450002
2. Luoyang Polytechnic, Luoyang 471003, China;
3. Key Laboratory of Animal Immunology of Henan Academy of Agricultural Sciences, Key Laboratory of Animal Immunology of Ministry of Agriculture, Key Laboratory of Animal Immunology in Henan Province, Zhengzhou 450002, China
肿瘤发生发展过程中涉及多种分子调控机制,其中microRNA(miRNA)对肿瘤的调控作用是目前学术界研究的热点之一。目前已在多种肿瘤组织及细胞系中检测到miRNA的异常表达,肿瘤细胞的增殖、分化、凋亡、转移等多种生物学过程都与miRNA密不可分,它可通过调节体内某些抑癌基因或癌基因的表达而在肿瘤发生发展中发挥重要的致癌或抑癌功能[1-4]。致瘤性病毒在动物肿瘤转化中发挥着至关重要的作用,近年来的研究表明miRNAs也参与病毒诱导的肿瘤发生[5-7]。
马立克病(Marek's disease,MD)是由马立克病病毒(Marek's disease virus,MDV)感染鸡后引起的一种以淋巴细胞增生为主要特征的肿瘤性疾病,是病毒诱导淋巴瘤发生的较理想的动物模型[8]。近年来,在MD模型系统里开展了多项有关宿主和病毒miRNAs的研究[9-10],Burnside等[11]在MDV感染的鸡胚成纤维细胞(Chicken embryo fibroblasts,CEF)里鉴定了63个miRNAs,gga-miR-let-7、gga-miR-199a、gga-miR-26a、gga-miR-181a、gga-miR-16等宿主基因在MDV诱导的肿瘤中的表达量下调,表明其在肿瘤发生中具有潜在的调控作用。Yao等[12]发现在MDV转化的细胞系中gga-miR-155、gga-miR-150、gga-miR-451、gga-miR-26a、gga-miR-223的表达量也呈下调表达,Lian等[13]研究发现在MDV感染的肝肿瘤组织、外周血淋巴细胞中gga-miR-181a、gga-miR-26a、gga-miR-221、gga-miR-222、gga-miR-199*和gga-miR-140*的表达量呈下调表达,gga-miR-146c呈上调表达,MDV感染的肿瘤组织和细胞中gga-miR-155表达量虽与非感染组织和细胞中的表达量差异不显著,但总的趋势是下调的。这些miRNAs表达的差异表明它们参与了MDV诱导的淋巴瘤转化,在肿瘤的转化中具有重要的作用。目前已经研究证实下调表达的gga-miR-26a[14]、gga-miR-181a[15]在MDV致肿瘤过程中可发挥“抑瘤”作用,其他下调表达的miRNAs在MDV致肿瘤过程中的作用还需进一步的研究证实。
研究表明miR-155在机体免疫功能的调节、恶性淋巴肿瘤形成等方面具有重要的生物学功能,在诸多人的肿瘤性疾病中miR-155均呈上调表达,表现为“致癌”功能。虽然有研究报道gga-miRNA-155是MDV1-miR-M4的功能性同源体[16],但是在MDV转化的T淋巴细胞系及MDV感染后的脾肿瘤组织及肝淋巴瘤中gga-miRNA-155均呈下调表达[12-13]。那么,在MD肿瘤发生中,gga-miRNA-155是发挥“致癌”功能还是“抑癌”功能还需进一步的验证。因此,为了明确gga-miRNA-155在MD肿瘤发生中的“致癌”或“抑癌”功能,本研究利用MDV转化的T淋巴细胞系MBS1细胞为模型,通过将人工合成gga-miRNA-155模拟物以及抑制物瞬时转染MDCC-MSB1细胞,观察gga-miRNA-155对MDCC-MSB1细胞增殖、细胞周期、细胞凋亡、迁移、侵袭能力的影响,为揭示gga-miRNA-155在MDV致瘤过程中的作用提供新的科学依据。
1 材料与方法 1.1 材料 1.1.1 细胞马立克病毒转化的肿瘤细胞系MDCC-MSB1为河南科技大学动物疫病与公共卫生重点实验室保存。
1.1.2 主要试剂和耗材Trizol RNA提取试剂、转染试剂LipofectamineTM2000均购自Invitrogen公司;SYBR Premix Ex TaqTM购自TaKaRa公司;HiScript逆转录酶购自Vazyme公司;RNA酶抑制剂购自Trans公司;AnnexinV-APC/7-AAD细胞凋亡检测试剂盒购自南京凯基生物有限公司;CCK8细胞增殖及细胞毒性检测试剂盒购自Biosharp公司;24孔板Transwell购自Corning公司;RPMI1640培养基、胎牛血清(FBS)均购自Gibco公司;Penicillin-Streptomycin Solution购自Hyclone公司;胰蛋白胨磷酸肉汤(TPB)购自Sigma公司,其他试剂均为国产分析纯。
1.1.3 主要仪器ABI7900荧光定量PCR仪(美国ABI公司),酶标仪(美国Thermo公司),CO2恒温培养箱(日本Sanyo公司),流式细胞仪(美国Beckman公司),倒置显微镜(日本Olympus公司),NanoDrop ND-2000超微量核酸蛋白测定仪(美国Thermo公司)等。
1.2 方法 1.2.1 gga-miR-155模拟物以及gga-miR-155抑制物合成根据miRBase数据库中gga-miR-155成熟体序列委托广州锐博生物科技有限公司合成gga-miR-155模拟物(gga-miR-155 mimic)、gga-miR-155模拟物阴性对照(gga-miR-155 mimic NC)、gga-miR-155抑制物(gga-miR-155 inhibitor)和gga-miR-155抑制物阴性对照(gga-miR-155 inhibitor NC)。
1.2.2 荧光定量引物的设计与合成根据miRBase数据库中gga-miR-155成熟体序列,用Primer 5.0软件设计gga-miR-155的茎环反转录引物和荧光定量PCR扩增引物,同时设计内参U6的茎环反转录引物和荧光定量PCR引物(表 1),引物由生工生物工程(上海)有限公司合成。
|
|
表 1 Real-time PCR引物序列 Table 1 Real-time PCR primer sequences |
MDCC-MSB1细胞用含10% FBS、1% Penicillin-Streptomycin Solution和10% TPB的RPMI1640培养基,5% CO2、37 ℃恒温培养箱培养。取处于对数生长期,生长状态良好的MDCC-MSB1细胞,用上述培养基调整细胞密度到3×105·mL-1,接入6孔板,每孔1 mL细胞悬液。根据Lipofectamine TM2000操作说明,每孔转染gga-miR-155模拟物、gga-miR-155抑制物及相应阴性对照各100 nmol,6 h后换正常培养液,在转染48 h后收集细胞进行相关检测及功能试验。
1.2.4 实时荧光定量PCR检测MDCC-MSB1细胞中gga-miR-155的表达水平于转染48 h后收集各组MDCC-MSB1细胞,用Trizol试剂提取细胞总RNA,定量后取1 μg的总RNA使用茎环反转录引物(表 1)将其反转录为cDNA,然后用特异性的荧光定量引物(表 1)进行Real-time PCR试验。反转录反应体系及反应条件:500 ng RNA 2 μL,5×Hiscript Buffer 4 μL,Hiscript Reverse Transcriptase 1 μL,Ribonuclease Inhibitor 0.5 μL,Loop primer 2 μL,RNase free water 9.5 μL;25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min。Real-time PCR反应体系及反应条件:2×SYBR Premix Ex Taq 10 μL,反转录产物2 μL,Forward primer 0.5 μL,Reverse primer 0.5 μL,去离子水7 μL;50 ℃ 2 min,95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,40个循环。U6作为内参。采用2-ΔΔCt法分析Real-time PCR试验数据,比较各组MDCC-MSB1细胞中gga-miR-155相对表达量的差异。
1.2.5 CCK-8法检测MDCC-MSB1细胞增殖能力将转染gga-miR-155模拟物、gga-miR-155抑制物以及相应阴性对照的MDCC-MSB1细胞,以2×103·孔-1的细胞数接种于96孔板,每组设3个重复孔,同时设仅添加细胞培养基的空白对照。分别在培养6、24、48、72、96 h每孔加入20 μL CCK-8,37 ℃培养4 h后用酶标仪检测450 nm处各孔的吸光度(A450 nm)值,利用空白对照组调零去除背景A450 nm值,统计分析并绘制细胞生长曲线。
1.2.6 流式细胞术检测MDCC-MSB1细胞周期MDCC-MSB1细胞分别转染gga-miR-155模拟物、gga-miR-155抑制物以及相应阴性对照48 h后,收集各组细胞,1 200 r·min-1离心5 min,弃上清;PBS润洗2次,1 200 r·min-1离心5 min,细胞沉淀用100 μL PBS重悬后,缓慢加入700 μL预冷的80%乙醇,4 ℃固定4 h以上。检测前于1 200 r·min-1离心5 min,弃去上清,再用预冷PBS润洗2次,加入100 μL RNase(50 μg·mL-1),37 ℃孵育30 min;加入400 μL PI (50 μg·mL-1),4 ℃避光染色30 min;流式细胞仪检测细胞周期分布。统计分析并绘制细胞各期分布图。
1.2.7 流式细胞术检测MDCC-MSB1的凋亡MDCC-MSB1细胞分别转染gga-miR-155模拟物、gga-miR-155抑制物以及相应阴性对照48 h后,收集各组细胞,1 500 r·min-1离心5 min,弃上清;PBS润洗2次,1 500 r·min-1离心5 min;按照AnnexinV-APC/7-AAD细胞凋亡检测试剂盒操作说明进行,先加入500 μL Binding Buffer,重悬细胞,加入5 μL AnnexinV-APC混匀后,再加入5 μL 7-AAD,混匀;室温避光反应5~15 min(同时设阴性对照,即正常细胞不加AnnexinV-APC和7-AAD;阳性对照1,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μL AnnexinV-APC单标;阳性对照2,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μL 7-AAD单标);流式细胞仪检测。
1.2.8 Transwell检测MDCC-MSB1细胞的迁移与侵袭MDCC-MSB1细胞分别转染gga-miR-155模拟物、gga-miR-155抑制物以及相应阴性对照48 h后,收集各组细胞,1 000 r·min-1离心5 min,去上清,PBS洗两次,清洗掉残余血清;无血清RPMI1640培养基重悬细胞,细胞计数板计数,用无血清RPMI1640培养基稀释细胞浓度至6×105cell·mL-1,备用;在24孔板中预先加入600 μL 10% FBS的1640培养基(含双抗),并放入Transwell小室;1 h后在Transwell上室分别接入200 μL各组细胞悬液(侵袭检测时,在Transwell小室上室底部中央垂直加入100 μL终浓度为300 μg·mL-1的Matrigel,待Matrigel干成胶状后在Transwell上室分别接入200 μL各组细胞悬液),37 ℃ 5% CO2培养箱培养24 h;取出Transwell小室,下室每孔加入60 μL CCK-8,37 ℃培养4 h;酶标仪测定各孔吸光值A450 nm。
1.2.9 数据分析采用SPSS18.0软件One-Way分析或T检验进行统计学处理,数据以平均值±标准差(x±s)表示,P<0.05为差异显著,P<0.01为差异极显著。
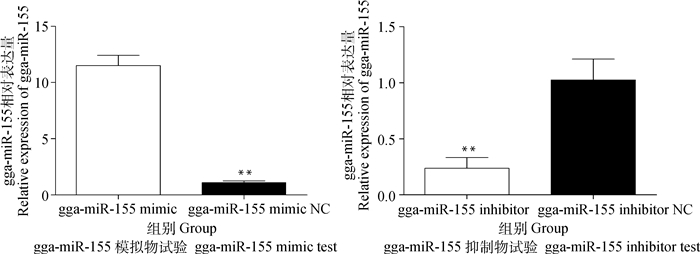
2 结果 2.1 gga-miR-155模拟物及其抑制物分别上调或下调MDCC-MSB1中gga-miR-155的表达水平MDCC-MSB1细胞分别转染gga-miR-155模拟物、gga-miR-155抑制物及相应阴性对照48 h,实时荧光定量PCR检测gga-miR-155在MDCC-MSB1细胞中的相对表达水平。结果显示,转染模拟物组gga-miR-155的表达水平极显著高于模拟物阴性对照组(P<0.01),转染抑制物组gga-miR-155的表达水平极显著低于抑制物阴性对照组(P<0.01,图 1)。
|
**.P<0.01 图 1 实时荧光定量PCR检测gga-miR-155在MDCC-MSB1细胞中的表达 Figure 1 The expression of gga-miR-155 in MDCC-MSB1 cells by Real-time quantitative PCR |
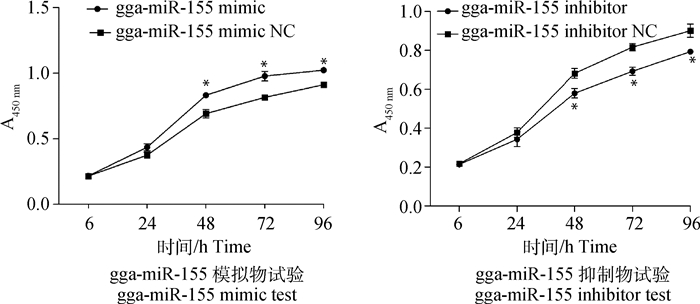
MDCC-MSB1细胞转染gga-miR-155模拟物、抑制物及其相应阴性对照后,采用CCK-8法检测各组细胞增殖能力的变化。结果显示,在转染后48、72和96 h,与各自阴性对照组相比,gga-miR-155模拟物转染组MDCC-MSB1细胞增殖水平显著增强,gga-miR-155抑制物转染组MDCC-MSB1细胞增殖水平显著下降(P<0.05,图 2)。
|
*. P<0.05 图 2 gga-miR-155对MDCC-MSB1细胞增殖的影响 Figure 2 Effects of gga-miR-155 on the proliferation of MDCC-MSB1 cells |
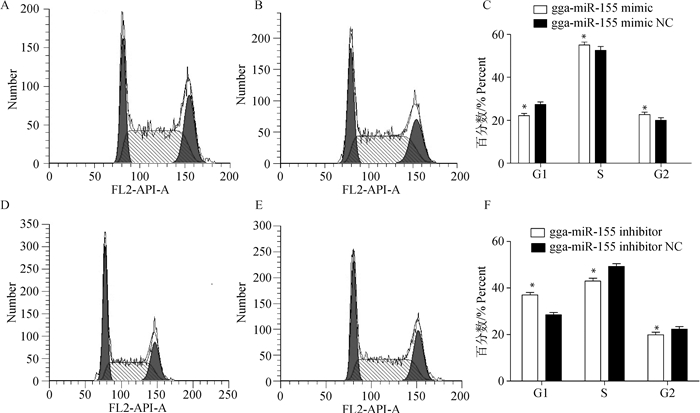
MDCC-MSB1细胞转染gga-miR-155模拟物、抑制物及其相应阴性对照后,采用流式细胞术检测各组细胞周期的变化。结果(图 3)显示,gga-miR-155模拟物转染组较其阴性对照转染组MDCC-MSB1细胞的G1期细胞分布减少,S期和G2期细胞增加,gga-miR-155抑制物转染组较其阴性对照转染组MDCC-MSB1细胞的G1期细胞分布增加,S期和G2期减少,差异显著(P<0.05)。
|
A. gga-miR-155模拟物组;B.gga-miR-155模拟物阴性对照组;C. gga-miR-155模拟物及其阴性对照数值统计(*. P<0.05);D. gga-miR-155抑制物组;E.gga-miR-155抑制物阴性对照组;F. gga-miR-155抑制物及其阴性对照数值统计(*. P<0.05) A.gga-miR-155 mimic group; B.gga-miR-155 mimic NC group; C. The numerical statistics of the gga-miR-155 mimic and its negative control (*. P < 0.05); D. gga-miR-155 inhibitor group; E. gga-miR-155 inhibitor NC group; F. The numerical statistics of the gga-miR-155 inhibitor and its negative control (*. P < 0.05) 图 3 gga-miR-155对MDCC-MSB1细胞周期的影响 Figure 3 Effects of gga-miR-155 on the cell cycle of MDCC-MSB1 cells |
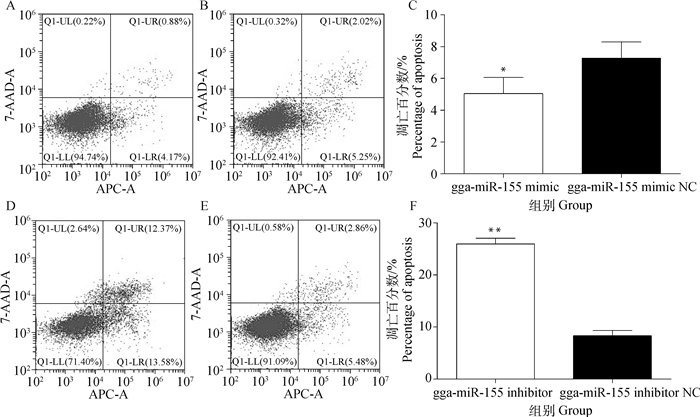
MDCC-MSB1细胞转染gga-miR-155模拟物、抑制物及其相应阴性对照后,采用流式细胞术检测各组细胞凋亡的变化。结果(图 4)显示,gga-miR-155模拟物转染组较其阴性对照转染组MDCC-MSB1细胞的凋亡细胞比例显著减少(P<0.05),gga-miR-155抑制物对照组较其阴性对照组的凋亡细胞比例极显著增加(P<0.01)。
|
A. gga-miR-155模拟物组;B.gga-miR-155模拟物阴性对照组;C. gga-miR-155模拟物及其阴性对照数值统计(*. P<0.05; **. P<0.01);D. gga-miR-155抑制物组;E.gga-miR-155抑制物阴性对照组;F. gga-miR-155抑制物及其阴性对照数值统计(*. P<0.05; **.P<0.01) A.gga-miR-155 mimic group; B.gga-miR-155 mimic NC group; C. The numerical statistics of the gga-miR-155 mimic and its negative control (*. P < 0.05; **. P < 0.01); D. gga-miR-155 inhibitor group; E. gga-miR-155 inhibitor NC group; F. The numerical statistics of the gga-miR-155 inhibitor and its negative control (*. P < 0.05; **. P < 0.01) 图 4 gga-miR-155对MDCC-MSB1细胞凋亡的影响 Figure 4 Effects of gga-miR-155 on the apoptosis of MDCC-MSB1 cells |
MDCC-MSB1细胞转染gga-miR-155模拟物、抑制物及其相应阴性对照后,采用Transwell检测各组细胞迁移能力的变化。结果显示,gga-miR-155模拟物转染组MDCC-MSB1细胞的迁移能力比其阴性对照组有所增加,但差异不显著(P>0.05),gga-miR-155抑制物转染组MDCC-MSB1细胞的迁移能力显著低于其阴性对照组(P<0.05,图 5)。
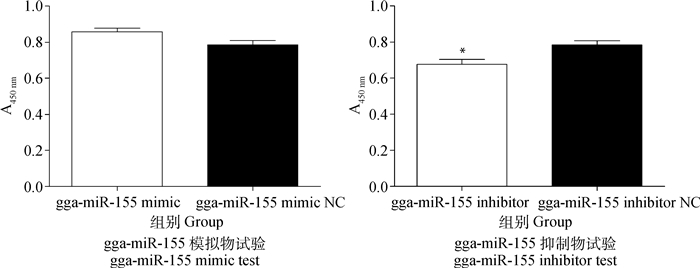
|
*. P<0.05 图 5 gga-miR-155对MDCC-MSB1细胞迁移的影响 Figure 5 Effects of gga-miR-155 on the migrate of MDCC-MSB1 cells |
MDCC-MSB1细胞转染gga-miR-155模拟物、抑制物及其相应阴性对照后,采用Transwell检测各组细胞侵袭能力的变化。结果显示,与各自阴性对照组相比,gga-miR-155模拟物转染组MDCC-MSB1细胞的侵袭能力显著增加,gga-miR-155抑制物转染组MDCC-MSB1细胞的侵袭能力显著下降(P<0.05,图 6)。
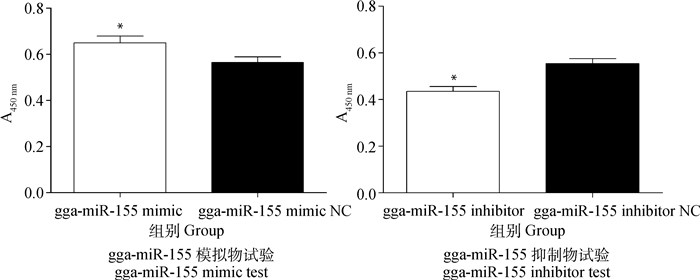
|
*. P<0.05 图 6 gga-miR-155对MDCC-MSB1细胞侵袭的影响 Figure 6 Effects of gga-miR-155 on the invasion of MDCC-MSB1 cells |
MicroRNA(miRNA)是一类长22~25 nt的保守单链非编码小分子RNA,是由具有发夹结构的初始转录本通过Drosha和Dicer两类RNA内切酶剪切加工形成的。成熟体miRNA 5′端的种子序列通过与靶基因的3′ UTR特异性结合而在转录后水平调控靶基因的表达。近年来研究表明miRNA已成为一类新型的癌基因或抑癌基因,在肿瘤细胞的增殖、分化、凋亡、转移等多种生物学过程中均发挥重要的调控作用,它不仅可以通过抑制致癌基因的表达而起到抑制肿瘤的作用,而且它还可以通过减少某些肿瘤抑制基因的表达而促进肿瘤的发展[4, 17]。因此,miRNAs已可作为癌症诊断、预后、分级、分期和评判治疗效果的分子标志。miR-155是已知miRNA中与肿瘤性疾病最相关的miRNA之一,已证实miRNA-155与许多种癌症的发生发展相关,如在肾癌[18]、神经胶质瘤[19]、肺癌[20]、结肠癌等恶性肿瘤细胞中常呈上调表达,发挥癌基因的作用。miR-155在肾癌组织中呈高表达,抑制肾癌细胞系中抑制miR-155的表达能抑制肾癌细胞增殖和侵袭、促进肾癌细胞的凋亡,上调靶基因GSK-3β的表达,表明miR-155可通过Wnt/β-catenin通路下调GSK-3β的表达促进在肾癌的发生[18]。在人非小细胞癌中miR-155呈高表达,miR-155过表达后可靶向抑制PDCD4基因的表达而抑制非小细胞肺癌细胞系的增殖与侵袭[20]。在人神经胶质瘤细胞里miR-155也呈高表达,抑制miR-155的表达可抑制神经胶质瘤细胞的增殖并增强其对替莫唑胺药物敏感性[21]。由此可见,miRNA-155在肿瘤发生发展中“致癌”或“抑癌”作用是通过其表达异常来实现的,如若采取相应的干预手段上调或者下调相应miRNAs的水平,可以达到抑制肿瘤生长的目的。该方面的研究一直是近年来关于miR-155在内的miRNAs作用研究的热点。在本研究中,荧光定量PCR检测结果显示,转染gga-miR-155模拟物后,MDCC-MSB1细胞中gga-miR-155的表达水平显著上调,转染抑制物后gga-miR-155表达水平显著下调,表明可以采用此干扰手段继续进行gga-miR-155的相应功能检测。在gga-miR-155过表达和抑制表达的基础上,本研究分别通过CCK-8法检测细胞增殖、流式细胞术检测细胞周期和凋亡、Transwell法检测胞迁移和侵袭。结果显示,过表达gga-miR-155显著促进MDCC-MSB1细胞的增殖,G1期细胞分布减少,S期和G2期细胞增加,细胞凋亡减少,迁移、侵袭能力增加;下调gga-miR-155的表达可显著抑制MDCC-MSB1细胞的增殖,G1期细胞分布增加,S期和G2期减少,细胞凋亡增加,迁移、侵袭能力下降。这些结果表明,虽然gga-miR-155在MDV转化的T淋巴细胞系及MDV感染后的脾肿瘤组织及肝淋巴瘤中均呈下调表达,但其本身可促进MDCC-MSB1细胞增殖、迁移和侵袭,抑制其凋亡。只是在MDV肿瘤形成过程中,gga-miR-155的功能可能被其高表达的功能性同源体MDV-miR-M4代替,但目前还不清楚gga-miR-155呈下调表达的具体机制。Yao等[22]研究发现网状内皮组织增生症病毒(reticuloendotheliosis virus)编码的致肿瘤蛋白v-rel可改变MDCC-MSB1细胞中gga-miR-155的低表达状态,使其异常高表达,且在v-rel诱导鸡胚脾细胞的转化过程中gga-miR-155的表达量异常增加,表明gga-miR-155在肿瘤细胞转化过程中具有重要的作用,这也验证了本研究的结果。近年来,其他非编码RNA,如长链非编码RNA(LncRNA)、环状RNA(circRNA)与miRNA间相互作用也逐渐被研究者们青睐,而gga-miRNA-155在MD肿瘤细胞或组织中呈下调表达是否也与其他的非编码RNA的作用有关,还有待进一步的探讨。
4 结论gga-miR-155可促进MDCC-MSB1细胞增殖、迁移和侵袭,并抑制其凋亡,其作用机制尚需进一步研究探讨。
| [1] | FENG J A. Target research on tumor biology characteristics of mir-155-5p regulation on gastric cancer cell[J]. Pak J Pharm Sci, 2016, 29(2): 711–718. |
| [2] | DEBRUYNE D N, TURCHI L, BUREL-VANDENBOS F, et al. DOCK4 promotes loss of proliferation in glioblastoma progenitor cells through nuclear beta-catenin accumulation and subsequent miR-302-367 cluster expression[J]. Oncogene, 2018, 37(2): 241–254. DOI: 10.1038/onc.2017.323 |
| [3] | LV K T, LIU Z, FENG J, et al. MiR-22-3p regulates cell proliferation and inhibits cell apoptosis through targeting the eIF4EBP3 gene in human cervical squamous carcinoma cells[J]. Int J Med Sci, 2018, 15(2): 142–152. DOI: 10.7150/ijms.21645 |
| [4] | WANG Y Y, CONG W, WU G, et al. MiR-376a suppresses the proliferation and invasion of non-small-cell lung cancer by targeting c-Myc[J]. Cell Biol Int, 2018, 42(1): 25–33. DOI: 10.1002/cbin.10828 |
| [5] | YU Z H, TENG M, SUN A J, et al. Virus-encoded miR-155 ortholog is an important potential regulator but not essential for the development of lymphomas induced by very virulent Marek's disease virus[J]. Virology, 2014, 448: 55–64. DOI: 10.1016/j.virol.2013.09.017 |
| [6] | WANG Y. The inhibition of microRNA-15a suppresses hepatitis B virus-associated liver cancer cell growth through the Smad/TGF-β pathway[J]. Oncol Rep, 2017, 37(6): 3520–3526. DOI: 10.3892/or.2017.5618 |
| [7] | KANG B W, CHOI Y, KWON O K, et al. High level of viral microRNA-BART20-5p expression is associated with worse survival of patients with Epstein-Barr virus-associated gastric cancer[J]. Oncotarget, 2017, 8(9): 14988–14994. |
| [8] | CALNEK B W. Marek's disease——a model for herpesvirus oncology[J]. Crit Rev Microbiol, 1986, 12(4): 293–320. |
| [9] | CHI J Q, TENG M, YU Z H, et al. Marek's disease virus-encoded analog of microRNA-155 activates the oncogene c-Myc by targeting LTBP1 and suppressing the TGF-β signaling pathway[J]. Virology, 2015, 476: 72–84. DOI: 10.1016/j.virol.2014.11.027 |
| [10] | ZHAO P, LI X J, TENG M, et al. In vivo expression patterns of microRNAs of Gallid herpesvirus 2(GaHV-2) during the virus life cycle and development of Marek's disease lymphomas[J]. Virus Genes, 2015, 50(2): 245–252. DOI: 10.1007/s11262-015-1167-z |
| [11] | BURNSIDE J, OUYANG M, ANDERSON A, et al. Deep sequencing of chicken microRNAs[J]. BMC Genomics, 2008, 9: 185. DOI: 10.1186/1471-2164-9-185 |
| [12] | YAO Y X, ZHAO Y G, SMITH L P, et al. Differential expression of microRNAs in Marek's disease virus-transformed T-lymphoma cell lines[J]. J Gen Virol, 2009, 90(Pt 7): 1551–1559. |
| [13] | LIAN L, QU L J, CHEN Y M, et al. A systematic analysis of miRNA transcriptome in Marek's disease virus-induced lymphoma reveals novel and differentially expressed miRNAs[J]. PLoS One, 2012, 7(11): e51003. DOI: 10.1371/journal.pone.0051003 |
| [14] | LI X, LIAN L, ZHANG D X, et al. gga-miR-26a targets NEK6 and suppresses Marek's disease lymphoma cell proliferation[J]. Poult Sci, 2014, 93(5): 1097–1105. DOI: 10.3382/ps.2013-03656 |
| [15] | LIAN L, LI X, ZHAO C F, et al. Chicken gga-miR-181a targets MYBL1 and shows an inhibitory effect on proliferation of Marek's disease virus-transformed lymphoid cell line[J]. Poult Sci, 2015, 94(11): 2616–2621. DOI: 10.3382/ps/pev289 |
| [16] | ZHUANG G Q, SUN A J, TENG M, et al. A tiny RNA that packs a big punch:The critical role of a viral miR-155 ortholog in lymphomagenesis in Marek's disease[J]. Front Microbiol, 2017, 8: 1169. DOI: 10.3389/fmicb.2017.01169 |
| [17] | GU J Y, LU Z S, JI C H, et al. Melatonin inhibits proliferation and invasion via repression of miRNA-155 in glioma cells[J]. Biomed Pharmacother, 2017, 93: 969–975. DOI: 10.1016/j.biopha.2017.07.010 |
| [18] | WEI R J, ZHANG C H, YANG W Z. MiR-155 affects renal carcinoma cell proliferation, invasion and apoptosis through regulating GSK-3β/β-catenin signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2017, 21(22): 5034–5041. |
| [19] | YAN Z Y, CHE S S, WANG J P, et al. miR-155 contributes to the progression of glioma by enhancing Wnt/β-catenin pathway[J]. Tumor Biol, 2015, 36(7): 5323–5331. DOI: 10.1007/s13277-015-3193-9 |
| [20] | LIU F, SONG D L, WU Y H, et al. MiR-155 inhibits proliferation and invasion by directly targeting PDCD4 in non-small cell lung cancer[J]. Thorac Cancer, 2017, 8(6): 613–619. DOI: 10.1111/1759-7714.12492 |
| [21] | MENG X F, NIU J J, YANG Y L, et al. Downregulation of miR-155 inhibits proliferation and enhances chemosensitivity to Temozolomide in glioma cells[J]. Int J Clin Exp Pathol, 2017, 10(2): 1303–1312. |
| [22] | YAO Y X, VASOYA D, KGOSANA L, et al. Activation of gga-miR-155 by reticuloendotheliosis virus T strain and its contribution to transformation[J]. J Gen Virol, 2017, 98(4): 810–820. DOI: 10.1099/jgv.0.000718 |



