鸭源鸡杆菌是鸡杆菌属的代表种,是鸡上呼吸道和下生殖道的一种常在菌,具有条件致病性,是鸡输卵管炎和腹膜炎的重要致病因子[1]。资料显示国内外鸡群中鸡杆菌流行广泛,2008年王川庆等[1]首次对河南地区进行鸭源鸡杆菌感染情况调查,结果显示鸡场普遍存在鸭源鸡杆菌的感染,随后陆续见到山东、山西、四川、河北和湖北等地区鸡群中鸭源鸡杆菌感染的报道[2-7],2014年杨晓林等[8]从四川鸽场中分离出鸡杆菌基因种3型;2018年,El-Adawy等[9]报道德国鸡群中有鸡杆菌的流行,Elbestawy等[10]报道埃及的鸡群中也有鸭源鸡杆菌的流行。鸭源鸡杆菌的易感禽类包括鸡、鸭、鹅、鹌鹑、火鸡和鸽等[1]。
乌鸡作为我国的一种特有珍禽,以其高营养价值闻名天下,在我国禽类养殖中占有特殊的地位,截至目前国内还未见到乌鸡中鸡杆菌流行情况的报道。因此,了解乌鸡中鸡杆菌的流行情况、流行种类及生物学特性,对乌鸡的健康养殖具有重要意义。
16S rRNA基因进化速度缓慢,保守性强,是细菌分类的黄金标准。gyrB基因编码DNA促旋酶B亚基,进化速度较16S rRNA快、碱基替换率高,在DNA复制等功能起重要作用[11],rpoB基因作为一个单一拷贝的管家基因,是RNA聚合酶的重要组成部分。gyrB基因和rpoB基因也可以作为一种分析方法,辅助进行16S rRNA基因的系统发育分析[12-17]。因此,在此前工作的基础上,笔者拟选取16S rRNA、rpoB和gyrB三个基因位点对分离的鸭源鸡杆菌进行遗传进化和耐药性分析。
1 材料与方法 1.1 主要仪器与试剂ETC-811 PCR仪为北京东胜创新生物技术有限公司产品;Universal Hood Ⅱ凝胶成像系统为美国伯乐公司产品;3-30K高速冷冻离心机为德国Sigma公司产品。
DNA Marker购自上海生工生物工程技术服务有限公司(以下简称上海生工);TaKaRa Ex Taq、10×Ex. Taq Buffer(Mg2+)、dNTP混合物、Premix Ex Taq、ROX Reference Dye Ⅱ均购自宝生物工程(大连)有限公司;绵羊血平板培养基购自郑州福博赛生物技术有限责任公司;OXOID药敏纸片购自赛默飞世尔科技(中国)有限公司。
1.2 引物参考Weisburg等[18]和Christensen等[19]的方法分别设计16S rRNA和rpoB基因的PCR引物;参考Johuson等[20]的方法设计gyrB基因的PCR引物;根据Huangfu等[21]的方法设计鸭源鸡杆菌的q-PCR引物和探针;参考Bojesen等[22]的方法设计鸡杆菌特异性PCR的两对引物,1133fgal、114r分别定位于16S rRNA和23S rRNA基因,另一对引物与rpoB基因PCR引物一致,作为内参。委托上海生工合成上述引物及探针,序列详见表 1。
|
|
表 1 引物和探针 Table 1 Primers and probes |
从河南省信阳和南阳的两个乌鸡场随机采样,每只乌鸡采集上腭裂和泄殖腔棉拭子各一份,南阳地区的乌鸡场采集12只,信阳地区的乌鸡场采集10只,共采集了22只乌鸡的44份样品,所采集的22只乌鸡均为外观健康鸡。
1.4 鸡杆菌的分离与鉴定 1.4.1 鸡杆菌的分离无菌方法将棉拭子涂布于血平板培养基,37 ℃培养24 h,挑取圆形、隆起、直径1~2 mm、β溶血的菌落,显微镜检查后,接种于含5%胎牛血清的LB肉汤,37 ℃ 200 r·min-1振荡培养24 h后,参考Huangfu等[21]的方法提取疑似菌株DNA,-20 ℃保存备用。
1.4.2 鸡杆菌PCR鉴定反应体系:10× Buffer(含Mg2+)2.5 μL,dNTP(10 U)0.5 μL,浓度均为25 μmol·L-1的引物1133fgal、114r、rpoB-L和rpoB-R各0.5 μL,Taq酶1.25 U,模板2 μL,补充灭菌去离子水至25 μL。反应程序:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃延伸10 min。电泳检测反应产物。
1.5 棉拭子样品的q-PCR检测参考Huangfu等[21]的方法提取44份棉拭子样品的DNA然后进行q-PCR检测,反应体系(20 μL):Premix Ex Taq 10 μL,引物Primer-F(10 μmol·L-1)和Primer-R(10 μmol·L-1)各0.4 μL,探针Probe_ IN(10 μmol·L-1) 0.6 μL,ROX DyeⅡ 0.2 μL,棉拭子DNA 2 μL,补充灭菌去离子水至20 μL。反应程序:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 34 s,40个循环;在每个循环60 ℃结束时进行荧光检测,检测结果Ct值小于35判定为阳性。
1.6 分离株的管家基因PCR扩增和测序参考皇甫和平等[17]的方法扩增分离菌株的16S rRNA、rpoB基因,参考Johnson等[20]的方法扩增gyrB基因,PCR产物纯化后,提交上海生工测序。
1.7 分离菌株的药敏试验参照美国临床和实验室标准协会(CLSI)抗菌药物敏感性试验标准(M100-S23),选取13种药敏片(氨苄西林、环丙沙星、复方新诺明、克林霉素、庆大霉素、左氧氟沙星、头孢曲松、氯霉素、头孢噻肟、阿米卡星、妥布霉素、氧氟沙星、四环素),采取纸片法对分离的4株鸭源鸡杆菌进行药敏试验。
1.8 遗传进化树的构建及相似性分析以多杀性巴氏杆菌为外群,将分离株与鸡杆菌属其他种进行比较分析,菌株信息见表 2,利用DNAStar软件中的MegAlign程序计算种间相似性,再利用MEGA5.0构建进化树(NJ建树法,1 000个重复),对于遗传差异显著的基因,推导出氨基酸序列后,利用DNAStar和在线软件(http://www.expasy.ch)进行氨基酸序列的比较分析。
|
|
表 2 鸡杆菌菌株信息 Table 2 Information of Gallibacterium strains |
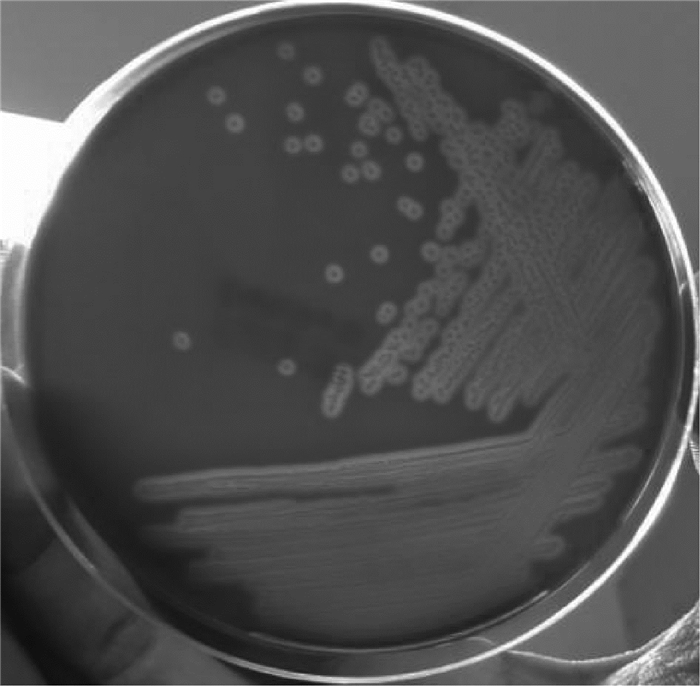
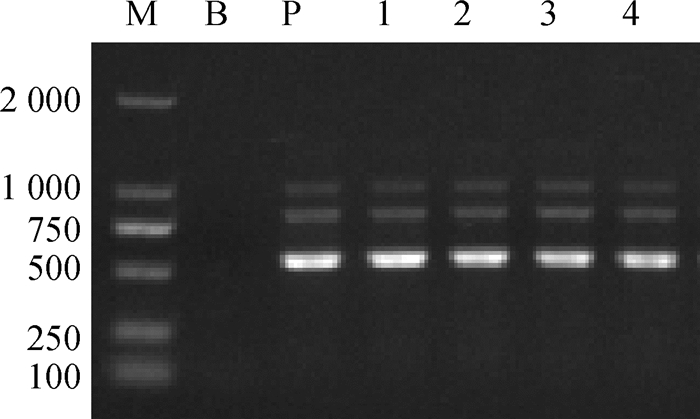
共分离到4株疑似菌株,菌株在血平板培养基上生长良好,菌落呈圆形、隆起、透明、边缘整齐的形态,β溶血(图 1)。油镜下细菌为革兰阴性菌,呈短杆状、单个或成对存在。LB肉汤均变浑浊,有的管底可见絮状沉淀。4株疑似菌株经鸡杆菌PCR扩增,均扩增到预期的3条DNA条带(1 030、790和560 bp),表明均为鸡杆菌,见图 2。
|
图 1 鸡杆菌分离菌株血平板生长状态 Figure 1 Blood plate growth state of isolated Gallibacterium strains |
|
M.DL2000 DNA相对分子质量标准;B.空白对照;P.阳性对照;1. GAC017;2. GAC018;3. GAC021;4. GAC193 M. DL2000 DNA marker; B. Blank control; P. Positive control; 1. GAC017; 2. GAC018; 3. GAC021; 4.GAC193 图 2 鸡杆菌特异性PCR鉴定 Figure 2 Gallibacterium specific PCR |
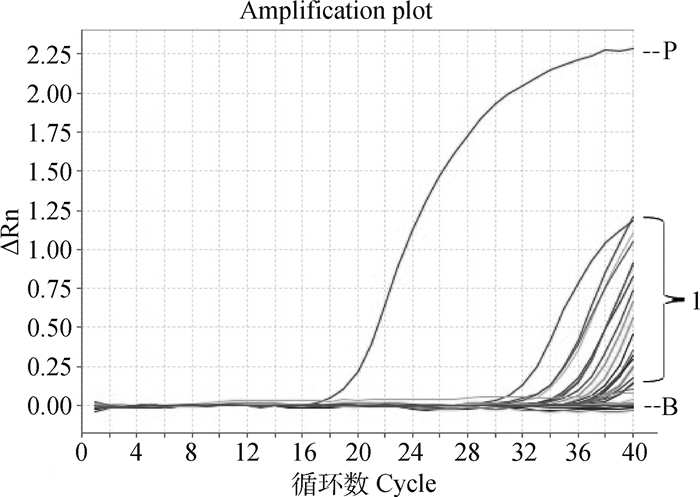
44份棉拭子样品中共检出23个阳性样本,鸭源鸡杆菌阳性乌鸡16只,检出率达72.7%(16/22),q-PCR检测结果见图 3。
|
B.空白对照和阴性样品;P.阳性对照;1.阳性样品 B. Blank control and negative samples; P. Positive control; 1. Positive samples 图 3 棉拭子样品q-PCR检测结果 Figure 3 q-PCR test results of cotton swab samples |
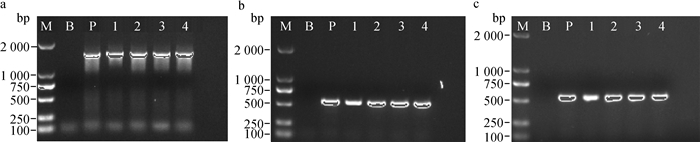
三个管家基因PCR均扩增到了预期的目的片段,16S rRNA基因1 600 bp,rpoB基因560 bp,gyrB基因561 bp,电泳结果如图 4所示。
|
a、b和c分别为16S rRNA、rpoB和gyrB基因的电泳结果。M. DL2000 DNA相对分子质量标准;B.空白对照;P.阳性对照;1. GAC017;2. GAC018;3. GAC021;4. GAC193。条带中有标记的代表强阳性 a, b and c were electrophoretic results of 16S rRNA, rpoB and gyrB genes. M. DL2000 DNA marker; B. Blank control; P. Positive control; 1. GAC017; 2. GAC018; 3. GAC021; 4.GAC193. The tagged bands represent strong positive 图 4 鸡杆菌分离株3个基因的PCR产物检测 Figure 4 Detection of PCR products of three genes of Gallibacterium isolates |
药敏试验结果见表 3,由表可知4株鸭源鸡杆菌均为多重耐药菌株,耐药数量别为9、7、11和11,有3种耐药谱:AMP-C-CIP-OFX-LEV-SXT-TE-CTX-DA、AMP-C-CIP-OFX-SXT-TE-DA、AMP-C-CIP-OFX-LEV-SXT-TE-CN-TOB- AK-DA。分离菌株对头孢曲松、头孢噻肟、阿米卡星和妥布霉素等药物敏感。
|
|
表 3 药敏试验结果 Table 3 Drug sensitivity test results |
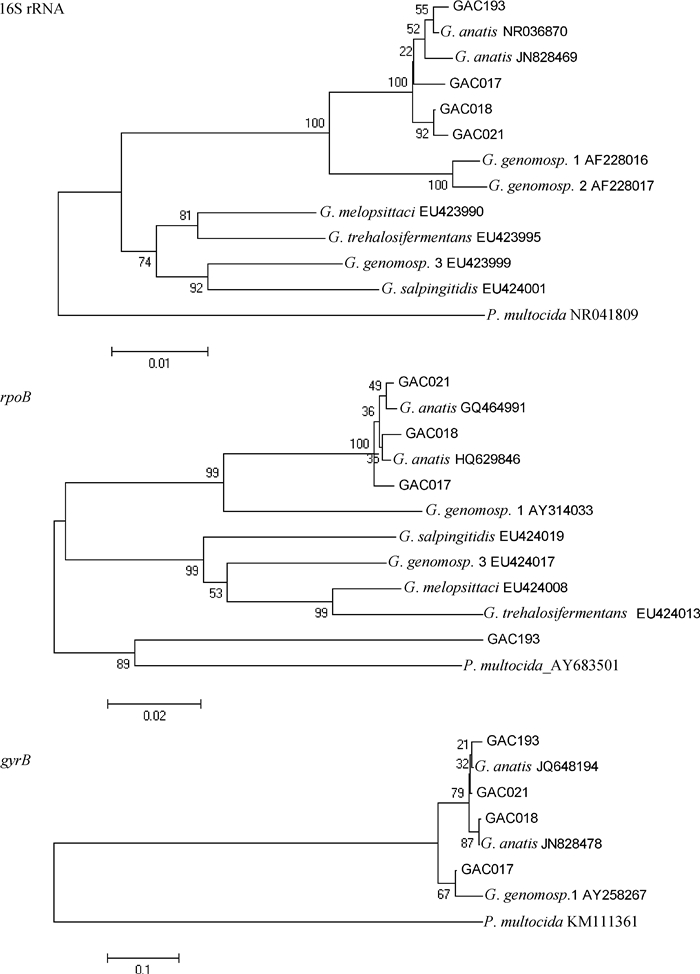
以多杀性巴氏杆菌为外群,建立遗传进化树,结果见图 5。除GAC193在rpoB基因位点与多杀性巴氏杆菌位于同一分支、GAC017在gyrB基因位点与鸡杆菌基因种1在一个小的分支之外,4株细菌在三个进化树中均与鸭源鸡杆菌参考株在同一分支。
|
图 5 鸡杆菌分离株与参考株基于3个基因的遗传进化树 Figure 5 Phylogenetic trees based on three genes of Gallibacterium isolates and reference strains |
3个管家基因相似性分析结果(表 4)显示:分离株与参考鸭源鸡杆菌16S rRNA基因相似性在99.1%~99.8%之间、rpoB基因相似性在85.4%~ 99.6%之间、gyrB基因相似性在92.7%~99.8%之间。分离株与鸡杆菌基因种1型16S rRNA基因相似性在96.3%~97.0%之间、rpoB基因相似性在83.8%~92.7%之间、gyrB基因相似性在89.0%~96.1%之间。将rpoB基因序列推导为氨基酸序列,进行氨基酸序列分析,发现GAC193分离株的RpoB氨基酸序列有10处氨基酸的替换,替换后其稳定性参数由40.42升高为45.64,不稳定性升高;同时对氨基酸序列进行相似性分析,GAC193分离株的氨基酸序列与巴氏杆菌相似性为95.6%,与其他鸭源鸡杆菌的相似性为93.7%。
|
|
表 4 相似性分析结果 Table 4 Analysis of similarity |
作为一种条件性致病菌,鸭源鸡杆菌的致病性和致病机制正逐渐被人们揭示,Kristensen等[23]报道了鸭源鸡杆菌的GtxA毒素,该毒素具有细胞毒性和溶血活性;张秀平等[24]用鸭源鸡杆菌感染原代输卵管上皮细胞,感染的上皮细胞分泌的促炎细胞因子明显增多,能够造成输卵管上皮细胞的损伤;此外,鸭源鸡杆菌的外膜囊泡、菌毛和金属蛋白酶等毒力因子也见诸报道[25-28]。因此,鸭源鸡杆菌感染导致的相关疾病也应引起人们重视。
本研究通过细菌分离、显微镜镜检、q-PCR及管家基因序列分析等方法证实乌鸡中有鸭源鸡杆菌存在,具有较高的检出率(72.7%),并分离到了4株鸭源鸡杆菌。乌鸡中较高的鸭源鸡杆菌检出率与蛋鸡中鸭源鸡杆菌的流行情况一致[1-2],提醒人们也要关注乌鸡中鸭源鸡杆菌感染引起的相应疾病问题。22只乌鸡中鸭源鸡杆菌的检出率为72.7%,而只分离到4株鸭源鸡杆菌,鸡杆菌的低分离率与细菌的分离方法有关,鸭源鸡杆菌处于一个弱势菌群,分离时难免有大肠杆菌等优势菌群与之相竞争,导致鸡杆菌的分离率较低。
基于16S rRNA基因的相似性和进化树分析显示,4株分离株与其他鸭源鸡杆菌参考株的相似性在99.1%~99.8%之间,大于97%,并且归在同一个分支中,证明了4株分离菌株均为鸭源鸡杆菌[29]。rpoB基因进化树中GAC017、GAC018和GAC021与鸭源鸡杆菌参考菌株归在一个分支,而GAC193分离株与巴氏杆菌位于同一分支,经同源性分析发现:GAC193菌株与其他鸭源鸡杆菌相似性在85.2%~86.0%,而与外群巴氏杆菌相似性为86.9%,其氨基酸序列与巴氏杆菌相似性为95.6%,与其他鸭源鸡杆菌的相似性为93.7%,对该菌株的rpoB基因序列的比对分析发现其发生了大范围的突变,GAC193分离株rpoB基因编码氨基酸序列有10处氨基酸的替换,替换后的RpoB不稳定性升高。但该基因突变究竟为适应乌鸡品种适应性改变还是药物压力选择等,以及其突变后相应功能是否发生改变均需要进一步深入的研究。gyrB基因进化树显示:GAC017分离株与其他鸭源鸡杆菌不在同一分支中,同源性分析显示:GAC017分离株gyrB基因序列与鸡杆菌基因种1型的相似性最高,为该基因的部分碱基的替换导致。上述研究结果表明乌鸡中分离的部分鸭源鸡杆菌在rpoB和gyrB基因具有明显的遗传进化差异,也验证了16S rRNA基因保守性明显高于rpoB和gyrB基因[30-31]。
鸡杆菌属目前包括鸭源鸡杆菌、输卵管炎鸡杆菌、虎皮鹦鹉鸡杆菌、海藻糖发酵鸡杆菌以及三个基因种(G. genomosp.1、2、3)[32-33],该属中部分鸭源鸡杆菌、鸡杆菌基因种1和鸡杆菌基因种2具有溶血活性。本次研究从乌鸡中仅分离到溶血表型的鸭源鸡杆菌,这与本研究中使用的细菌分离方法有一定关系,具体乌鸡中是否存在其他鸡杆菌种,需要进一步深入研究。
药敏试验结果显示,乌鸡分离的4株鸭源鸡杆菌产生了3种耐药谱,耐药数量最少的有7种,该结果与郭伦涛[34]、高冬生[35]的研究结果一致,说明鸭源鸡杆菌分离株严重的耐药性;分离株的耐药性与不同的地理来源有一定关系,信阳分离的两株细菌耐药数量较少,且对庆大霉素、阿米卡星、妥布霉素三种药物敏感,而南阳分离的两株鸡杆菌耐药数量较多,且耐药谱一致,对庆大霉素、阿米卡星、妥布霉素药物出现耐药现象。鸭源鸡杆菌严重的多重耐药性已经引起人们的重视,彭志锋等[36]的研究表明鸭源鸡杆菌Ⅰ类整合子与其多重耐药有一定关联,但并不能完全揭示该菌的多重耐药机制,因此仍需进一步深入研究。
4 结论乌鸡体内有鸭源鸡杆菌存在,并具有较高的检出率;本研究从乌鸡中分离到4株鸭源鸡杆菌,未分离到其他种鸡杆菌;分离的鸭源鸡杆菌多重耐药现象严重,耐药种类达11种;乌鸡群中分离的部分鸭源鸡杆菌在rpoB和gyrB基因位点具有明显遗传进化差异。
| [1] |
王川庆, 陈陆, 杨霞, 等. 蛋鸡群卡氏杆菌感染情况的初步研究[J]. 河南农业科学, 2008, 37(3): 97–100, 103.
WANG C Q, CHEN L, YANG X, et al. A premilinary study of Gallibacterium anantis infection in laying hens[J]. Journal of Henan Agricultural Sciences, 2008, 37(3): 97–100, 103. DOI: 10.3969/j.issn.1004-3268.2008.03.029 (in Chinese) |
| [2] |
郑鹿平, 杨霞, 陈陆, 等. 45株鸡卡氏杆菌的分离鉴定[J]. 中国兽医学报, 2010, 30(3): 347–351.
ZHENG L P, YANG X, CHEN L, et al. Isolation and preliminary identification of 45 Gallibacterium anatis strains[J]. Chinese Journal of Veterinary Science, 2010, 30(3): 347–351. (in Chinese) |
| [3] |
田明星, 林艳, 邹年莉, 等. 鸡卡氏杆菌的分离与16S rRNA基因的分析鉴定[J]. 中国畜牧兽医, 2010, 37(9): 57–61.
TIAN M X, LIN Y, ZOU N L, et al. Isolation of Gallibacterium and identification and analysis of 16S rRNA gene[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(9): 57–61. (in Chinese) |
| [4] |
王珊, 陈陆, 付仁一, 等. 我国部分地区蛋鸡群鸭源鸡杆菌血清流行病学调查[J]. 中国预防兽医学报, 2011, 33(2): 114–117.
WANG S, CHEN L, FU R Y, et al. Seroepidemiological survey of Gallibacterium anatis infection in layer chicken flocks in some provinces[J]. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(2): 114–117. DOI: 10.3969/j.issn.1008-0589.2011.02.08 (in Chinese) |
| [5] |
李乔晶, 张九州, 姬郭彪, 等. 河北省鸡群鸭源鸡杆菌血清流行病学调查[J]. 河南农业科学, 2012, 41(2): 132–135.
LI Q J, ZHANG J Z, JI G B, et al. Seroepidemiological survey of Gallibacterium anatis infection in chicken flocks in Hebei Province[J]. Journal of Henan Agricultural Sciences, 2012, 41(2): 132–135. DOI: 10.3969/j.issn.1004-3268.2012.02.033 (in Chinese) |
| [6] |
方翟, 项玉, 谷长勤, 等. 1株鸭源鸡杆菌的分离与鉴定[J]. 中国兽医杂志, 2014, 50(6): 3–5, 8, 49.
FANG D, XIANG Y, GU C Q, et al. Isolation and identification of a Gallibacterium anatis isolated from chicks[J]. Chinese Journal of Veterinary Medicine, 2014, 50(6): 3–5, 8, 49. DOI: 10.3969/j.issn.0529-6005.2014.06.001 (in Chinese) |
| [7] |
董青, 史静柯, 王海花, 等. 郑州地区7株鸭源鸡杆菌的MALDI-TOF MS鉴定及其生物学特性分析[J]. 河南农业科学, 2017, 46(10): 143–147.
DONG Q, SHI J K, WANG H H, et al. Identification of 7 Gallibacterium anatis strains by MALDI-TOF MS in Zhengzhou area and research on partial biological characteristics[J]. Journal of Henan Agricultural Sciences, 2017, 46(10): 143–147. (in Chinese) |
| [8] |
杨晓林, 陈英, 余松城, 等. 1株鸽源鸡杆菌复合群3的分离和鉴定[J]. 浙江大学学报:农业与生命科学版, 2014, 40(3): 249–256.
YANG X L, CHEN Y, YU S C, et al. Isolation and identification of one pigeon-origin Gallibacterium genomosp. 3[J]. Journal of Zhejiang University:Agriculture & Life Sciences, 2014, 40(3): 249–256. (in Chinese) |
| [9] | EL-ADAWY H, BOCKLISCH H, NEUBAUER H, et al. Identification, differentiation and antibiotic susceptibility of Gallibacterium isolates from diseased poultry[J]. Ir Vet J, 2018, 71: 5. DOI: 10.1186/s13620-018-0116-2 |
| [10] | ELBESTAWY A R, ELLAKANY H F, EL-HAMID H S A, et al. Isolation, characterization, and antibiotic sensitivity assessment of Gallibacterium anatis biovar haemolytica, from diseased Egyptian chicken flocks during the years 2013 and 2015[J]. Poultry Sci, 2018, 97(5): 1519–1525. DOI: 10.3382/ps/pey007 |
| [11] | LA DUC M T, SATOMI M, AGATA N, et al. gyrB as a phylogenetic discriminator for members of the Bacillus anthracis-cereus-thuringiensis group[J]. J Microbiol Methods, 2004, 56(3): 383–394. DOI: 10.1016/j.mimet.2003.11.004 |
| [12] |
侯晓丽, 曹清毅, 潘劲草, 等. 霍乱弧菌和副溶血弧菌分离株的gyrB基因系统发育分析[J]. 微生物学报, 2006, 46(6): 884–889.
HOU X L, CAO Q Y, PAN J C, et al. Classification and identification of Vibrio cholerae and Vibrio parahaemolyticus isolates based on gyrB gene phylogenetic analysis[J]. Acta Microbiologica Sinica, 2006, 46(6): 884–889. DOI: 10.3321/j.issn:0001-6209.2006.06.006 (in Chinese) |
| [13] |
李路茜, 李振军, 楼永良. GyrB基因在诺卡菌菌种鉴定中的应用研究[J]. 疾病监测, 2016, 31(6): 503–506.
LI L X, LI Z J, LOU Y L. Identification of Nocardia species based on gyrB gene[J]. Disease Surveillance, 2016, 31(6): 503–506. (in Chinese) |
| [14] |
邵高祥, 束长龙, 耿丽丽, 等. 茶卡盐湖中耐盐抗真菌芽孢杆菌的分离和鉴定[J]. 中国生物防治学报, 2016, 32(4): 440–448.
SHAO G X, SHU C L, GENG L L, et al. Isolation and identification of antifungal Bacillus with Salt-tolerant in Caka Salt Lake[J]. Chinese Journal of Biological Control, 2016, 32(4): 440–448. (in Chinese) |
| [15] |
倪萍, 李美芽, 葛尔宁, 等. 肠道病原菌gyrB基因系统发育分析[J]. 浙江中医药大学学报, 2015, 39(7): 548–554.
NI P, LI M Y, GE E N, et al. Classification and identification of enteric pathogens based on gyrB gene phylogenetic analysis[J]. Journal of Zhejiang Chinese Medical University, 2015, 39(7): 548–554. (in Chinese) |
| [16] |
何艳霞, 向诗非, 李浇, 等. 基于16S rRNA和rpoB基因的分子系统发育分析在铜绿假单胞菌鉴定中的应用[J]. 微生物学杂志, 2016, 36(4): 27–35.
HE Y X, XIANG S F, LI J, et al. Molecular phylogeny analysis based on 16S rRNA and rpoB sequences for identification of clinical isolates of Pseudomonas aeruginosa[J]. Journal of Microbiology, 2016, 36(4): 27–35. DOI: 10.3969/j.issn.1005-7021.2016.04.005 (in Chinese) |
| [17] |
皇甫和平, 杨霞, 赵军, 等. 豫陕两省14株鸡杆菌的gyrB、16S rRNA和rpoB基因序列比较分析[J]. 畜牧兽医学报, 2012, 43(7): 1103–1110.
HUANGFU H P, YANG X, ZHAO J, et al. Sequence analysis of fourteen Gallibacterium isolates from Henan and Shanxi Provinces based on gyrB, 16S rRNA and rpoB genes[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(7): 1103–1110. (in Chinese) |
| [18] | WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. J Bacteriol, 1991, 173(2): 697–703. DOI: 10.1128/jb.173.2.697-703.1991 |
| [19] | CHRISTENSEN H, KUHNERT P, OLSEN J E, et al. Comparative phylogenies of the housekeeping genes atpD, infB and rpoB and the 16S rRNA gene within the Pasteurellaceae[J]. Int J Syst Evol Microbiol, 2004, 54(5): 1601–1609. DOI: 10.1099/ijs.0.03018-0 |
| [20] | JOHNSON T J, DANZEISEN J L, TRAMPEL D, et al. Genome analysis and phylogenetic relatedness of Gallibacterium anatis strains from poultry[J]. PLoS One, 2013, 8(1): e54844. DOI: 10.1371/journal.pone.0054844 |
| [21] | HUANGFU H P, XU W B, WANG H K, et al. Detection of Gallibacterium anatis by TaqMan fluorescent quantitative PCR[J]. Avian Pathol, 2018, 47(3): 245–252. DOI: 10.1080/03079457.2017.1416590 |
| [22] | BOJESEN A M, VAZQUEZ M E, ROBLES F, et al. Specific identification of Gallibacterium by a PCR using primers targeting the 16S rRNA and 23S rRNA genes[J]. Vet Microbiol, 2007, 123(1-3): 262–268. DOI: 10.1016/j.vetmic.2007.02.013 |
| [23] | KRISTENSEN B M, FREES D, BOJESEN A M. GtxA from Gallibacterium anatis, a cytolytic RTX-toxin with a novel domain organisation[J]. Vet Res, 2010, 41(3): 25. DOI: 10.1051/vetres/2009073 |
| [24] |
张秀平, 卢彩景, 陈陆, 等. 鸭源鸡杆菌对鸡原代输卵管上皮细胞作用[J]. 中国兽医学报, 2016, 36(2): 228–233.
ZHANG X P, LU C J, CHEN L, et al. Impact of Gallibacterium anatis on chicken oviduct epithelial cells[J]. Chinese Journal of Veterinary Science, 2016, 36(2): 228–233. (in Chinese) |
| [25] | BAGER R J, PERSSON G, NESTA B, et al. Outer membrane vesicles reflect environmental cues in Gallibacterium anatis[J]. Vet Microbiol, 2013, 167(3-4): 565–572. DOI: 10.1016/j.vetmic.2013.09.005 |
| [26] | BAGER R J, NESTA B, PORS S E, et al. The fimbrial protein FlfA from Gallibacterium anatis is a virulence factor and vaccine candidate[J]. Infect Immun, 2013, 81(6): 1964–1973. DOI: 10.1128/IAI.00059-13 |
| [27] | GARCÍA-GÉMEZ E, VACA S, PÉREZ-MÉNDEZ A, et al. Gallibacterium anatis-secreted metalloproteases degrade chicken IgG[J]. Avian Pathol, 2005, 34(5): 426–429. DOI: 10.1080/03079450500267866 |
| [28] |
王继洋, 王艳, 彭志锋, 等. 鸭源鸡杆菌相关致病因子研究进展[J]. 中国兽医学报, 2017, 37(8): 1627–1632.
WANG J Y, WANG Y, PENG Z F, et al. Research process on the virulence factors of Gallibacterium anatis in poultry[J]. Chinese Journal of Veterinary Science, 2017, 37(8): 1627–1632. (in Chinese) |
| [29] | DRANCOURT M, BOLLET C, CARLIOZ A, et al. 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J]. J Clin Microbiol, 2000, 38(10): 3623–3630. |
| [30] | PEI A Y, OBERDORF W E, NOSSA C W, et al. Diversity of 16S rRNA genes within individual prokaryotic genomes[J]. Appl Environ Microbiol, 2010, 76(12): 3886–3897. DOI: 10.1128/AEM.02953-09 |
| [31] | KIM B J, KIM C J, CHUN J, et al. Phylogenetic analysis of the genera Streptomyces and Kitasatospora based on partial RNA polymerase β-subunit gene (rpoB) sequences[J]. Int J Syst Evol Microbiol, 2004, 54(2): 593–598. DOI: 10.1099/ijs.0.02941-0 |
| [32] | CHRISTENSEN H, BISGAARD M, BOJESEN A M, et al. Genetic relationships among avian isolates classified as Pasteurella haemolytica. 'Actinobacillus salpingitidis' or Pasteurella anatis with proposal of Gallibacterium anatis gen. nov., comb. Nov. and description of additional genomospecies within Gallibacterium gen. nov.[J]. Int J Syst Evol Microbiol, 2003, 53(Pt 1): 275–287. |
| [33] | BISGAARD M, KORCZA B M, BUSSE H J, et al. Classification of the taxon 2 and taxon 3 complex of bisgaard within Gallibacterium and description of Gallibacterium melopsittaci sp. nov., Gallibacterium trehalosifermentans sp. nov. and Gallibacterium salpingitidis sp. nov.[J]. Int J Syst Evol Microbiol, 2009, 59(4): 735–744. DOI: 10.1099/ijs.0.005694-0 |
| [34] |
郭伦涛.鸡杆菌地方分离株耐药性及耐药基因的研究[D].郑州: 河南农业大学, 2010.
GUO L T. Studies on drug resistance and resistant genes of Gallibacterium anatis strains isolated from chickens in different localities[D]. Zhengzhou: Henan Agricultural University, 2010. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10466-2010270671.htm |
| [35] |
高冬生. 61株鸭源鸡杆菌部分耐药基因及其与耐药性关系的研究[D].郑州: 河南农业大学, 2011.
GAO D S.The correlation between drug resistance and some drug resistance genes in sixty-one Gallibacterium anatis isolates[D]. Zhengzhou: Henan Agricultural University, 2011. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10466-1012275402.htm |
| [36] |
彭志锋, 高冬生, 刘红英, 等. 鸭源鸡杆菌整合子及其与耐药性的相关性分析[J]. 畜牧兽医学报, 2016, 47(8): 1676–1681.
PENG Z F, GAO D S, LIU H Y, et al. Gallibacterium anatis Integron and its correlation with the drug resistance[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8): 1676–1681. (in Chinese) |



