2. 农业部动物疾病临床诊疗技术重点试验室, 呼和浩特 010018
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease of Ministry of Agriculture, Hohhot 010018, China
防御素(defensins)是具有两亲性和阳离子性质的小半胱氨酸肽家族,被认为是构成最初和有效的宿主防御系统的一部分,其广泛存在于植物、昆虫和脊椎动物中[1-2]。防御素基于半胱氨酸残基之间分子内二硫键形成的模式分为3类:α-、β-和θ-防御素[3]。β-防御素是一种由38~42个氨基酸组成,且存在于许多脊椎动物体内的阳离子抗菌肽[4],其在先天和适应性免疫方面起着关键作用,能够杀死各种病原体,包括细菌、真菌、病毒和寄生虫。此外,β-防御素还是免疫细胞的趋化性引诱剂,能够参与免疫调节[5]。
β-葡聚糖是一种广泛存在于细菌、真菌、藻类和植物细胞壁中的多糖,其因能够增强免疫力、抗肿瘤、抗菌、抗病毒、促进伤口愈合以及刺激先天和适应性免疫反应而备受关注[6-8]。近年来一些研究表明,β-葡聚糖可以通过促进人和鱼类白细胞介素、防御素和cathelicidins的分泌,从而对侵入机体内的微生物起到防御功能[9-13]。然而,关于酿酒酵母细胞壁成分β-葡聚糖对反刍动物RECs防御素表达影响的研究尚未见相关报道。
本试验采用qPCR和ELISA方法检测β-葡聚糖在不同浓度、不同时间段刺激RECs后SBD-1 mRNA和蛋白的表达变化。为今后了解β-葡聚糖与上皮细胞防御素表达的关系,解析防御素发挥免疫调节作用的途径和机制提供一定的理论基础及依据。
1 材料与方法 1.1 试验材料试验动物来自呼和浩特市北亚屠宰场健康状况良好的绵羊。绵羊屠宰后立刻剪取一块内表面乳头较大且较密的瘤胃组织,用生理盐水冲洗干净后放入PBS中备用。
1.2 绵羊RECs原代培养根据金鑫等[14]报道的绵羊RECs培养方法进行绵羊RECs的原代培养,钝性分离瘤胃组织的浆膜和肌层,将分离后的黏膜层经0.25%胰蛋白酶在37 ℃温箱消后化,将后4次收集得到的细胞加入含体积分数20%胎牛血清的DMEM/F12培养液终止消化,过滤、离心、分装,于37 ℃、5% CO2培养箱中静置培养,待细胞在培养瓶中达到80%~100%传代培养后,用不含有两性霉素和其他抗生素的细胞培养基37 ℃,5% CO2孵育过夜,用于后续刺激试验。
1.3 β-葡聚糖刺激绵羊RECs的条件优化用不同浓度(0、5、10、20、50、100 μg·mL-1)的β-葡聚糖(Sigma-Aldrich)刺激RECs,37 ℃,5% CO2孵育8 h。然后通过qPCR和ELISA方法检测SBD-1 mRNA和蛋白的表达量,以选取β-葡聚糖刺激SBD-1表达的最佳浓度;用最佳的β-葡聚糖浓度分别刺激RECs 0、2、4、8、12、24 h,然后通过qPCR和ELISA方法检测SBD-1 mRNA和蛋白的表达量,以选取β-葡聚糖刺激SBD-1表达的最佳时间。
1.4 引物设计本研究中β-actin为内参基因,SBD-1为所要检测的目的基因。引物均由生工生物工程(上海)股份有限公司设计和合成(表 1)。
|
|
表 1 引物序列 Table 1 Primer sequences |
绵羊RECs总RNA的提取按照RNA提取试剂盒(Axygen Scientific, Inc. USA)进行操作,并使用Synergy H4 Hybrid酶标仪(BioTek Inc,Winooski,VT,USA)测量260和280 nm处的吸光度来分析总RNA浓度和纯度,将OD260 nm/OD280 nm比值在1.9~2.0范围内的样品按照TaKaRa的去除基因组DNA的反转录试剂盒(TaKaRa,Japan)进行反转录反应,将得到的cDNA于-20 ℃保存备用。
1.6 绵羊SBD-1 mRNA的实时荧光定量PCR(qPCR)内参基因β-actin和目的基因SBD-1的qPCR测定在QuantStudioTM7 Flex Real-time PCR System仪器(Thermo Fisher Scientific)上进行。每20 μL反应物含有SYBR Premin Ex Taq(2×)10 μL,正向和反向引物(10 μmol·L-1)各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。反应程序为扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,45个循环;熔解程序:95 ℃ 5 s;60 ℃ 30 s;95 ℃ 15 s,每个样品分别做5个重复。使用2-ΔΔCt方法计算mRNA的相对表达量。
1.7 绵羊SBD-1蛋白的ELISA检测收集不同浓度的β-葡聚糖处理组以及同浓度刺激0、2、4、8、12和24 h后的共培养上清,采用绵羊防御素β1(DEFβ1)ELISA试剂盒,按其说明进行操作,然后用Synergy H4 Hybrid酶标仪(BioTek Inc,Winooski,VT,USA)测定各样品OD值(450 nm),并运用EXCEL(2007)软件绘制标准曲线。
1.8 绵羊RECs的活力鉴定将RECs以2×104个·孔-1的密度接种在96孔板。用不同浓度(0、5、10、20、50和100 μg·mL-1)的β-葡聚糖(Sigma-Aldrich)刺激RECs 8 h,以及用诱导SBD-1表达最高的β-葡聚糖浓度刺激瘤胃上皮0、2、4、8、12和24 h,同时单独培养的细胞作为空白对照。将100 μL DMEM/F12培养基和10 μL MTT(Sigma-Aldrich)加入到每个孔中,并在37 ℃,5% CO2孵育4 h后用DMSO溶解。使用酶标仪在540 nm下测定孔的密度。
1.9 统计分析使用GraphPad Prism5软件绘制图片。所有试验数据采用SPSS 20.0软件进行单因素方差分析(one-way,ANOVA),多重比较采用最小显著性差异法(least-significant difference,LSD)。所有数据表示为至少5个独立试验的“平均值±标准差”。统计学显著性设定在P<0.05水平。
2 结果 2.1 绵羊RECs的传代培养绵羊RECs传代细胞生长迅速,培养2 d后,细胞形态清晰,呈鹅卵石铺路状(图 1A);培养4 d后,细胞即有90%以上聚集生长,镜下观察基本没有空余位置,形成漩涡状排列的致密单层细胞集落,且细胞界限明显,可以进行后续试验(图 1B)。

|
A.传代培养2 d的绵羊RECs;B.传代培养4 d的绵羊RECs A. The ovine ruminal epithelial cells after 2 days subculture; B. The ovine ruminal epithelial cells after 4 days subculture 图 1 绵羊RECs的传代培养(100×) Figure 1 Subcultures of ovine ruminal epithelial cells (100×) |
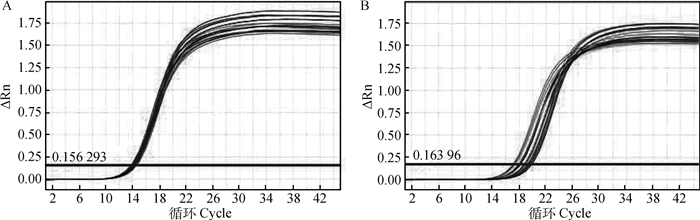
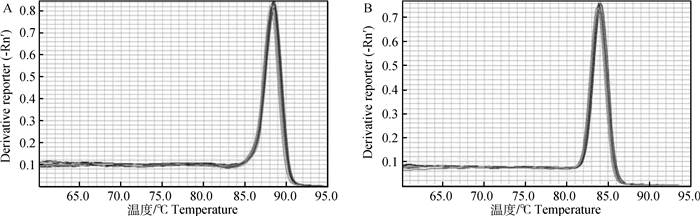
以β-actin为内参基因,SBD-1为目的基因,将反转录得到的cDNA经qPCR扩增反应,扩增曲线表明,扩增效果良好(图 2A, 2B),经熔解曲线分析,β-actin和SBD-1分别在88.5和84 ℃出现单一峰,均没有出现杂峰,并且主峰(熔解峰)对应的Tm值与引物设计后预期产物Tm值相同(图 3A, 3B),说明qPCR的扩增产物为单一的具有特异性的产物。
|
A. β-actin基因的扩增曲线;B. SBD-1基因的扩增曲线 A. The amplification curve of β-actin gene; B. The amplification curve of SBD-1 gene 图 2 β-actin和SBD-1基因的扩增曲线 Figure 2 The amplification curves of β-actin and SBD-1 genes |
|
A. β-actin熔解曲线;B. SBD-1熔解曲线 A. The melt peak curve of β-actin gene; B. The melt peak curve of SBD-1 gene 图 3 β-actin和SBD-1的熔解曲线 Figure 3 The melt peak curves of β-actin and SBD-1 genes |
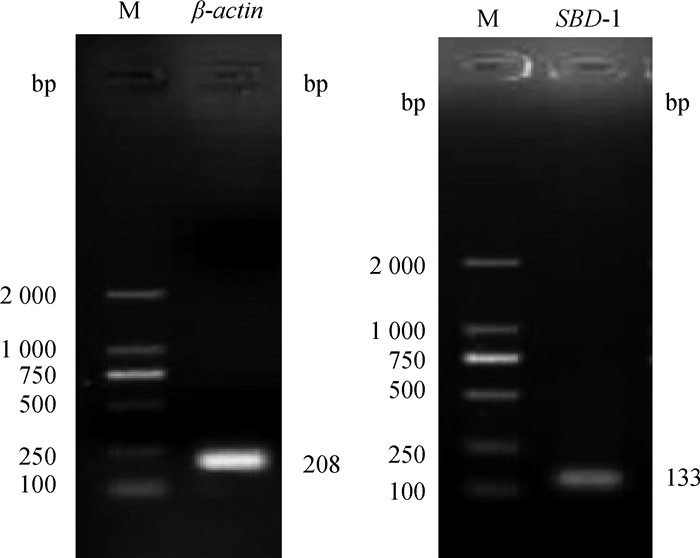
将qPCR扩增反应后的产物经1%的琼脂糖凝胶电泳分析,结果显示,在约208和133 bp位置处可见各有一条特异性条带,与引物设计预期的片段大小相一致,扩增产物条带整齐且无二聚体形成,表明qPCR产物分别为β-actin和SBD-1的基因产物(图 4)。
|
图 4 β-actin和SBD-1基因qPCR产物琼脂糖凝胶电泳图 Figure 4 The agarose gel electrophoresis of amplified products of β-actin and SBD-1 by qPCR |
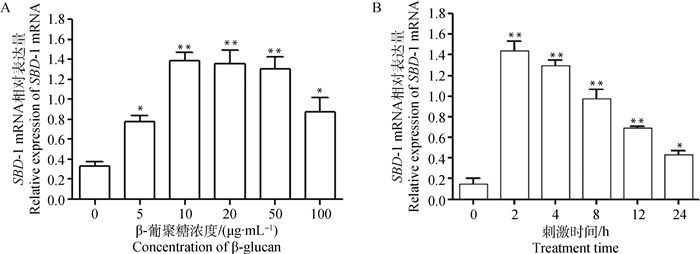
数据经SPSS 20.0分析,结果如图 5所示,用不同浓度的β-葡聚糖(5、10、20、50和100 μg·mL-1)刺激RECs 8 h后,发现β-葡聚糖能够诱导SBD-1 mRNA的表达,且当β-葡聚糖浓度为10 μg·mL-1时SBD-1的表达量极显著高于对照组(P<0.01),而当β-葡聚糖的浓度为100 μg·mL-1刺激RECs时,发现SBD-1 mRNA的表达量显著降低,但仍显著高于空白对照组(P<0.05,图 5A)。接下来用10 μg·mL-1的β-葡聚糖刺激RECs 0、2、4、8、12和24 h后,与空白对照组相比,β-葡聚糖刺激2 h后观察到SBD-1的表达量达到最高(P<0.01,图 5B)。因此,当浓度为10 μg·mL-1的β-葡聚糖刺激RECs 2 h后SBD-1 mRNA的表达量达到最高。
|
A.β-葡聚糖不同刺激浓度对SBD-1 mRNA表达的影响;B. β-葡聚糖不同刺激时间对SBD-1 mRNA表达的影响。*. P<0.05;* *. P<0.01,下图同 A.Effects of different concentrations of β-glucan on SBD-1 mRNA expression; B. Effects of β-glucan stimulated RECs at different times on SBD-1 mRNA expression. *. P < 0.05; * *. P < 0.01, the same as the following figures 图 5 β-葡聚糖对绵羊RECs SBD-1 mRNA表达的影响 Figure 5 Effect of β-glucan on the expression of sheep RECs SBD-1 mRNA |
标准曲线的二次多项式拟合方程为y=ax2+bx+ c(其中a=2 656.3,b=3 185.5,c=-249.72),相关系数R2=0.997 3,表明样品浓度可以利用此标准曲线计算(图 6)。
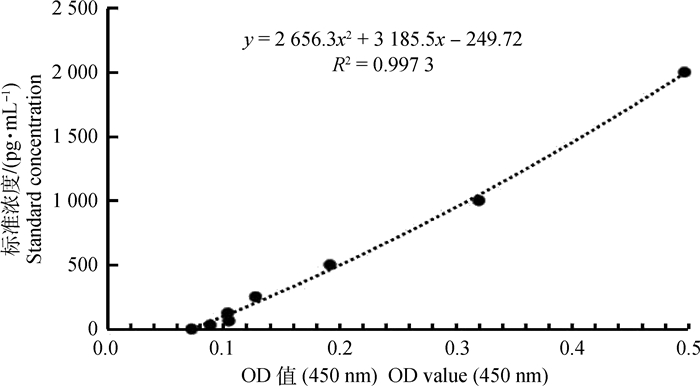
|
图 6 ELISA试验标准曲线 Figure 6 Standard curve of ELISA test |
ELISA结果表明,SBD-1在蛋白水平的表达趋势与mRNA水平相似。用不同浓度的β-葡聚糖(5、10、20、50和100 μg·mL-1)刺激绵羊RECs后检测SBD-1的蛋白表达情况,结果显示,与对照组相比,用10 μg·mL-1的β-葡聚糖刺激RECs后极显著增加了RECs中SBD-1的蛋白表达(P<0.01,图 7A)。接下来,用10 μg·mL-1的β-葡聚糖刺激RECs 0~24 h后检测发现,SBD-1蛋白的表达最大刺激时间为4 h(P<0.01,图 7B)。这表明,β-葡聚糖刺激RECs后均能提高共培养上清中SBD-1的蛋白表达,且当浓度10 μg·mL-1刺激4 h SBD-1的蛋白表达达到峰值。
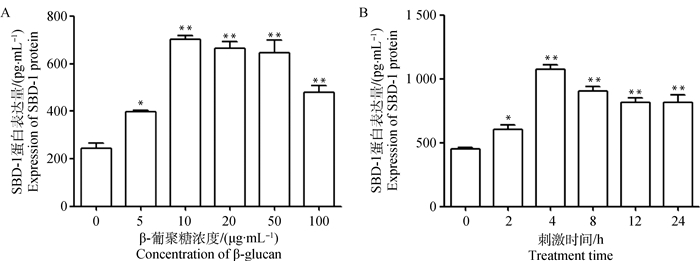
|
A.β-葡聚糖不同刺激浓度对SBD-1蛋白表达的影响;B. β-葡聚糖不同刺激时间对SBD-1蛋白表达的影响 A. Effects of different concentrations of β-glucan on SBD-1 protein expression; B. Effects of β-glucan stimulated RECs at different times on SBD-1 protein expression 图 7 β-葡聚糖对绵羊RECs SBD-1蛋白表达的影响 Figure 7 Effect of β-glucan on the expression of sheep RECs SBD-1 protein |
为了确定β-葡聚糖可能的毒性,本研究用不同浓度β-葡聚糖(5、10、20、50和100 μg·mL-1)刺激RECs 8 h。使用MTT测定法检测β-葡聚糖刺激RECs后上皮细胞的存活率。观察到在RECs中β-葡聚糖浓度为5、10、20、50 μg·mL-1(P>0.05)对RECs没有毒性,而浓度为100 μg·mL-1时发现显著的细胞死亡(P<0.05,图 8A)。而后,用10 μg·mL-1的β-葡聚糖刺激RECs 0~24 h后,观察到β-葡聚糖浓度为10 μg·mL-1刺激RECs 0~24 h的细胞均存活(P>0.05,图 8B)。
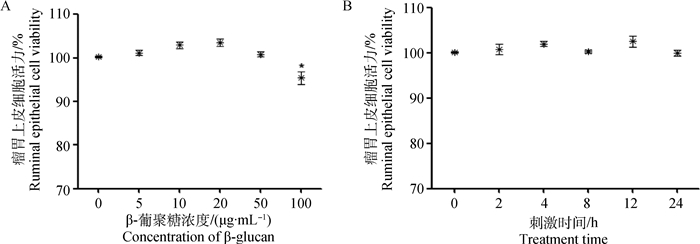
|
A.β-葡聚糖不同刺激浓度对绵羊RECs活性影响; B. β-葡聚糖不同刺激时间对绵羊RECs活性影响 A. Effects of different concentrations of β-glucan on the activity of sheep RECs; B. Effect of β-glucan stimulated RECs at different times on the activity of sheep RECs 图 8 β-葡聚糖刺激绵羊RECs后细胞活性检测 Figure 8 The sheep ruminal epthelial cell viability after β-glucan treatment |
长期以来,在畜牧业生产中抗生素一直被用于预防动物疾病和促进动物的生长[15]。然而,由于细菌对抗生素耐药性负面影响的不断增加[16],抗生素替代品的开发已成为研究的新热点,而防御素被认为是抗生素的潜在替代品之一。以往的研究表明,益生菌、维生素D3、丁酸、胆汁酸和维甲酸可以诱导反刍动物、人或家禽体内宿主防御肽(host defence peptides,HDPs)的表达,并增强机体对疾病的抵抗力[17-20]。因此,通过饮食调节来诱导内源性HDPs的表达是一种用于控制和预防疾病的新型抗微生物方法。而酵母β-葡聚糖是一种从酿酒酵母细胞壁中提取的多糖,已被广泛研究,并被证明具有涉及受体识别的免疫调节活性,能够最有效地增强哺乳动物物种中的宿主先天性免疫反应[21-24]。
尽管许多多糖被证明是参与激活宿主防御机制的成分,但有关酿酒酵母细胞壁成分β-葡聚糖与先天免疫系统中发挥重要作用的抗微生物肽防御素的表达关系仍少见报导。Van Der Marel等[12]和Schmitt等[13]的研究结果表明,在鱼饮食中补充一定剂量的酵母聚糖能够促进鳃中β-防御素-2和皮肤中β-防御素基因的表达以及肠上皮细胞中防御素和cathelicidins的分泌。同样,Campoverde等[25]研究发现,在大西洋白姑鱼体内注射β-葡聚糖24 h后,肾中β-防御素的表达显著上调,而在体外培养的肾和肠细胞中与β-葡聚糖分别共培养4或24 h后β-防御素的表达增加,之后呈下降趋势。本研究同样发现,β-葡聚糖以剂量和时间依赖方式诱导SBD-1 mRNA和蛋白的表达,并且低浓度的β-葡聚糖(10 μg·mL-1)刺激RECs 2或4 h就能有效诱导SBD-1的表达量达到最高,而后呈下降趋势。说明利用酿酒酵母细胞壁成分β-葡聚糖作为诱导剂,特异性诱导β-防御素在RECs内的高效表达具有可行性,且β-葡聚糖对机体的诱导效果可能取决于作用的剂量和时间,太低的剂量或刺激时间较短诱导效果不明显,而太高的剂量或刺激时间较长具有抑制作用。由此提示,在一定浓度和时间范围内,β-葡聚糖在RECs上诱导SBD-1的表达过程可能是机体自身的一种调节过程,即当用β-葡聚糖刺激RECs后SBD-1的表达量升高,但达到最高时机体也会随着刺激时间的延长逐渐将SBD-1的表达量调节到自身基础水平,从而保持SBD-1表达的稳态。
另有研究表明,益生菌分子与宿主的相互作用可能是益生菌发挥益生效应的基础,如革兰氏阳性细菌的主要细胞壁成分肽聚糖和脂磷壁酸,革兰氏阴性细菌的主要细胞壁成分脂多糖,均被认为是免疫调节作用的关键组分[26-29],而本研究中证明的酿酒酵母菌细胞壁成分β-葡聚糖能够诱导SBD-1的表达,同样也可猜测为β-葡聚糖在免疫调节中发挥着重要作用,但是其发挥免疫调节作用的机制有待进一步研究。
4 结论本研究利用体外培养的绵羊RECs,从mRNA和蛋白质水平证明了酿酒酵母菌一个主要的细胞壁成分β-葡聚糖能够上调绵羊RECs SBD-1基因的表达,且β-葡聚糖浓度为10 μg·mL-1分别刺激RECs 2和4 h后SBD-1 mRNA和蛋白的表达水平达到最高,此结果为今后β-葡聚糖制剂添加于饲料中最佳的添加比例和饲喂间隔时间提供理论依据。
| [1] | PESCHEL A, SAHL H G. The co-evolution of host cationic antimicrobial peptides and microbial resistance[J]. Nat Rev Microbiol, 2006, 4(7): 529–536. DOI: 10.1038/nrmicro1441 |
| [2] | TAM J P, WANG S J, WONG K H, et al. Antimicrobial peptides from plants[J]. Pharmaceuticals, 2015, 8(4): 711–757. DOI: 10.3390/ph8040711 |
| [3] | GANZ T. Defensins:antimicrobial peptides of innate immunity[J]. Nat Rev Immunol, 2003, 3(9): 710–720. DOI: 10.1038/nri1180 |
| [4] | ZHU S Y, GAO B. Evolutionary origin of β-defensins[J]. Dev Comp Immunol, 2013, 39(1-2): 79–84. DOI: 10.1016/j.dci.2012.02.011 |
| [5] | DONG J J, WU F, YE X, et al. β-defensin in Nile tilapia (Oreochromis niloticus):sequence, tissue expression, and anti-bacterial activity of synthetic peptides[J]. Gene, 2015, 566(1): 23–31. DOI: 10.1016/j.gene.2015.04.025 |
| [6] | PELIZON A C, KANENO R, SOARES A M V C, et al. Immunomodulatory activities associated with beta-glucan derived from Saccharomyces cerevisiae[J]. Physiol Res, 2005, 54(5): 557–564. |
| [7] | QI C J, CAI Y H, GUNN L, et al. Differential pathways regulating innate and adaptive antitumor immune responses by particulate and soluble yeast-derived β-glucans[J]. Blood, 2011, 117(25): 6825–6836. DOI: 10.1182/blood-2011-02-339812 |
| [8] |
徐智鹏, 胡骏鹏, 周小辉. 酵母细胞壁多糖的作用及其成分检测方法[J]. 中国饲料, 2015(11): 40–42.
XU Z P, HU J P, ZHOU X H. The function of yeast cell wall polysaccharide and its detection methods[J]. China Feed, 2015(11): 40–42. (in Chinese) |
| [9] | SUZUKI I, TANAKA H, KINOSHITA A, et al. Effect of orally administered β-glucan on macrophage function in mice[J]. Int J Immunopharmacol, 1990, 12(6): 675–684. DOI: 10.1016/0192-0561(90)90105-V |
| [10] | WALLER K P, COLDITZ I G. Effect of intramammary infusion of beta-1, 3-glucan or interleukin-2 on leukocyte subpopulations in mammary glands of sheep[J]. Am J Vet Res, 1999, 60(6): 703–707. |
| [11] | KOUGIAS P, WEI D, RICE P J, et al. Normal human fibroblasts express pattern recognition receptors for fungal (1→3)-β-D-glucans[J]. Infect Immun, 2001, 69(6): 3933–3938. DOI: 10.1128/IAI.69.6.3933-3938.2001 |
| [12] | VAN DER MAREL M, ADAMEK M, GONZALEZ S F, et al. Molecular cloning and expression of two β-defensin and two mucin genes in common carp (Cyprinus carpio L.) and their up-regulation after β-glucan feeding[J]. Fish Shellfish Immunol, 2012, 32(3): 494–501. DOI: 10.1016/j.fsi.2011.12.008 |
| [13] | SCHMITT P, WACYK J, MORALES-LANGE B, et al. Immunomodulatory effect of cathelicidins in response to a β-glucan in intestinal epithelial cells from rainbow trout[J]. Dev Comp Immunol, 2015, 51(1): 160–169. DOI: 10.1016/j.dci.2015.03.007 |
| [14] |
金鑫, 张曼, 范燕茹, 等. 酿酒酵母菌对绵羊瘤胃上皮细胞β-防御素-1(SBD-1)基因表达的影响[J]. 中国农业科学, 2015, 48(19): 3910–3918.
JIN X, ZHANG M, FAN Y R, et al. Effects of saccharomyces cerevisiae on the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J]. Scientia Agricultura Sinica, 2015, 48(19): 3910–3918. DOI: 10.3864/j.issn.0578-1752.2015.19.013 (in Chinese) |
| [15] | THACKE P A. Alternatives to antibiotics as growth promoters for use in swine production:a review[J]. J Anim Sci Biotechnol, 2013, 4(1): 35. DOI: 10.1186/2049-1891-4-35 |
| [16] | VAN DER FELS-KLERX H J, PUISTER-JANSEN L F, VAN ASSELT E D, et al. Farm factors associated with the use of antibiotics in pig production[J]. J Anim Sci, 2011, 89(6): 1922–1929. DOI: 10.2527/jas.2010-3046 |
| [17] |
王佩, 范燕茹, 金鑫, 等. 枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响[J]. 畜牧兽医学报, 2015, 46(5): 760–767.
WANG P, FAN Y R, JIN X, et al. Effects of Bacillus subtilis on the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(5): 760–767. (in Chinese) |
| [18] | CUPERUS T, COORENS M, VAN DIJK A, et al. Avian host defense peptides[J]. Dev Comp Immunol, 2013, 41(3): 352–369. DOI: 10.1016/j.dci.2013.04.019 |
| [19] | ZHANG G L, SUNKARA L T. Avian antimicrobial host defense peptides:from biology to therapeutic applications[J]. Pharmaceuticals (Basel), 2014, 7(3): 220–247. DOI: 10.3390/ph7030220 |
| [20] | CAMPBELL Y, FANTACONE M L, GOMBART A F. Regulation of antimicrobial peptide gene expression by nutrients and by-products of microbial metabolism[J]. Eur J Nutr, 2012, 51(8): 899–907. DOI: 10.1007/s00394-012-0415-4 |
| [21] | ESTRADA A, YUN C H, VAN KESSEL A, et al. Immunomodulatory activities of oat β-glucan in vitro and in vivo[J]. Microbiol Immunol, 1997, 41(12): 991–998. DOI: 10.1111/mim.1997.41.issue-12 |
| [22] | VOLMAN J J, RAMAKERS J D, PLAT J. Dietary modulation of immune function by β-glucans[J]. Physiol Behav, 2008, 94(2): 276–284. DOI: 10.1016/j.physbeh.2007.11.045 |
| [23] | SALEH M A D, AMORIM A B, GRECCO H A T, et al. Effects of β-(1→3, 1→6)-D-glucan and density of diets on the blood profiles of immunologically challenged weaned piglets[J]. Int J Biol Macromol, 2015, 80: 659–667. DOI: 10.1016/j.ijbiomac.2015.07.024 |
| [24] | SHAO Y J, WANG Z, TIAN X Y, et al. Yeast β-D-glucans induced antimicrobial peptide expressions against Salmonella infection in broiler chickens[J]. Int J Biol Macromol, 2016, 85: 573–584. DOI: 10.1016/j.ijbiomac.2016.01.031 |
| [25] | CAMPOVERDE C, MILNE D J, ESTÉVEZ A, et al. Ontogeny and modulation after PAMPs stimulation of β-defensin, hepcidin, and piscidin antimicrobial peptides in meagre (Argyrosomus regius)[J]. Fish Shellfish Immunol, 2017, 69: 200–210. DOI: 10.1016/j.fsi.2017.08.026 |
| [26] | LEE I C, TOMITA S, KLEEREBEZEM M, et al. The quest for probiotic effector molecules-unraveling strain specificity at the molecular level[J]. Pharmacol Res, 2013, 69(1): 61–74. DOI: 10.1016/j.phrs.2012.09.010 |
| [27] | KIM K W, KANG S S, WOO S J, et al. Lipoteichoic acid of probiotic Lactobacillus plantarum attenuates Poly Ⅰ:C-induced IL-8 production in porcine intestinal epithelial cells[J]. Front Microbiol, 2017, 8: 1827. DOI: 10.3389/fmicb.2017.01827 |
| [28] | CLUA P, KANMANI P, ZELAYA H, et al. Peptidoglycan from immunobiotic Lactobacillus rhamnosus improves resistance of infant mice to respiratory syncytial viral infection and secondary pneumococcal pneumonia[J]. Front Immunol, 2017, 8: 948. DOI: 10.3389/fimmu.2017.00948 |
| [29] | LI Q, BAO F X, ZHI D F, et al. Lipopolysaccharide induces SBD-1 expression via the P38 MAPK signaling pathway in ovine oviduct epithelial cells[J]. Lipids Health Dis, 2016, 15: 127. DOI: 10.1186/s12944-016-0294-4 |



