2. 山西农业大学生命科学学院, 太谷 030801
2. College of Life Sciences, Shanxi Agricultural University, Taigu 030801, China
牛属于单胎动物,在每个发情周期中,只有一个卵泡发育成熟并最终排卵[1],卵泡的生长发育与排卵在牛繁殖过程中起重要作用。在牛卵泡发育过程中,会受到多种因素的影响,激素类物质如促卵泡素FSH会启动牛卵泡发育波[2]、促黄体素LH则在卵泡成熟排卵及黄体形成时发挥作用[3];生长因子与细胞因子也在牛卵泡发育过程中起重要作用,如胰岛素样生长因子IGFs会促进卵泡颗粒细胞(granulosa cells, GCs)与内膜细胞增殖与分化,促进GCs分泌E2[4];此外,一些重要的基因与蛋白(如CART等)也会在牛卵泡发育过程中起重要作用[5]。本课题组前期以母牛为研究对象,利用高通量深度测序技术筛选出10个与牛卵泡发育相关的基因,其中PRSS35在转录组(PDF1和ODF1)的差异表达倍数为2.4,推测PRSS35可能与牛卵泡发育密切相关[6]。研究表明,PRSS35特异性表达于小鼠卵巢,并在小鼠卵泡发育和排卵过程,以及黄体形成与退化中表达量上调,推测其可能会促进卵泡发育并诱导排卵[7-10]。功能研究表明,PRSS35可能与卵母细胞受精潜力[11]、人唇腭裂[12]、肾纤维化[13]相关。目前有关PRSS35的研究主要集中于模式动物小鼠与人上,在牛上未见报道,根据基因在物种之间的保守性,推测其在牛上具有相同效果。本研究通过实时荧光定量PCR(qRT-PCR)和Western blotting试验分别从mRNA和蛋白水平对PRSS35在牛卵泡GCs的表达进行定量研究,通过免疫组织化学试验对PRSS35蛋白在牛卵泡中的表达进行定位分析;应用基因沉默技术合成siRNA并转染GCs,通过qRT-PCR和细胞凋亡检测等观察PRSS35对GCs增殖的影响,初步探明PRSS35与牛卵泡发育的关系,为进一步揭示PRSS35及其家族蛋白在牛卵泡发育过程中的作用奠定理论基础。
1 材料与方法 1.1 试验动物及样品采集选取18月龄正常发情的海福特母牛,PGF2α同期发情处理后,B超超声波监测(每12 h 1次)并记录卵泡大小变化,当其中一个卵泡直径增长率显著高于其它卵泡时,即出现优势卵泡(dominant follicle, DF),其它卵泡则为从属卵泡(subordinate follicles, SF)。屠宰并采集双侧卵巢,分离DF和SF。本试验3头牛的DF和SF用于总RNA提取,另3头牛的DF和SF用于总蛋白提取,1头牛的DF和SF用于免疫组织化学研究(以上材料均为课题组前期保存);细胞培养用GCs采自山西省文水县肉牛屠宰场。
1.2 试验方法 1.2.1 总RNA和总蛋白的提取将分离的DF和SF分别置于灭菌DPBS中,用手术剪将卵泡剪开,刮刀轻刮卵泡内壁并收集GCs。Trizol法提取总RNA,提取步骤按RNAiso Plus试剂盒说明书进行;将GCs分别置于液氮预冷的研钵中研磨后,PMSF以1:1 000比例制备RIPA裂解液提取总蛋白。测定总RNA和总蛋白浓度,-80 ℃保存备用。
1.2.2 RT-PCR按照RT-PCR kit说明书合成cDNA链。采用两步法,第1步:去除gDNA反应,建立10 μL反应体系:总RNA 1 μL,gDNA Eraser 1 μL,5×gDNA Eraser Buffer 2 μL,RNase Free dH2O定容至10 μL,充分混匀,置于PCR仪,42 ℃ 2 min;第2步:反转录反应,将EP管从PCR仪中取出,继续加入PrimeScript RT Enzyme Mix Ⅰ 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer Ⅱ 4 μL,RNase Free dH2O 4 μL,用手轻弹EP管使其混匀,置于PCR仪,37 ℃ 15 min,85 ℃ 5 s,4 ℃冰箱中保存备用。
1.2.3 qRT-PCR检测根据NCBI上公布的牛PRSS35 mRNA序列(NM_001035457.3)和内参基因RPLP0 mRNA序列(NM_001012682.1),使用Primer 5.0设计引物(表 1)。qRT-PCR引物跨越内含子,引物跨越内含子会避免基因组DNA的影响,从而提高试验的准确性。
|
|
表 1 qRT-PCR引物序列 Table 1 Primers of qRT PCR |
qRT-PCR反应体系20 μL,反应条件:95 ℃预变性30 s,95 ℃ 5 s,62 ℃ 30 s,72 ℃ 15 s,45个循环;熔解曲线分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。目的基因和内参基因均在同一反应条件下进行反应,反应结束后测定CT值。
1.2.4 免疫组织化学检测分离后的DF和SF置于4%多聚甲醛溶液中固定24 h,经脱水、浸蜡、包埋,制成6 μm厚的切片。按照SP Rabbit HRP Kit(DAB)说明书进行操作,二甲苯脱蜡后梯度酒精水化;试剂A(endogenous peroxydase enzymes blocking buffer)室温孵育10 min,PBS清洗;试剂B(normal goat serum for blocking)室温孵育10 min,PBS清洗;试验组滴加兔抗PRSS35(1:100稀释),对照组滴加PBS作为对照,湿盒4 ℃过夜孵育14 h;37 ℃恒温培养箱复温30 min,PBS清洗;试剂C(goat anti-rabbit IgG)室温孵育10 min,PBS清洗;试剂D(streptavidin-HRP)室温孵育10 min,PBS清洗;DAB显色10 min,蒸馏水冲洗;苏木精复染40 s,蒸馏水冲洗;梯度酒精脱水,二甲苯透明;中性树胶封片。利用Olympus光学显微镜观察并采集图像。
1.2.5 Western blotting检测根据SDS-PAGE Gel Kit说明书配置12%的分离胶和5%的浓缩胶,蛋白上样缓冲液与蛋白样品以1:4比例混合,95 ℃ 5 min蛋白变性后,上样至凝胶加样孔,上样量为20 μL。80 V 30 min浓缩胶电泳;120 V 50 min分离胶电泳。将目的条带所在的胶条进行割胶,与NC膜贴合,100 V 90 min,进行转膜电泳。5%封闭蛋白干粉封闭90 min。一抗4 ℃孵育过夜14 h,试验组PRSS35兔抗以1:1 000稀释,对照组一抗β-actin兔多克隆抗体以1:2 000稀释,TBST清洗10 min,重复3次;二抗室温孵育90 min,HRP-山羊抗兔IgG以1:3 000稀释,TBET清洗10 min,重复3次;NC膜涂发光液后凝胶成像系统进行曝光。
1.2.6 siRNA的设计与合成根据NCBI数据库已知的牛PRSS35基因序列(NM_001035457.3),按照siRNA设计原则[14],Invitrogen在线设计1对PRSS35基因的siRNA前体寡核苷酸序列,序列及阴性对照(siNC)由生工生物工程(上海)股份有限公司合成(表 2)。
|
|
表 2 siRNA前体寡核苷酸序列 Table 2 siRNA precursor oligonucleotide sequence |
卵泡GCs细胞培养液选择MEMα细胞培养液,配置方法:双抗(青霉素100 000 IU·L-1,链霉素0.1 g·L-1)、两性霉素B(1 mg·L-1)、HEPES(0.02 mol·L-1)、BSA(1 g·L-1)、NaHCO3(0.84 g·L-1)、NEAA(1.1 mg·L-1)、NaSeO3(40 μg·L-1)、转铁蛋白(5 mg·L-1)、雄烯二酮(10-6 mol·L-1)、牛胰岛素(10 ng·mL-1)、胰岛素样生长因子(1 ng·mL-1)、FSH(25 ng·mL-1),MEMα基础培养液填至50 mL,充分混匀,4 ℃备用。
1.2.8 卵泡GCs体外培养刮取GCs后,用细胞培养液重悬细胞并离心,弃上清;将GCs接种于10 cm无菌培养皿内,补足细胞培养液至10 mL,轻晃培养皿,37 ℃,5%CO2进行原代贴壁细胞培养。每48 h换一次培养液,当观察到细胞铺满培养皿,进行细胞传代。
1.2.9 siRNA转染卵泡颗粒细胞选择传代至3代或4代的牛卵泡GCs接种于24孔板进行培养,当细胞密度达到70%~90%时,参照Lipofectamine®3000说明书步骤进行转染。培养48 h后荧光显微镜检测。
1.2.10 PRSS35基因沉默效果检测培养48 h后,取出24孔细胞培养板,吸去部分GCs,无菌PBS清洗两次,分别添加300 μL Trizol提取总RNA;qRT-PCR检测沉默组(siPRSS35组)、阴性对照(siNC组)和空白对照组(Blank组)中PRSS35 mRNA的表达。
1.2.11 培养液E2浓度测定及细胞凋亡检测筛选PRSS35基因沉默效果检测合格的培养组,应用牛E2 Elisa kit对培养液进行E2浓度测定;TUNEL细胞凋亡检测试剂盒对凋亡细胞进行荧光染色,因细胞凋亡过程中细胞核DNA的非正常断裂,可被荧光染料染色,从而可通过荧光显微镜观察到凋亡的细胞。使用生物软件ImageJ对凋亡细胞与总细胞进行细胞计数,计算凋亡细胞占总细胞数的百分比即为凋亡细胞百分率。
1.3 数据分析qRT-PCR检测结果采用△△CT法计算各目的基因的相对表达量,各基因的相对表达水平=2-△△CT;各基因表达量经内参基因RPLP0校正,分别设定PRSS35基因在SF和siNC组的表达量作为对照组;所有结果均采用“平均值±标准差”表示,统计结果应用SPSS 17.0统计分析软件对数据进行单因素方差分析。
2 结果 2.1 总RNA凝胶电泳检测1%琼脂糖凝胶电泳检测(图 1),图 1中可清晰看出3条带,分别为28S RNA、18S RNA、5S RNA。总RNA的纯度比较高,且完整性好,可用于qRT-PCR试验。
|
图 1 总RNA琼脂糖凝胶电泳 Figure 1 Electrophoresis pattern of total RNA |
牛卵泡GCs qRT-PCR分析结果显示(图 2),PRSS35基因在牛DF中的表达量是SF的10.69倍(P<0.001)。
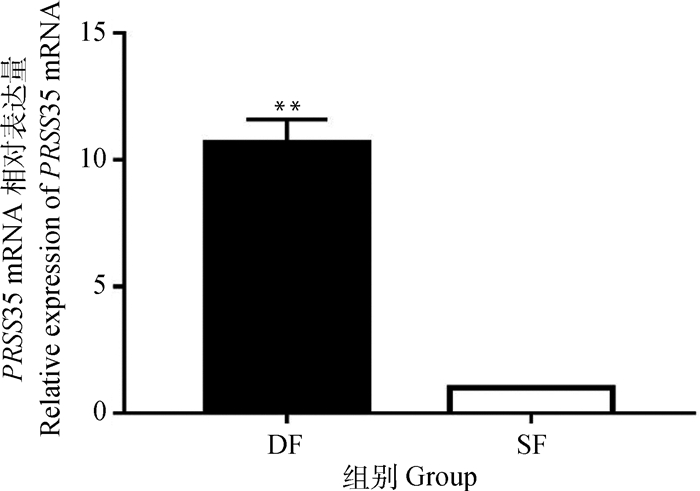
|
* *. P<0.001,下同 * *. P < 0.001, the same as below 图 2 PRSS35基因在牛DF和SF中的表达 Figure 2 qRT-PCR analysis of PRSS35 mRNA expression in bovine DF and SF |
Western blotting对PRSS35在牛DF与SF颗粒细胞中表达量进行对比分析,并与内参蛋白β-actin进行比较,从图 3A可见,PRSS35在DF中的条带较粗较浓;对蛋白印迹进行灰度值分析显示,PRSS35在DF中的表达量极显著高于SF(P<0.01)(图 3B),该结果与qRT-PCR对PRSS35 mRNA的分析结果相一致。
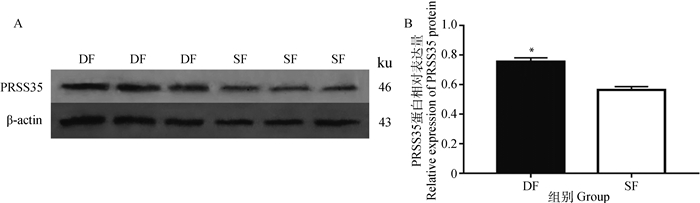
|
*. P<0.01,下同 *. P < 0.01, the same as below 图 3 PRSS35蛋白在牛DF与SF中的Western blotting检测(A)与灰度值分析(B) Figure 3 Western blotting bands (A) and grey value analysis (B) of PRSS35 protein in bovine DF and SF |
免疫组化分析表明,PRSS35在牛卵巢DF和SF均有表达(图 4A, B, C),对照组无特异性显色(图 4a, b, c);且PRSS35在牛卵巢DF和SF的颗粒层、膜细胞层均有表达。
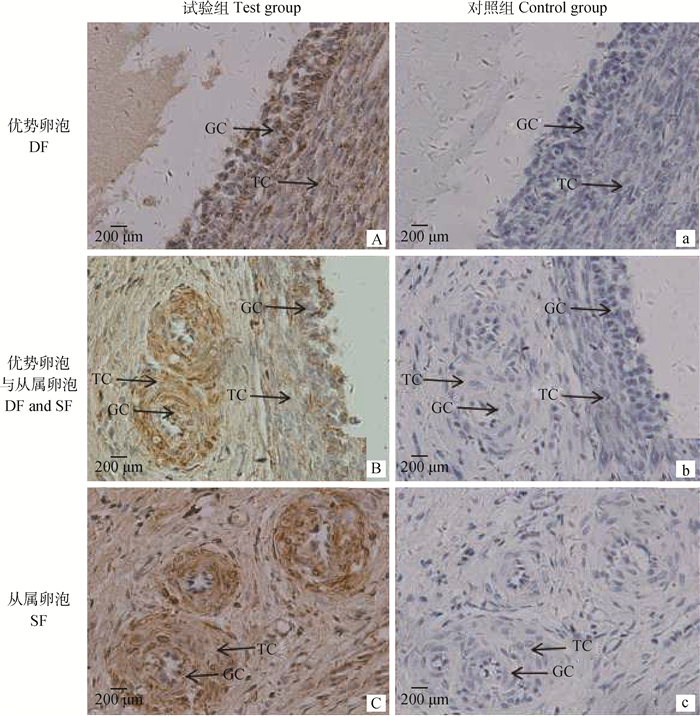
|
GC.颗粒层;TC.膜细胞层 GC.Granulosa cells; TC.Theca cells 图 4 卵巢组织PRSS35的表达(免疫组化, 400×) Figure 4 Expressions of PRSS35 in the ovary (immunohistochemistry, 400×) |
设计并合成的前体寡核苷酸序列siPRSS35和siNC带有绿色荧光标记,转染48 h,荧光显微镜检测表明,与对照组相比,可明显观察到绿色荧光(图 5)。

|
图 5 siPRSS35和siNC转染效果图(40×) Figure 5 Transfection effect of siPRSS35 and siNC(40×) |
利用qRT-PCR方法对转染siRNA 48 h后PRSS35基因在沉默组、阴性对照组(siNC)以及空白对照组中的表达量进行分析,结果显示,PRSS35基因在沉默组的表达量极显著低于阴性对照组和空白对照组(P<0.001),阴性对照组和空白对照组间无显著差异(图 6)。
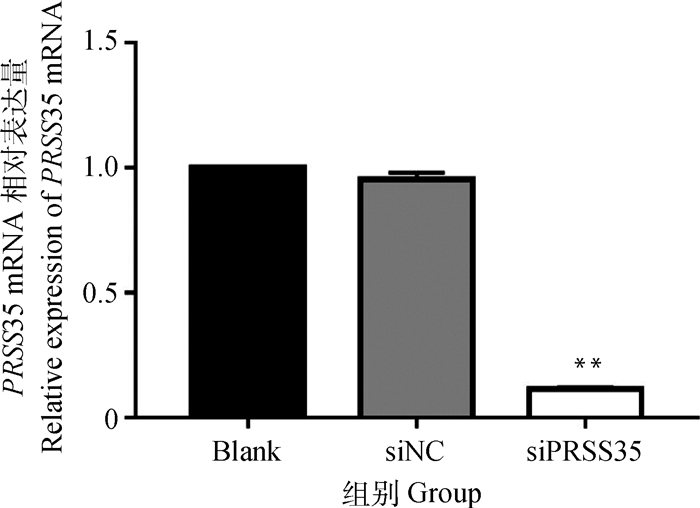
|
图 6 转染siRNA 48 h牛颗粒细胞PRSS35 mRNA的表达 Figure 6 Expression of PRSS35 mRNA at 48 h after siRNA transfection |
ELISA法检测培养液E2浓度结果表明,沉默组E2浓度极显著低于阴性对照组和空白对照组(P<0.01),阴性对照组和空白对照组间无显著差异(图 7)。
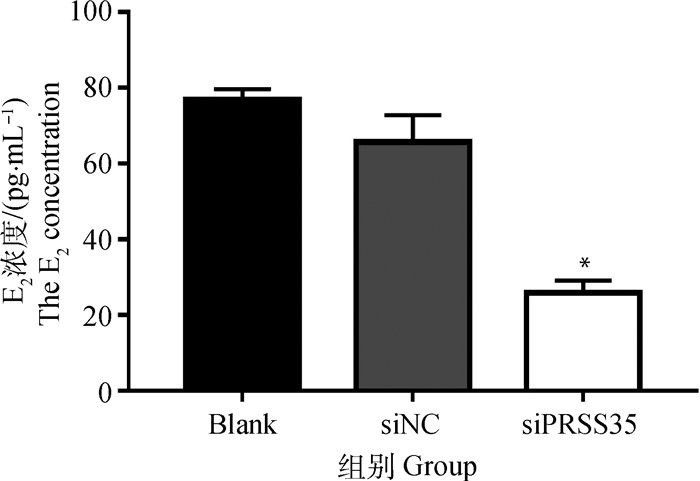
|
图 7 细胞培养液中E2浓度 Figure 7 The E2 concentration in cell culture media |
TUNEL细胞凋亡检测结果显示,空白对照组、阴性对照组细胞凋亡数明显低于沉默组(图 8);凋亡细胞百分率分析结果显示,沉默组凋亡细胞百分率极显著高于空白对照组和阴性对照组(P<0.001),空白对照组和阴性对照组间无显著差异(图 9)。
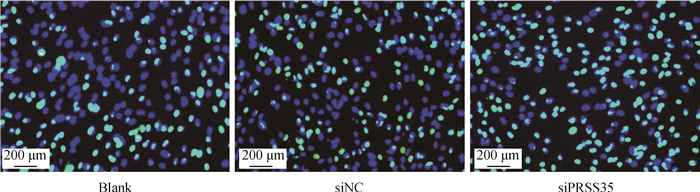
|
图 8 细胞凋亡检测情况(40×) Figure 8 Cell apoptosis detection(40×) |
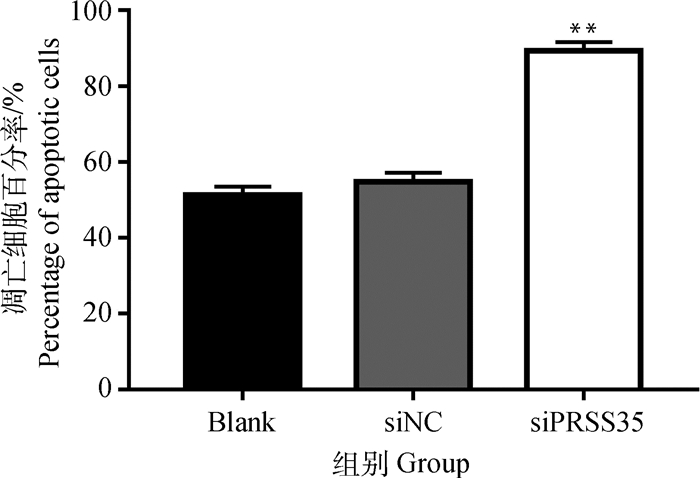
|
图 9 颗粒细胞凋亡率分析 Figure 9 Apoptosis rate analysis of GCs |
雌性哺乳动物生殖系统的独特之处在于每次发情周期都进行着快速、广泛的组织重构,其中卵泡生长、排卵以及黄体的形成与退化均受蛋白的严格调控[15-16]。牛卵泡生长发育过程会受到诸如激素类物质、生长因子与细胞因子以及一些重要基因与蛋白的调控[2-5]。PRSS35是丝氨酸蛋白酶家族成员之一,作为蛋白水解酶在生物体内发挥重要作用。PRSS35首次发现于小鼠卵巢[8],有研究显示,PRSS35在小鼠卵泡的发育、排卵过程以及黄体的形成与退化中发挥作用[7-8, 10]。
单胎动物牛在发情周期中,一般会出现2~3个卵泡波[17],当卵泡波发生偏差时,一个卵泡会被选择为DF继续生长,直到卵巢上发生黄体溶解,导致孕酮的分泌减少,随后的LH脉冲频率增加,出现一个LH峰,引起LH/FSH的激增,进而发生排卵反应[18],其余卵泡均为SF,则停止生长直至闭锁。本试验通过B超超声波确定并成功分离牛DF与SF,qRT-PCR和Western blotting结果显示,牛DF颗粒细胞中PRSS35在mRNA和蛋白水平表达均极显著高于SF(P<0.01);免疫组化结果显示PRSS35蛋白在牛卵泡的DF与SF颗粒层均有表达。GCs作为卵泡中对卵母细胞有营养作用与重要调节作用的细胞,其增殖与分化常作为卵泡发育的标志[19]。
本试验成功设计PRSS35 siRNA干扰序列,转染GCs,通过细胞培养液E2浓度测定与细胞凋亡计数来研究PRSS35的功能。E2的分泌能力是卵泡的一个重要特征[20],而E2由卵泡GCs分泌生成,GCs凋亡个数增多时,E2分泌能力会显著下降,卵泡闭锁的最主要原因是GCs的凋亡[21]。如果观察到一个发育卵泡中有10%以上的颗粒细胞发生细胞凋亡,表明该卵泡已经或正在闭锁,且卵泡一旦进入闭锁就不能再回到正常的发育轨道上。因此当E2分泌能力丧失时即发生卵泡闭锁[22]。Fortune[23]对牛发情周期内各卵泡E2的浓度大小进行了比较分析,发现在发情周期的第5天,DF卵泡液中E2浓度比第3天募集卵泡的浓度要高得多,而第5天的SF卵泡液中E2浓度与第3天的募集卵泡相似。当发生偏差,检测到DF略大于最大SF时,其卵泡液中的E2浓度更高,GCs会分泌更多的E2。DF是与SF相比具有更大的E2分泌能力[24]。因此DF中GCs会继续增殖分化,并通过E2的分泌来维持DF的继续生长发育,为最终的卵泡排卵提供生理基础;而SF中GCs会停止生长,细胞逐步凋亡,最终造成卵泡闭锁。细胞培养液中添加的FSH会促进卵泡GCs增殖与E2的分泌,FSH与GCs上受体结合,通过cAMP信号途径激活芳香化酶从而使得雄烯二酮转化为E2的能力增强。GCs上不光有FSH受体,也有胰岛素受体。在培养液中添加胰岛素可以增强FSH对芳香化酶的刺激作用,增加E2分泌量[25]。沉默PRSS35基因后,可观察到GCs凋亡个数与E2浓度的同步降低,说明PRSS35对GCs的增殖分化起促进作用,在牛卵泡发育过程中起促进作用。
4 结论PRSS35在牛DF和SF差异表达,PRSS35基因沉默后,通过抑制牛卵泡GCs增殖,降低卵泡E2分泌,从而调控牛卵泡的生长发育。
| [1] | STOCK A E, FORTUNE J E. Ovarian follicular dominance in cattle:relationship between prolonged growth of the ovulatory follicle and endocrine parameters[J]. Endocrinology, 1993, 132(3): 1108–1114. DOI: 10.1210/endo.132.3.8440173 |
| [2] | FRICKE P M, AL-HASSAN M J, ROBERTS A J, et al. Effect of gonadotropin treatment on size, number, and cell proliferation of antral follicles in cows[J]. Domest Anim Endocrinol, 1997, 14(3): 171–180. DOI: 10.1016/S0739-7240(97)00006-4 |
| [3] | SHELDON I M, NOAKES D E, RYCROFT A N, et al. Influence of uterine bacterial contamination after parturition on ovarian dominant follicle selection and follicle growth and function in cattle[J]. Reproduction, 2002, 123(6): 837–845. DOI: 10.1530/rep.0.1230837 |
| [4] | ARMSTRONG D G, GUTIERREZ C G, BAXTER G, et al. Expression of mRNA encoding IGF-Ⅰ, IGF-Ⅱ and type 1 IGF receptor in bovine ovarian follicles[J]. J Endocrinol, 2000, 165(1): 101–113. DOI: 10.1677/joe.0.1650101 |
| [5] | SEN A, BETTEGOWDA A, JIMENEZ-KRASSEL F, et al. Cocaine-and amphetamine-regulated transcript regulation of follicle-stimulating hormone signal transduction in bovine granulosa cells[J]. Endocrinology, 2007, 148(9): 4400–4410. DOI: 10.1210/en.2007-0332 |
| [6] |
李鹏飞, 孟金柱, 郝庆玲, 等. PDF2和ODF1转录组测序筛选牛卵泡发育相关基因[J]. 畜牧兽医学报, 2018, 49(2): 300–309.
LI P F, MENG J Z, HAO Q L, et al. Screening and analysing of genes associated with follicular development in bovine ODF1 and PDF2 transcriptome[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(2): 300–309. (in Chinese) |
| [7] | DIAO H L, XIAO S, LI R, et al. Distinct spatiotemporal expression of serine proteases prss23 and prss35 in periimplantation mouse uterus and dispensable function of prss35 in fertility[J]. PLoS One, 2013, 8(2): e56757. DOI: 10.1371/journal.pone.0056757 |
| [8] | MIYAKOSHI K, MURPHY M J, YEOMAN R R, et al. The identification of novel ovarian proteases through the use of genomic and bioinformatic methodologies[J]. Biol Reprod, 2006, 75(6): 823–835. DOI: 10.1095/biolreprod.106.052290 |
| [9] | GOES F S, HAMSHERE M L, SEIFUDDIN F, et al. Genome-wide association of mood-incongruent psychotic bipolar disorder[J]. Transl Psych, 2012, 2(10): e180. DOI: 10.1038/tp.2012.106 |
| [10] | WAHLBERG P, NYLANDER Å, AHLSKOG N, et al. Expression and localization of the serine proteases high-temperature requirement factor A1, Serine Protease 23, and Serine Protease 35 in the mouse ovary[J]. Endocrinology, 2008, 149(10): 5070–5077. DOI: 10.1210/en.2007-1736 |
| [11] | LI S H, LIN M H, HWU Y M, et al. Correlation of cumulus gene expression of GJA1, PRSS35, PTX3, and SERPINE2 with oocyte maturation, fertilization, and embryo development[J]. Reprod Biol Endocrinol, 2015, 13(1): 93. DOI: 10.1186/s12958-015-0091-3 |
| [12] | LETRA A, MENEZES R, FONSECA R F, et al. Novel cleft susceptibility genes in chromosome 6p[J]. J Dent Res, 2010, 89(9): 927–932. DOI: 10.1177/0022034510370004 |
| [13] | LEBLEU V S, TENG Y Q, O'CONNELL J T, et al. Identification of human epididymis protein-4 as a fibroblast-derived mediator of fibrosis[J]. Nat Med, 2013, 19(2): 227–231. DOI: 10.1038/nm.2989 |
| [14] | REYNOLDS A, LEAKE D, BOESE Q, et al. Rational siRNA design for RNA interference[J]. Nat Biotechnol, 2004, 22(3): 326–330. DOI: 10.1038/nbt936 |
| [15] | VELAZQUEZ M A, SPICER L J, WATHES D C. The role of endocrine insulin-like growth factor-Ⅰ (IGF-Ⅰ) in female bovine reproduction[J]. Domest Anim Endocrinol, 2008, 35(4): 325–342. DOI: 10.1016/j.domaniend.2008.07.002 |
| [16] | DROST M. Bubaline versus bovine reproduction[J]. Theriogenology, 2007, 68(3): 447–449. DOI: 10.1016/j.theriogenology.2007.04.012 |
| [17] | SUNDERLAND S J, CROWE M A, BOLAND M P, et al. Selection, dominance and atresia of follicles during the oestrous cycle of heifers[J]. J Reprod Fertil, 1994, 101(3): 547–555. DOI: 10.1530/jrf.0.1010547 |
| [18] | MANABE N, GOTO Y, MATSUDA-MINEHATA F, et al. Regulation mechanism of selective atresia in porcine follicles:regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50(5): 493–514. DOI: 10.1262/jrd.50.493 |
| [19] | GINTHER O J. Selection of the dominant follicle in cattle and horses[J]. Anim Reprod Sci, 2000, 60-61: 61–79. DOI: 10.1016/S0378-4320(00)00083-X |
| [20] | KOBAYASHI Y, JIMENEZ-KRASSEL F, IRELAND J J, et al. Evidence of a local negative role for cocaine and amphetamine regulated transcript (CART), inhibins and low molecular weight insulin like growth factor binding proteins in regulation of granulosa cell estradiol production during follicular waves in cattle[J]. Reprod Biol Endocrinol, 2006, 4: 22. DOI: 10.1186/1477-7827-4-22 |
| [21] | GINTHER O J, KOT K, KULICK L J, et al. Sampling follicular fluid without altering follicular status in cattle:oestradiol concentrations early in a follicular wave[J]. J Reprod Fertil, 1997, 109(2): 181–186. DOI: 10.1530/jrf.0.1090181 |
| [22] | SARTORI R, FRICKE P M, FERREIRA J C, et al. Follicular deviation and acquisition of ovulatory capacity in bovine follicles[J]. Biol Reprod, 2001, 65(5): 1403–1409. DOI: 10.1095/biolreprod65.5.1403 |
| [23] | FORTUNE J E. Ovarian follicular growth and development in mammals[J]. Biol Reprod, 1994, 50(2): 225–232. DOI: 10.1095/biolreprod50.2.225 |
| [24] | SHIMIZU T, KOSAKA N, MURAYAMA C, et al. Apelin and APJ receptor expression in granulosa and theca cells during different stages of follicular development in the bovine ovary:involvement of apoptosis and hormonal regulation[J]. Anim Reprod Sci, 2009, 116(1-2): 28–37. DOI: 10.1016/j.anireprosci.2009.01.009 |
| [25] |
李鹏飞, 孟金柱, 郝庆玲, 等. 胰岛素和FSH对体外培养猪卵泡颗粒细胞雌激素的影响[J]. 畜牧兽医学报, 2017, 48(11): 2084–2090.
LI P F, MENG J Z, HAO Q L, et al. Effects of insulin and FSH on E2 production of pig ovarian follicular granulosa cells in vitro culture[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(11): 2084–2090. (in Chinese) |



