2. 甘肃农业大学动物科技学院, 兰州 730050
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730050, China
骨骼肌约占躯体重量的40%,具有维持机体能量需求、保持姿势和保护软组织等功能。骨骼肌正常发育是动物维持正常生命活动与代谢的先决条件,任何非正常发育都会导致疾病发生,如肌营养不良、肌萎缩、肌肉肥大等,极大地降低动物的生产性能。了解骨骼肌生长发育相关的转录因子、表观遗传因子以及相关信号通路,可为更好地预防、治疗肌肉疾病和提高畜牧业经济效益奠定基础。骨骼肌的生长发育是一个长期且复杂的生理过程,可将其大体分为4个阶段,主要包括位于生皮肌节中的生肌前体细胞增殖,成肌细胞形成、增殖、分化和融合生成肌管,肌纤维和肌肉组织的形成[1]。骨骼肌的发育离不开众多因子的精准调控,许多与细胞增殖、分化、再生、迁移和凋亡相关基因相互作用,形成一个复杂而精确的调控网络来维持骨骼肌正常的形态以及收缩功能。以往研究表明,miRNAs作为重要的调控因子在骨骼肌发育、肌纤维形态和结构的维持以及肌细胞生存等生物学过程中发挥重要作用[2]。
miRNAs是一类长度为18~22 nt的非编码小RNA,其通过与靶mRNA 3′ UTR碱基互补配对调控靶基因的表达,进而发挥其功能[3-4]。目前,大量报道表明,miRNAs参与调控成肌细胞的增殖与分化。miR-98通过直接对E2F5(转录抑制因子)的调控参与到骨骼肌细胞的分化过程[5]。miR-374b可以直接靶向MYF6,抑制C2C12细胞的分化。miR-140-3p通过抑制myomaker的表达,抑制成肌细胞融合与分化[6]。miR-151-3p通过抑制ATP2a2表达来调控慢肌基因的表达[7]。miR-30-5p可以靶向MBNL调控肌肉分化[8]。miR-128靶向MSTN(肌生成抑制素),促进肌细胞增殖,抑制其分化[9]。越来越多的研究表明,miR-487b-3p参与多种生命活动的调控。研究发现,miR-487b-3p作为抑癌基因抑制多种肿瘤增殖、迁移和侵袭[10-11]。近年来也有研究表明,miR-487b-3p抑制C2C12成肌细胞的分化[12]。但miR-487b-3p影响骨骼肌发育的具体机制却少有报道。因此,本试验通过在小鼠C2C12成肌细胞中过表达和抑制miR-487b-3p,探究miR-487b-3p对细胞增殖与分化的调控作用。
Wnt信号通路是参与肌肉发育的一个重要通路,PITX2作为Wnt信号通路上的一个转录因子,广泛参与生物体的早期发育进程[13-14]。有研究表明,PITX2是眼外肌生成的激活剂,参与调控眼肌发育[15-16]。Kumar和Moses[17]研究发现,PITX2参与细胞定型与特化过程,对生物体的遗传发育具有重要作用,还有大量研究表明,PITX2在多种组织器官的形成中发挥重要作用[18-20],推测其可能参与骨骼肌生长发育的调控。Lozano-Velasco等[14]研究表明,PITX2可通过下调miR-15b、miR-23b、miR-106b、miR-503促进成肌细胞增殖,PITX2-微小RNA(miRNA)途径还可以促进早期活化的卫星细胞增殖,增强MYF5基因的表达,促进卫星细胞定向分化为生肌细胞。MYOD基因是控制骨骼肌发生的核心调节网络的一部分,并且是肌细胞命运的基本决定因素,PITX2通过与MYOD核心增强子的直接结合激活肢体肌肉前体细胞中的MYOD基因[21]。综上推测PITX2参与肌肉发育的调控。
本研究利用生物信息学软件预测miR-487b-3p与PITX2的靶标关系,通过双荧光素酶报告系统来验证这种关系。探究miR-487b-3p在小鼠C2C12成肌细胞增殖和分化中的作用及可能的分子机制,为后期家畜肌肉发育机理研究和产肉性能的改良提供理论依据。
1 材料与方法 1.1 主要材料与试剂C2C12成肌细胞系购自中国科学院上海细胞库;Dual-Luciferase Reporter Gene Assay Kit双荧光素酶检测试剂盒购自Biovision公司(美国);DMEM高糖培养基、胎牛血清(FBS)、胰酶、青/链霉素双抗均购自美国Gibco公司;miRNA mimics、inhibitor、negative control、inhibitor negative control均购自上海吉玛制药技术有限公司;LipofectamineTM 3000转染试剂购自Invitrogen公司;miRNeasy Mini Kit总RNA提取试剂盒购自德国Qiagen公司;反转录试剂盒、荧光定量试剂盒均购自TaKaRa大连宝生物公司;CCK-8、BCA蛋白浓度测定试剂盒(增强型)购自碧云天生物技术有限公司;一抗PCNA、一抗MYOD、一抗MYOG、一抗MYHC、一抗β-actin和二抗均购自美国Abcam公司。
1.2 小鼠miR-487b-3p靶基因预测利用miRNA靶基因预测软件TargetScan(http://www.targetscan.org/vert_71/)和miRDB(http://www.mirdb.org/)对miR-487b-3p的靶基因进行预测,查阅大量相关文献后,筛选出与肌肉发育相关的靶基因PITX2。
1.3 构建小鼠miR-487b-3p靶基因的突变型与野生型载体本研究选择pmirGLO Vector(Promega)作为载体骨架,其载体结构见图 1。构建重组载体时,首先得到靶基因PITX2与miR-487b-3p的结合位点,并获取包括结合位点在内的70 bp的PITX2 3′ UTR,此序列为野生型序列,而突变序列是把预测可能结合的位点突变成它的反向互补序列,具体信息见图 2。碱基合成后直接将其连入载体质粒中,通过测序以验证序列的准确性。
|
图 1 pmirGLO载体图 Figure 1 Map of pmirGLO vector |
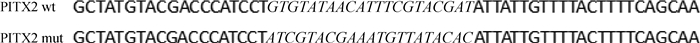
|
斜体部分为小鼠PITX2 3′ UTR突变型与野生型载体的差异碱基序列 Italic parts represent the different sequences between wild-type(WT) and mutant-type(MT) vectors of mouse PITX2 3′ UTR(mut) 图 2 PITX2 3′ UTR野生型与突变型载体序列信息 Figure 2 The sequence information of wild-type and mutant-type vectors of PITX2 3′ UTR |
将小鼠C2C12细胞从液氮中取出,迅速置于37 ℃水浴中使其快速融化,1 000 r·min-1离心5 min,弃上清。用完全培养基(10% FBS和90% DMEM)重悬细胞悬液至适当接种浓度,放入37 ℃ 5% CO2培养箱内培养。分别在培养12、24、36和48 h观察细胞生长状态并拍照,同时提取各时间点细胞总RNA。
当C2C12细胞生长至90%以上汇合度时,采用血清撤离方法诱导C2C12细胞成肌分化。弃去培养基,用PBS清洗细胞1次,加入分化培养基(2%马血清和98% DMEM),记为D0天,每天更换1次培养基,在分化培养的D0、D1、D3、D5、D7分别收取细胞,用于荧光定量PCR检测不同分化阶段miR-487b-3p及相关基因的表达趋势。
1.5 小鼠C2C12细胞转染及双荧光素酶活性分析 1.5.1 miR-487b-3p mimics(inhibitor)单转染转染前1 d取生长旺盛的C2C12细胞,经清洗、胰酶消化和离心后,显微镜下细胞计数,传代于6孔板(5×104)或96孔板(2×103)中,轻轻晃动板子,使细胞均匀分布。待细胞长至70%左右密度时,将培养基更换为OPTI-DMEM(无血清培养基),饥饿细胞4 h,然后将miR-487b-3p mimics(M)、miR-487b-3p inhibitor(I)、Mimics Negative Control(MNC)、Inhibitor Negative Control(INC)与OPTI-DMEM混合,lip 3000与OPTI-DMEM混合,静置5 min,将两者轻轻混匀后室温静置20 min,逐滴加入培养基使mimics或MNC(inhibitor或INC)转染终浓度为50 nmol·L-1(100 nmol·L-1)。
1.5.2 载体pmir-PITX2与miR-487b-3p mimics共转染将C2C12细胞接种至24孔板,待细胞密度达70%左右。利用lip 3000将miR-487b-3p mimics和双荧光素酶报告载体共转染C2C12细胞,转染12 h后更换为完全培养基(10% FBS+90% DMEM),继续培养48 h后收细胞。将转染试验分为4个组:miR-487b-3p mimics+pmir-PITX2-3′ UTR-WT;MNC+pmir-PITX2-3′ UTR-WT;miR-487b-3p mimics+pmir-PITX2-3′ UTR-MT;MNC+pmir-PITX2-3′ UTR-MT。
1.5.3 双荧光素酶活性检测按照Dual-Luciferase Reporter Gene Assay Kit(Biovision)说明书向每孔中加入适量细胞裂解液,室温孵育10 min;10 000 g离心5 min,取上清作为待测液;取100 μL待测液加入96孔发光板中,加入100 μL萤火虫荧光素酶检测工作液,吹吸混匀;放入化学发光仪(中生北控BK-L96C)测定发光值,积分时间5 s,得到萤火虫荧光素酶活性值;加入海肾荧光素酶检测工作液100 μL,吹打混匀,上机测定发光值,积分时间5 s,得到海肾荧光素酶活性值。
1.6 CCK-8法检测小鼠C2C12细胞增殖情况将处于对数生长期的C2C12成肌细胞均匀接种到96孔板中,每个处理6个重复,并在4个空孔中加入等量培养基作为空白对照。在转染后12、24、36、48、72 h分别从培养箱中取出一个96孔板,每孔加入10 μL CCK-8溶液(尽量不要产生气泡,否则影响OD值读数),孵育1~2 h后用酶标仪检测450 nm处的OD值,并绘制细胞生长曲线。
1.7 qRT-PCR检测小鼠miR-487b-3p和相关目的基因的表达 1.7.1 小鼠miR-487b-3p和相关目的基因扩增引物的设计根据miRBase数据库获得小鼠miR-487b-3p成熟序列,设计miR-487b-3p特异性荧光定量引物;登录NCBI数据库获得目的基因mRNA序列,利用Primer Premier 5.0设计跨内含子的特异性荧光定量引物。引物序列见表 1,由苏州泓迅生物科技有限公司合成。
|
|
表 1 qRT-PCR引物序列 Table 1 The sequences of qRT-PCR primers |
根据miRNeasy Mini Kit(Qiagen)说明书提取细胞总RNA。NanoDrop 2000微量分光光度计检测总RNA的完整性和纯度,琼脂糖凝胶电泳检测总RNA完整性。参照反转录试剂盒进行miRNA和mRNA反转录,并将得到的cDNA产物作为qRT-PCR的模板,检测miR-487b-3p和目的基因的表达情况。
1.8 蛋白免疫印迹检测相关蛋白的表达将C2C12细胞培养板(6孔板)从培养箱中取出,PBS清洗2次,加入适量含1% PMSF的RIPA裂解液(碧云天),冰上放置30 min,转移到1.5 mL离心管中,12 000 g,4 ℃离心15 min,小心吸取上清,分装后-80 ℃保存。根据目的蛋白的大小配制相应浓度分离胶,浓缩胶浓度一般为5%。取出蛋白溶液置于冰上解冻,采用BCA蛋白定量试剂盒(碧云天)测定蛋白浓度,随后调整至同一浓度。加入5×SDS上样缓冲液,封口膜封好后100 ℃煮沸10 min,冷却后加入到胶孔中,在80 V恒压下缓慢电泳至浓缩胶与分离胶界面,然后120 V恒压电泳至溴酚蓝跑至胶底部,开始转膜。转膜前PVDF膜置于甲醇中浸泡活化2 min,海绵和滤纸置于转膜缓冲液中备用。根据目的蛋白大小进行切胶,并按照海绵、滤纸、胶、PVDF膜、滤纸和海绵的三明治紧密排列顺序恒流转膜。转膜结束后,取出PVDF膜,并将其放入5% BSA中,室温封闭1~2 h(根据抗体而定)。随后将PVDF膜放入一定配比的一抗孵育液中,4 ℃过夜。TBST摇动洗膜3次,每次10 min。加入HRP标记二抗孵育液,室温放置60 min。倒掉二抗,TBST摇动洗膜3次,每次10 min。膜上滴加ECL显影液,待膜表面全部被显影液覆盖,置于FluorChem R多功能成像分析系统中曝光并拍照。
1.9 数据统计与分析采用相对定量的方法,分别以U6和GAPDH为内参,用2-△△Ct法计算miR-487b-3p和相关基因mRNA的相对表达量。双荧光素酶活性采用萤火虫荧光素酶活性/海肾荧光素酶活性比值计算。所有数据至少重复3次,以SPSS 21.0软件中双尾t检验进行统计学分析,结果以“平均值±标准误”表示。P<0.05为显著水平。采用数据分析软件GraphPad Prism 5.0作图。
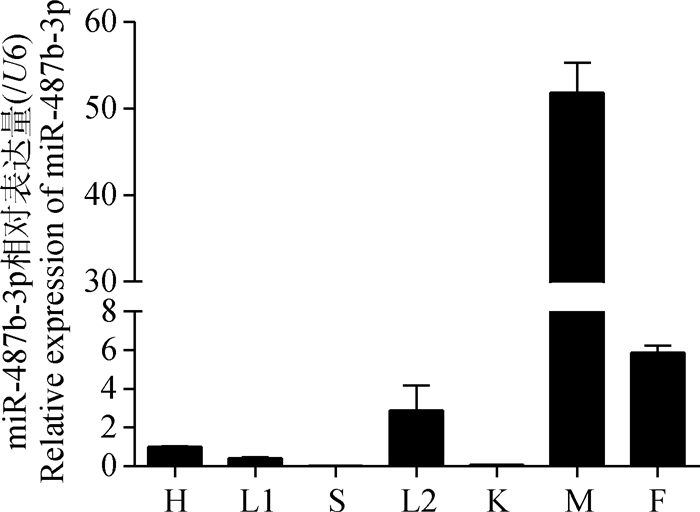
2 结果 2.1 miR-487b-3p小鼠组织表达谱检测qRT-PCR检测miR-487b-3p在小鼠各组织中的表达情况,如图 3所示,miR-487b-3p在小鼠各个组织中广泛表达,骨骼肌中相对表达最高,其次是脂肪。推测miR-487b-3p在小鼠骨骼肌中发挥重要作用。
|
H.心;L1.肝;S.脾;L2.肺;K.肾;M.骨骼肌;F.脂肪 H. Heart; L1. Liver; S. Spleen; L2. Lung; K. Kidney; M. Skeletal muscle; F. Fat 图 3 miR-487b-3p在小鼠不同组织中的表达 Figure 3 Expression of miR-487b-3p in mouse different tissues |
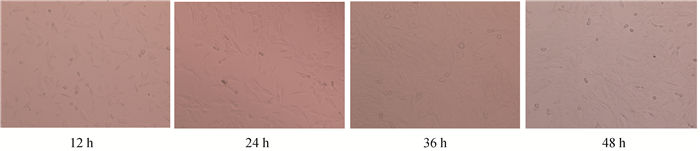
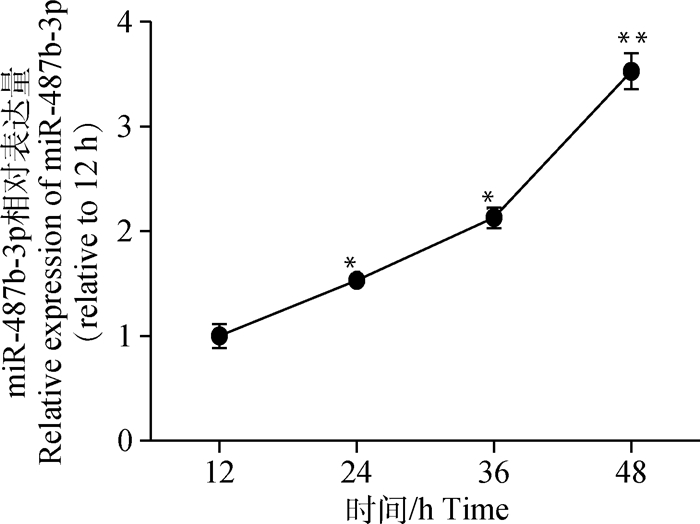
显微镜下观察同一区域C2C12细胞在增殖不同时间点的形态学变化。如图 4所示,在C2C12细胞增殖过程中,细胞数量明显增加,增殖48 h后,细胞出现融合趋势。qRT-PCR检测分析后发现(图 5),随着C2C12细胞生长时间增加,miR-487b-3p表达量均逐渐升高。与12 h相比,miR-487b-3p在48 h表达量极显著上升(P<0.01)。
|
图 4 C2C12成肌细胞在增殖过程中的形态变化(100×) Figure 4 Morphological changes of C2C12 myoblasts during proliferation(100×) |
|
*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同 * indicate significant difference(P < 0.05), ** indicate extremely significant difference(P < 0.01).The same as follows 图 5 miR-487b-3p在C2C12成肌细胞增殖过程中的时序表达 Figure 5 Expression of miR-487b-3p during C2C12 myoblasts proliferation |
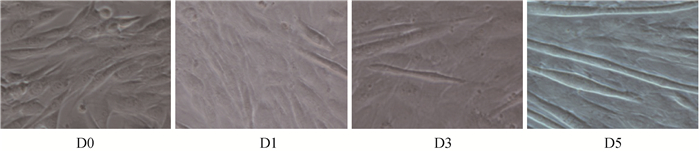
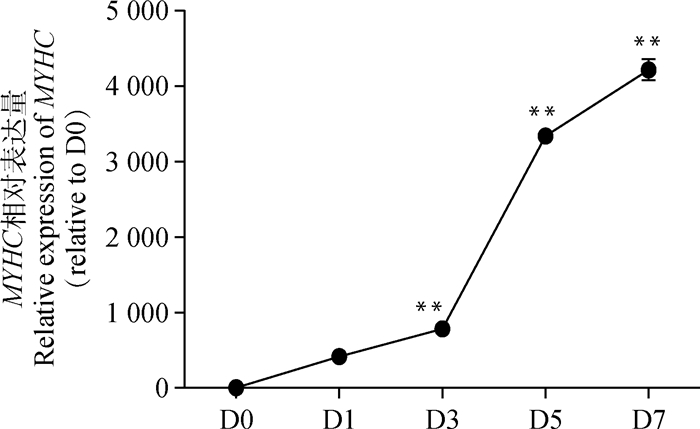
C2C12细胞在分化不同时间点的细胞形态学变化如图 6所示。随着诱导天数的不断增加,肌管形成越来越明显。诱导分化1 d后,细胞开始纵向分布,有少数细胞出现融合现象;3 d后出现较多的多核肌管,单核细胞变少;5 d后肌管变粗变长,分化明显。qRT-PCR检测结果显示(图 7),随着诱导时间延长,MYHC表达量呈上升趋势。与D0相比,MYHC mRNA表达量在D3、D5和D7均极显著升高(P<0.01)。以上结果显示,体外成功诱导小鼠C2C12成肌细胞分化。
|
图 6 C2C12成肌细胞在分化过程中的形态变化(400×) Figure 6 Morphological changes of C2C12 myoblasts during differentiation(400×) |
|
图 7 C2C12细胞分化状态下MYHC的表达趋势 Figure 7 Expression of MYHC during C2C12 myoblasts differentiation |
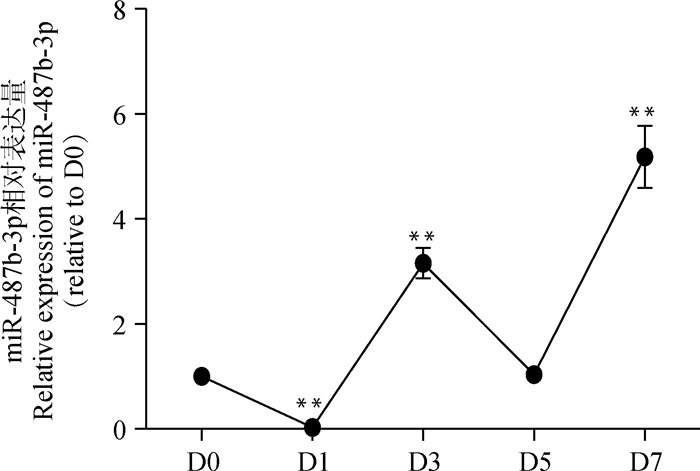
利用qRT-PCR检测miR-487b-3p在分化D0、D1、D3、D5和D7的表达模式。qRT-PCR结果显示(图 8),随着分化的进程,miR-487b-3p在C2C12细胞中的表达呈现上升趋势。与D0相比,C2C12细胞在D7中miR-487b-3p的表达量极显著上升(P<0.01),推测miR-487b-3p对C2C12成肌细胞的分化可能具有重要调控作用。
|
图 8 miR-487b-3p在C2C12细胞分化过程中的表达 Figure 8 Expression of miR-487b-3p during C2C12 myoblasts differentiation |
转染miR-487b-3p mimics(inhibitor)12 h后,更换为10% FBS的完全培养基,24 h后收集细胞提取总RNA,qRT-PCR检测转染效率,如图 9所示,与对照组相比,转染mimics组miR-487b-3p的表达量极显著上升(P<0.01),而inhibitor组miR-487b-3p的表达量极显著降低(P<0.01),表明细胞转染成功。
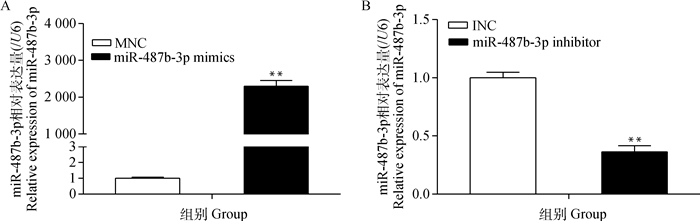
|
图 9 转染效率的检测 Figure 9 The detection of transfection efficiency |
转染miR-487b-3p mimics(inhibitor)12 h后,更换为10% FBS的完全培养基,此时记为0 h,36 h后收集细胞提取总RNA和总蛋白,检测增殖标志基因PCNA的表达变化。如图 10~12所示,与对照组相比,过表达miR-487b-3p组细胞PCNA在mRNA和蛋白水平均极显著上升(P<0.01);而抑制miR-487b-3p使PCNA在mRNA(P<0.05)和蛋白(P<0.01)水平显著降低。CCK-8结果显示(图 13),与对照相比,miR-487b-3p mimics处理48 h后显著促进细胞生长,miR-487b-3p mimics组细胞在450 nm处的OD值极显著增加(P<0.01);与对照相比,转染miR-487b-3p inhibitor组细胞在培养36 h后生长受到抑制,且随着时间延长,抑制作用显著(P<0.05)。综上可知,过表达miR-487b-3p促进C2C12细胞增殖。
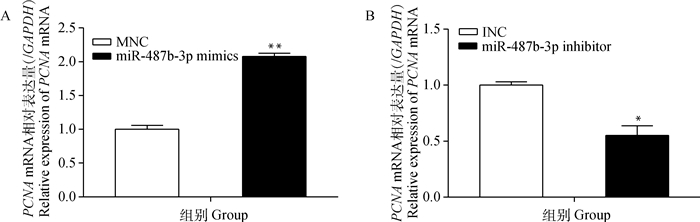
|
图 10 转染miR-487b-3p mimics、inhibitor后C2C12细胞中PCNA的表达情况 Figure 10 Expression of PCNA in C2C12 cells transfected with miR-487b-3p mimics, inhibitor |

|
A.转染miR-487b-3p mimics后,C2C12细胞中PCNA蛋白Western blotting检测;B.转染miR-487b-3p mimics后,C2C12细胞中PCNA蛋白相对表达量检测 A shows the Western blotting analysis of PCNA protein in C2C12 cells transfected with miR-487b-3p mimics; B shows the expression level of PCNA protein detected by Western blotting after miR-487b-3p mimics transfecting into C2C12 cells 图 11 转染miR-487b-3p mimics后C2C12细胞中PCNA蛋白表达检测 Figure 11 Western blotting analysis of PCNA in C2C12 cells transfected with miR-487b-3p mimics |
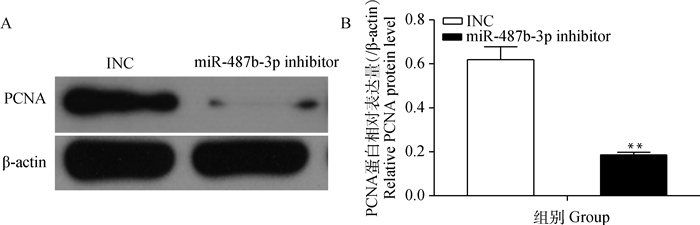
|
A.转染miR-487b-3p inhibitor后,C2C12细胞中PCNA蛋白Western blotting检测;B.转染miR-487b-3p inhibitor后,C2C12细胞中PCNA蛋白相对表达量检测 A shows the Western blotting analysis of PCNA protein in C2C12 cells transfected with miR-487b-3p inhibitor; B shows the expression level of PCNA protein detected by Western blotting after miR-487b-3p inhibitor transfecting into C2C12 cells 图 12 转染miR-487b-3p inhibitor后C2C12细胞中PCNA蛋白表达检测 Figure 12 Western blotting analysis of PCNA in C2C12 cells transfected with miR-487b-3p inhibitor |
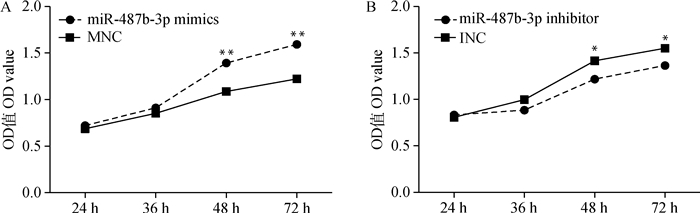
|
图 13 CCK-8检测miR-487b-3p mimics、inhibitor对C2C12细胞增殖的影响 Figure 13 Effect of miR-487b-3p mimics, inhibitor on C2C12 cells proliferation by CCK-8 test |
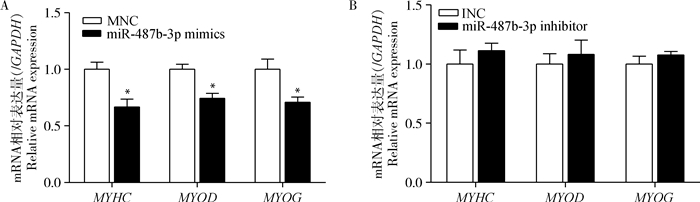
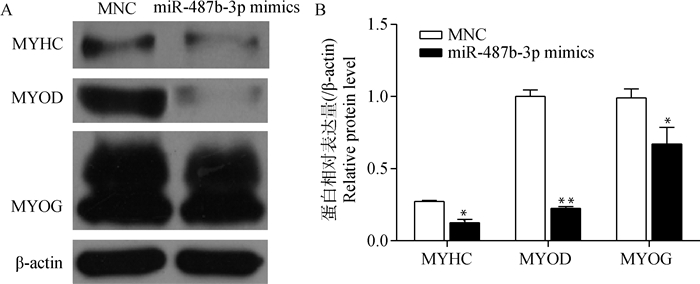
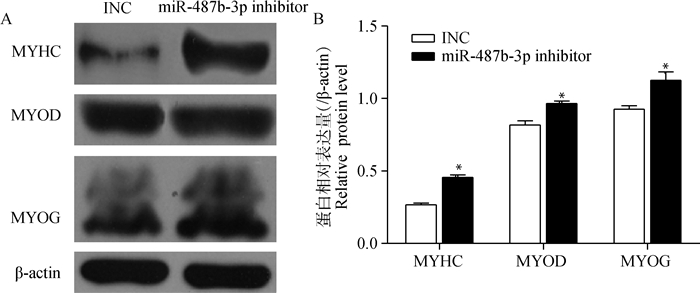
转染miR-487b-3p mimics(inhibitor)12 h后,更换为生长培养基(10% FBS,90% DMEM)培养24 h,细胞密度达到90%左右时,更换分化培养基(2%马血清,98% DMEM),此时记为0 h,96 h后收集细胞提取总RNA和总蛋白,检测分化标志基因MYHC、MYOD和MYOG的表达变化。qRT-PCR检测结果如图 14所示,过表达miR-487b-3p后,MYOD、MYHC和MYOG在转录水平的表达量均显著下降(P<0.05);抑制miR-487b-3p后,MYOD、MYHC和MYOG mRNA的表达量增加,但未达到显著水平(P>0.05)。Western blotting检测结果显示(图 15~16),过表达miR-487b-3p组显著抑制MYHC(P<0.05)、MYOD(P<0.01)、MYOG(P<0.05)蛋白表达;而抑制miR-487b-3p组显著增加MYOD、MYHC和MYOG蛋白表达量(P<0.05)。
|
图 14 转染miR-487b-3p mimics、inhibitor后C2C12细胞中分化标记基因的表达情况 Figure 14 Expression of differentiation marker genes in C2C12 cells transfected with miR-487b-3p mimics, inhibitor |
|
A.转染miR-487b-3p mimics后,C2C12细胞中分化相关蛋白Western blotting检测;B.转染miR-487b-3p mimics后,C2C12细胞中分化相关蛋白相对表达量检测 A shows the Western blotting analysis of differentiation-related proteins in C2C12 cells transfected with miR-487b-3p mimics; B shows the expression levels of differentiation-related proteins detected by Western blotting after miR-487b-3p mimics transfecting into C2C12 cells 图 15 转染miR-487b-3p mimics后C2C12细胞中分化相关蛋白的表达情况 Figure 15 Expression of differentiation-related proteins in C2C12 cells transfected with miR-487b-3p mimics |
|
A.转染miR-487b-3p inhibitor后,C2C12细胞中分化相关蛋白Western blotting检测;B.转染miR-487b-3p inhibitor后,C2C12细胞中分化相关蛋白相对表达量检测 A shows the Western blotting analysis of differentiation-related proteins in C2C12 cells transfected with miR-487b-3p inhibitor; B shows the expression levels of differentiation-related proteins detected by Western blotting after miR-487b-3p inhibitor transfecting into C2C12 cells 图 16 转染miR-487b-3p inhibitor后C2C12细胞中分化相关蛋白的表达情况 Figure 16 Expression of differentiation-related proteins in C2C12 cells transfected with miR-487b-3p inhibitor |
运用生物信息学软件预测小鼠miR-487b-3p的靶基因,结果显示,配对样同源域转录因子2(paired-like homeodomain transcription factor 2,PITX2)基因的3′ UTR有miR-487b-3p的结合位点(图 17)。前期研究表明,PITX2作为Wnt信号通路中的调控因子,在多种组织器官的形成中发挥重要作用[18-20],因此推测,PITX2有可能参与肌肉发育的调控。

|
图 17 miR-487b-3p与PITX2 3′ UTR的结合位点 Figure 17 The binding site of miR-487b-3p to PITX2 3′ UTR |
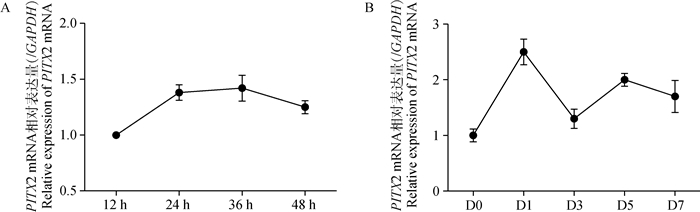
为了确定miR-487b-3p与PITX2之间的关系,利用qRT-PCR初步验证miRNAs与预测的靶基因的表达量是否存在负相关。如图 18所示,在C2C12细胞增殖阶段,PITX2的表达量处于一个较稳定的水平,而在分化阶段,PITX2表达量起伏较明显,整体呈现下降趋势。
|
A.PITX2在C2C12细胞增殖阶段的表达;B. PITX2在C2C12细胞分化阶段的表达 A. Expression of PITX2 during C2C12 cells proliferation; B. Expression of PITX2 during C2C12 cells differentiation 图 18 PITX2在C2C12成肌细胞增殖及分化过程中的表达模式 Figure 18 Expression patterns of PITX2 during the proliferation and differentiation of C2C12 myoblasts |
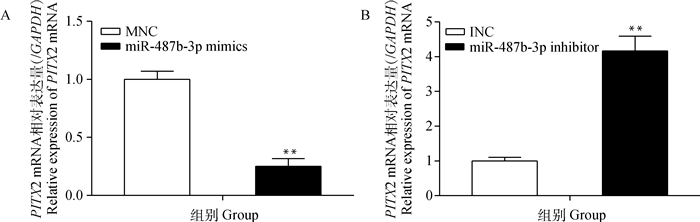
如图 19所示,与MNC相比,过表达miR-487b-3p后PITX2 mRNA表达量极显著降低(P<0.01);将miR-487b-3p inhibitor转染C2C12细胞后,PITX2 mRNA表达量极显著上升(P<0.01)。
|
图 19 转染miR-487b-3p mimics、inhibitor后PITX2 mRNA相对表达量 Figure 19 The relative expression of PITX2 mRNA after transfection of miR-487b-3p mimics, inhibitor |
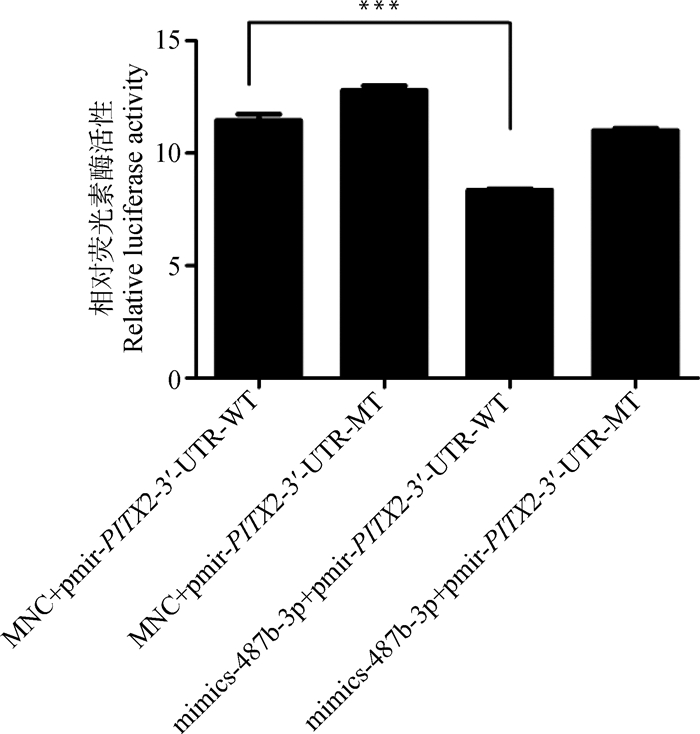
如图 20所示,miR-487b-3p与野生型载体共转染后检测到荧光素酶活性(萤火虫荧光活性/海肾荧光活性比值)显著降低(P<0.01),而与突变型载体共转染后荧光素酶活性与对照相比无显著变化(P>0.05),综上可知,miR-487b-3p靶向PITX2发挥其功能。
|
WT.野生型;MT.突变型 WT. Wild type; MT. Mutant type 图 20 miR-487b-3p与PITX2作用关系分析 Figure 20 The relationship analysis between miR-487b-3p and PITX2 |
骨骼肌发育离不开成肌细胞的增殖和分化这两个重要的生物学过程,探讨miRNAs对骨骼肌细胞增殖与分化的调控是研究骨骼肌发育的核心内容。其中MYOD调控骨骼肌干细胞定向分化为成肌细胞,参与成肌分化的初始阶段,MYOG和MYHC主要调控成肌细胞分化为肌纤维和肌肉组织,参与成肌分化的终末阶段[22]。目前,关于miRNAs对成肌细胞分化的调控研究中,均采用MYOD、MYOG和MYHC基因的表达量来反映成肌细胞分化程度,进而确定miRNAs对成肌细胞分化的具体作用机制[23-25]。增殖细胞核抗原(PCNA)是一个同源三聚体环状结构,与许多分子互作共同参与DNA代谢各个方面的调控,包括DNA复制、DNA修复、细胞周期调节和染色质重塑,其表达量直接反映细胞增殖情况[26]。因此,本试验通过获得性和缺失性研究将外源miR-487b-3p mimics和inhibitor分别导入小鼠C2C12细胞,通过比较MYOD、MYOG和MYHC基因表达量分析不同处理组C2C12成肌细胞的分化程度,比较PCNA基因的表达量来分析C2C12细胞增殖情况进而确定miR-487b-3p在骨骼肌发育过程中的生物学功能。研究发现,过表达miR-487b-3p显著提高增殖标记基因PCNA的表达量,降低分化标记基因MYOD、MYOG和MYHC的表达水平;而抑制miR-487b-3p则降低PCNA的表达,促进MYOD、MYOG和MYHC的表达。可见,miR-487b-3p促进C2C12细胞增殖但抑制其分化。这与Katase等[12]的研究结果相一致。对癌症的研究发现,miR-487b-3p可抑制多种类型癌细胞增殖[10-11]。推测miR-487b-3p在不同生理过程中发挥不同作用。
本研究发现,miR-487b-3p在小鼠体内各个组织均有表达,说明miR-487b-3p广泛参与到小鼠的各项生命活动,且在小鼠C2C12成肌细胞增殖与分化过程中存在差异表达。由此,笔者推测miR-487b-3p可能参与骨骼肌细胞的发育。在C2C12细胞分化过程中,随着分化的进程,miR-487b-3p的表达呈现上升趋势。在分化第1天表达量降低可能是由于细胞间接触,增殖受到抑制,分化第5天miR-487b-3p表达量低于第3天可能是由于分化较明显的状态导致其他信号通路激活,影响其表达,具体原因有待进一步研究。
miRNAs主要通过与靶基因3′ UTR区域互补配对来降解靶基因或抑制其翻译,完成对靶基因的调控,来影响靶基因所在的相关通路,进而参与调控动物体生长发育、代谢及癌症发生,因此准确筛选miRNAs作用的靶基因对于充分了解miRNAs的功能具有十分重要的意义。本研究预测与肌肉发育相关信号通路上的PITX2为miR-487b-3p的靶基因,推测其可能参与骨骼肌生长发育的调控。本研究利用qRT-PCR检测小鼠C2C12细胞增殖与分化中和过表达(抑制)miR-487b-3p后PITX2基因表达量,发现PITX2与miR-487b-3p表达趋势相反,进一步采用双荧光素酶报告系统验证miR-487b-3p和PITX2的靶向关系。可见,miR-487b-3p通过靶向PITX2参与调控C2C12细胞增殖与分化。Katase等[12]研究发现,miR-487b-3p通过靶向Wnt3a和Wnt5a参与调控C2C12细胞成肌分化,与本研究结果不同,可能是由于一个miRNA可以调控多个靶基因共同完成对骨骼肌发育的调控。
4 结论本试验结果表明,miR-487b-3p在小鼠各组织均有表达,其在骨骼肌中相对表达最高。miR-487b-3p过表达和抑制表达试验发现,miR-487b-3p促进小鼠C2C12细胞增殖但抑制其分化。双荧光素酶报告系统验证miR-487b-3p通过靶向PITX2参与骨骼肌发育的调控。
| [1] | PARKER M H, SEALE P, RUDNICKI M A. Looking back to the embryo:defining transcriptional networks in adult myogenesis[J]. Nat Rev Genet, 2003, 4(7): 497–507. DOI: 10.1038/nrg1109 |
| [2] | O'ROURKE J R, GEORGES S A, SEAY H R, et al. Essential role for Dicer during skeletal muscle development[J]. Dev Biol, 2007, 311(2): 359–368. DOI: 10.1016/j.ydbio.2007.08.032 |
| [3] | KRISHNAN K, STEPTOE A L, MARTIN H C, et al. MicroRNA-182-5p targets a network of genes involved in DNA repair[J]. RNA, 2013, 19(2): 230–242. DOI: 10.1261/rna.034926.112 |
| [4] | ARORA S, RANA R, CHHABRA A, et al. miRNA-transcription factor interactions:a combinatorial regulation of gene expression[J]. Mol Genet Genomics, 2013, 288(3-4): 77–87. DOI: 10.1007/s00438-013-0734-z |
| [5] | KROPP J, DEGERNY C, MOROZOVA N, et al. miR-98 delays skeletal muscle differentiation by down-regulating E2F5[J]. Biochem J, 2015, 466(1): 85–93. DOI: 10.1042/BJ20141175 |
| [6] | LUO W, LI E, NIE Q H, et al. Myomaker, regulated by MYOD, MYOG and miR-140-3p, promotes chicken myoblast fusion[J]. Int J Mol Sci, 2015, 16(11): 26186–26201. DOI: 10.3390/ijms161125946 |
| [7] | WEI H, LI Z W, WANG X, et al. microRNA-151-3p regulates slow muscle gene expression by targeting ATP2a2 in skeletal muscle cell[J]. J Cell Physiol, 2015, 230(5): 1003–1021. DOI: 10.1002/jcp.24793 |
| [8] | ZHANG B W, CAI H F, WEI X F, et al. miR-30-5p regulates muscle differentiation and alternative splicing of muscle-related genes by targeting MBNL[J]. Int J Mol Sci, 2016, 17(2): 182. DOI: 10.3390/ijms17020182 |
| [9] | SHI L, ZHOU B, LI P H, et al. microRNA-128 targets myostatin at coding domain sequence to regulate myoblasts in skeletal muscle development[J]. Cell Signal, 2015, 27(9): 1895–1904. DOI: 10.1016/j.cellsig.2015.05.001 |
| [10] | HATA T, MOKUTANI Y, TAKAHASHI H, et al. Identification of microRNA-487b as a negative regulator of liver metastasis by regulation of KRAS in colorectal cancer[J]. Int J Oncol, 2017, 50(2): 487–496. DOI: 10.3892/ijo.2016.3813 |
| [11] | FORMOSA A, MARKERT E K, LENA A M, et al. microRNAs, miR-154, miR-299-5p, miR-376a, miR-376c, miR-377, miR-381, miR-487b, miR-485-3p, miR-495 and miR-654-3p, mapped to the 14q32.31 locus, regulate proliferation, apoptosis, migration and invasion in metastatic prostate cancer cells[J]. Oncogene, 2014, 33(44): 5173–5182. DOI: 10.1038/onc.2013.451 |
| [12] | KATASE N, TERADA K, SUZUKI T, et al. miR-487b, miR-3963 and miR-6412 delay myogenic differentiation in mouse myoblast-derived C2C12 cells[J]. BMC Cell Biol, 2015, 16: 13. DOI: 10.1186/s12860-015-0061-9 |
| [13] |
陆琼琼, 李谨. PITX2在牙齿早期发育中的作用[J]. 口腔生物医学, 2011, 2(2): 93–95.
LU Q Q, LI J. The role of Pitx2 at the early stage of tooth development[J]. Oral Biomedicine, 2011, 2(2): 93–95. (in Chinese) |
| [14] | LOZANO-VELASCO E, VALLEJO D, ESTEBAN F J, et al. APitx2-MicroRNA pathway modulates cell proliferation in myoblasts and skeletal-muscle satellite cells and promotes their commitment to a myogenic cell fate[J]. Mol Cell Biol, 2015, 35(17): 2892–2909. DOI: 10.1128/MCB.00536-15 |
| [15] | ZACHARIAS A L, LEWANDOSKI M, RUDNICKI M A, et al. Pitx2 is an upstream activator of extraocular myogenesis and survival[J]. Dev Biol, 2011, 349(2): 395–405. DOI: 10.1016/j.ydbio.2010.10.028 |
| [16] | HEBERT S L, DANIEL M L, MCLOON L K. The role of Pitx2 in maintaining the phenotype of myogenic precursor cells in the extraocular muscles[J]. PLoS One, 2013, 8(3): e58405. DOI: 10.1371/journal.pone.0058405 |
| [17] | KUMAR J, MOSES K. Transcription factors in eye development:a gorgeous mosaic?[J]. Genes Dev, 1997, 11(16): 2023–2028. DOI: 10.1101/gad.11.16.2023 |
| [18] | AI D, WANG J, AMEN M, et al. Nuclear factor 1 and T-cell factor/LEF recognition elements regulate Pitx2 transcription in pituitary development[J]. Mol Cell Biol, 2007, 27(16): 5765–5775. DOI: 10.1128/MCB.01848-06 |
| [19] | GHOSH P, SAHA S K, NANDI S S, et al. Involvement of Pitx2, a homeodomain transcription factor, in hypothyroidism associated reproductive disorders[J]. Cell Physiol Biochem, 2007, 20(6): 887–898. DOI: 10.1159/000110449 |
| [20] | TESSARI A, PIETROBON M, NOTTE A, et al. Myocardial Pitx2 differentially regulates the left atrial identity and ventricular asymmetric remodeling programs[J]. Circ Res, 2008, 102(7): 813–822. DOI: 10.1161/CIRCRESAHA.107.163188 |
| [21] | L'HONORE A, OUIMETTE J F, LAVERTU-JOLIN M, et al. Pitx2 defines alternate pathways acting through MyoD during limb and somitic myogenesis[J]. Development, 2010, 137(22): 3847–3856. DOI: 10.1242/dev.053421 |
| [22] | ITO Y, KAYAMA T, ASAHARA H. A systems approach and skeletal myogenesis[J]. Comp Funct Genomics, 2012, 2012: 759407. |
| [23] |
马美琳.miRNA-432在成肌细胞增殖分化中的作用及机制研究[D].杨凌: 西北农林科技大学, 2017.
MA M L.The effect and mechanism of miR-432 on myoblast proliferation and differentiation[D]. Yangling: Northwest A&F University, 2017.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3224113 |
| [24] |
王萌.miR-34c通过YY1调控骨骼肌细胞增殖及分化的机制研究[D].北京: 中国农业大学, 2017.
WANG M.miR-34c regulates the proliferation and differentiation of skeletal muscle cells by targeting YY1[D]. Beijing: China Agricultural University, 2017.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10019-1017164406.htm |
| [25] |
朱瑜珣.miR-31-5p对C2C12细胞增殖与肌向分化的调控作用[D].大连: 大连医科大学, 2015.
ZHU Y X.Effect of miR-31-5p in proliferation and myogenic differentiation of C2C12 cell lines[D]. Dalian: Dalian Medical University, 2015.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10161-1015625317.htm |
| [26] | MOLDOVAN G L, PFANDER B, JENTSCH S. PCNA, the maestro of the replication fork[J]. Cell, 2007, 129(4): 665–679. DOI: 10.1016/j.cell.2007.05.003 |



