2. 山东出入境检疫检验局/食品农产品检测中心, 青岛 266001;
3. 青岛博隆实验动物有限公司, 青岛 266225;
4. 澳兰百特生物工程有限公司, 青岛 266101
2. Shandong Entry-Exit Inspection and Quarantine Bureau/Food and Agricultural Products Monitoring Center, Qingdao 266001, China;
3. Qingdao Beagle Experimental Animal Co., LTD., Qingdao 266225, China;
4. Qingdao Oland-Better Bioengineering Co., LTD., Qingdao 266101, China
实验用猪在人类疾病发病机制研究、新药研发等方面的应用越来越广泛,这些领域对实验用猪质量的要求也愈来愈高。病毒病是影响实验动物质量的重要因素之一,建立针对实验用猪病毒病的快速、高通量检测方法十分必要[1]。实验用猪病中,CSFV(classical swine fever virus),PRRSV(porcine reproductive and respiratory syndrome virus),TGEV(transmissible gastroenteritis virus of swine),PEDV(porcine epidemic diarrhea virus),SIV(swine influenza virus),PRV(pseudorabies virus),PCV2(porcine circovirus 2),PPV(porcine parvovirus),PCMV(porcine cytomegalovirus),FMDV(food-and-mouth disease virus)是危害猪群健康的主要病原,且在临床中存在多种病毒混合感染的情况[2],因此同步、快速、高通量检测这10种病毒病对实验用猪质量控制具有重要意义。
目前,针对病毒性传染病的诊断一般采用病原分离鉴定以及血清学方法,但这些方法操作复杂、费时费力、敏感性较差,特别是当猪群混合感染多种病原时,应用常规方法难以进行早期快速检测和鉴别诊断。基因芯片技术作为一种新兴的分子生物学研究方法,具有高通量、多样性、微量化以及自动化的特点[3-5]。该方法快速、准确,在疾病的诊断和病原体的筛查上发挥着越来越重要的作用[6]。
本研究针对猪常见的10种病毒设计了10对特异性引物,设计检测基因点阵,探索研究同时检测10种病毒的基因芯片检测方法,并进行实际应用效果评价,以期进一步提高实验室诊断效率,为实验用猪质量控制及这10种病毒的防控和分子流行病学调查提供了有力工具。
1 材料与方法 1.1 材料 1.1.1 检测样本2016年11月—2017年3月来源于辽宁葫芦岛、河南洛阳、山东胶州、广西玉林采集的和送检的临床病料,来源于山东即墨屠宰线采集的样本,均为肝、脾、肺、肾、淋巴结等脏器组织,每个组织标记为一个样本,共1 006份样本。
1.1.2 病毒毒株猪繁殖与呼吸综合征病毒JXA 1株购自中国动物疫病预防控制中心;猪瘟弱毒疫苗、猪圆环病毒2型灭活疫苗、猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒(G5型)弱毒疫苗(弱毒华毒株+弱毒CV777株+NX株)均购自哈尔滨维科生物技术开发公司;猪伪狂犬病活疫苗、猪乙型脑炎活疫苗SA14-14-2株购自中牧股份实业有限公司;猪口蹄疫灭活病毒(A型、O型、Asia型)由中国农业科学院兰州兽医研究所提供。细小病毒灭活疫苗购自吉林正业生物制品股份有限公司;猪流感病毒[7]由本实验室分离并保存;猪巨细胞病毒阳性病料[8]由本实验室保存。
1.1.3 主要试剂晶芯光学级氨基基片、晶芯基因芯片点样液均购自北京博奥生物有限公司;核酸杂交液购自南京森贝伽生物科技有限公司;λ DNA、RNAiso Plus试剂、Reverse Transcriptase XL(AMV)反转录酶、Ribonuclease Inhibitor(RNasin)RNA抑制剂、pMD19-T Vector购自宝生物工程(大连)有限公司;RNeasy Mini Kit购自QIAGEN公司;质粒小量提取试剂盒、琼脂糖凝胶DNA回收试剂盒购于AXYGEN公司;Trans1-T1感受态细胞、DNA提取试剂盒、2×EasyTaq PCR Super Mix、Trans2K DNA Marker购自北京全式金公司;无水乙醇、异丙醇、三氯甲烷等均为国产分析纯。
1.1.4 引物设计与合成根据GenBank公布的CSFV、PRRSV、TGEV、PEDV、SIV的H1N1、H3N2、H9N2亚型、PRV、PCV2、PPV、PCMV、FMDV的保守基因核苷酸序列,参考国内外相关文献,设计10对特异性引物。其中TGEV的引物序列参考《猪传染性胃肠炎病毒RT-PCR检测方法》[9]设计;FMDV引物根据Fernández等[10]设计;PPV根据《猪细小病毒病聚合酶链反应操作规程》[11]设计。通过NCBI上的BLAST工具对这10对引物进行比对分析,分析表明这10对引物与其他病毒不存在任何同源性。每对引物合成一条上游引物和两条下游引物,并将其中一条下游引物的5′端进行Cy3分子修饰以对靶基因进行标记。定位基因引物参考曹三杰等[12]设计合成。引物序列、目的基因以及扩增片段长度见表 1;引物委托生工生物工程(上海)股份有限公司合成。
|
|
表 1 引物信息及目的基因片段长度 Table 1 Information of primers for probe and length of fragment |
PRV、PCV2、PPV核酸提取采用酚-氯仿快速抽提法,CSFV、PRRSV、TGEV、PEDV、SIV、FMDV核酸提取采用QIAGEN公司的RNeasy Mini Kit进行,RNA提取后进行反转录。以提取的核酸DNA或反转录产物cDNA作为模板,以表 1未标记的引物进行PCR扩增。10种病毒的PCR反应体系为30 μL:DNA/cDNA 4 μL,上游引物(25 μmol·L-1)1.5 μL,下游引物(25 μmol·L-1)1.5 μL,2×EasyTaq PCR Super Mix 15 μL,补ddH2O至30 μL。PCR反应程序为:95 ℃变性5 min;94 ℃ 30 s,51~59 ℃ 45 s,72 ℃ 1 min,共30循环;最后72 ℃延伸5 min。
1.2.1.2 PCR退火温度的确定以梯度PCR仪在51~59 ℃范围内自动设置8个退火温度梯度。梯度退火温度51、51.3、52.2、53.4、54.8、56.3、57.7、59.2 ℃,每种病毒分别进行梯度PCR扩增,以确定10种病毒的退火温度。
1.2.1.3 重组质粒的构建PCR反应结束后,用2%琼脂糖凝胶进行电泳鉴定。切胶后用DNA回收。将目的片段导入pMD19-T载体,转化后挑取单菌落进行菌液PCR鉴定,经鉴定后保菌,提取克隆质粒备用,将提取的质粒送至生工生物工程上海股份有限公司测序鉴定。
1.2.2 基因芯片的制备 1.2.2.1 靶基因及定位对照基因的制备将制备好的标准品10种病毒重组质粒稀释50倍后分别作为各PCR反应模板,以表 1不带标记的引物进行PCR扩增,定位对照基因以λDNA为模板用带标记和不带标记的引物分别进行PCR扩增,作为芯片反应的阳性质控,反应体系为100 μL:质粒2 μL,上游引物(25 μmol·L-1)2 μL,下游引物(25 μmol·L-1)2 μL,2×EasyTaq PCR Super Mix 50 μL,补ddH2O至100 μL。PCR反应程序:94 ℃变性5 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,共40循环;最后72 ℃延伸5 min。PCR反应结束后,用2%琼脂糖凝胶进行电泳鉴定。鉴定后用酚-氯仿-异戊醇抽提法对产物进行纯化。
1.2.2.2 芯片的设计与制备将靶基因和定位对照基因定量至400 ng·μL-1,加入等量的基因芯片点样缓冲液配制成点样液,将点样液按芯片设计要求(图 1)加入96孔板内,设纯点样缓冲液为阴性对照,用基因芯片点样系统在氨基化基片上进行非接触式点样。

|
图 1 基因芯片矩阵设计 Figure 1 The design of DNA microarray spotting |
点制好的芯片静置于点样仪上过夜固定,放入盛有0.2% SDS的烧杯中,室温摇床中清洗10 min,再放入盛有无水乙醇的烧杯中洗涤,上下快速提拉芯片架30次,重复此操作,放入50 mL离心管中,2 000 r·min-1室温离心10 min甩干后密封,室温保存备用。
1.2.3 基因芯片杂交试验采用Cy3直接标记法标记探针,以稀释50倍的各标准品重组质粒为模板,采用各病毒5′端标记Cy3分子的下游引物和上游引物分别进行PCR扩增,将cDNA进行标记。扩增结束后电泳鉴定进行纯化。杂交前为了保证同一张芯片上4个点阵区域有相同的反应条件,并且为防止各个样品之间产生交叉污染,需要对芯片进行围栏的粘贴,将胶粘贴至芯片上使平等分为四个区域。然后将芯片置于芯片架上,浸入98 ℃水中变性2 min,取出芯片架迅速浸入冰冷的乙醇中1 min,1 500 r·min-1室温离心10 min甩干。与此同时进行探针的变性处理,将纯化后的各PCR产物混合,95 ℃水中变性5 min,立即冰浴2 min,后与杂交液按1:2比例混合均匀。
使用Advalytix的生物芯片杂交仪SB401-0145进行杂交,55 ℃ 2 h。
1.2.4 芯片杂交后洗涤杂交结束后,将芯片水平取出,放入预热至42 ℃的洗涤液Ⅰ(0.3×SSC/0.1%SDS)中200 r·min-1室温清洗2 min,取出芯片放入预热至42 ℃的洗液Ⅱ(0.6% SSC)中200 r·min-1室温清洗2 min,洗涤两次,最后将芯片在无水乙醇中上下浸提几次,然后把芯片放入离心管中,1 500 r·min-1离心10 min甩干。
1.2.5 芯片扫描与结果判定芯片用晶芯LuxScan 10K进行扫描。扫描参数为绿色10 μm分辨率、532 nm单色荧光、100% Power Gain,扫描结果用16位tiff格式图片保存,最后对扫描的结果进行统计分析。
当第1列与第14列阳性位点有绿色荧光信号,且2列和13列阴性位点没有荧光信号时,芯片检测结果为有效结果。结果软件系统分析各位点的信噪比值(signal to noise ratio, SNR),统计计算定位对照基因(10个位点)和探针(各10个位点)的平均SNR,根据10个点信号中位值(Median)以及其与背景信号平均值的比值(SNRm)为判定依据。当Median≥1 000、SNRm值≥2;扫描出的各个点阳性清晰可见,三者结果一致可以判定为杂交结果成立。
1.2.6 芯片检测的特异性、敏感性、重复性检测分别以正常组织、CSFV、PRRSV、PEDV、TGEV、SIV、PRV、PCV2、PPV、JEV和PoRV为模板进行PCR扩增,分别与制备病毒基因芯片进行杂交,以验证病毒基因芯片的特异性。
测定各病毒重组质粒常规PCR胶回收产物的浓度,将各病毒回收产物等比例混合作101~108倍比稀释后,分别与制备的基因芯片进行杂交,以评价病毒基因芯片检测的灵敏性。
以各病毒核酸为模板用带Cy3分子标记的引物进行PCR扩增制备混合探针然后与3个批次的6张芯片(2张·批次-1)和同一批次的6张芯片进行杂交,以检验批次内及批次间芯片之间的一致性。
1.2.7 临床样品检测随机选取80份临床样品处理后取上清液用于病毒RNA或DNA的提取,然后反转录进行PCR扩增,选用Cy3分子标记的引物标记探针,PCR扩增后取5 μL电泳,其余与制备的基因芯片杂交,记录电泳结果,与基因芯片检测结果进行对比。
2 结果 2.1 PCR退火温度的确定10种病毒的PCR/RT-PCR最佳退火温度范围均较广,PRRSV退火温度在51~53.4 ℃之间会产生非特异性扩增,在53.4~59.2 ℃特异性扩增效果良好,PRV退火温度在52.2~56.3 ℃扩增良好,FMDV退火温度在51~54.8 ℃扩增良好,其他病毒在51~59 ℃扩增效果均良好无明显差别(图 2),10种病毒各自最佳退火温度见表 2。
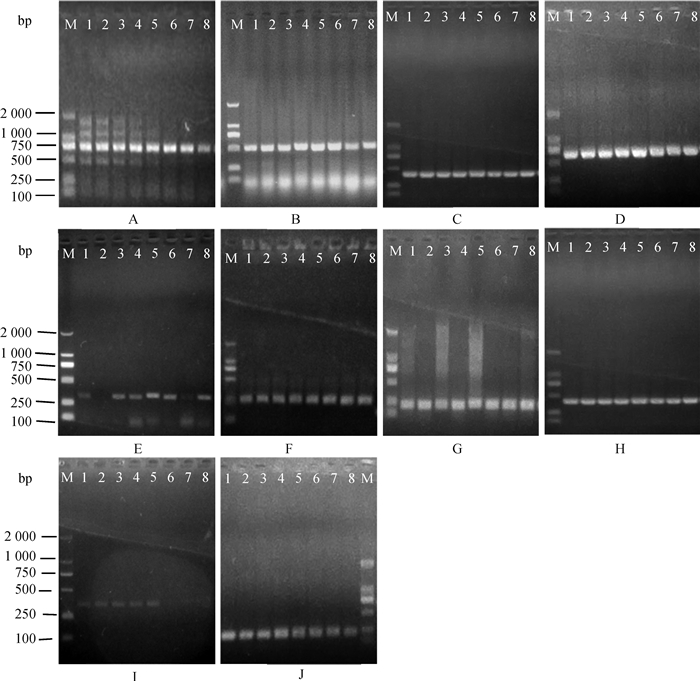
|
M.DL2000 DNA相对分子质量标准;A. PRRSV;B. PCV2;C. PCMV;D. SIV;E. PRV;F. CSFV;G. PPV;H. PEDV;I. FMDV;J. TGEV;1. 51 ℃;2. 51.3 ℃;3. 52.2 ℃;4. 53.4 ℃;5. 54.8 ℃;6. 56.3 ℃;7. 57.7 ℃;8. 59.2 ℃ M. DL2000 DNA marker; A. PRRSV; B. PCV2; C. PCMV; D. SIV; E. PRV; F. CSFV; G. PPV; H. PEDV; I. FMDV; J. TGEV; 1. 51 ℃; 2. 51.3 ℃; 3. 52.2 ℃; 4. 53.4 ℃; 5. 54.8 ℃; 6. 56.3 ℃; 7. 57.7 ℃; 8. 59.2 ℃ 图 2 单项PCR退火温度优化结果 Figure 2 Optimization for annealing temperature of single PCR |
|
|
表 2 10种病毒最佳退火温度 Table 2 Optimum annealing temperature of ten viruses |
以提取的CSFV、PRRSV、TGEV、PEDV、SIV、PRV、PCV2、PPV、PCMV、FMDV、λDNA的核酸为模板,用表 1不代标记的特异性引物分别扩增相应病毒。结果经琼脂糖凝胶电泳显示,扩增出条带与预期相符,分别约247、270、276、447、229、355、472、322、263、275 bp(图 3)。连接转化后筛选阳性重组质粒送至生工生物工程(上海)股份有限公司测序,测序结果经NCBI在线工具BLAST比对分析。结果显示,扩增序列与10种病毒各自引物设计株的预期扩增序列相似性均在99%以上,所测的序列分别为CSFV 5′ UTR基因、PRRSV ORF6基因、TGEV N基因、PEDV N基因、SIV M基因、PRV gH基因、PCV2 ORF2基因、PPV VP2基因、PCMV gB基因、FMDV 3D基因,均为各病毒高度保守基因序列区域,验证了基因芯片上的杂交结果的可信性。
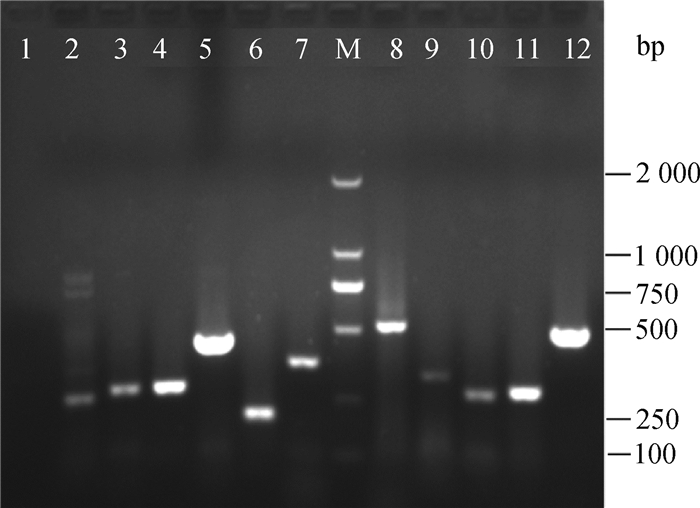
|
M.DL2000 DNA相对分子质量标准;1.阴性对照;2. CSFV PCR产物(247 bp);3. PRRSV PCR产物(270 bp);4. TGEV PCR产物(276 bp);5. PEDV PCR产物(447 bp);6. SIV PCR产物(229 bp);7. PRV PCR产物(355 bp);8. PCV2 PCR产物(472 bp);9. PPV PCR产物(322 bp);10. PCMV PCR产物(263 bp);11. FMDV PCR产物(275 bp);12. λDNA PCR产物(500 bp) M. DL2000 DNA marker; 1. Negative control; 2. PCR products (247 bp) of CSFV; 3. PCR products (270 bp) of PRRSV; 4. PCR products (276 bp) of TGEV; 5. PCR products (447 bp) of PEDV; 6. PCR products (229 bp) of SIV; 7. PCR products (355 bp) of PRV; 8. PCR products (472 bp) of PCV2; 9. PCR products (322 bp) of PPV; 10. PCR products (263 bp) of PCMV; 11. PCR products (275 bp) of FMDV; 12. PCR products (500 bp) of λDNA 图 3 琼脂糖凝胶电泳检测PCR扩增结果 Figure 3 PCR product showed on Agarose gel |
使用带标记的引物分别扩增CSFV、PRRSV、PEDV、TGEV、SIV、PRV、PCV2、PPV、PCMV、FMDV、JEV和PoRV等常见猪病毒的基因,与对照基因混合后进行芯片杂交,扫描后分析结果,芯片上各病毒靶基因与其目标探针有较强杂交信号、可见斑点清晰,与其他非目的探针基本没有可见信号,非目标病毒检测结果呈阴性(图 4)。试验结果表明基因芯片检测这10种病毒的方法特异性良好。

|
A.阴性对照;B.基因芯片检测CSFV结果;C.基因芯片检测PRRSV结果;D.基因芯片检测TGEV结果;E.基因芯片检测PEDV结果;F.基因芯片检测SIV结果;G基因芯片检测PRV结果;H.基因芯片检测PCV2结果;I.基因芯片检测PPV结果;J.基因芯片检测PCMV结果;K.基因芯片检测FMDV结果;L.基因芯片检测JEV、PoRV结果 A. Negative control; B. The gene microarray hybridization result of CSFV; C. The gene microarray hybridization result of PRRSV; D. The gene microarray hybridization result of TGEV; E. The gene microarray hybridization result of PEDV; F. The gene microarray hybridization result of SIV; G. The gene microarray hybridization result of PRV; H. The gene microarray hybridization result of PCV2; I. The gene microarray hybridization result of PPV; J. The gene microarray hybridization result of PCMV; K. The gene microarray hybridization result of FMDV; L. The gene microarray hybridization result of JEV, PoRV 图 4 芯片检测特异性结果 Figure 4 The specificity of the gene microarray assay |
测定各病毒PCR产物浓度,换算成DNA的拷贝数,将各病毒产物作101~108倍比稀释后与芯片杂交,扫描结果分析,各病毒的芯片检测敏感性不同,最低检测浓度分别如下:CSFV 1.96×105 copies·μL-1、PRRSV 2.25×105 copies·μL-1、TGEV 3.39×105 copies·μL-1、PEDV 2.16×105 copies·μL-1、SIV 2.63×105 copies·μL-1、PRV 2.68×105 copies·μL-1、PCV2 2.93×105 copies·μL-1、PPV 2.32×105 copies·μL-1、PCMV 3.51×106 copies·μL-1、FMDV 1.57×106 copies·μL-1,芯片检测敏感性结果表明,该检测芯片的最低可检测到105 copies的病毒。
2.5 芯片稳定性检测使用带标记引物分别扩增各病毒模板,将混合探针与杂交液混合,进行批内、批间重复试验。扫描结果显示在相同杂交条件下,批次内和批次间的芯片荧光信号值相对稳定,检测结果一致,信号中位值的变异系数均小于5.26%,检测结果表明同一批次或不同批次的芯片均具有较好可重复性。
2.6 临床样本检测156份临床样品中,基因芯片检测CSFV、PRRSV、TGEV、PEDV、SIV、PRV、PCV2、PPV、PCMV的阳性率分别为6.41%、3.21%、7.05%、7.69%、5.13%、5.13%、3.85%、4.49%、3.21%,未检出FMDV感染;混合感染情况与单项PCR/RT-PCR符合率见表 3;850份屠宰场样品中,基因芯片检测CSFV、PRRSV、TGEV、PEDV、SIV、PRV、PCV2、PPV、PCMV的阳性率分别为7.53%、4.12%、2.35%、0.59%、0.59%、1.18%、4.71%、1.88%、1.18%,未检出FMDV感染;混合感染情况与单项PCR/RT-PCR符合率见表 4,部分样品检测结果见图 5。
|
|
表 3 临床样品的检测结果统计 Table 3 Statistics on detection of clinical sample used for gene chips |
|
|
表 4 屠宰场采集样品850份检测结果统计 Table 4 Statistics on detection of 850 samples taken from slaughterhouse used for gene chips |

|
图 5 部分临床样品芯片检测结果 Figure 5 Screening of clinical specimens by gene chips |
猪是医学研究领域常用的实验动物,高质量的实验动物是获得理想实验结果的必要前提。基因芯片检测方法具有快速、灵敏和高通量等特点[13],可同时对多种病毒基因进行检测分析,可最大限度保证检出率,及时监控实验动物质量水平。
本研究建立的猪病芯片检测方法,在一次试验中可同时检测10种猪病毒,有效缩短检测时间。本试验研究的基因芯片为cDNA芯片,并将探针长度设计为约200~450个碱基,各病毒探针之间的同源性均小于46.7%,避免产生碱基错配影响杂交结果分析保证了该cDNA芯片的特异性和敏感性,并且各病毒探针有相似的Tm值,从而使杂交条件接近芯片上所有靶基因的最佳条件。
芯片杂交属于固-液相杂交反应,影响杂交反应的条件包括杂交双方的浓度和杂交序列特点、杂交的温度以及时间、洗涤条件等。一般情况下杂交温度比靶基因Tm值小5 ~ 10 ℃时杂交效率高,本试验设计的所有探针均有相似的Tm值,均在82~ 94 ℃,在杂交过程中加入含50%甲酰胺的杂交液可使杂交温度降低25 ℃,同时能够降低杂交背景。本研究的最适杂交温度为55 ℃,杂交的效果好,杂交斑点清晰可见,信号值稳定。
目前标记探针的制备分为直接标记法和间接标记法,间接标记法是在扩增时将染料标记的底物掺入cDNA,直接标记法是引物的5′端加入荧光修饰基团,以带标记的引物扩增使cDNA带上标记。直接标记法迅速、操作简单、步骤少,可快速大规模分析样品。而间接标记法步骤繁多,引入误差的几率增大,还需要在掺入标记底物的过程中进行等优化,这些步骤使得间接标记的成本要高于直接标记。另外,根据杨国淋等[14]、马锐等[15]报道,采用直接标记法的芯片敏感性比间接标记法高100倍,因此本研究选择直接标记法进行试验。
应用本试验所构建的芯片检测方法对随机选取的156份临床发病样本进行检测,检测结果显示,所测样本中有151份感染病毒,未感染病毒的只占3.21%,单纯感染中以冠状病毒(TGEV、PEDV)阳性率最高均为7%以上,混合感染阳性率达到50.64%,多以CSFV+PRRSV感染为主,表明临床上送检病料中混合感染较为普遍,所有临床样本经单项PCR/RT-PCR方法验证,芯片检测与PCR技术检测的最低符合率为96.79%;应用基因芯片对屠宰场采集的850份样品进行检测,结果显示屠宰场的病毒检出率比临床病料的检出率低,未感染的占28.47%,单纯感染占24.11%,其中屠宰场中CSFV、PCV2和PRRSV的检出率较高,为7.53%、4.71%、4.12%,混合感染中这三种病毒的两两混合的检出率较高,芯片与PCR技术的检测总符合率均在96.79%以上,表明基因芯片适用于高通量检测。
本研究所建立的10种病毒基因芯片检测试验方法,是建立在PCR/RT-PCR以及核酸特异性杂交的基础上,暂时无法区分各个病毒强弱毒株,需要进行进一步的研究[16]。但对实验用猪而言,只要检出病毒阳性,无论是野毒株还是疫苗株,均应立即淘汰。希望本研究所建立的检测方法,能够成为实验用猪质量控制的有力工具。
4 结论建立了检测猪常见10种疫病病毒的基因芯片检测方法,杂交后荧光信号清晰、特异性好。芯片检测与普通PCR的符合率高于96%。本方法最低可检测到105 copies的病毒,该方法的建立为实现多样品、多病毒的高通量筛查检测奠定了基础,对生猪检疫和实验用猪质量控制均有裨益。
致谢: 此研究为国家科技支撑计划资助项目,特表感谢。同时,衷心感谢山东出入境检验检疫技术中心给以场地、仪器上的支持,特别感谢中国水产科学研究院黄海水产研究所的王晨女士在实验研究过程中的技术帮助,感谢中国农业科学院兰州兽医研究所陈豪泰博士提供猪口蹄疫灭活病毒。| [1] |
任小侠, 吴思捷, 王锡乐, 等. 实验用猪微生物学质量控制标准的研究[J]. 实验动物科学, 2017, 34(3): 61–65.
REN X X, WU S J, WANG X L, et al. Study on the standards of microbiological quality control of experimental pigs[J]. Laboratory Animal Science, 2017, 34(3): 61–65. DOI: 10.3969/j.issn.1006-6179.2017.03.013 (in Chinese) |
| [2] | YANG X H, WEI X F, HU J H, et al. Epidemiological investigation of influenza A viruses in laboratory swine and dogs in Shanghai[J]. Adv Mater Res, 2012, 393-395: 733–736. |
| [3] | AN D J, SONG D S, PARK J Y, et al. A DNA miniarray system for simultaneous visual detection of porcine circovirus type 1(PCV1) and 2(PCV2) in pigs[J]. Vet Res Commun, 2009, 33(2): 139–147. DOI: 10.1007/s11259-008-9080-8 |
| [4] |
杨若松, 姜金庆, 张志, 等. 4种猪群常见病毒基因芯片检测方法的建立与应用[J]. 西北农林科技大学学报:自然科学版, 2012, 40(3): 34–38.
YANG R S, JIANG J Q, ZHANG Z, et al. Development of agenechip for detection of CSFV, PRRSV, PCV-2 and PPV[J]. Journal of Northwest A&F University:Natural Science Edition, 2012, 40(3): 34–38. (in Chinese) |
| [5] | KIM Y K, LIM S I, CHO Y Y, et al. The CSFV DNAChip:a novel diagnostic assay for classical swine fever virus[J]. J Virol Methods, 2014, 204: 44–48. DOI: 10.1016/j.jviromet.2014.03.020 |
| [6] |
孙芳芳, 董英, 薛强, 等. 口蹄疫病毒分子生物学检测方法研究进展[J]. 中国畜牧兽医, 2013, 40(6): 190–194.
SUN F F, DONG Y, XUE Q, et al. Research progress on the molecular biology techniques in detection of foot and mouth disease virus[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(6): 190–194. DOI: 10.3969/j.issn.1671-7236.2013.06.042 (in Chinese) |
| [7] |
王新, 徐守振, 刘均华, 等. 猪流感(H1N1+H3N2)二价油乳剂灭活疫苗的研制[J]. 畜牧与兽医, 2013, 45(11): 11–16.
WANG X, XU S Z, LIU J H, et al. Development of bivalent inactivated oil-emulsion vaccines for swine influenza (H1N1 and H3N2)[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(11): 11–16. (in Chinese) |
| [8] |
刘兴彩, 尹燕博, 徐守振, 等. 猪巨细胞病毒gB基因的克隆与序列分析[J]. 中国兽医杂志, 2012, 48(2): 17–21.
LIU X C, YIN Y B, XU S Z, et al. Cloning and sequence analysis of porcinecytomegalovirus(PCMV) gB gene[J]. Chinese Journal of Veterinary Medicine, 2012, 48(2): 17–21. DOI: 10.3969/j.issn.0529-6005.2012.02.005 (in Chinese) |
| [9] |
辽宁省质量技术监督局. 猪传染性胃肠炎病毒RT-PCR检测方法: DB21/T 2325-2014[S]. 辽宁省质量技术监督局, 2014.
Liaoning Province Bureau of Quality and Technical Supervision. Method of RT-PCR for the detection of transmissible gastroenteritis virus: DB21/T 2325-2014[S]. Liaoning Province Bureau of Quality and Technical Supervision, 2014. (in Chinese) |
| [10] | FERNÁNDEZ J, AGVERO M, ROMERO L, et al. Rapid and differential diagnosis of foot-and-mouth disease, swine vesicular disease, and vesicular stomatitis by a new multiplex RT-PCR assay[J]. J Virol Methods, 2008, 147: 301–311. DOI: 10.1016/j.jviromet.2007.09.010 |
| [11] |
中华人民共和国国家质量监督检验检疫总局. 猪细小病毒病聚合酶链反应操作规程: SN/T 1874-2007[S]. 北京: 中国标准出版社, 2007.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Protocol of polymerase chain reaction for porcine parvovirus: SN/T 1874-2007[S]. Beijing: Standards Press of China, 2007. (in Chinese) |
| [12] |
曹三杰, 黄小波, 文心田, 等. 猪传染性胃肠炎病毒检测基因芯片的构建[J]. 中国兽医学报, 2009, 29(2): 121–124.
CAO S J, HUANG X B, WEN X T, et al. Construction of detectinggenechip for transmissible gastroenteritis virus[J]. Chinese Journal of Veterinary Science, 2009, 29(2): 121–124. (in Chinese) |
| [13] | LUNG O, FISHER M, BEESTON A, et al. Multiplex RT-PCR detection and microarray typing of vesicular disease viruses[J]. J Virol Methods, 2011, 175(2): 236–245. DOI: 10.1016/j.jviromet.2011.05.023 |
| [14] |
杨国淋, 赵松, 黄小波, 等. 两种标记方法对cDNA芯片杂交信号的初步分析[J]. 中国兽医科学, 2016, 46(3): 338–343.
YANG G L, ZHAO S, HUANG X B, et al. Preliminary analysis of cDNA microarray hybridization signal based on two labeling methods[J]. Chinese Veterinary Science, 2016, 46(3): 338–343. (in Chinese) |
| [15] |
马锐, 尹人杰, 黄小波, 等. 猪病毒性腹泻检测基因芯片的两种样品标记技术比较[J]. 畜牧兽医学报, 2016, 47(4): 752–761.
MA R, YIN R J, HUANG X B, et al. Comparision of two fluorescence-labeling methods of porcine diarrheal viruses detection microarrays[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 752–761. (in Chinese) |
| [16] |
陈红军, 侯义宏, 白华, 等. 猪流感病毒分型基因芯片的建立和初步应用[J]. 畜牧兽医学报, 2007, 38(7): 708–712.
CHEN H J, HOU Y H, BAI H, et al. Establishment and initial application of low density DNAarray for diagnosing the subtypes of SIV[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(7): 708–712. (in Chinese) |

 图 1(Figure 1)
图 1(Figure 1)


