2. 国家民族事务委员会青藏高原动物疫病防控创新团队, 成都 610041
2. Animal Disease Prevention and Control Innovation Team in the Qinghai Tibet Plateau of State Ethnic Affairs Commission, Chengdu 610041, China
牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)是引起犊牛腹泻的重要病原,该病毒属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)成员。BVDV在世界范围内广泛存在,给世界养牛业造成了不可估量的经济损失[1]。该病毒不仅能感染牛,引起犊牛发生腹泻等症状,还可以感染各种动物,如猪、绵羊、山羊和野生有蹄类动物[2-3]。根据BVDV 5′UTR、Npro等基因序列的差异,可将BVDV分为2种基因型,即BVDV1和BVDV2型,从生物角度每个基因型可分为致细胞病变和不致细胞病变型。BVDV感染后可表现出典型的临床症状,主要表现为发烧、腹泻、持续性感染、免疫抑制性疾病、呼吸系统疾病、生殖障碍等[4-6],出血性综合征则表现为出血、血小板减少和黏膜病等[7-9]。有研究显示,急性BVDV感染后主要表现为白细胞减少和血小板减少等症状[10-12]。这些血液学方面的异常可能归因于BVDV的感染和复制所致[12-13]。BVDV诱导血小板减少症的发病机制尚不清楚。然而,有报道称是因为感染BVDV后加速了血小板的破坏速率或减少了血小板的生成速率[14-15]。另外有研究显示以BALB/c小鼠为试验动物,通过组织病理变化,免疫组化等试验表明肺是BVDV病原的主要复制器官[16]。
目前,国内关于BVDV感染小鼠的致病性和动物模型研究较少,为了探索BVDV感染小鼠后的致病性。本研究利用腹腔注射的方式诱导BVDV感染BALB/c小鼠,并通过病理组织学、血液学和荧光定量PCR的方法对收集到的血液和组织进行检测。探究攻毒之后BVDV在小鼠体内的感染情况以及白细胞、血小板和淋巴细胞的变化情况,比较BVDV在小鼠血液和组织之间感染的差异,以及BVDV感染小鼠后产生的病理变化和临床症状。为更好地研究BVDV感染动物模型的建立和致病性提供一定的理论依据。
1 材料与方法 1.1 试验动物及分组SPF级雌鼠BALB/c(18~22 g)36只购自成都达硕实验动物有限公司;本研究攻毒组随机分为3组,分别为Z6组、DJ2组和OregonC24 V组,另设1个对照组,共4组,每组各9只BALB/c小鼠。
1.2 毒株、仪器及主要试剂BVDV1-Z6和BVDV1-DJ2分离株由本实验室分别从牦牛腹泻粪便和健康牦牛粪便样本中分离得到,病毒TCID50·100 μL-1分别为10-8.11和10-5.81,两株分离株均属于致细胞病变型;OregonC24 V毒株购自中国药品生物制品检定所;一次性1 mL无菌注射器;牛肾上皮细胞(MDBK);DMEM培养基;荧光定量PCR仪购自杭州博日科技有限公司;BM860血常规分析仪购自泰安市泰诺科贸有限公司;Quick Taq HS DyeMix购自东洋纺(上海)生物科技有限公司;DNA Marker Ⅱ购自宝生物工程(大连)有限公司;Prime ScriptTMRT试剂盒购自宝生物工程有限公司;Tirzol试剂盒(RNAiso Plus)购自上海英骏生物科技有限公司。
1.3 试验方法3株不同来源的BVDV毒株经过MDBK细胞接种繁毒后保存于-80 ℃冰箱备用。将BALB/c小鼠饲养在无菌条件的动物房,在小鼠适应1 d之后,攻毒组OregonC24 V、Z6和DJ2每只小鼠各自腹腔注射6.0×106 TCID50病毒液。对照组每只小鼠各自腹腔注射1 mL DMEM。攻毒完成后每天观察小鼠的活动状况和精神状态并记录。
1.4 病料采集攻毒后第5、7和10天每组各处理3只小鼠并采集组织、粪便和血液等样本,每天定时称量小鼠体重。本研究通过眼眶采血的方式收集血液,并用枸橼酸三钠作为抗凝剂收集血液用于血常规检测(白细胞、血小板、淋巴细胞)。在无菌操作台上解剖小鼠并观察其脏器的病理变化,采集每只小鼠肠道、心、肝、脾、肺、肾等组织。对收集到的组织一部分用于BVDV抗原的检测,另一部分则用4%的多聚甲醛固定液固定,用于HE染色并观察其病理变化。
1.5 RNA提取将粪便样品和组织样品反复研磨,加入1 mL生理盐水,经过反复冻融后,以3 000 r·min-1离心10 min,取上清。参照上海英俊生物科技有限公司Trizol试剂盒(RNAisoPlus)说明书提取从小鼠身上采集到的各组织和粪便的RNA,取500 μL上清液加入700 μL的Trizol, 室温静置10 min;加入200 μL氯仿,剧烈振荡15 s,4 ℃、12 000 r·min-1离心15 min,取上清液;加入等体积的异丙醇充分颠倒混匀,室温静置10 min;4 ℃、12 000 r·min-1离心15 min,弃上清液,加入1 mL 75%(经DEPC处理过的灭菌水配制)乙醇;4 ℃、12 000 r·min-1离心10 min,弃上清液,用15 μL经过DEPC处理过的无菌水溶解沉淀,置-80 ℃冰箱备用。利用Prime Script TMRT试剂盒将RNA反转录成cDNA,并置于-20 ℃保存备用。
1.6 组织荧光定量PCR的检测应用本实验室已建好的荧光定量PCR方法对采集的组织和粪便中BVDV的感染率进行检测。引物序列:F-CTCAGCGAAGGCCGAAAA;R-CAGGGCTTCAGCCATCCA,目的片段100 bp。反应体系20 μL:SYBR Ⅱ 10 μL,引物F/R均为10 pmol·L-1各0.5 μL,cDNA 2 μL,ddH2O 7 μL。荧光定量PCR反应程序:94 ℃ 2 min,94 ℃ 15 s,61 ℃ 30 s,最后新增一个溶解段,扩增40个循环。
1.7 血液血常规的测定及相关组织HE染色将加有抗凝剂(枸橼酸三钠)的血液使用BM860血常规分析仪进行血常规检测,主要包括血小板(PLT)、白细胞(WBC)、淋巴细胞(LYM)。另外用4%多聚甲醛固定液固定后的肺、脾、肝、十二指肠、空肠和回肠送到成都市里来生物技术有限公司制备切片,并进行HE染色。对得到的数据和切片进行收集、观察和整理。
1.8 数据分析数据表示为“x±sx”。每个值都是三次独立试验的结果。使用GraphPad Prism16.0软件对试验数据进行作图分析,并采用SPSS19.0进行单因素方差分析确定每个时间点(第5、7和10天)攻毒组和对照组小鼠之间差异的统计学意义,P值小于0.05被认为是差异显著,P值小于0.01为差异极显著。
2 结果 2.1 攻毒后小鼠的临床症状以及剖解病理变化在本研究中,3组攻毒组通过腹腔注射接种BVDV病原后,大部分被感染的小鼠都表现出一定的临床症状。主要表现为聚集成堆、被毛粗糙、采食量减少、精神沉郁、轻微腹泻等。解剖可见攻毒组小鼠肺和肝有出血点,脾边缘发绀并伴有肿大,肠道内容物呈黄色水样状,Z6组与DJ2组相比,Z6组病理变化更加明显。整个试验过程中,对照组小鼠没有明显的临床症状和病理变化。
2.2 荧光定量PCR扩增检测采用荧光定量PCR方法对BVDV在小鼠体内的感染情况进行检测,统计结果如表 1。结果发现:攻毒后第5天,Z6组和DJ2组中空肠、结肠以及OregonC24 V组中肺、十二指肠、结肠没有检测到BVDV,其他组织均能检测到BVDV;攻毒第7天,Z6组空肠,DJ2组空肠、结肠以及OregonC24 V组肺、空肠、回肠、结肠没有检测到BVDV,其他组织均能检测到BVDV;攻毒第10天,除Z6组空肠、回肠,DJ2组肝、回肠、结肠等组织外,其他组织均能检测到BVDV;OregonC24 V组中在肺、肝、脾、十二指肠和空肠中能检测到BVDV。在整个试验过程中,攻毒组小鼠粪便中均能检测到BVDV,而对照组小鼠组织和粪便均不能检测到BVDV。从组织检测率来看,肺、肝和脾的检出率高于其他组织,Z6组高于DJ2组,猜测小鼠肺和肝可能是BVDV复制的主要器官。
|
|
表 1 小鼠组织中BVDV的荧光定量PCR检测结果 Table 1 The detection of BVDV in mice tissues by fluorescence quantitative PCR |
小鼠攻毒后,每天定时称量并记录小鼠体重变化。如图 1所示:可以看出,攻毒后第7天与第5天相比,Z6组小鼠体重显著降低(P < 0.05);攻毒第7天,DJ2组和OregonC24 V组小鼠体重有明显的降低趋势,且差异极显著(P < 0.01),Z6组差异显著(P < 0.05);攻毒第10天,Z6组和DJ2组与对照组相比差异显著(P < 0.05),OregonC24 V组差异极显著(P < 0.01)。整个试验过程中,攻毒组体重增加无明显变化,而对照组小鼠体重增加明显。
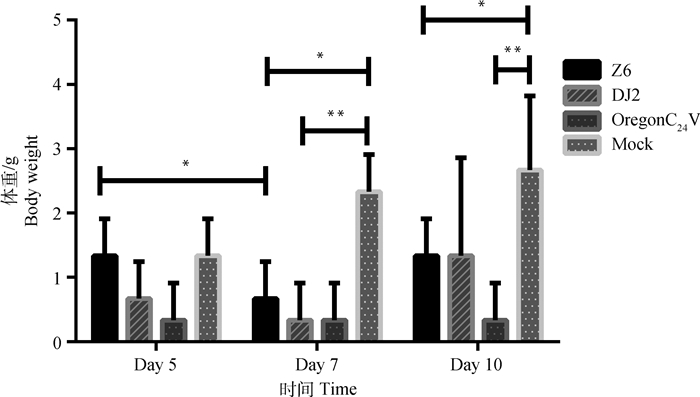
|
*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01) The * indicate significant difference (P < 0.05), the ** indicate extremely significant difference (P < 0.01) 图 1 攻毒组和对照组小鼠攻毒后体重变化 Figure 1 Changes of body weight of mice in the experimental group and the negative control group |
将加有枸橼酸三钠作为抗凝剂的血液使用BM860血常规分析仪测定小鼠血液中白细胞(WBC)、淋巴细胞(LYM)和血小板(PLT)在攻毒后的变化情况。从图 2中可以看出,小鼠经腹腔注射BVDV后,OregonC24 V组、Z6组和DJ2组的白细胞、淋巴细胞和血小板均降低且低于小鼠正常值。如图 2中A图所示:攻毒第5天,Z6组白细胞低于对照组且差异显著(P < 0.05);攻毒第7天,Z6组和OregonC24 V组白细胞显著低于对照组且差异极显著(P < 0.01),DJ2组与对照组相比差异显著(P < 0.05);攻毒第10天,Z6组与对照组相比差异极显著(P < 0.01),OregonC24 V组与对照组相比差异显著(P < 0.05)。
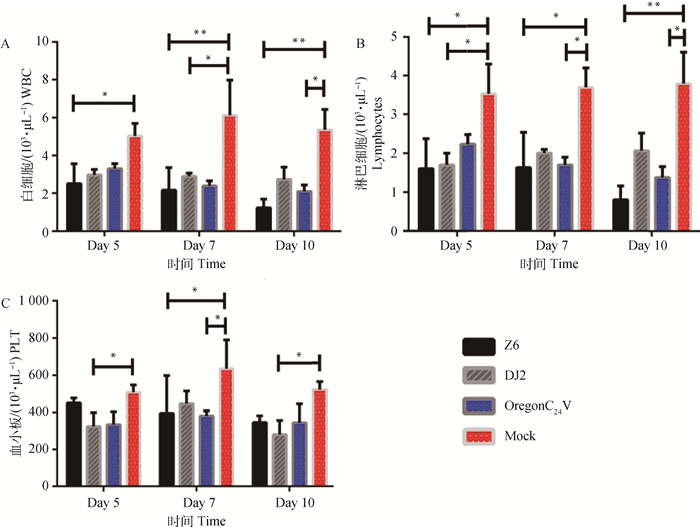
|
*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01) The * indicate significant difference (P < 0.05), the ** indicate extremely significant difference (P < 0.01) 图 2 攻毒组和对照组小鼠攻毒后体内白细胞(图A)、淋巴细胞(图B)、血小板变化图(图C) Figure 2 The changing of leukocyte (Fig.A), lymphocytes (Fig.B), platelets (Fig.C) in infected mice of the experimental group and the negative control mice |
如图 2中B图所示:攻毒第5天,Z6组和DJ2组淋巴细胞显著(P < 0.05)低于对照组;攻毒第7天,Z6组和OregonC24 V组淋巴细胞显著(P < 0.05)低于对照组;攻毒第10天,Z6组淋巴细胞极显著(P < 0.01)低于对照组,OregonC24 V组与对照组相比差异显著(P < 0.05);在整个试验过程中,Z6组和OregonC24 V组淋巴细胞持续降低,攻毒第10天降低到最低。
如图 2中C图所示:攻毒后DJ2组总体呈现先增加后下降的趋势,而Z6组在整个试验过程中持续降低。攻毒第7天,DJ2组血小板含量低于对照组,且差异显著(P < 0.05);Z6组和OregonC24 V组与对照组相比差异显著(P < 0.05);攻毒第7天,DJ2组和对照组血小板含量高于第5和第10天;攻毒第10天,DJ2组血小板与对照组相比差异显著(P < 0.05);而对照组基本保持不变且在正常范围内。血常规结果表明BVDV感染BALB/c小鼠后,能引起小鼠白细胞、淋巴细胞和血小板降低。
2.5 组织病理学变化从组织病理学观察,如图 3所示。攻毒第5天,HE染色可观察到DJ2组十二指肠黏膜下层少量炎性细胞浸润(图 3A),肺出血(图 3D)等病理变化。Z6组小鼠脾红髓内巨噬细胞增多;攻毒第7天,DJ2组和OregonC24 V组肝细胞内可见空泡或颗粒样物质,肺泡内大量蛋白样物质沉积、间质内中性粒细胞浸润(图 3F),其他病理变化与攻毒第5天类似。Z6组十二指肠可见固有层内大量淋巴细胞聚集(图 3B),肝细胞可见空泡样变形(图 3H),少量肝细胞呈灶状坏死和炎性细胞浸润,肺可见部分肺泡萎缩,肺泡腔塌陷,体积明显变小;攻毒第10天,OregonC24 V组肝细胞质内出现少量空泡状物质,肝出血(图 3I),十二指肠肠绒毛上皮细胞及固有层细胞坏死或脱落(图 3C),脾内淋巴细胞和吞噬细胞增多。而DJ2组中肝细胞可见少量颗粒状物质,肝细胞质内出现少量空泡状物质(图 3G),肝窦内可见深染的圆形单核样细胞浸润,脾内淋巴细胞增多,细胞排列致密,空肠黏膜上皮细胞出现坏死、脱落。Z6组肺泡萎缩、血管内大量蛋白样物质沉积(图 3E),脾红髓区域内巨噬细胞不同程度增多,空肠和回肠可见上皮及固有层细胞不同程度的坏死或脱落,坏死区域细胞核溶解消失,细胞质均质红染等病理变化。HE染色结果表明BVDV感染小鼠后可导致组织病理上的变化,且Z6组与DJ2组相比,病理变化更明显,而对照组无明显病理变化。
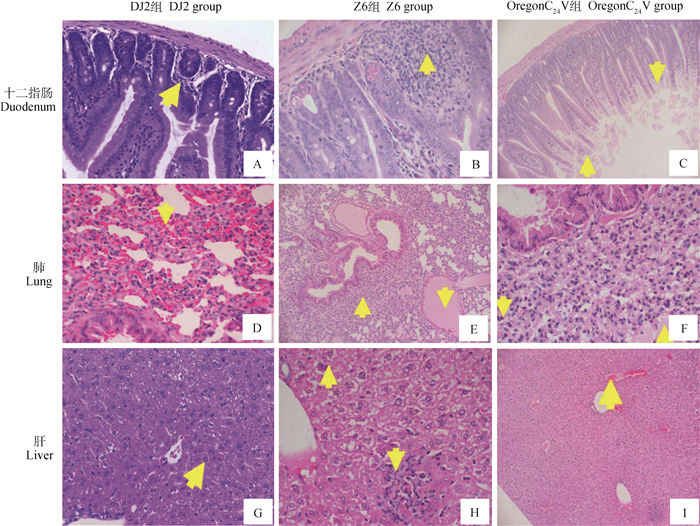
|
A.十二指肠黏膜下层少量炎性细胞浸润(↑),400×;B.十二指肠固有层内大量淋巴细胞聚集(↑),400×;C.十二指肠肠绒毛上皮细胞(↑)及固有层细胞(↓)坏死或脱落,100×;D.肺出血(↓),400×;E.肺泡萎缩(↑)、血管内大量蛋白样物质沉积(↓),100×;F.肺泡内大量蛋白样物质沉积(↑)、间质内中性粒细胞浸润(↓),400×;G.肝细胞质内出现少量空泡状物质(↑),400×;H.肝细胞空泡样变性,400×;I.肝出血(↑),100× A. Duodenal submucosa inflammatory cell infiltration (↑), 400×; B. A large number of lymphocyte aggregates in the duodenal lamina propria (↑), 400×; C. Duodenal villous epithelial cells (↑) and lamina propria cells (↓) necrosis or shedding, 100×; D. Lung hemorrhage (↓), 400×; E. Alveolar atrophy (↑), intravascular deposition of large amounts of protein-like substances (↓), 100×; F. Large amount of protein-like substance deposition in alveoli (↑), intrastromal neutrophil infiltration (↓), 400×; G. A small amount of vacuoles in the cytoplasm of the liver (↑), 400×; H. Liver cell vacuolar degeneration, 400×; I. Liver hemorrhage (↑), 100× 图 3 攻毒小鼠部分主要病理变化(HE染色) Figure 3 Main pathological changes in inoculated mice (HE staining) |
牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)是引起犊牛腹泻的重要病原,给世界养牛行业造成了巨大的经济损失[17]。有研究表明用该病毒对血清学BVDV抗体阴性犊牛以鼻孔喷雾途径进行接种试验,犊牛出现明显的白细胞总数减少、体温升高、呼吸困难等症状[18]。也有研究通过人工感染BVDV后的妊娠母羊和胚胎以及所生羔羊,除了产生明显的临床症状外,剖解还可见消化道黏膜弥散性出血、肠系膜淋巴结肿大等病理变化[19]。有学者证实新西兰兔饮食被BVDV污染的干草,试验第5天兔被成功感染且大多数器官检测呈阳性,淋巴器官出现了典型的组织学变化[20]。相比其他实验动物,小鼠更为方便,因此本试验以BALB/c小鼠为试验动物,通过腹腔注射病毒的方式感染小鼠,小鼠不仅出现了典型的临床症状,而且还表现出病理组织上的变化。
本研究通过腹腔注射致细胞病变的BVDV1型毒株感染BALB/c小鼠后出现了精神萎靡、扎堆、被毛粗糙、腹泻等临床症状。解剖可观察到肝和肺有出血点,脾边缘发绀和肿胀。血常规检测结果表明OregonC24 V组、Z6组和DJ2组小鼠白细胞、淋巴细胞和血小板含量都降低。有研究表明低毒力致细胞病变的BVDV1型毒株能引起小鼠血液中血小板和淋巴细胞的降低[21-22],本研究血常规结果与该结果吻合,而对照组在整个试验过程中,白细胞、淋巴细胞和血小板都明显高于攻毒组,且在正常范围内。荧光定量PCR方法可以从攻毒组小鼠肺、脾、肝和十二指肠等组织以及粪便中不同程度检测到BVDV,且肺和肝中BVDV的检出率明显高于其他组织,Z6组BVDV检出率高于DJ2组,据该试验结果推测小鼠肺和肝可能是BVDV病原的主要复制器官。有学者通过腹腔注射非致细胞病变型BVDV1也能在小鼠不同组织中检测到BVDV病原[23],该结果与本研究类似。
为分析小鼠感染BVDV病原后对组织造成的病理变化,组织HE染色可见肝的静脉周围及肝窦内见少量炎性细胞浸润,肠黏膜出现不同程度的坏死和脱落,在整个试验过程中,Z6组和DJ2组与OregonC24 V组相比,Z6组病理变化最严重,DJ2组较轻。有研究通过口服致细胞病变的BVDV1型毒株感染6~8周龄小鼠后不仅出现了典型的临床症状,且注射高剂量组的小鼠出现体重减轻、白细胞和淋巴细胞下降[21],该研究结果与本研究相符。另外有研究显示通过腹腔注射BVDV的方式感染小鼠没有出现任何典型的临床症状,但BVDV病原能够在试验组的脾中检测到[24],这与本研究结果存在一定的差异,这些差异可能与病毒感染部位以及病毒毒力强弱有关,也有可能是由于病毒感染途径和攻毒剂量的不同所导致。
4 结论以BALB/c小鼠为试验对象,腹腔注射3株致细胞病变BVDV1型毒株。根据临床症状的变化、血常规、HE染色和组织分布等结果,表明成功诱导BALB/c小鼠感染致细胞病变型BVDV。该结果可进一步为BVDV病原感染小鼠动物模型的建立和致病性的研究提供一定的数据参考和指导。
| [1] | HOUE H. Epidemiological features and economical importance of bovine virus diarrhoea virus (BVDV) infections[J]. Vet Microbiol, 1999, 64(2-3): 89–107. DOI: 10.1016/S0378-1135(98)00262-4 |
| [2] | BACHOFEN C, VOGT H R, STALDER H, et al. Persistent infections after natural transmission of bovine viral diarrhoea virus from cattle to goats and among goats[J]. Vet Res, 2013, 44(1): 32. DOI: 10.1186/1297-9716-44-32 |
| [3] | KIRCHGESSNER M S, DUBOVI E J, WHIPPS C M. Spatial point pattern analyses of Bovine viral diarrhea virus infection in domestic livestock herds and concomitant seroprevalence in wild white-tailed deer (Odocoileus virginianus) in New York State, USA[J]. J Vet Diagn Invest, 2013, 25(2): 226–233. DOI: 10.1177/1040638713479121 |
| [4] | PASSLER T, DITCHKOFF S S, GIVENS M D, et al. Transmission of bovine viral diarrhea virus among white-tailed deer (Odocoileus virginianus)[J]. Vet Res, 2010, 41(2): 20. DOI: 10.1051/vetres/2009068 |
| [5] | NELSON D D, DARK M J, BRADWAY D S, et al. Evidence for persistent Bovine viral diarrhea virus infection in a captive mountain goat (Oreamnos americanus)[J]. J Vet Diagn Invest, 2008, 20(6): 752–759. DOI: 10.1177/104063870802000606 |
| [6] | CARMAN S, CARR N, DELAY J, et al. Bovine viral diarrhea virus in alpaca:abortion and persistent infection[J]. J Vet Diagn Invest, 2005, 17(6): 589–593. DOI: 10.1177/104063870501700613 |
| [7] | SEONG G, OEM J K, CHOI K S. The first finding of the ophthalmosteresis in a Korean native calf with bovine viral diarrhea-case report[J]. Vet Arh, 2015, 85(1): 111–116. |
| [8] | DUBOVI E J. Impact of bovine viral diarrhea virus on reproductive performance in cattle[J]. Vet Clin North Am Food Anim Pract, 1994, 10(3): 503–514. DOI: 10.1016/S0749-0720(15)30535-1 |
| [9] | BROWNLIE J, CLARKE M C, HOWARD C J. Experimental production of fatal mucosal disease in cattle[J]. Vet Rec, 1984, 114(22): 535–536. DOI: 10.1136/vr.114.22.535 |
| [10] | CORAPI W V, ELLIOTT R D, FRENCH T W, et al. Thrombocytopenia and hemorrhages in veal calves infected with bovine viral diarrhea virus[J]. J Am Vet Med Assoc, 1990, 196(4): 590–596. |
| [11] | SPAGNUOLO M, KENNEDY S, FOSTER J C, et al. Bovine viral diarrhoea virus infection in bone marrow of experimentally infected calves[J]. J Comp Pathol, 1997, 116(1): 97–100. DOI: 10.1016/S0021-9975(97)80047-3 |
| [12] | WOOD R D, GOENS S D, CARMAN P S, et al. Effect on hematopoietic tissue of experimental infection of calves with noncytopathic type 2 bovine viral diarrhea virus[J]. Can J Vet Res, 2004, 68(1): 42–48. |
| [13] | WALZ P H, BELL T G, STEFICEK B A, et al. Experimental model of type Ⅱ bovine viral diarrhea virus-induced thrombocytopenia in neonatal calves[J]. J Vet Diagn Invest, 1999, 11(6): 505–514. DOI: 10.1177/104063879901100604 |
| [14] | CORAPI W V, FRENCH T W, DUBOVI E J. Severe thrombocytopenia in young calves experimentally infected with noncytopathic bovine viral diarrhea virus[J]. J Virol, 1989, 63(9): 3934–3943. |
| [15] | MARSHALL D J, MOXLEY R A, KELLING C L. Distribution of virus and viral antigen in specific pathogen-free calves following inoculation with noncytopathic bovine viral diarrhea virus[J]. Vet Pathol, 1996, 33(3): 311–318. DOI: 10.1177/030098589603300308 |
| [16] |
王雪枝. 牛病毒性腹泻病毒E0蛋白单抗与多抗制备及实验感染小鼠的研究[D]. 北京: 中国农业科学院, 2014.
WANG X Z. Preparations of monoclonal antibody and polyclonal antibody against E0protein of bovine viral diarrhea virus and experimental infection of mice with the virus[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [17] |
李彩虹, 何文, 王怀禹. 牛病毒性腹泻病毒四川株SC的分离鉴定及其生物学特性分析[J]. 畜牧与兽医, 2017, 49(1): 75–79.
LI C H, HE W, WANG H Y. Isolation and identification of bovine viral diarrhea virus Sichuan strain SC and analysis of its biological characteristics[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(1): 75–79. (in Chinese) |
| [18] |
王炜. 牛主要呼吸道病毒病血清学调查、牛病毒性腹泻病毒分离株鉴定及疫苗研究[D]. 北京: 中国农业科学院, 2014.
WANG W. Serosurvey of major bovine resporitary viruses and identification of BVDV isolates and vaccine development[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [19] |
周霞. BVDV在人工感染绵羊体内抗原定位的试验研究[D]. 乌鲁木齐: 新疆农业大学, 2001.
ZHOU X. Study on antigen location of BVDV in artifical infected sheep[D]. Urumchi: Xinjiang Agricultural University, 2001. (in Chinese) |
| [20] | BACHOFEN C, GRANT D M, WILLOUGHBY K, et al. Experimental infection of rabbits with bovine viral diarrhoea virus by a natural route of exposure[J]. Vet Res, 2014, 45(1): 34. DOI: 10.1186/1297-9716-45-34 |
| [21] | SEONG G, LEE J S, LEE K H, et al. Experimental infection with cytopathic bovine viral diarrhea virus in mice induces megakaryopoiesis in the spleen and bone marrow[J]. Arch Virol, 2016, 161(2): 417–424. DOI: 10.1007/s00705-015-2649-y |
| [22] | RAYA A I, GOMEZ-VILLAMANDOS J C, BAUTISTA M J. Role of thymic epithelial cells in lymphoid depletion after experimental infection with the noncytopathogenic BVDV1 strain 7443[J]. Vet Pathol, 2015, 52(2): 291–294. DOI: 10.1177/0300985814535610 |
| [23] | SEONG G, LEE J S, LEE K H, et al. Noncytopathic bovine viral diarrhea virus 2 impairs virus control in a mouse model[J]. Arch Virol, 2016, 161(2): 395–403. DOI: 10.1007/s00705-015-2665-y |
| [24] | SEONG G, OEM J K, LEE K H, et al. Experimental infection of mice with bovine viral diarrhea virus[J]. Arch Virol, 2015, 160(6): 1565–1571. DOI: 10.1007/s00705-015-2412-4 |



