2. 浙江省农业科学院畜牧兽医研究所, 杭州 310021
2. Institute of Animal Husbandry and Veterinary Medicine of Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
鸭瘟病毒(duck plaque virus, DPV)是引起鸭、鹅和天鹅等雁形目鸭科水禽发生一种称为鸭瘟的急性、败血性、高度致死性传染病病原[1-2],又被称为鸭肠炎病毒。DPV为疱疹病毒科α疱疹病毒亚科马立克病毒属鸭甲疱疹病毒1型成员[2-3],基因组为双股线性DNA,不同毒株的基因组全长存在差异,在158~162 kb,包含长独特区(UL)、内部反向重复序列(IRS)、短独特区(US)及末端反向重复序列区(TRS),包含约78个开放阅读框(ORFs)[3-6],即基因组结构为UL-IRS-US-TRS。
Baudet等于1923年首次报道鸭瘟在荷兰发生。黄引贤[7]于1957年报道了我国广州出现首例鸭瘟病例。DPV可感染不同品种及日龄的鸭,鸭瘟传播迅速、流行广泛,发病急、死亡率高,是危害养鸭业的主要疫病之一。近年来该病的流行出现了一些新的变化,如低日龄鸭发病增多,DPV对鸭的致病力减弱,免疫鸭群仍出现典型的鸭瘟[8-10]或非典型的鸭瘟病例等[11-13]。福建省曾于1998年出现樱桃谷肉鸭感染鸭瘟的病例,此后至2015年的17年间均未见发生鸭瘟的报道。然而2016年初开始,福建省部分地区肉鸭陆续出现疑似鸭瘟的病例[10],2017年该病仍在鸭群中持续蔓延。本研究采集了2016—2017年福建不同地区37份临床疑似感染DPV的病死鸭肝、食道组织,对样品进行检测、病毒分离以及部分基因的序列分析,以明确近年来在福建省鸭群中新流行的DPV分子特征,为新流行鸭瘟的快速确切诊断和防控提供科学依据。
1 材料与方法 1.1 样品的来源及处理样品为2016—2017年自福建不同地区送检的疑似感染DPV病例样品,共计37份。采集的样品经磨碎后与含抗生素的0.01 mol·L-1磷酸缓冲盐溶液(PBS,pH 7.2)按1:3的比例制成悬浮液,将上述组织悬浮液冻融3次后,保存于-80 ℃备用。
1.2 临床样品的检测及病毒分离鉴定将处理好的临床样品离心后取上清,应用EasyPure Viral DNA/RNA Kit(北京全式金生物技术有限公司)提取病毒DNA。参照Plummer等[14]提供的方法进行DPV的PCR检测。获得的阳性样品经尿囊腔接种10日龄非免疫鸭胚,弃24 h内死亡鸭胚,无菌收集24~120 h内死亡鸭胚和120 h仍未死亡鸭胚尿囊液,收获的鸭胚尿囊液经PCR检测为DPV阳性的分装保存于-80 ℃备用。
1.3 DPV部分基因的PCR扩增应用EasyPure Viral DNA/RNA Kit提取所有DPV阳性鸭胚尿囊液中的病毒DNA,应用高保真酶Phanta Super-Fidelity DNA Polymerase(南京诺唯赞生物科技有限公司)扩增24株DPV分离株UL区域的UL56/LORF5(约4 kb)、TK/gH(约4 kb)基因、UL2/UL1(约0.7 kb),扩增引物见表 1。反应液参照高保真酶使用说明配制,PCR反应条件:95 ℃预变性3 min;随后94 ℃ 30 s,50~58 ℃ 30 s,72 ℃ 2 min,进行35个循环;最后72 ℃延伸7 min结束反应,经1%琼脂凝胶电泳为阳性的PCR产物纯化回收后送福州铂尚生物技术有限公司测序。
|
|
表 1 本试验用扩增引物 Table 1 The sequences of primer used in this study |
应用生物学软件Lasergene 7.0和MEGA 5.1对测序结果进行拼接、编辑,并进行核苷酸变异及同源性分析;再运用MEGA5.1软件中邻接法Neighbor-Joining(Kimuar2-parameter算法)分析DPV分离株间的进化发育关系,构建病毒遗传进化树,利用自展法(Bootstrap Method)检验进化树的可靠性,共进行1 000次重复分析。
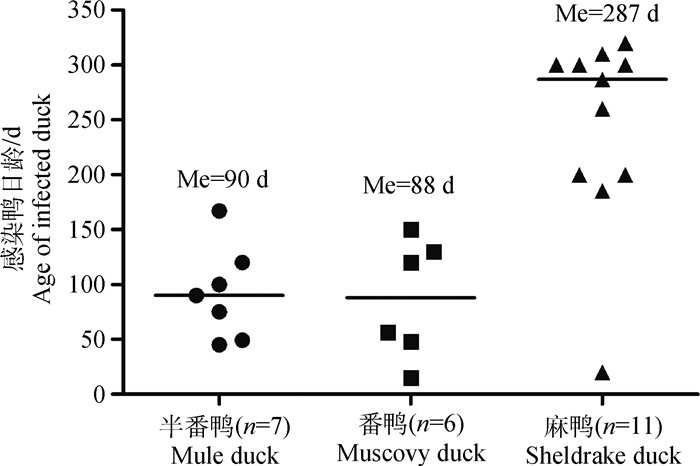
2 结果 2.1 DPV的分离与鉴定参照Plummer等[14]提供的方法从37份临床样品中检测到24份DPV阳性样品,阳性率为65%,将24份阳性样品接种10日龄非免疫鸭胚后,收集所有鸭胚尿囊液并进行PCR检测。PCR扩增产物经1%琼脂凝胶电泳显示,24份尿囊液均扩增到目的条带,回收纯化扩增产物进行测序,表明所有扩增产物均为DPV基因片段。以上结果表明,24份阳性样品均成功分离到DPV,其中2016年分离到14株,2017年分离到10株(表 2)。从表 2可发现,感染鸭的品种包括半番鸭、番鸭及麻鸭,感染鸭日龄从15至320 d均有。对感染鸭的日龄进行统计分析发现,半番鸭和番鸭感染DPV的日龄中位值(Me)分别为90和88 d,而麻鸭感染DPV的日龄中位值为287 d(图 1)。
|
|
表 2 临床样品分离的DPV毒株信息 Table 2 The information of DPV strains isolated from clinical samples |
|
n. DPV病毒阳性样本数;Me.感染鸭日龄中位值 n. Number of DPV-positive samples; Me. Medium value of DPV-positive-duck age 图 1 感染DPV鸭日龄统计分析 Figure 1 Statistical analysis of the DPV-positive duck age |
本研究对24株DPV分离株的UL56/LORF5区域进行扩增,获得了2 432—6 262 bp间约3.83 kb的片段(GenBank ID为MH401564~MH401587),所分离病毒间序列相似性在99.7%以上,与我国鸭群中分离的DPV强毒株CHv、LH2011、CV(又标记为CSC)及CV同源传代毒株序列相似性极高,核苷酸相似性介于99.5%~99.8%,与疫苗株VAC或弱毒株(C-KCE和K)、其他地区的强毒分离株,如毒株2085(德国)、Holland(美国)的基因序列相似性在98.9%左右。值得注意的是毒株2085、Holland、Jansen和D11-JW-016(韩国)等4株病毒在基因组核苷酸2 561位后(核苷酸位置参照毒株CV基因组序列,下同)出现了1 167 bp的连续缺失,毒株Clone-03在2 703位核苷酸后出现了1 929 bp的连续缺失,疫苗株VAC或弱毒株(C-KCE和K)在2 715位后出现了3 513 bp核苷酸的连续缺失,本研究分离的24株病毒与我国的强毒株在该区域均未出现核苷酸的缺失或插入。
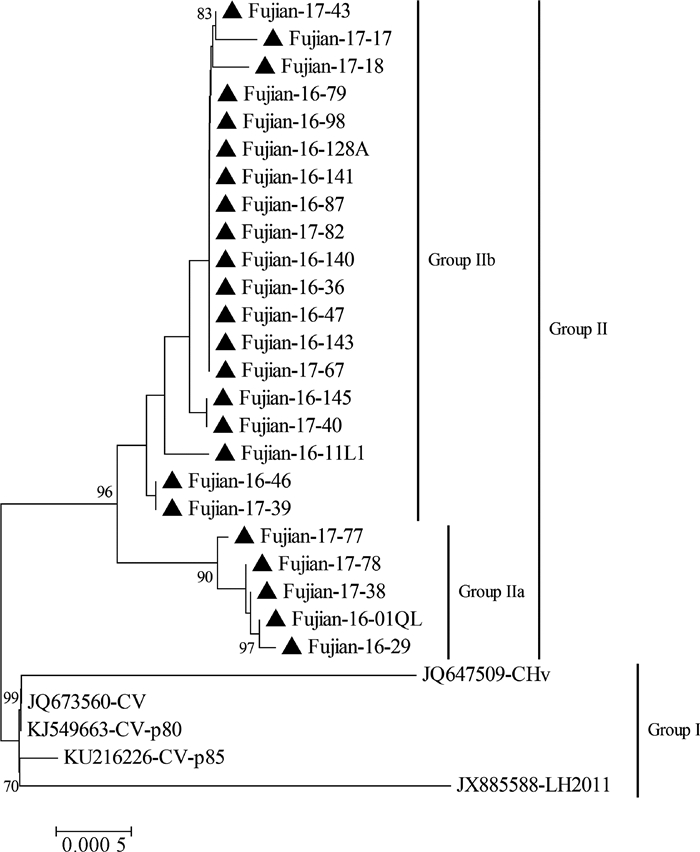
基于该扩增片段的分子系统进化分析表明,所有在该区域未出现基因缺失的毒株形成了2个不同进化分支(图 2),其中强毒株CHv、LH2011、CV及其传代毒株构成了进化分支Group Ⅰ,本研究分离的24株病毒构成了一个大的进化分支Group Ⅱ,这些分离株又形成2个不同的进化群,Fujian-16-01QL、Fujian-16-29、Fujian-17-38、Fujian-17-77和Fujian-17-78等5株病毒构成了Group Ⅱa进化分支,其余19株病毒形成Group Ⅱb进化分支(图 2),各分离毒株20余位点存在核苷酸差异,其中10个位点的核苷酸存在群特异性(表 3)。
|
标注黑三角(▲)的毒株为本研究分离毒株;图中树结处的阿拉伯数字为Bootstrap检验置信值(1 000次重复),低于75的置信值未显示 Virus marked with black triangle (▲) were isolated in this study; Arabia numbers on the tree node represented confidence values from bootstrap test (1 000 replicates), confidence values less than 75 were not shown 图 2 基于UL56/LORF5基因的DPV分子系统进化分析 Figure 2 Phylogenetic analysis of DPV based on UL56/LORF5 gene |
|
|
表 3 分离株不同进化分支间的差异核苷酸 Table 3 Differential nucleotides among different viral lineages |
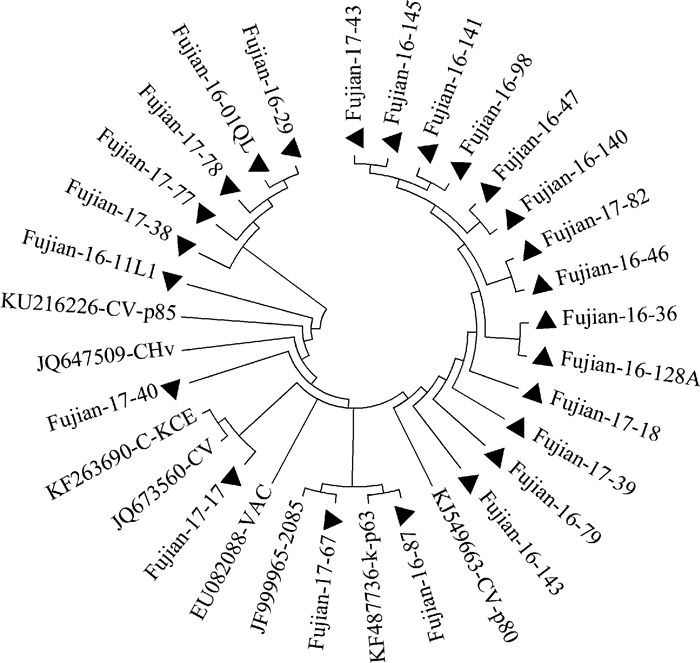
本研究扩增获得了DPV 77 919—82 004 bp区域TK/gH基因约4.1 kb的片段(GenBank ID为MH401612~MH401635),所有24株分离病毒与GenBank中登录的DPV毒株该区域的核苷酸相似性在99.9%以上,未出现基因的缺失或插入,基于该基因区域的分子系统进化分析结果与基于UL56/LORF5区域的系统进化分析结果类似,所分离的24株病毒中,Fujian-16-01QL等5株病毒构成一个进化分支,其余的19株病毒构成另外一个进化分支(图 3)。24株分离毒株与GenBank已登录的病毒株该区域的序列高度保守,但不同毒株在78 577、78 866及79 333 bp 3个位点的核苷酸存在差异,这3个位点均处于TK基因中。毒株FJ-16-01QL、FJ-16-29、FJ-17-77和FJ-17-78在78 577位的核苷酸为胞嘧啶(C),其余20株病毒及GenBank已登录的毒株均为胸腺嘧啶(T);毒株FJ-16-36、FJ-16-46、FJ-16-47、FJ-16-98、FJ-16-128A、FJ-16-140、FJ-16-141、FJ-16-145、FJ-17-18、FJ-17-43和FJ-17-82等11株病毒在78 866位的核苷酸为胸腺嘧啶(T),其余13株病毒及GenBank已登录的毒株均为胞嘧啶(C);Fujian-16-01QL、Fujian-16-29、Fujian-17-38、Fujian-17-77和Fujian-17-78等5株病毒在79 333位的核苷酸为腺嘌呤(A),其余19株病毒及GenBank已登录的毒株均为胞嘧啶(C)。
|
标注黑三角(▲)的毒株为本研究分离毒株 Viruses marked with black triangle (▲) were isolated in this study 图 3 基于TK/gH基因的DPV分子系统进化分析 Figure 3 Phylogenetic analysis of DPV based on the TK gene and gH gene |
本研究扩增获得了DPV 115 106—115 889 bp区域UL2/UL1基因约0.78 kb的片段(GenBank ID为MH401588~MH401611),所有24株分离病毒该区域的序列高度保守,与GenBank中登录的DPV强毒株CV、CHv、2085及2016年广西分离株Yulin/2016/30D(KX925439.1)和Yulin/2016/60D(KX925440.1)的核苷酸相似性均在99.9%以上,而疫苗株VAC或致弱毒株C-KCE和K从115 223位后开始出现524 bp的连续缺失,另外与其他毒株相比,疫苗株VAC在115 160、115 165及115 208位后均有一个腺嘌呤碱基(A)插入。
3 讨论鸭瘟自1957年在我国被发现以来已有60多年,尽管各地陆续出现报道,但各分离毒株的抗原性高度保守,疫苗的使用对该病的控制取得了显著效果[2]。然而,近年来,临床上病例报道日渐增多,部分免疫过鸭瘟疫苗的鸭群依然发生该病[9-11],鸭瘟的地方性流行已不容忽视。本研究对2016—2017年福建省鸭群中流行的鸭瘟病毒流行状况调查发现,低日龄鸭发生鸭瘟的病例日渐增多,且易感日龄存在品种差异。流行病学统计发现,确诊的24个病例为肉用番鸭、半番鸭及麻鸭;半番鸭和番鸭感染DPV的日龄中位值(Me)分别为90和88 d,而麻鸭感染DPV的日龄中位值为287 d(图 1),即半番鸭及番鸭多在青年期较易感染DPV,而麻鸭则在产蛋高峰期更易感染该病毒。鉴于这种品种间的易感日龄差异,建议对以上不同鸭品种制定针对性鸭瘟疫苗免疫程序,以免因免疫程序不当造成的免疫失败。对于24个发病鸭群,经调查其中17个鸭群分别于发病前不同时间免疫过不同羽份量的鸭瘟弱毒疫苗,但依然发病,且病死率很高,这可能与疫苗运输和保存不当、疫苗质量不稳定等有关,为此建议鸭瘟疫苗生产企业、经销单位予以重视。至于新流行鸭瘟病毒是否发生抗原性变异,尚需进一步研究明确。
据DPV基因组5′末端UL区域(UL56/LORF5)基因缺失情况,可将现有的DPV大致分为四类,一类是以我国参考毒株CV株(又称为CSC株)及CHv株为代表的强毒株,其基因组最长,在162 kb以上[5-6, 15-17];第二类是以德国毒株2085为代表的强毒株,其基因组在2 561位(参照毒株CV基因组序列,下同)后出现了1 171 bp的连续缺失[15, 18],另外登录在GenBank数据库中的美国Holland分离株、法国Jansen分离株及韩国D11-JW-016分离株均在该区域出现相同片段缺失;第三类是以Clone-03为代表的毒株,其基因组在2 703位核苷酸后出现了1 930 bp的连续缺失[19-20];第四类是以疫苗株VAC为代表,这类病毒基因组全长158 kb左右,在基因组2 715位后出现了3 513 bp核苷酸的连续缺失[4, 15],弱毒株C-KCE和K也在该区域出现相同的基因缺失[21-22]。本研究所分离的24株毒株在基因组变异较大的5′末端UL区域(UL56/LORF5)均未出现基因连续缺失。尽管所分离的24株病毒之间及与我国强毒参考株CV及CHv等毒株间同源性极高,但前者与后者在5′末端UL区域(UL56/LORF5)存在30多个核苷酸差异。系统进化分析表明,所有已报道的在该区域未出现连续缺失的毒株演化成了2个不同进化分支(图 2),本研究分离的24株病毒构成了一个新的进化分支(Group Ⅱ),且这些分离株存在不同程度的差异,在Group Ⅰ、Group Ⅱa和Group Ⅱb 3个群之间存在10个进化分支特异性的差异性核苷酸位点(表 3)。可见,当前在鸭群中流行的DPV出现了不同程度的、有规律的变异,毒株在流行过程中形成了不同的进化亚分支。目前还不清楚这些变异是否会改变病毒的抗原性,是否与毒株持续在鸭群、甚至在免疫鸭群中流行相关。
本研究对24株病毒的TK基因及gH基因分析表明,尽管该区域与GenBank中登录的DPV毒株有极高的序列同源性,但在TK基因中还是存在3位点的差异,且其中2个位点(78 577 bp及79 333 bp)变异的毒株均为上述Group Ⅱa进化分支中的毒株。根据DPV基因组3′末端UL区域可将现有的DPV大致可分为两群病毒,一群是以CV、CHv及2085等强毒株为代表的毒株,在3′末端UL区域(UL2基因)未出现基因的缺失[6, 17, 19],另一群是疫苗株VAC或致弱毒株C-KCE和K等毒株,其基因组在115 223位(参照毒株CV基因组序列)后开始出现524 bp的连续缺失[4, 15, 21-22]。本研究所分离的24株DPV与我国DPV参考强毒CV、CHv及其他流行毒株在该区域的序列相似性达到100%,未出现连续的基因缺失。以上结果表明,所分离的24株病毒TK、gH及UL2基因区域在传播流行过程中高度保守。
4 结论对2016—2017年福建省鸭群中发生的鸭瘟流行状况及其病毒的分子特征进行了分析,发现鸭感染DPV存在品种间的易感日龄差异,当前新流行的DPV与我国参考强毒株的分子特征相近,但在部分基因上已出现不同程度的变异,应加强对新流行DPV的分子流行病学监测,以实时了解其变异情况。
| [1] |
SAIF Y M.禽病学[M].苏敬良, 高福, 索勋, 译. 12版.北京: 中国农业出版社, 2012: 444-454.
SAIF Y M. Diseases of poultry[M]. SU J L, GAO F, SUO X, trans. 12th ed. Beijing: China Agriculture Press, 2012: 444-454. (in Chinese) |
| [2] |
苏敬良, 黄瑜, 胡薛英.
鸭病学[M]. 北京: 中国农业大学出版社, 2016: 63-80.
SU J L, HUANG Y, HU X Y. Duck diseases[M]. Beijing: China Agricultural University Press, 2016: 63-80. (in Chinese) |
| [3] | YANG C H, ZHANG B, LI J P, et al. Complete genomic sequence of a duck enteritis virus attenuated via serial passage in chick embryos[J]. Arch Virol, 2017, 162(11): 3549–3550. DOI: 10.1007/s00705-017-3491-1 |
| [4] | LI Y F, HUANG B, MA X L, et al. Molecular characterization of the genome of duck enteritis virus[J]. Virology, 2009, 391(2): 151–161. DOI: 10.1016/j.virol.2009.06.018 |
| [5] | WU Y, CHENG A C, WANG M S, et al. Complete genomic sequence of Chinese virulent duck enteritis virus[J]. J Virol, 2012, 86(10): 5965. DOI: 10.1128/JVI.00529-12 |
| [6] | YANG C H, LI Q H, LI J P, et al. Comparative genomic sequence analysis between a standard challenge strain and a vaccine strain of duck enteritis virus in China[J]. Virus Genes, 2014, 48(2): 296–303. DOI: 10.1007/s11262-013-1009-9 |
| [7] |
黄引贤. 拟鸭瘟的研究[J]. 华南农学院学报, 1959(1): 67–78.
HUANG Y X. A study of suspected duck plague[J]. Journal of South China Agricultural University, 1959(1): 67–78. (in Chinese) |
| [8] |
孟刚, 王经满, 曹瑞兵. 2株鸭瘟病毒强毒株的分离鉴定[J]. 畜牧与兽医, 2012, 44(4): 59–62.
MENG G, WANG J M, CAO R B. Isolation and identification of 2 strains of duck plague virus[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(4): 59–62. (in Chinese) |
| [9] |
姜甜甜, 张大丙. 鸭瘟强毒与疫苗毒的囊膜糖蛋白序列比较[J]. 中国兽医杂志, 2013, 49(2): 3–7.
JIANG T T, ZHANG D B. Comparison of the glycoprotein sequences between virulent and attenuated strains of Anatid herpesvirus 1[J]. Chinese Journal of Veterinary Medicine, 2013, 49(2): 3–7. DOI: 10.3969/j.issn.0529-6005.2013.02.001 (in Chinese) |
| [10] |
刘荣昌, 黄瑜, 卢荣辉, 等. 鸭瘟病毒的分离鉴定及其UL 2、TK基因序列分析[J]. 福建农业学报, 2016, 31(12): 1257–1261.
LIU R C, HUANG Y, LU R H, et al. Isolation and identification of Duck plague virus and sequence analysis on its UL 2 and TK gene[J]. Fujian Journal of Agricultural Sciences, 2016, 31(12): 1257–1261. (in Chinese) |
| [11] |
吕桂霞, 刁有祥, 刘月林. 一种"新型鸭瘟"的报道[J]. 山东家禽, 2001(6): 18–19.
LV G X, DIAO Y X, LIU Y L. Case report on one new duck plague[J]. Shandong Poultry, 2001(6): 18–19. DOI: 10.3969/j.issn.1673-1085.2001.06.006 (in Chinese) |
| [12] |
岳华, 刘群, 汤承, 等. "鸭传染性肿头症"病毒的分离及部分特性研究[J]. 西南民族大学学报:自然科学版, 2002, 28(3): 314–316.
YUE H, LIU Q, TANG C, et al. Isolation and characterization of duck "infectious swollen head" virus[J]. Journal of Southwest University for Nationalities:Natural Science Edition, 2002, 28(3): 314–316. (in Chinese) |
| [13] |
丁巧玲, 袁生, 李建军, 等. 广东部分地区发生"新型鸭瘟"的初步诊断报告[J]. 广东畜牧兽医科技, 2006, 31(4): 28, 32.
DING Q L, YUAN S, LI J J, et al. Primary diagnosis report of "a new type duck plague" occurred in some areas of Guangdong province[J]. Guangdong Journal of Animal and Veterinary Science, 2006, 31(4): 28, 32. (in Chinese) |
| [14] | PLUMMER P J, ALEFANTIS T, KAPLAN S, et al. Detection of duck enteritis virus by polymerase chain reaction[J]. Avian Dis, 1998, 42(3): 554–564. DOI: 10.2307/1592682 |
| [15] | WU Y, CHENG A C, WANG M S, et al. Comparative genomic analysis of duck enteritis virus strains[J]. J Virol, 2012, 86(24): 13841–13842. DOI: 10.1128/JVI.01517-12 |
| [16] |
吴英.鸭瘟病毒中国强毒株基因组解析及UL55基因功能初步研究[D].雅安: 四川农业大学, 2015.
WU Y. A preliminary study on the genome analysis and UL55 gene function of the duck plague virus in China[D]. Ya'an: Sichuan Agricultural University, 2015. (in Chinese) |
| [17] |
王继春, 张传健, 许梦微, 等. 鸭瘟病毒LH2011强毒株部分基因序列的测定与分析[J]. 江苏农业学报, 2013, 29(5): 1086–1091.
WANG J C, ZHANG C J, XU M W, et al. Sequencing and analysis of several genes of a virulent duck enteritis virus strain LH2011[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(5): 1086–1091. DOI: 10.3969/j.issn.1000-4440.2013.05.026 (in Chinese) |
| [18] | WANG J C, HÖPER D, BEER M, et al. Complete genome sequence of virulent duck enteritis virus (DEV) strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains[J]. Virus Res, 2011, 160(1-2): 316–325. DOI: 10.1016/j.virusres.2011.07.004 |
| [19] | LIU S W, LI H X, LI Y, et al. Phylogeny of duck enteritis virus:evolutionary relationship in the family herpesviridae[J]. Intervirology, 2008, 51(3): 151–165. DOI: 10.1159/000146865 |
| [20] | LIU X L, HAN Z X, SHAO Y H, et al. Different linkages in the long and short regions of the genomes of duck enteritis virus Clone-03 and VAC Strains[J]. Virol J, 2011, 8: 200. DOI: 10.1186/1743-422X-8-200 |
| [21] | LIU F Y, MA B, ZHAO Y, et al. Characterization of the gene encoding glycoprotein C of duck enteritis virus[J]. Virus Genes, 2008, 37(3): 328–332. DOI: 10.1007/s11262-008-0266-5 |
| [22] | YANG C H, LI J P, LI Q H, et al. Complete genome sequence of an attenuated duck enteritis virus obtained by in vitro serial passage[J]. Genome Announc, 2013, 1(5): e00685–e00713. |



