2. 中国农业科学院家畜品种改良与繁育工程技术研究中心, 北京 100193;
3. 山东奥克斯畜牧种业有限公司, 济南 250100
2. Center of Domestic Animal Reproduction and Breeding, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Shandong OX Livestock Breeding Co., Ltd, Jinan 250100, China
家畜精液冷冻保存与应用对畜牧业生产具有重要的经济意义,然而家畜精液在体外降温、冷冻、解冻和离心处理等过程中产生过量活性氧自由基(reactive oxygen species, ROS)却降低精子活力和运动能力,改变质膜脂质组分和顶体结构,甚至造成精子染色体和DNA片段化,最终对精子功能造成损伤[1-2]。由于精子的胞质体积较小且抗氧化系统中抗氧化酶浓度较低,不足以清除精子在体外处理过程中产生的过量ROS,从而使精子结构发生改变,最终降低受精能力和早期胚胎发育能力。精液处理过程中添加褪黑素[3]、维生素C[4]、白藜芦醇[5]等不同抗氧化剂均能降低冷冻对精子造成的损伤,保护精子结构完整性,提高精子活力及受精能力。
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)作为绿茶中一种具有强抗氧化能力的生物活性化合物通过清除超氧阴离子和羟自由基、螯合金属离子和增强其他抗氧化酶活性等途径发挥抗氧化作用[6-7]。EGCG在缓解和削弱氧化应激引发的疾病,尤其是在治疗雌性和雄性不育方面发挥着重要作用[8-12]。低浓度EGCG孵育精子提高了男性精子活力、运动能力以及调控细胞存活的蛋白质磷酸化水平[13]。不同浓度EGCG与猪冷冻-解冻精液共孵育,虽然对精子活力和顶体完整率无显著影响,但孵育后精子受精能力显著提高[14]。
虽然EGCG抗氧化作用在不同细胞系中研究十分广泛[6, 15],但其对牛冷冻-解冻精液品质影响的相关研究较少。本试验探究不同浓度EGCG孵育牛冷冻-解冻精液对精子动力学参数、结构完整性、精子中相关酶活性及受精后早期胚胎发育能力的影响,以期为提高牛冻精的利用效率提供一定的理论基础。
1 材料与方法 1.1 试验材料荷斯坦奶牛冻精购自于山东奥克斯畜牧种业有限公司。
1.2 试剂与仪器除特别注明外,本试验所用试剂均购于西格玛奥德里奇贸易有限公司(上海)。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、乳酸脱氢酶(lactate dehydrogenase, LDH)、谷草转氨酶(aspartate transaminase, AST/glutamic oxalo acetic transaminase, GOT)活力测定试剂盒,丙二醛(malondialdehyde, MDA)含量测定试剂盒,JC-1染色试剂盒均购于南京建成生物工程研究所;计算机辅助精子分析系统(Minitube, 德国);倒置荧光显微镜(尼康Eclipse TE2000-s,日本);CO2培养箱(Thermo Scientific);全自动酶标仪(SpectraMax M5, Molecular Devices, 美国)。
1.3 牛冷冻-解冻精液孵育从液氮罐中取出荷斯坦奶牛冻精在38℃水浴锅中解冻30 s,分别用6 mL洗精液将精液洗涤两次(1 800 r·min-1离心8 min),用含有不同浓度EGCG(0、5、10和20 μmol·L-1)的洗精液将精子密度稀释至(2~10)×106·mL-1后,38.5 ℃孵育1 h[16]。洗精液以BO液(Brackett and Olipant)为基础液添加10 mmol·L-1咖啡因和4 mg·mL-1牛血清白蛋白。
1.4 EGCG处理牛冷冻-解冻精液的动力学参数测定将EGCG处理后精液轻轻吹打混匀后,取4 μL涂于已预热的载玻片上,然后轻轻盖上盖玻片,将玻片置于精子分析仪显微镜载物台上并调整视野,每张玻片测定精子数不少于200个,每个处理组重复3次。测定参数包括精子总活力(TM,%)、前进式活力(PR, %)、曲线速度(VCL, μm·s-1)、直线速度(VSL, μm·s-1)、平均路径速度(VAP, μm·s-1)、鞭打频率(BCF, Hz)、平均横向位移(ALH, μm)、直线系数(STR, %)、线性系数(LIN, %)和摆动系数(WOB, %)。
1.5 EGCG处理牛冷冻-解冻精子结构完整性测定 1.5.1 质膜完整性检测低渗肿胀法(hypoosmotic swelling test, HOST)检测精子质膜完整性,即取EGCG处理后精液50 μL置于1.5 mL离心管中,向其中加入已预热的低渗溶液(0.735 g柠檬酸钠和1.350 g果糖溶于100 mL超纯水)1 mL,38.5 ℃孵育30 min。取低渗溶液孵育后的精液5 μL置于已预热的载玻片上,压片后显微镜观察精子尾部弯曲状态并照相,统计精子尾部卷曲成“g”型的质膜完整精子。
1.5.2 顶体完整性检测将EGCG处理的精液混合均匀,加入50 μL 1 mg·mL-1 FITC,38.5 ℃避光孵育30 min,再加入5 μL 1 mg·mL-1 PI,38.5 ℃避光孵育10 min。用DPBS洗涤(1 800 r·min-1离心8 min)3遍以去除染液,将精子密度稀释至(2~10)×106·mL-1,压片置于荧光显微镜下,观察顶体损伤状况并照相,每张玻片统计至少200个精子,每个处理组重复3次。头部染成绿色的精子为顶体损伤精子,头部染成红色的精子为顶体完整的死精子,头部既被染成绿色又被染成红色的精子为顶体损伤的死精子。本试验只统计没被染上颜色的精子即顶体完整的活精子。
1.5.3 线粒体膜完整性检测JC-1染色试剂盒检测线粒体膜完整性,具体步骤:向EGCG处理后的精液中加入JC-1工作染液,38.5 ℃避光孵育20 min,1 800 r·min-1离心8 min,加入染色结合液离心洗涤两次,以去除染液,最后将精子密度稀释至(2~10)×106·mL-1,压片,荧光显微镜下观察并照相,每张玻片统计至少200个精子,每个处理组重复3次。线粒体段被染成黄色的精子为线粒体膜电位高的精子,被染成绿色的精子为线粒体膜电位低的精子。本试验中只统计线粒体膜电位高的精子即为线粒体膜完整的精子。
1.6 EGCG处理牛冷冻-解冻精液相关酶活性测定 1.6.1 样品准备精子中酶的粗提参照Shen等[17]方法,将不同浓度EGCG孵育后的精子25 ℃ 1 600 r·min-1离心5 min,弃上清,沉淀用360 μL 1% Triton-100稀释并重悬,静置抽提20 min,4 ℃ 4 000 g离心30 min,最后收集上清,即精子中酶粗提物作为待测样品。
Bradford法蛋白浓度测定试剂盒测定每个样品的蛋白浓度。将蛋白质样品或稀释的BSA与Bradford试剂混合,595 nm处测定吸光度值,根据BSA标准曲线计算样品蛋白质浓度。
1.6.2 SOD、CAT、LDH和AST酶活力检测黄嘌呤氧化法测定样品SOD活力,全自动酶标仪测定450 nm处吸光度值,并将反应体系中SOD抑制率达50%时所对应的酶量定义为一个SOD活力单位(U)。
钼酸铵显色法测定CAT活力,CAT分解H2O2的反应可通过加入钼酸铵而迅速终止,剩余的H2O2与钼酸铵作用产生一种淡黄色络合物,测定405 nm处吸光度值,计算CAT活力。
LDH活力的测定,LDH能够催化乳酸生成丙酮酸,丙酮酸与2, 4-二硝基苯肼生成丙酮酸二硝基苯腙,在碱性溶液中呈棕红色,测定450 nm吸光度值,计算酶活力。
AST使α-酮戊二酸和天冬门氨酸移换氨基和酮基,生成谷氨酸和草酰乙酸,草酰乙酸在反应过程中可自发脱酸并生成丙酮酸。丙酮酸与2, 4-二硝基苯肼反应生成2, 4-二硝基苯腙,在碱性溶液中呈红棕色,测定510 nm处吸光度值,制作标准曲线,计算酶活力。以上相关酶活力的测定严格遵照试剂盒说明书进行测定。
1.6.3 MDA含量测定过氧化脂质降解产物MDA与硫代巴比妥酸(TBA)缩合,形成红色产物,测定532 nm处吸光度值,具体步骤参照MDA试剂盒说明书。
1.7 EGCG处理牛冷冻-解冻精液体外受精能力检测 1.7.1 牛卵母细胞的采集牛卵巢采自河北省屠宰场,保存于28~30 ℃生理盐水,2 h内运至实验室。用含有青、链霉素的37 ℃生理盐水洗涤卵巢3次。采用真空泵和18号针头抽取直径为2~6 mm卵泡中的卵泡液,并在显微镜下从卵泡液沉淀中挑选出包含3层及3层以上卵丘细胞且胞质均匀的卵丘-卵母细胞复合体(cumulus-oocyte complexes, COCs)。将COCs在预先平衡的体外成熟(in vitro maturation, IVM)培养液中洗3遍,放入四孔板中,每孔IVM培养液(750 μL)培养50枚COCs,置于38.5 ℃、5% CO2、饱和湿度的培养箱中培养22~24 h。体外成熟培养液包含TCM-199(Gibco)、0.01 IU·mL-1 FSH、10 IU·mL-1 LH、1 μg·mL-1 E2和10% (v/v) FBS(Gibco)。
1.7.2 体外受精体外受精方法与Pang等[18]相同,将成熟后的COCs在预先平衡2 h的受精滴中洗涤3次,并去除外周部分卵丘细胞。然后将COCs放于50 μL的受精滴中,每滴放入15~20枚COCs。向受精滴中加入50 μL经不同浓度EGCG处理的精液。最后将精子和卵母细胞在38.5 ℃、5% CO2、饱和湿度的培养箱中共孵育8~16 h。
1.7.3 体外胚胎培养利用玻璃针去除体外受精后8~16 h受精卵外周卵丘细胞,然后将受精卵在前期胚胎培养液中洗3遍,放入38.5 ℃、5%CO2、饱和湿度的培养箱中培养48 h,换入后期胚胎培养液,此后每隔48 h进行半量换液,并在第2和第7天分别统计早期胚胎的卵裂率和囊胚率。胚胎培养液以CRlaa[19]为基础液,前期胚胎培养液添加6 mg·mL-1 BSA,后期胚胎培养液添加10% (v/v) FBS。
1.8 统计分析所有试验至少进行3次重复,采用SAS统计软件中One-way ANOVA程序分析试验数据,结果以“平均值±标准差”表示,P < 0.05表示差异显著。
2 结果 2.1 EGCG处理牛冷冻-解冻精液的精子动力学参数分析由表 1可知,与对照组相比,添加5、10和20 μmol·L-1 EGCG孵育牛冷冻-解冻精液能够提高精子TM和PR,但只有10 μmol·L-1 EGCG处理组TM显著升高(P < 0.05)。不同浓度EGCG处理对VCL、VSL和VAP无显著影响。与对照组相比,10和20 μmol·L-1 EGCG处理能够显著提高BCF(P < 0.05),但不同浓度EGCG处理对ALH、STR和LIN无显著影响。
|
|
表 1 不同浓度EGCG处理牛冷冻-解冻精液对精子动力学参数的影响 Table 1 Effect of different concentrations of EGCG on sperm kinetic parameters of bovine frozen-thawed semen |
精子质膜完整性检测见图 1A。5、10和20 μmol·L-1 EGCG处理组精子质膜完整率均显著高于对照组(P < 0.05);但与10 μmol·L-1 EGCG处理组相比,5、20 μmol·L-1 EGCG处理组精子质膜完整率显著降低(P < 0.05,图 1B)。
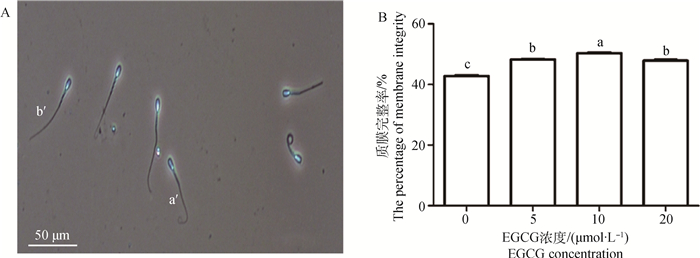
|
A.精子质膜完整性检测结果: a′.质膜完整精子;b′.质膜损伤精子;标尺:50 μm。B.不同EGCG处理组精子质膜完整率;不同浓度组间比较:不同字母代表差异显著(P < 0.05), 相同字母表示差异不显著(P>0.05)。下同 A.The results of sperm plasma membrane integrity: a′. Sperm with integral plasma membrane; b′.Sperm with damaged plasma membrane; Bar: 50 μm. B. The percentage of sperm plasma membrane integrity in each EGCG treatment group: comparison among groups of different concentrations:different letter mean significant difference (P < 0.05); same letters mean no significant difference (P > 0.05), the same as following figures 图 1 不同浓度EGCG处理牛冷冻-解冻精液对精子质膜完整率的影响 Figure 1 Effects of different concentrations of EGCG on plasma membrane integrity of bovine frozen-thawed sperm |
精子顶体完整性检测结果见图 2A。与对照组相比,5、10和20 μmol·L-1 EGCG处理显著提高了精子顶体完整率(P < 0.05)。随着EGCG浓度的增加,精子顶体完整率逐渐升高(图 2B)。
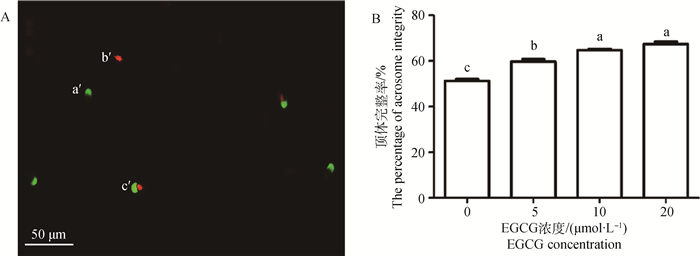
|
A.精子顶体完整性检测结果: a′.顶体损伤活精子;b′.顶体完整死精子;c′.顶体损伤死精子;标尺:50 μm。B.不同EGCG处理组精子顶体完整率 A.The results of sperm acrosome integrity:a′.Alive sperm with damaged acrosome; b′.Dead sperm with integral acrosome; c′.Dead sperm with damaged acrosome; Bar: 50 μm. B.The percentage of sperm acrosome integrity in each EGCG treatment group 图 2 不同浓度EGCG处理牛冷冻-解冻精液对精子顶体完整率的影响 Figure 2 Effects of different concentrations of EGCG on acrosome integrity of bovine frozen-thawed sperm |
精子线粒体膜完整性检测见图 3A。不同浓度EGCG处理可提高精子线粒体膜完整率,与对照组相比,5和10 μmol·L-1 EGCG处理能够显著提高线粒体膜完整率(P < 0.05),20 μmol·L-1 EGCG处理虽然提高了线粒体膜完整率,但未达到显著水平。此外,与5 μmol·L-1和10 μmol·L-1 EGCG处理组相比,20 μmol·L-1 EGCG处理组精子线粒体膜完整率显著降低(P < 0.05,图 3 B)。
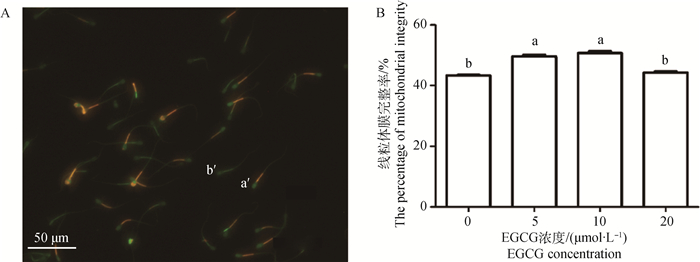
|
A.精子线粒体膜完整性检测结果:a′.线粒体膜完整精子;b′.线粒体膜损伤精子;标尺:50 μm。B.不同EGCG处理组精子顶体完整率 A.The results of sperm mitochondrial membrane integrity; a′.Sperm with integral mitochondrial membrane; b′. Sperm with damaged mitochondrial membrane; Scale bar: 50 μm. B.The percentage of sperm mitochondrial integrity in each EGCG treatment group 图 3 不同浓度EGCG处理牛冷冻-解冻精液对精子线粒体膜完整率的影响 Figure 3 Effects of different concentrations of EGCG on mitochondrial membrane integrity of bovine frozen-thawed sperm |
由表 2可见,与对照组相比,5、10和20 μmol·L-1 EGCG处理组SOD活力显著升高(P < 0.05)。随着EGCG浓度的增加,精子中SOD活力逐渐升高。5、10和20 μmol·L-1 EGCG处理组精子中CAT活力高于对照组,且随着EGCG浓度的升高,精子中CAT活力升高。与对照组相比,10和20 μmol·L-1 EGCG处理组CAT活力显著升高(P < 0.05),但5 μmol·L-1 EGCG处理组CAT活力无显著差异。
|
|
表 2 不同浓度EGCG处理牛冷冻-解冻精液对相关酶活力和MDA含量的影响 Table 2 Effects of different concentrations of EGCG on the activities of related enzymes and the content of MDA in bovine frozen-thawed sperm |
与对照组相比,5和10 μmol·L-1 EGCG处理组孵育后精子中LDH活力降低,且10 μmol·L-1 EGCG处理组LDH活力显著降低(P < 0.05),但20 μmol·L-1 EGCG处理组LDH活力升高。
不同浓度EGCG孵育牛冷冻-解冻精液后精子中AST活力均降低,与对照组相比,20 μmol·L-1 EGCG处理组AST活力显著降低(P < 0.05)。
2.4 EGCG处理对牛精子中MDA含量的影响精子中MDA含量测定结果表明,与对照组相比,10 μmol·L-1 EGCG处理组MDA含量显著降低(P < 0.05),5 μmol·L-1 EGCG处理组无显著差异,但20 μmol·L-1 EGCG处理组MDA含量显著升高(P < 0.05,表 2)。
2.5 EGCG处理对牛精子体外受精后早期胚胎发育能力的影响EGCG处理后精子体外受精结果表明(表 3),10和20 μmol·L-1 EGCG处理组精子体外受精后早期胚胎的卵裂率和囊胚率均显著高于对照组(P < 0.05),5 μmol·L-1 EGCG处理组卵裂率和囊胚率虽高于对照组,但无显著差异。
|
|
表 3 不同浓度EGCG处理对精子体外受精能力的影响 Table 3 Effects of different concentrations of EGCG on the in vitro fertilization ability of bovine frozen-thawed sperm |
本研究表明,在牛冷冻-解冻精液中添加不同浓度EGCG可提高精子质量,其中添加10 μmol·L-1 EGCG显著增强了精子活力,提高了精子质膜、顶体和线粒体膜完整率和抗氧化酶SOD和CAT活力,降低了LDH、AST活力和MDA含量,提高了受精后早期胚胎发育能力。
研究发现,精子膜上的大量多不饱和脂肪酸在受到氧化应激时会产生脂质过氧化反应,使精子表面积累大量脂质过氧化产物,从而降低精子活力并造成氧化损伤[20]。De Amicis等[13]发现在人精液中添加2和20 μmol·L-1 EGCG能够提高精子活力、运动能力,并通过雌激素受体提高Bcl2、Akt和Src等调控细胞活性相关蛋白的磷酸化水平。Kitaji等[21]在猪精液稀释液中添加绿茶多酚提取物能够显著提高解冻后猪精子活力和顶体完整性。与之研究结果相同,本研究结果表明,EGCG能够提高牛冷冻-解冻精液精子动力学参数以及顶体、质膜和线粒体结构完整性。
精子活力与精子穿卵能力密切相关且精子功能缺陷是最常见的导致雄性不育和妊娠失败的诱因[22-23]。牛精液冷冻-解冻过程对精子活力、结构及抗氧化能力造成损伤,从而影响体外受精时精子活力和受精能力。本试验发现,10和20 μmol·L-1 EGCG孵育的精子受精后早期胚胎卵裂率和囊胚率显著升高。Gadani等[14]在公猪冷冻-解冻精液中添加25和50 μmol·L-1 EGCG虽然对精子活力和顶体完整率无显著影响,但体外受精过程中的总受精效率显著提高。Kitaji等[21]在猪精液冷冻过程中添加0.01%绿茶多酚提取物发现体外受精效率和囊胚率显著提高。这表明,EGCG处理可提高精子的受精能力及受精后早期胚胎发育能力。
精子内源性抗氧化酶如SOD和CAT在防御脂质过氧化反应及维持精子活力和运动能力方面发挥重要作用[24]。曹念等[25]利用EGCG处理肺缺血再灌注损伤大鼠模型可显著提高SOD和CAT活力,并抑制脂质过氧化,从而减轻肺缺血再灌注损伤。贺音[26]发现, EGCG能够通过提高SOD活力和降低脂质过氧化程度减轻大鼠肝和神经细胞氧化损伤。本研究发现,10 μmol·L-1 EGCG处理不但显著提高精子中SOD和CAT活力,还降低了LDH和AST活力,这与相关研究结果一致[27-29]。MDA是自由基和不饱和脂肪酸过氧化反应的主要代谢产物,其含量可间接反映自由基代谢对细胞造成损伤的程度,它被认为是脂质过氧化反应的标志物[30]。本试验结果表明,5和10 μmol·L-1 EGCG处理组MDA含量显著降低。Guvvala等[31]研究发现,EGCG可降低三氧化二砷诱导的小鼠睾丸组织中脂质过氧化反应。任仲坤等[32]研究发现,EGCG能够降低MDA含量从而削弱高糖诱导的心肌细胞损伤。此外,Hyon[33]发现,茶多酚容易被脂质双分子层、细胞外基质和各种细胞膜受体所吸收,因此,精子可能通过吸收EGCG提高抗氧化酶活力,降低脂质过氧化反应,从而提高冷冻-解冻精液品质。
EGCG对牛冷冻-解冻精液品质的影响仍处在基础研究阶段,未来可以考虑通过抗氧化作用相关的通路如Keap1-Nrf2/ARE信号通路探究其改善精液品质的具体作用机制,以期为畜牧业生产创造更大的价值。
4 结论本试验结果表明,10 μmol·L-1 EGCG孵育牛冷冻-解冻精液能够显著提高精子动力学参数,增强精子质膜、顶体和线粒体膜完整性,提高抗氧化酶活力,降低脂质过氧化反应并提高精子体外受精后早期胚胎卵裂率和囊胚率。
| [1] | COLÁS C, JUNQUERA C, PÉREZ-PÉ R, et al. Ultrastructural study of the ability of seminal plasma proteins to protect ram spermatozoa against cold-shock[J]. Microsc Res Tech, 2009, 72(8): 566–572. DOI: 10.1002/jemt.v72:8 |
| [2] | AGARWAL A, SHARMA R K, NALLELLA K P, et al. Reactive oxygen species as an independent marker of male factor infertility[J]. Fertil Steril, 2006, 86(4): 878–885. DOI: 10.1016/j.fertnstert.2006.02.111 |
| [3] | SUCCU S, BERLINGUER F, PASCIU V, et al. Melatonin protects ram spermatozoa from cryopreservation injuries in a dose-dependent manner[J]. J Pineal Res, 2011, 50(3): 310–318. DOI: 10.1111/jpi.2011.50.issue-3 |
| [4] | PAUDEL K P, KUMAR S, MEUR S K, et al. Ascorbic acid, catalase and chlorpromazine reduce cryopreservation-induced damages to crossbred bull spermatozoa[J]. Reprod Domest Anim, 2010, 45(2): 256–262. DOI: 10.1111/rda.2010.45.issue-2 |
| [5] | BUCAK M N, ATAMAN M B, BAŞPINAR N, et al. Lycopene and resveratrol improve post-thaw bull sperm parameters:sperm motility, mitochondrial activity and DNA integrity[J]. Andrologia, 2015, 47(5): 545–552. DOI: 10.1111/and.2015.47.issue-5 |
| [6] | KIM J E, SHIN M H, CHUNG J H. Epigallocatechin-3-gallate prevents heat shock-induced MMP-1 expression by inhibiting AP-1 activity in human dermal fibroblasts[J]. Arch Dermatol Res, 2013, 305(7): 595–602. DOI: 10.1007/s00403-013-1393-y |
| [7] | PETER B, BOSZE S, HORVATH R. Biophysical characteristics of proteins and living cells exposed to the green tea polyphenol epigallocatechin-3-gallate (EGCG):review of recent advances from molecular mechanisms to nanomedicine and clinical trials[J]. Eur Biophys J, 2017, 46(1): 1–24. |
| [8] | OLIVA J, BARDAG-GORCE F, TILLMAN B, et al. Protective effect of quercetin, EGCG, catechin and betaine against oxidative stress induced by ethanol in vitro[J]. Exp Mol Pathol, 2011, 90(3): 295–299. DOI: 10.1016/j.yexmp.2011.02.006 |
| [9] | KIM H S, QUON M J, KIM J A. A New insights into the mechanisms of polyphenols beyond antioxidant properties; lessons from the green tea polyphenol, epigallocatechin 3-gallate[J]. Redox Biol, 2014, 2: 187–195. DOI: 10.1016/j.redox.2013.12.022 |
| [10] | GUPTA J, SIDDIQUE Y H, BEG T, et al. A review on the beneficial effects of tea polyphenols on human health[J]. Int J Pharmacol, 2008, 4(5): 314–338. DOI: 10.3923/ijp.2008.314.338 |
| [11] | DING J, WANG H, WU Z B, et al. Protection of murine spermatogenesis against ionizing radiation-induced testicular injury by a green tea polyphenol[J]. Biol Reprod, 2015, 92(1): 6. |
| [12] | ROYCHOUDHURY S, AGARWAL A, VIRK G, et al. Potential role of green tea catechins in the management of oxidative stress-associated infertility[J]. Reprod Biomed Online, 2017, 34(5): 487–498. DOI: 10.1016/j.rbmo.2017.02.006 |
| [13] | DE AMICIS F, SANTORO M, GUIDO C, et al. Epigallocatechin gallate affects survival and metabolism of human sperm[J]. Mol Nutr Food Res, 2012, 56(11): 1655–1664. DOI: 10.1002/mnfr.v56.11 |
| [14] | GADANI B, BUCCI D, SPINACI M, et al. Resveratrol and Epigallocatechin-3-gallate addition to thawed boar sperm improves in vitro fertilization[J]. Theriogenology, 2017, 90: 88–93. DOI: 10.1016/j.theriogenology.2016.11.020 |
| [15] | LI W, ZHU S, LI J H, et al. EGCG stimulates autophagy and reduces cytoplasmic HMGB1 levels in endotoxin-stimulated macrophages[J]. Biochem Pharmacol, 2011, 81(9): 1152–1163. DOI: 10.1016/j.bcp.2011.02.015 |
| [16] | PANG Y W, SUN Y Q, JIANG X L, et al. Protective effects of melatonin on bovine sperm characteristics and subsequent in vitro embryo development[J]. Mol Reprod Dev, 2016, 83(11): 993–1002. DOI: 10.1002/mrd.v83.11 |
| [17] | SHEN T, JIANG Z L, LIU H, et al. Effect of Salvia miltiorrhiza polysaccharides on boar spermatozoa during freezing-thawing[J]. Anim Reprod Sci, 2015, 159: 25–30. DOI: 10.1016/j.anireprosci.2015.05.003 |
| [18] | PANG Y W, SUN Y Q, SUN W J, et al. Melatonin inhibits paraquat-induced cell death in bovine preimplantation embryos[J]. J Pineal Res, 2016, 60(2): 155–166. DOI: 10.1111/jpi.2016.60.issue-2 |
| [19] | ROSENKRANS C F Jr, FIRST N L. Effect of free amino acids and vitamins on cleavage and developmental rate of bovine zygotes in vitro[J]. J Anim Sci, 1994, 72(2): 434–437. DOI: 10.2527/1994.722434x |
| [20] | KODAMA H, KURIBAYASHI Y, GAGNON C. Effect of sperm lipid peroxidation on fertilization[J]. J Androl, 1996, 17(2): 151–157. |
| [21] | KITAJI H, OOKUTSU S, SATO M, et al. Preincubation with green tea polyphenol extract is beneficial for attenuating sperm injury caused by freezing-thawing in swine[J]. Anim Sci J, 2015, 86(11): 922–928. DOI: 10.1111/asj.12379 |
| [22] | KIKUCHI K, NAGAI T, KASHIWAZAKI N, et al. Cryopreservation and ensuing in vitro fertilization ability of boar spermatozoa from epididymides stored at 4℃[J]. Theriogenology, 1998, 50(4): 615–623. DOI: 10.1016/S0093-691X(98)00166-6 |
| [23] | ADEWOYIN M, IBRAHIM M, ROSZAMAN R, et al. Male infertility:the effect of natural antioxidants and phytocompounds on seminal oxidative stress[J]. Diseases, 2017, 5(1): 9. |
| [24] | GADEA J, SELLÉS E, MARCO M A, et al. Decrease in glutathione content in boar sperm after cryopreservation:effect of the addition of reduced glutathione to the freezing and thawing extenders[J]. Theriogenology, 2004, 62(3-4): 690–701. DOI: 10.1016/j.theriogenology.2003.11.013 |
| [25] |
曹念, 许建强, 戴阅, 等. EGCG对大鼠肺缺血再灌注损伤的保护作用研究[J]. 临床肺科杂志, 2018, 23(2): 292–295.
CAO N, XU J Q, DAI Y, et al. Protective effect study of EGCG on lung ischemia-reperfusion injury[J]. Journal of Clinical Pulmonary Medicine, 2018, 23(2): 292–295. DOI: 10.3969/j.issn.1009-6663.2018.02.027 (in Chinese) |
| [26] |
贺音.EGCG缓解丙烯酰胺诱导的大鼠肝及神经损伤机理研究[D].沈阳: 沈阳农业大学, 2017.
HE Y.Study on the mechanism of epigallocatechin-3-gallate on alleviating acrylamide-induced liver and nerve damage in rats[D]. Shenyang: Shenyang Agricultural University, 2017.(in Chinese) http://www.bigengculture.com/shoufeilunwen/gckjbs/2040839.html |
| [27] |
刘颖.茯苓多糖、黄芪多糖和银杏叶黄酮对猪精子冷冻保存效果的研究[D].杨凌: 西北农林科技大学, 2014.
LIU Y.Effect of pachymaran, APS and ginkgo flavones on cryopreservation of boar sperm[D]. Yangling: Northwest A&F University, 2014.(in Chinese) |
| [28] |
杨健.绵羊精液稀释液添加PUFA对精子冷冻保护效果研究[D].呼和浩特: 内蒙古农业大学, 2006.
YANG J.The research to protecting effect of frozen semen in sheep semen diluent with supplementation of PUFA[D]. Huhhot: Inner Mongolia Agricultural University, 2006.(in Chinese) http://book.hzu.edu.cn/329159.html |
| [29] |
王锋, 刘季春, 何明. 表没食子儿茶素没食子酸酯预处理对乳鼠心肌细胞缺氧/复氧损伤保护及相关机制的研究[J]. 江西医学院学报, 2009, 49(2): 14–17.
WANG F, LIU J C, HE M. Study of preconditioning with epigallocatechin gallate protects cultured neonatal rat myocardial cells against anoxia/reoxygenation injury[J]. Acta Academiae Medicinae Jiangxi, 2009, 49(2): 14–17. DOI: 10.3969/j.issn.1000-2294.2009.02.004 (in Chinese) |
| [30] | WEI D, ZHANG X L, WANG Y Z, et al. Lipid peroxidation levels, total oxidant status and superoxide dismutase in serum, saliva and gingival crevicular fluid in chronic periodontitis patients before and after periodontal therapy[J]. Aust Dent J, 2010, 55(1): 70–78. DOI: 10.1111/adj.2010.55.issue-1 |
| [31] | GUVVALA P R, RAVINDRA J P, RAJANI C V, et al. Protective role of epigallocatechin-3-gallate on arsenic induced testicular toxicity in Swiss albino mice[J]. Biomed Pharmacother, 2017, 96: 685–694. DOI: 10.1016/j.biopha.2017.09.151 |
| [32] |
任仲坤, 张志毕, 刘艳红, 等. EGCG抗糖尿病心肌病小鼠心肌组织中氧化应激损伤作用机制的探讨[J]. 中国实验方剂学杂志, 2018, 24(3): 148–153.
REN Z K, ZHANG Z B, LIU Y H, et al. Anti-inflammatory and anti-oxidative stress damage of catechin gallate on diabetic myocardial in C57 mice[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(3): 148–153. (in Chinese) |
| [33] | HYON S H. A non-frozen living tissue bank for allotransplantation using green tea polyphenols[J]. Yonsei Med J, 2004, 45(6): 1025–1034. DOI: 10.3349/ymj.2004.45.6.1025 |



