畜舍内空气环境质量是影响家畜健康和生产的重要因素。随着畜牧业集约化程度的不断提高,规模化猪场舍内饲养密度过高,通风不良,导致猪舍内空气质量问题日益突出。猪舍内产生的大量颗粒物(particulate matter,PM)严重损害了猪的健康和生产,进而影响猪场经济效益[1]。PM是悬浮在气体介质中所有小固体颗粒和液体颗粒的总称,是一种同时携带多种污染物的混合物。根据空气动力学等效直径大小,通常将PM分为总悬浮颗粒物(total suspended particulate,TSP,直径≤100 μm)、可吸入颗粒物(PM10,直径≤10 μm)和细颗粒物(PM2.5,直径≤2.5 μm)三大类。PM10和PM2.5颗粒细小,可随呼吸进入气管和肺部,其中因PM2.5粒径极小,比表面积较大,易吸附携带更多有害物质,且可直接进入肺泡,因此危害最大。由于猪舍内环境复杂且污染源众多,舍内PM可携带内毒素、致病菌、病毒等多种病原体,对猪群健康,尤其对呼吸道功能产生严重危害。肺泡巨噬细胞是肺内游离的免疫细胞,主要分布于呼吸道和肺泡表面,是肺抵御外源物质入侵的第一道防线。当动物长期暴露于高浓度PM环境下,肺泡巨噬细胞的吞噬功能会受到损伤,细胞极化状态发生改变,并产生大量促炎因子,进而引发肺部乃至机体其他部位发生复杂的免疫反应,影响动物健康[2]。本文根据近年来国内外的相关研究报道以及结合笔者课题组开展的相关研究,从猪舍PM的特征及成分、PM对猪的健康和生长性能的影响、PM对肺泡巨噬细胞功能的影响及相关调控机制等方面进行综述。
1 猪舍颗粒物的特征及成分猪舍内PM的产生和多种因素相关,包括猪的生长阶段、活动强度及饲养密度[3];饲料类型、饲养管理及猪舍的构造[4];季节、猪舍的温度、湿度及通风情况[5]等。Cofala等[6]对不同猪舍和鸡舍内PM粒径大小分布进行分析对比发现,肉鸡舍中PM10和PM2.5占比较高,其次为猪舍(表 1)。
刘杨[7]对不同季节育肥猪舍内PM粒径进行了分析(表 2),发现四个季节中,大于PM10所占比例最高,均已超过60%,其中夏季甚至已经超过75%,PM2.5在TSP中的占比以春季最低,只有3.69%,冬季为8.88%,秋季和夏季的占比接近或超过15%。笔者课题组对春季保育舍和育肥舍内颗粒物浓度进行测定,发现保育舍内PM10/TSP为37.18%,PM2.5/TSP为24.86%,PM2.5/PM10为66.86%;育肥舍内PM10/TSP为56.01%,PM2.5/TSP为43.70%,PM2.5/PM10为78.02%,两舍内PM2.5/PM10的值均超过60%,说明两舍内PM10中大部分为PM2.5[8]。畜舍内的PM携带多种有毒、有害物质,包括内毒素、重金属离子、挥发性有机化合物(volatile organic chemcials,VOCs)、NO3-、SO42-、氨气(NH3)、气味化合物、抗生素、过敏原、尘螨及β-葡聚糖等[9-10]。其中,内毒素对猪的健康和生产危害最大,它是革兰阴性菌细胞膜的脂多糖成分,在细菌生长期、稳定期以及细菌死亡崩解时会被释放出来,其在猪舍中浓度最高可达6 970 EU·m-3[11]。关于猪舍内PM上附着的细菌种类以及内毒素的含量,国内学者做了相关的研究,李超等[12]对国内不同猪场内环境调查发现,猪舍内微生物种类繁多,其中需氧革兰阴性菌群主要有肠杆菌属、假单胞菌属、莫拉菌属,内毒素含量介于114~533 EU·m-3。另外,鞠雷等[13]对保育舍内不同粒径悬浮颗粒物细菌菌落进行高通量测序发现,细菌主要来自4个门、40个菌属,其中2.1~3.3 μm粒径悬浮颗粒细菌菌群丰富度最高。
|
|
表 2 不同季节育肥猪舍内不同粒径颗粒物占比[7] Table 2 Size distribution of PM in the fattening barns in different seasons[7] |
根据PM来源、化学组成和粒径大小的不同,将其分为初级颗粒物和二次颗粒物[4]。初级颗粒物粒径较大,可直接排放到舍外,其来源广泛,化学成分中C、H、O、N、P和S含量丰富。猪舍内初级颗粒物的来源主要分为动物来源,包括皮肤、毛发、粪便和尿液、肠道菌群、肠上皮细胞和呼吸道细菌;垫料来源,包括植物细胞、霉菌、内毒素、昆虫和微生物;饲料来源,包括蛋白酶、矿物质、霉菌、内毒素、昆虫和微生物;大气来源,包括花粉粒、细菌芽胞和病原体。Donham[14]研究发现,猪舍中粗颗粒物(直径≥10 μm)主要源自饲料颗粒,而细颗粒物(直径≤10 μm)主要来源于粪便粒子,小部分来源于猪的皮屑,猪舍内的霉菌和灰分等,这些粪便粒子源的细颗粒物能够进入肺泡,危害较粗颗粒物更大。然而,Aarnink等[15]则研究报道,猪舍PM主要来源于饲料和皮肤,造成这种差异的原因,可能是因为饲料和粪便中的有机物成分相似,区分PM是来源于饲料还是粪便中未被消化的饲料比较困难,这就容易导致在对猪舍PM进行监测和评估时,高估饲料来源,而低估粪便来源[16]。而二次颗粒物主要是以氨气为前体,和H2SO4、HNO3及HCl等气体进行反应后,形成固体或液体的二次无机粒子,主要包括硫酸铵、硫酸氢铵、硝酸铵和氯化铵等[17]。目前,关于二次颗粒物在总悬浮颗粒物中所占比例仍不清楚,但Roumeliotis和Van Heyst[18]研究报道,约50%的PM2.5源自于二次颗粒物。
2 猪舍颗粒物对猪的生长性能和呼吸道健康的影响猪舍内PM会影响猪的生产性能,研究表明舍内PM浓度过高,可使猪的生长性能下降8%~10%[19]。究其原因,可能有两方面的因素,一是猪吸入PM后,会引发免疫应答,促炎因子释放,采食欲降低,导致猪的采食量减少[20];二是由PM激活的免疫应答会改变猪体内的代谢过程,代谢过程的改变会导致用于生长的部分营养物质重新分配到免疫系统,进而导致机体的生长速度减慢和饲料利用率下降[21]。另外,在免疫反应中,被激活的单核免疫细胞释放的促炎因子IL-1β、IL-6和TNF-α会通过降低合成代谢激素(如生长激素和胰岛素样生长因子)的释放,以及增加分解代谢激素(如糖皮质激素)的释放,影响血液中葡萄糖的动态平衡,增加蛋白质的氧化,加快肌肉蛋白质的水解,导致原本用以生长和沉积于骨骼肌的能量用于支持免疫应答产生的各种代谢反应,减少机体蛋白质的沉积,进而影响猪的生长性能[22]。
此外,PM浓度过高还会对猪的呼吸道产生损害。Donham[23]研究表明,猪舍内PM浓度过高,可增加猪的肺炎和胸膜炎的发病率和死亡率。也有研究表明,猪舍内PM导致猪呼吸道功能紊乱和鼻黏膜受损[24]。这主要因为猪舍PM携带氨气、内毒素、葡聚糖、致病菌等多种有害物质,且PM2.5粒径小,极易被吸入肺泡,直接刺激肺泡巨噬细胞,导致肺部发生炎症反应和免疫刺激,影响肺的正常功能,而且肺释放的促炎因子也会随血液进入全身,引起全身性的免疫反应。
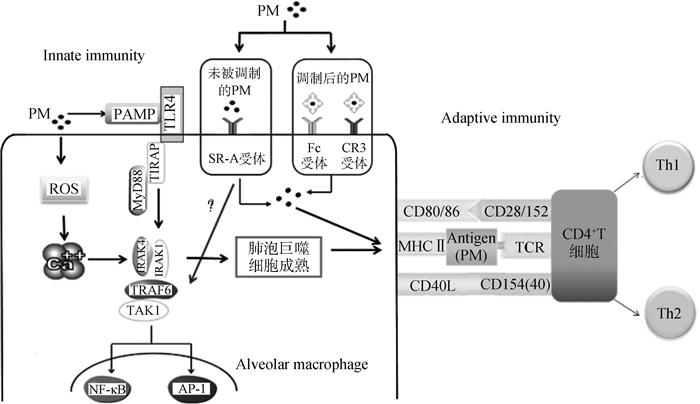
3 颗粒物对肺泡巨噬细胞功能的影响肺泡巨噬细胞作为肺部和气道抵御外源物质的第一道防线,在维持肺部免疫系统稳态以及宿主防御的过程中发挥着重要作用[25]。由于PM2.5粒径极小,可被直接吸入肺泡,危害较大。通常情况下,肺泡巨噬细胞可将吸入肺内的PM2.5吞噬、溶解、清除[26],但当机体长时间暴露于高浓度PM环境下,则会诱发肺泡巨噬细胞产生一系列复杂的先天免疫反应及适应性免疫反应,主要包括影响吞噬功能、改变细胞极化状态、识别模式识别受体(Toll样识别受体和清道夫识别受体),激活转录因子NF-κB和AP-1,产生大量促炎因子。
3.1 颗粒物对肺泡巨噬细胞吞噬功能的影响为抵御PM对呼吸道造成的损伤,黏膜防御系统会通过多种机制清除这些异物[27]。纤毛的扶梯运输是鼻、咽和支气管抵御外界侵染物的第一道防线,而一些没有被纤毛清除完全的,进入到肺泡中的细颗粒物则会被支气管上皮细胞或巨噬细胞吞噬。由于巨噬细胞的吞噬能力比支气管上皮细胞强[28],因此肺泡巨噬细胞在清除气道和肺泡有害环境中微小组分发挥着重要的作用。当肺泡中沉积的PM过多时,则会产生负面影响,导致其吞噬能力降低。Knetter等[1]研究发现,猪舍PM会降低猪肺泡巨噬细胞的吞噬能力及其细胞杀伤能力,同时能显著提高CD163蛋白的表达水平,而CD163与猪繁殖与呼吸综合征病毒(PRRSV)感染靶细胞高度相关。有学者通过体外试验[29-30]发现,猪舍PM可降低人和小鼠巨噬细胞的吞噬能力。
导致肺泡巨噬细胞吞噬能力下降的原因,可能是因为PM表面携带的许多有害物质易引起肺泡巨噬细胞产生活性氧簇(reactive oxygen species, ROS),从而下调肺泡巨噬细胞的表面标记蛋白、巨噬细胞甘露糖受体CD206和调理素受体CD11b/CD11c,进而降低肺泡巨噬细胞的吞噬能力[31]。
3.2 颗粒物对肺泡巨噬细胞极性的改变巨噬细胞是具有不同表型极化的细胞群,不同极化类型的巨噬细胞在宿主抵抗病原微生物、肿瘤免疫、炎症反应和组织修复等过程中发挥着不同的功能和作用。根据巨噬细胞的表型,通常将巨噬细胞分为经典激活途径巨噬细胞(M1型)和替代激活途径巨噬细胞(M2型)。在IFN-γ及LPS的刺激下,休眠状态的巨噬细胞(M0)会诱导极化为M1型细胞,分泌大量的促炎因子(如IL-1、IL-6、TNF-α、一氧化氮合酶等)和趋化因子(如MCP-1、CCL2-4、CXCL8-11),并通过趋化性吸引Th1细胞,促进Th1免疫反应。与之相反的是,巨噬细胞会在IL-13、IL-4、免疫复合物或是IL-10的刺激下,诱导为M2型,并释放大量的抑炎因子(IL-4、IL-13和IL-10等)、血管内皮细胞生长因子、精氨酸酶-1、血小板源生长因子及转化生长因子-β等。M2型巨噬细胞在血管生成、抗炎因子分泌以及促进组织修复和伤口愈合方面发挥着重要的作用[32]。同时,巨噬细胞具有高度可塑性、局部组织功能特异性,炎症因子诱导下分化异常等特点。当外源物质入侵机体时,巨噬细胞会极化为M1型,产生大量促炎因子,消灭入侵的外源物质,并激活适应性免疫。同时这些炎症因子又可诱导巨噬细胞凋亡或向M2型巨噬细胞极化,减轻炎症,避免机体过度损伤[33]。
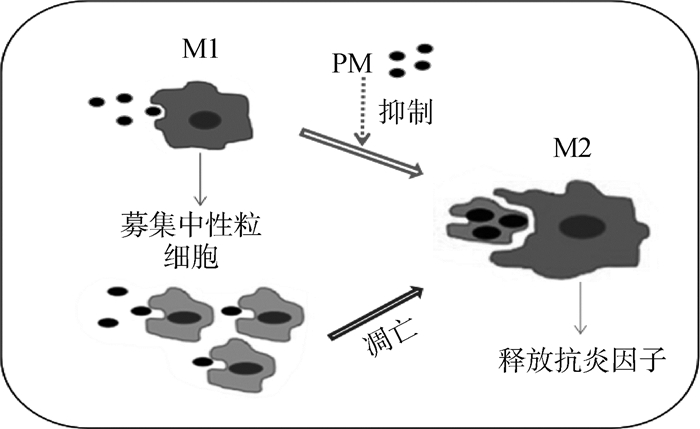
通过PM暴露小鼠的体内试验发现,肺泡灌洗液中M1型细胞因子(TNF-α、IL-6和IFN-γ)显著增加,而M2型细胞因子(IL-13和IL-10)则维持在较低的水平[34]。此结论也在体外试验中得到了验证,大气来源的PM10刺激人的肺泡巨噬细胞后,产生了大量的促炎症因子,但是IL-10的水平没有提高[35]。以上研究结果都表明,PM刺激肺泡巨噬细胞后,会促使其向M1型极化。此外,PM还会改变肺泡巨噬细胞的极化状态,PM刺激M1型肺泡巨噬细胞后,会产生大量的促炎介导因子,并招募其他免疫细胞,例如中性粒细胞,当PM被吞噬内化后,这些细胞会凋亡,从而使肺泡巨噬细胞转为M2型细胞产生抗炎因子来缓解PM刺激后诱导的炎症反应,而PM会在一定程度上阻止肺泡巨噬细胞由M1型向M2型转变,加重炎症反应[36](图 1)。PM引起肺泡巨噬细胞极化状态改变的机制,可能是由于PM刺激肺泡巨噬细胞后,引起线粒体损伤,继而导致细胞内ROS水平上升产生炎症反应,促进其向M1状态极化,同时通过激活mTOR途径抑制其向M2状态极化[37]。
3.3 颗粒物对模式识别受体(PRR)的激活 3.3.1 Toll样识别受体(TLRs)TLRs是激活先天免疫的第一步,它可以直接识别来自微生物病原体的病原相关分子模式(PAMPs)[38]。猪舍PM中的多种生物成分(如LPS、β-葡聚糖、细菌组分和真菌孢子)都存在与TLRs相互作用的潜在机制[39]。在13个TLRs中,TLR2和TLR4是连接PM最主要的两个受体。猪场PM中的革兰阴性菌细胞壁上的内毒素和革兰阳性菌中的酵母聚糖、肽聚糖可分别与TLR4和TLR2受体结合,从而启动信号级联反应。此外,在细胞膜上,TLR4和TLR2分别有各自的配体,与支气管上皮细胞相比,肺泡巨噬细胞膜上的TLR4是它的10倍[40]。Becker等[40]通过PM10处理细胞的体外试验发现,阻断TLR4表达后,肺泡巨噬细胞中IL-6的释放被抑制,而阻断TLR2后,气道上皮细胞中IL-8的释放被抑制。另外,He等[41]通过TLR2-/-、TLR4-/-和MyD88-/-小鼠的体内试验,检测肺泡灌洗液中的免疫因子,发现PM主要通过TLR4/MyD88这一途径引起免疫反应,其次为TLR2/MyD88途径。大量的试验证明,TLR2/4参与了由PM引起的先天免疫反应,但是关于PM如何调节这些受体表达的机制,目前依然没有统一的定论。He等[42]将小鼠巨噬细胞RAW264.7暴露于浓度为3 μg·mL-1 PM10中3 h,发现PM10显著提高了细胞TLR2 mRNA的表达量。Alexis等[43]把人肺泡巨噬细胞暴露于PM2.5-10中3 h,发现TLR4的mRNA表达水平显著增高。但是,Becker等[44]将人肺泡巨噬细胞暴露于PM中18 h后则发现,TLR2和TLR4的mRNA表达水平均显著降低;Williams等[45]把树突细胞暴露于PM2.5中48 h,也得出相似的变化趋势,这些结果可能由于暴露时间不同所致。PM短时间暴露(3 h),TLRs表达量升高,可能是由于细胞产生大量的促炎因子所致;而长时间暴露(18或48 h),TLRs表达量则会降低,可能是由于前期产生的大量促炎因子在后期又负向调节了TLR的表达所致。但无论变化趋势如何,上述研究结果都表明了PM暴露后,TLRs在肺相关细胞的免疫反应中具有重要作用,并且以TLR4最为关键。
3.3.2 清道夫受体(SR-A)在巨噬细胞吞噬外源物质之前,会首先发挥其调理作用(即抗体、补体与吞噬细胞表面结合,促进巨噬细胞吞噬微生物等颗粒性抗原的作用),PM中的微生物组分会经过特定的调理素(抗体或补体)调理后,被肺泡巨噬细胞中调理素相关的吞噬受体(Fc受体、补体受体和凝结素受体)识别而被吞噬[46],然而由于PM中的无机成分未被调理过,所以不能被调理素相关的吞噬受体识别,但其会被另一个重要模式识别受体(pattern recognition receptor,PRR)——A类清道夫受体(scavenger receptor A,SR-A)识别。SR-A主要在巨噬细胞中表达,并在非特异性吞噬未被调理过的PM中发挥重要作用[47]。依据功能不同可将PRRs分为信号传导PRRs和胞吞PRRs两种。信号传导PRRs(如TLRs)只介导细胞内的信号途径,并不介导病原体的吞噬,而SR-A不仅介导细胞内的信号通路,还参与病原体的黏附、吞噬和消化。PM中的微生物组分会经过特定的调理素(抗体或补体)进行调理,另外,有研究表明PM中的无机成分除了与SR-A结合外,还能与甘露糖受体及β2整合素结合。但当PM作用于这些PRRs后,促炎因子的释放却与PM作用于TLR的结果相反,原因在于SR-A受体激活会导致促炎因子的降低,以防止肺组织中中性粒细胞的涌入[47]。此外,有研究表明,SRM1648(PM10的标准品)通过激活Caspase-3引起肺泡巨噬细胞的凋亡,但是这种凋亡可被SR-A的抑制剂阻断[48]。目前,关于SR-A如何缓解免疫反应的机制尚不清楚。
3.4 肺泡巨噬细胞中TLR相关转录因子(NF-κB和AP-1)的激活研究表明,PM暴露会引起肺细胞炎症因子(IL-1β、TNF-α、IL-6、IL-8等)的释放[49-50],其中,NF-κB和AP-1是目前研究与PM暴露后引起炎症反应最多的两种转录因子。猪舍PM中的微生物成分是转录因子激活的有效刺激物,其可通过识别TLRs继而激活其下游的转录因子NF-κB和AP-1。
NF-κB是一种可被细胞表面受体(如TLRs)激活的细胞膜受体,它还可以作为潜在的细胞质因子以及细胞质中p65和p50蛋白之间的异质二聚体,与抑制蛋白IκBα结合[51]。当巨噬细胞被PM刺激后,抑制蛋白IκBα就会从异质二聚体上游离出来,使得异质二聚体转运入核,与特定的DNA序列结合,激起下游炎症因子的释放。以上论述表明,PM刺激肺泡巨噬细胞后会通过NF-κB通路产生大量的促炎因子。而NF-κB的激活是由于肺巨噬细胞受PM刺激产生的ROS所致。PM引起肺巨噬细胞氧化应激损伤,导致细胞内质网中钙离子释放,从而激活NF-κB,促使其下游促炎因子(IL-1β、TNF-α、IL-6、IL-8等)的表达上调[52]。ROS激活NF-κB启动炎症级联反应的同时,也会激活氧化还原敏感的核转录因子Nrf2启动细胞的自我保护机制。ROS的作用机制较为复杂,在氧化应激过程中,Nrf2和NF-κB均和ROS呈剂量依赖性。低水平的ROS会引起相关抗氧化酶的释放,而中高水平的ROS则会引起NF-κB和MAPKs(ERK、JNK和p38)的激活,增加细胞毒性,导致细胞凋亡[53],而被激活的MAPKs则通过下游转录因子(AP-1)的磷酸化来调节其下游基因促炎因子的表达。目前,已有大量试验使用肺泡Ⅱ型细胞作为研究MAPK通路的细胞模型,而在肺泡巨噬细胞中研究较少[54]。
4 颗粒物对肺泡巨噬细胞引发适应性免疫反应的影响肺泡巨噬细胞是重要的抗原呈递细胞(antigen-presenting cells,APC),当PM被肺泡巨噬细胞吞噬内化后,PM中的有机成分(如LPS、β-葡聚糖、细菌组分或真菌孢子)会被消化为小肽片段,与组织相容性复合体(major histcompatibility complex,MHC)Ⅱ类分子结合形成MHC Ⅱ复合体,将抗原呈递给CD4+T细胞,这是细胞介导的适应性免疫的关键步骤[55-56]。研究表明,LPS刺激可上调肺泡巨噬细胞中MHCⅡ表达,因此,吸入含有内毒素的PM后也会引起肺泡巨噬细胞中MHCⅡ表达上调[45]。Alexis等[43]通过体内试验,使志愿者吸入6.35 mg的PM2.5-10,发现志愿者的支气管灌洗液中MHCⅡ表达水平上调。而当经过热处理去除PM中的微生物相关成分后,MHC Ⅱ的过量表达被抑制了,因此可以得出结论,PM中的微生物相关成分是引起MHCⅡ上调的主要原因。与此同时,热处理损害的不仅仅是微生物的相关成分,还会损伤如PAH等有机挥发性成分。而相反的是,体外试验中未检测到MHC Ⅱ表达水平的升高,原因是体外试验中缺乏LPS结合蛋白和CD14,而LPS需要和LPS结合蛋白结合,才能将LPS传递到细胞表面模式识别受体CD14引发免疫反应。
除了抗原特异性的MHC和T细胞受体外,T细胞还需要共刺激信号才能被完全激活。共刺激信号有两种,CD80/CD86和CD40L,其在激活的CD4+T细胞上都有相应的配体,CD80/86与配体CD28和CD152结合,CD40L与配体CD154 (CD40)结合,从而使CD4+T细胞极化为Th1或Th2型[57]。而这些信号分子会在APC的膜上表达,当成熟的肺泡巨噬细胞被激活时,其吞噬功能会下降,同时MHC Ⅱ和共刺激分子会上调。
目前,对PM刺激肺泡巨噬细胞诱导Th1/Th2分化的研究结果不一致。在PM暴露小鼠的试验发现,肺泡灌洗液中Th1细胞因子(IL-12和IFN-γ)的表达水平上调[58],而Th2细胞因子(IL-4、IL-10和IL-13)表达水平下降[59]。然而,亦有研究表明,PM会增强肺中Th2免疫反应,加剧过敏性哮喘和急性哮喘[60]。这种矛盾观点产生的主要原因是因为PM的组成成分复杂,其中的微生物组分(内毒素和过渡金属)刺激肺泡巨噬细胞后,产生大量的ROS,而Th1细胞的主要作用是攻击细胞内的病原体和LPS,其通过TLR4信号传导被激活并释放IL-12,促使Th1分化,因此,Th1分化是PM中微生物组分刺激肺泡巨噬细胞后诱导的自然生理过程。而导致Th2分化的原因是由于氧化应激造成的,谷胱甘肽是中和ROS的主要抗氧化剂,且可以通过干扰IL-4的产生促进Th1分化,而氧化应激可将谷胱甘肽氧化,所以过量的氧化应激会使谷胱甘肽相对缺乏,导致Th2分化[61]。关于PM影响Th1/Th2分化的过程十分复杂,且目前相关研究报道也较少,其影响的分子机制还需要进一步探讨。
另外,TLRs的识别以及NF-κB的激活介导的先天性免疫对于适应性免疫反应也是必不可少的。NF-κB激活可以促进APC成熟,MHCⅡ和共刺激分子表达水平上调以及IL-12表达水平上升,其中IL-12是Th1细胞分化的重要因子[62]。由于NF-κB的激活对PM呈剂量依赖性,由此我们也可以推测先天性免疫和NF-κB的激活在PM引起的适应性免疫反应中也存在着剂量依赖关系。
5 结语和展望肺泡巨噬细胞不仅是肺抵御外源物质的第一道防线,也是肺中的游离免疫细胞,它的主要功能是吞噬和清除吸入的PM,而在此过程中就会引起一系列的先天性免疫和适应性免疫反应。PM刺激肺泡巨噬细胞产生ROS,引起细胞内钙离子水平升高,同时PM还会与TLRs结合,继而引起下游的转录因子(NF-κB和AP-1)激活,释放大量的促炎因子,引起局部以及全身的免疫反应。另外,肺泡巨噬细胞还能作为APC,引发适应性免疫反应(图 2)。
|
图 2 PM暴露肺泡巨噬细胞后诱导的先天性免疫和适应性免疫反应[63] Figure 2 Innate and adaptive immunity induced by PM in alveolar macrophage[63] |
猪舍PM,特别是小粒径的PM10和PM2.5,其组成成分复杂,对猪乃至人的健康危害较大,越来越引起人们的重视。国内对猪舍PM相关研究起步较晚,缺乏相关基础数据,很多源解析的数据仍需借鉴国外的能谱。但是,由于不同国家地域的猪舍构造、猪的品种、饲料组成和饲养管理都不尽相同,所以许多国外学者的猪舍PM源解析研究数据与我国实际情况存在很多差异。因此,针对中国的规模化养猪场PM组成成分的源解析和关键致毒成分的确定以及对免疫系统影响的机制研究是今后科学研究中有待解决的主要问题。
另外,目前国内外学者主要采用细胞培养技术等体外试验法来研究PM对动物机体健康的影响机制,而缺乏对动物试验的研究数据,因此在今后的研究中,应多采用体内外试验相结合的研究方法,以更加系统、准确地研究PM对家畜健康的影响机制。
| [1] | KNETTER S M, TUGGLE C K, WANNEMUEHLER M J, et al. Organic barn dust extract exposure impairs porcine macrophage function in vitro:implications for respiratory health[J]. Vet Immunol Immunopathol, 2014, 157(1-2): 20–30. DOI: 10.1016/j.vetimm.2013.10.019 |
| [2] | MA J H, SONG S H, GUO M, et al. Long-term exposure to PM2.5 lowers influenza virus resistance via down-regulating pulmonary macrophage Kdm6a and mediates histones modification in IL-6 and IFN-β promoter regions[J]. Biochem Biophys Res Commun, 2017, 493(2): 1122–1128. DOI: 10.1016/j.bbrc.2017.09.013 |
| [3] | WINKEL A, MOSQUERA J, KOERKAMP P W G G, et al. Emissions of particulate matter from animal houses in the Netherlands[J]. Atmos Environ, 2015, 111: 202–212. DOI: 10.1016/j.atmosenv.2015.03.047 |
| [4] | XU W, ZHENG K, MENG L M, et al. Concentrations and emissions of particulate matter from intensive pig production at a large farm in North China[J]. Aerosol Air Qual Res, 2016, 16(1): 79–90. |
| [5] | MOSTAFA E, HOELSCHER R, DIEKMANN B, et al. Evaluation of two indoor air pollution abatement techniques in forced-ventilation fattening pig barns[J]. Atmos Pollut Res, 2017, 8(3): 428–438. DOI: 10.1016/j.apr.2016.11.003 |
| [6] | COFALA J, KLIMONT Z, AMANN M. The potential for further control of emissions of fine particulate matter in Europe[R]. Laxenburg, Austria: ⅡASA, 2006. |
| [7] |
刘杨.育肥猪舍气溶胶产生规律与减排方法研究[D].北京: 中国农业科学院, 2016.
LIU Y.Study on the aerosols production and mitigation methods in fattening pig barns[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese) |
| [8] |
吴胜, 沈丹, 唐倩, 等. 规模化半封闭式猪场舍内颗粒物、氨气和二氧化碳分布规律[J]. 畜牧与兽医, 2018, 50(3): 30–38.
WU S, SHEN D, TANG Q, et al. Distribution of particulate matters and noxious gases in large-scale semi-enclosed swine houses[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(3): 30–38. (in Chinese) |
| [9] | LI Q F, WANG-LI L J, LIU Z F, et al. Major ionic compositions of fine particulate matter in an animal feeding operation facility and its vicinity[J]. J Air Waste Manag Assoc, 2014, 64(11): 1279–1287. DOI: 10.1080/10962247.2014.942442 |
| [10] | MOSTAFA E, NANNEN C, HENSELER J, et al. Erratum to:physical properties of particulate matter from animal houses-empirical studies to improve emission modelling[J]. Environ Sci Pollut Res, 2016, 23(12): 12264. DOI: 10.1007/s11356-016-6659-4 |
| [11] | ZHANG Y P, MO J H, LI Y G, et al. Can commonly-used fan-driven air cleaning technologies improve indoor air quality? A literature review[J]. Atmos Environ, 2011, 45(26): 4329–4343. DOI: 10.1016/j.atmosenv.2011.05.041 |
| [12] |
李超, 郝海玉, 孙玲玉, 等. 猪舍环境气载微生物监测[J]. 畜牧兽医学报, 2014, 45(10): 1684–1692.
LI C, HAO H Y, SUN L Y, et al. Airborne microbiological of swine houses monitoring[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(10): 1684–1692. (in Chinese) |
| [13] |
鞠雷, 郭洪梅, 朱术会, 等. 保育猪舍不同粒径悬浮颗粒物细菌群落组成的初步研究[J]. 畜牧兽医学报, 2017, 48(11): 2198–2204.
JU L, GUO H M, ZHU S H, et al. Preliminary study on bacterial community composition of different particle size of suspended particulates in weaning pig house[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(11): 2198–2204. (in Chinese) |
| [14] | DONHAM K J. Hazardous agents in agricultural dusts and methods of evaluation[J]. Am J Ind Med, 1986, 10(3): 205–220. DOI: 10.1002/(ISSN)1097-0274 |
| [15] | AARNINK A J A, ROELOFS P F M M, ELLEN H, et al. Dust sources in animal houses[C]//Proceedings of 1999 Conference of Dust Control in Animal Production Facilities. Horsens, Denmark: Danish Institute of Agricultural Sciences, 1999: 34-40. |
| [16] | HONEY L F, MCQUITTY J B. Some physical factors affecting dust concentrations in a pig facility[J]. Can Agric Eng, 1979, 21(1): 9–14. |
| [17] | BESSAGNET B, BEAUCHAMP M, GUERREIRO C, et al. Can further mitigation of ammonia emissions reduce exceedances of particulate matter air quality standards?[J]. Environ Sci Policy, 2014, 44: 149–163. DOI: 10.1016/j.envsci.2014.07.011 |
| [18] | ROUMELIOTIS T S, VAN HEYST B J. Investigation of secondary particulate matter formation in a layer barn[C]//Proceedings of 2008 Livestock Environment Ⅷ. Iguassu Falls, Brazil: American Society of Agricultural and Biological Engineers, 2009: 1-17. |
| [19] | WATHES C M, DEMMERS T G M, TEER N, et al. Production responses of weaned pigs after chronic exposure to airborne dust and ammonia[J]. Anim Sci, 2004, 78(1): 87–97. DOI: 10.1017/S135772980005387X |
| [20] | RENAUDEAU D. Effect of housing conditions (clean vs. dirty) on growth performance and feeding behavior in growing pigs in a tropical climate[J]. Trop Anim Health Prod, 2009, 41(4): 559–563. DOI: 10.1007/s11250-008-9223-5 |
| [21] | SANDBERG F B, EMMANS G C, KYRIAZAKIS I. The effects of pathogen challenges on the performance of naïve and immune animals:the problem of prediction[J]. Animal, 2007, 1(1): 67–86. DOI: 10.1017/S175173110765784X |
| [22] | BLACK J L, GILES L R, WYNN P C, et al. Factors limiting the performance of growing pigs in commercial environments[C]//Proceedings of the 8th Conference of the Australasian Pig Science Association. Werribee: Australasian Pig Science Association, 2001: 25-28. |
| [23] | DONHAM K J. Community and occupational health concerns in pork production:a review[J]. J Anim Sci, 2010, 88(S13): E102–E111. |
| [24] | URBAIN B, MAST J, BEERENS D, et al. Effects of inhalation of dust and endotoxin on respiratory tracts of pigs[J]. Am J Vet Res, 1999, 60(9): 1055–1060. |
| [25] | HE M, ICHINOSE T, YOSHIDA S, et al. PM2.5-induced lung inflammation in mice:differences of inflammatory response in macrophages and type Ⅱ alveolar cells[J]. J Appl Toxicol, 2017, 37(10): 1203–1218. DOI: 10.1002/jat.v37.10 |
| [26] | CHU X, LIU X J, QIU J M, et al. Effects of Astragalus and Codonopsis pilosula polysaccharides on alveolar macrophage phagocytosis and inflammation in chronic obstructive pulmonary disease mice exposed to PM2.5[J]. Environ Toxicol Pharmacol, 2016, 48: 76–84. DOI: 10.1016/j.etap.2016.10.006 |
| [27] | GOLD M J, HIEBERT P R, PARK H Y, et al. Mucosal production of uric acid by airway epithelial cells contributes to particulate matter-induced allergic sensitization[J]. Mucosal Immunol, 2016, 9(3): 809–820. DOI: 10.1038/mi.2015.104 |
| [28] | KUHN D A, VANHECKE D, MICHEN B, et al. Different endocytotic uptake mechanisms for nanoparticles in epithelial cells and macrophages[J]. Beilstein J Nanotechnol, 2014, 5: 1625–1636. DOI: 10.3762/bjnano.5.174 |
| [29] | POOLE J A, WYATT T A, OLDENBURG P J, et al. Intranasal organic dust exposure-induced airway adaptation response marked by persistent lung inflammation and pathology in mice[J]. Am Physiol Lung Cell Mol Physiol, 2009, 296(6): L1085–L1095. DOI: 10.1152/ajplung.90622.2008 |
| [30] | POOLE J A, ALEXIS N E, PARKS C, et al. Repetitive organic dust exposure in vitro impairs macrophage differentiation and function[J]. J Allergy Clin Immun, 2008, 122(2): 375–382.e4. DOI: 10.1016/j.jaci.2008.05.023 |
| [31] | LI B, GUO L, KU T T, et al. PM2.5 exposure stimulates COX-2-mediated excitatory synaptic transmission via ROS-NF-κB pathway[J]. Chemosphere, 2017, 190: 124–134. |
| [32] | ZHU L N, ZHAO Q J, YANG T, et al. Cellular metabolism and macrophage functional polarization[J]. Int Rev Immunol, 2015, 34(1): 82–100. DOI: 10.3109/08830185.2014.969421 |
| [33] |
阮静瑶, 陈必成, 张喜乐, 等. 巨噬细胞M1/M2极化的信号通路研究进展[J]. 免疫学杂志, 2015, 31(10): 911–917.
RUAN J Y, CHEN B C, ZHANG X L, et al. Progress in signaling pathways of macrophage M1/2 polarization[J]. Immunological Journal, 2015, 31(10): 911–917. (in Chinese) |
| [34] | FONCECA A M, ZOSKY G R, BOZANICH E M, et al. Accumulation mode particles and LPS exposure induce TLR-4 dependent and independent inflammatory responses in the lung[J]. Respir Res, 2018, 19: 15. DOI: 10.1186/s12931-017-0701-z |
| [35] | VAN EEDEN S F, TAN W C, SUWA T, et al. Cytokines involved in the systemic inflammatory response induced by exposure to particulate matter air pollutants (PM10)[J]. Am J Respir Crit Care Med, 2001, 164(5): 826–830. DOI: 10.1164/ajrccm.164.5.2010160 |
| [36] | HIRAIWA K, VAN EEDEN S F. Contribution of lung macrophages to the inflammatory responses induced by exposure to air pollutants[J]. Mediators Inflamm, 2013, 2013: 619523. |
| [37] | ZHAO Q J, CHEN H, YANG T, et al. Direct effects of airborne PM2.5 exposure on macrophage polarizations[J]. Biochim Biophys Acta, 2016, 1860(12): 2835–2843. DOI: 10.1016/j.bbagen.2016.03.033 |
| [38] | LI R J, ZHAO L F, TONG J L, et al. Fine particulate matter and sulfur dioxide coexposures induce rat lung pathological injury and inflammatory responses via TLR4/p38/NF-κB pathway[J]. Inter J Toxicol, 2017, 36(2): 165–173. DOI: 10.1177/1091581816682225 |
| [39] | HE M, ICHINOSE T, YOSHIDA Y, et al. Urban PM2.5 exacerbates allergic inflammation in the murine lung via a TLR2/TLR4/MyD88-signaling pathway[J]. Sci Rep, 2017, 7(1): 11027. DOI: 10.1038/s41598-017-11471-y |
| [40] | BECKER S, MUNDANDHARA S, DEVLIN R B, et al. Regulation of cytokine production in human alveolar macrophages and airway epithelial cells in response to ambient air pollution particles:further mechanistic studies[J]. Toxicol Appl Pharmacol, 2005, 207(2): 269–275. DOI: 10.1016/j.taap.2005.01.023 |
| [41] | HE M, ICHINOSE T, SONG Y, et al. Desert dust induces TLR signaling to trigger Th2-dominant lung allergic inflammation via a MyD88-dependent signaling pathway[J]. Toxicol Appl Pharmacol, 2016, 296: 61–72. DOI: 10.1016/j.taap.2016.02.011 |
| [42] | HE M, ICHINOSE T, YOSHIDA S, et al. Urban particulate matter in Beijing, China, enhances allergen-induced murine lung eosinophilia[J]. Inhal Toxicol, 2010, 22(9): 709–718. DOI: 10.3109/08958371003631608 |
| [43] | ALEXIS N E, LAY J C, ZEMAN K, et al. Biological material on inhaled coarse fraction particulate matter activates airway phagocytes in vivo in healthy volunteers[J]. J Allergy Clin Immun, 2006, 117(6): 1396–1403. DOI: 10.1016/j.jaci.2006.02.030 |
| [44] | BECKER S, DAILEY L, SOUKUP J M, et al. TLR-2 is involved in airway epithelial cell response to air pollution particles[J]. Toxicol Appl Pharmacol, 2005, 203(1): 45–52. DOI: 10.1016/j.taap.2004.07.007 |
| [45] | WILLIAMS M A, PORTER M, HORTON M, et al. Ambient particulate matter directs nonclassic dendritic cell activation and a mixed TH1/TH2-like cytokine response by naive CD4+ T cells[J]. J Allergy Clin Immunol, 2007, 119(2): 488–497. DOI: 10.1016/j.jaci.2006.10.022 |
| [46] |
余杰, 毛丽君, 赵金垣. 二氧化硅通过肺泡巨噬细胞的识别反应启动肺内炎性损伤的机制[J]. 中国工业医学杂志, 2015, 28(4): 265–269.
YU J, MIAO L J, ZHAO J Y. Mechanism of intrapulmonary inflammatory injury initiated by recognition response of alveolar macrophages by silica[J]. Chinese Journal of Industrial Medicine, 2015, 28(4): 265–269. (in Chinese) |
| [47] |
杨萌, 姚三巧. 胶原样结构巨噬细胞受体和上皮间质转化在矽肺发病机制中作用研究进展[J]. 中国职业医学, 2017, 44(3): 371–375.
YANG M, YAO S Q. Study advance in the role of collagen-like macrophage receptors and epithelial-mesenchymal transition in the pathogenesis of silicosis[J]. China Occupational Medicine, 2017, 44(3): 371–375. (in Chinese) |
| [48] | OBOT C J, MORANDI M T, BEEBE T P Jr, et al. Surface components of airborne particulate matter induce macrophage apoptosis through scavenger receptors[J]. Toxicol Appl Pharmacol, 2002, 184(2): 98–106. DOI: 10.1006/taap.2002.9493 |
| [49] | SIJAN Z, ANTKIEWICZ D S, HEO J, et al. An in vitro alveolar macrophage assay for the assessment of inflammatory cytokine expression induced by atmospheric particulate matter[J]. Environ Toxicol, 2015, 30(7): 836–851. DOI: 10.1002/tox.v30.7 |
| [50] | MICHAEL S, MONTAG M, DOTT W. Pro-inflammatory effects and oxidative stress in lung macrophages and epithelial cells induced by ambient particulate matter[J]. Environ Pollut, 2013, 183: 19–29. DOI: 10.1016/j.envpol.2013.01.026 |
| [51] |
简悦. AMPK-NF-κB在肺部炎症通路的研究进展[J]. 临床肺科杂志, 2016, 21(12): 2291–2293, 2310.
JIAN Y. The research progress of AMPK-NF-κB in pulmonary inflammation pathway[J]. Journal of Clinical Pulmonary Medicine, 2016, 21(12): 2291–2293, 2310. DOI: 10.3969/j.issn.1009-6663.2016.12.045 (in Chinese) |
| [52] | SAKAMOTO N, HAYASHI S, GOSSELINK J, et al. Calcium dependent and independent cytokine synthesis by air pollution particle-exposed human bronchial epithelial cells[J]. Toxicol Appl Pharmacol, 2007, 225(2): 134–141. DOI: 10.1016/j.taap.2007.07.006 |
| [53] | XIAO G G, WANG M Y, LI N, et al. Use of proteomics to demonstrate a hierarchical oxidative stress response to diesel exhaust particle chemicals in a macrophage cell line[J]. J Biol Chem, 2003, 278(50): 50781–50790. DOI: 10.1074/jbc.M306423200 |
| [54] | MAZZOLI-ROCHA F, FERNANDES S, EINICKER-LAMAS M, et al. Roles of oxidative stress in signaling and inflammation induced by particulate matter[J]. Cell Biol Toxicol, 2010, 26(5): 481–498. DOI: 10.1007/s10565-010-9158-2 |
| [55] | WENZEL J, OUDERKIRK J L, KRENDEL M, et al. Class Ⅰ myosin Myo1e regulates TLR4-triggered macrophage spreading, chemokine release, and antigen presentation via MHC class Ⅱ[J]. Eur J Immunol, 2015, 45(1): 225–237. DOI: 10.1002/eji.201444698 |
| [56] | WU C F, LIU C W, LUO K, et al. Changes in Expression of the Membrane receptors CD14, MHC-Ⅱ, SR-A, and TLR4 in tissue-specific monocytes/macrophages following Porphyromonas gingivalis-LPS stimulation[J]. Inflammation, 2018, 41(2): 418–431. DOI: 10.1007/s10753-017-0698-y |
| [57] | BRANDENBERGER C, KLING K M, VITAL M, et al. The role of pulmonary and systemic immunosenescence in acute lung injury[J]. Aging Dis, 2017, 9(3): 1–14. |
| [58] | PARK E J, ROH J, KIM Y, et al. PM2.5 collected in a residential area induced Th1-type inflammatory responses with oxidative stress in mice[J]. Environ Res, 2011, 111(3): 348–355. DOI: 10.1016/j.envres.2010.11.001 |
| [59] | YOSHIZAKI K, BRITO J M, TOLEDO A C, et al. Subchronic effects of nasally instilled diesel exhaust particulates on the nasal and airway epithelia in mice[J]. Inhal Toxicol, 2010, 22(7): 610–617. DOI: 10.3109/08958371003621633 |
| [60] | POURAZAR J, FREW A J, BLOMBERG A, et al. Diesel exhaust exposure enhances the expression of IL-13 in the bronchial epithelium of healthy subjects[J]. Respir Med, 2004, 98(9): 821–825. DOI: 10.1016/j.rmed.2004.02.025 |
| [61] | PETERSON J D, HERZENBERG L A, VASQUEZ K, et al. Glutathione levels in antigen-presenting cells modulate Th1 versus Th2 response patterns[J]. Proc Natl Acad Sci U S A, 1998, 95(6): 3071–3076. DOI: 10.1073/pnas.95.6.3071 |
| [62] | TONIATO E, FRYDAS I S, ROBUFFO I, et al. Activation and inhibition of adaptive immune response mediated by mast cells[J]. J Biol Regul Homeost Agents, 2017, 31(3): 543–548. |
| [63] | MIYATA R, VAN EEDEN S F. The innate and adaptive immune response induced by alveolar macrophages exposed to ambient particulate matter[J]. Toxicol Appl Pharmacol, 2011, 257(2): 209–226. DOI: 10.1016/j.taap.2011.09.007 |