2. Roslin Institute (Edinburgh), Roslin, Midlothian EH25 9RG, Scotland
2. Roslin Institute(Edinburgh), Roslin, Midlothian EH25 9RG, Edinburgh, UK
骨骼重塑对于维持骨骼健康是非常重要的,产蛋后期蛋鸡骨骼变脆,甚至发生骨折[1],表明在该阶段骨骼重塑出现异常。前期研究发现,在骨骼强度不同的产蛋后期蛋鸡胫骨中胱硫醚β合酶(Cystathionine beta synthase,CBS)基因的表达水平存在显著差异。结果表明,CBS在调节骨骼重塑中起着非常重要的作用[2-7]。CBS是转硫途径代谢中的一种5′磷酸吡哆醛依赖性酶,也是体内同型半胱氨酸(Homocysteine, Hcy)代谢的关键酶,催化丝氨酸和Hcy合成胱硫醚。CBS活性下降、基因表达水平下降和碱基突变均可引起血液中Hcy水平上升,表现为高同型半胱氨酸血症(HHcy),从而引发包括骨骼重塑异常和心血管疾病在内的多种疾病[4, 6, 8]。
遗传选择和营养与管理水平显著影响蛋鸡的产蛋性能,蛋鸡在产蛋期间需要大量的钙以满足蛋壳形成,同时随着蛋鸡日龄的增加,骨骼质量会发生变化,如骨骼变脆等。蛋鸡每产1枚蛋大约需要2.3 g钙,相当于其本身骨骼中钙总量的10%[9]。产蛋后期蛋鸡容易患骨质疏松症[1]。血浆中Hcy调节骨骼重塑,且与老年人骨骼胶原蛋白交联比呈显著相关,进而影响骨骼质量[3, 5-7],因此推测,CBS基因表达调控对产蛋后期鸡骨骼重塑起着重要作用。人CBS基因外显子1a和1b上游至少有2个富含GC的TATA less启动子(包含预测的转录元件Sp1、AP1和AP2等)[10]。人CBS基因5′调控区突变显著降低了汉族人群先天性心脏病的易感性[11]。鸡CBS基因定位于1号染色体上,全长大约28 kb,cDNA由18个外显子组成,其中外显子1不编码氨基酸(数据来源于Ensemble数据库http://www.ensembl.org/index.html)。启动子位于基因上游,在转录水平对基因表达起调控作用,目前尚未见鸡CBS基因转录调控的相关报道。
本研究克隆鸡CBS基因5′调控区序列,利用生物信息学方法对其序列特征进行分析,并采用双荧光素酶报告基因确定鸡CBS基因核心启动子区,预测了与骨骼重塑相关的转录因子结合位点。
1 材料与方法 1.1 试验动物选取健康、正常产蛋的68周龄罗曼蛋鸡16只,采集胫骨组织,并置于液氮中速冻后用于提取基因组DNA。
1.2 试验材料DF-1细胞购于北京协和细胞资源库;T4连接酶购于Promega公司;内切酶Kpn Ⅰ和Xho Ⅰ购于NEB公司;PCR克隆载体pSC-A-amp/kan试剂盒购于StrataClone公司;Taq酶、DNA marker购于Roche公司;双荧光素酶报告基因检测试剂盒购于Promega公司;Tris Base、EDTA、琼脂糖、琼脂粉、酵母提取物、NaCl、硼酸购于北京索莱宝科技有限公司。DMEM培养基、鸡血清、胎牛血清、青链霉素、Lipofectamine LTX购于ThermoFisher公司。
1.3 试验方法 1.3.1 基因组提取胫骨组织匀浆后,采用常规酚-氯仿抽提法提取基因组总DNA。
1.3.2 引物设计下载Ensemble数据库中CBS基因(1号染色体:109 704 963~109 732 461 bp,Gallus_gallus-4.0,2011)上游长度为2 000 bp的核苷酸序列,结合生物信息学分析结果设计扩增引物,并在正反向引物5′端分别添加Kpn Ⅰ和Xho Ⅰ酶切位点(表 1,黑体加下划线)和保护碱基(表 1,用黑体表示),引物信息见表 1。
|
|
表 1 蛋鸡CBS基因扩增引物 Table 1 Primers for amplifying CBS gene |
以胫骨组织DNA为模板进行PCR扩增,扩增总体积为20 μL:Faststart Taq buffer(10×) 2 μL,gDNA 1 μL,正向和反向引物(浓度为10 pmol·μL-1)分别为1 μL,Faststart Taq 0.2 μL,灭菌水14.8 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55~60 ℃退火30 s,72 ℃延伸30 s~1 min,30个循环;72 ℃延伸7 min。用2%琼脂糖凝胶电泳检测后,回收PCR产物并克隆到pSC-A-amp/kan载体上。经酶切鉴定后,将阳性克隆送至华大基因公司测序。
1.3.4 生物信息学分析利用生物信息分析软件对蛋鸡CBS基因5′-调控区序列进行分析。CpG岛预测采用CpG Island Search (http://cpgislands.usc.edu/)和MethPrimer (http://www.urogene.org/methprimer/);转录因子结合位点分析采用Alibaba2 (http://www.gene-regulation.com)。
1.3.5 CBS基因缺失表达载体的构建利用限制性内切酶Kpn Ⅰ和Xho Ⅰ对pGL3-basic载体和PCR产物克隆载体分别进行双酶切,并回收酶切片段,用T4 DNA连接酶连接载体和目的片段,连接产物转化至感受态细胞DH5α,鉴定为阳性的克隆经测序验证后,提取无内毒素质粒。
1.3.6 细胞培养、质粒转染与双荧光素酶活性分析用DMEM培养基(含10%胎牛血清+2%鸡血清+100 U青链霉素)培养鸡成纤维细胞系DF-1,细胞转染前24 h将1×104个细胞接种于96孔细胞培养板,培养板底部覆盖率达到80%~90%时,用Lipofectamine LTX (Life technologies)转染缺失表达质粒和内参质粒pRL-TK(比例为1:25)。转染48 h后利用双荧光素酶检测试剂盒进行检测。
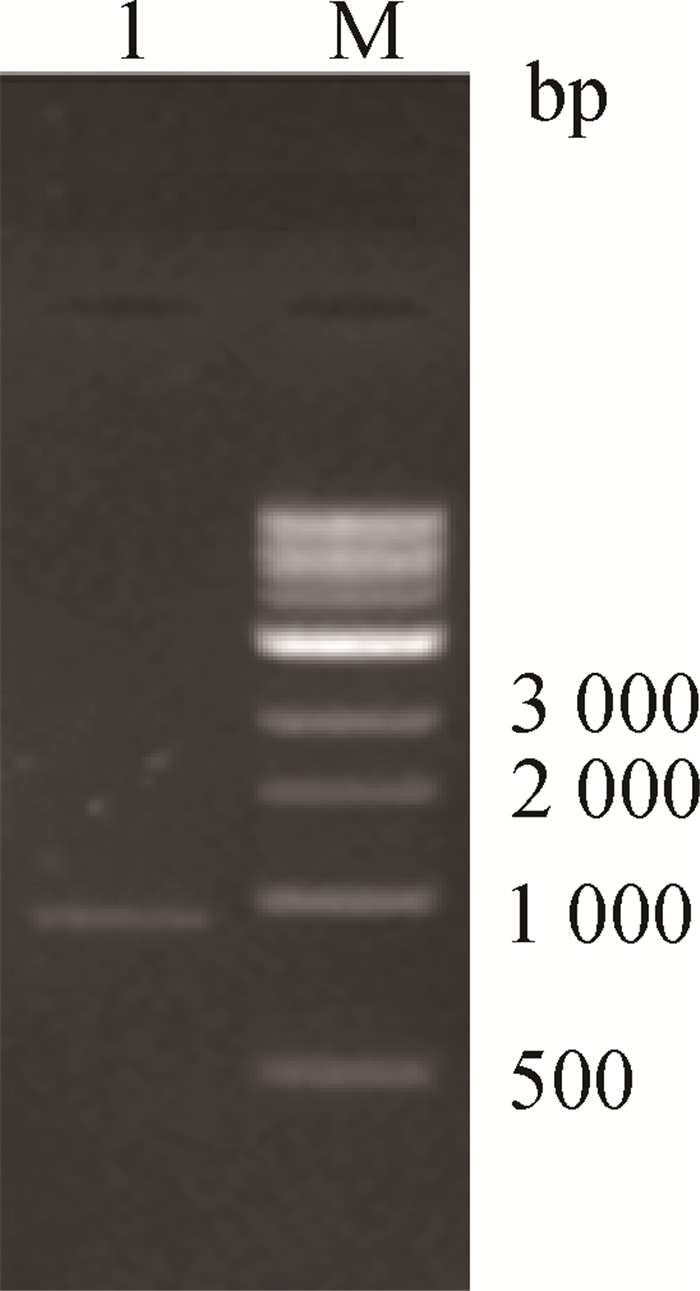
2 结果 2.1 鸡CBS基因启动子区扩增以胫骨基因组DNA为模板,利用F1F和F1R引物(表 1)进行目的片段扩增,经电泳检测得到特异性扩增条带(图 1)。测序结果表明,扩增产物与预期片段大小一致,说明成功扩增获得蛋鸡CBS基因5′调控区。
|
M. DNA相对分子质量标准;1.引物F1的PCR产物 M. DNA marker; 1. PCR product amplified by F1 图 1 鸡CBS基因5′调控区PCR产物电泳图 Figure 1 PCR agarose gel photograph of 5′ regulatory region of chicken CBS gene |
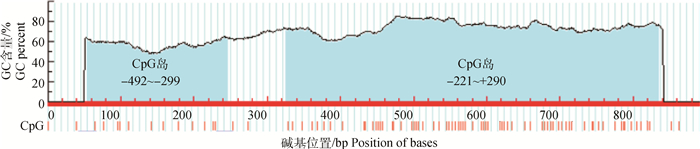
将测序结果与UCSC数据库中的序列进行比对分析(图 2),与1号染色体:109 058 488~109 059 378 bp区域同源性为99.7%,且包含一个GC含量为74.9%(CpG位点数为50)的CpG岛(图 3)。CBS基因5′调控区序列碱基组成分析发现,A、T、C、G碱基含量分别为18.52%、12.79%、35.58%、33.11%,其中C+G含量为68.69%。转录因子结合位点预测发现CBS基因5′调控区包含54个Sp1结合位点。

|
图 2 蛋鸡CBS基因5′调控区序列与UCSC数据库比对结果 Figure 2 Alignment of 5′ regulatory sequence of layer CBS gene with UCSC database |
|
图 3 鸡CBS基因5′调控区预测的CpG岛 Figure 3 The predicted CpG islands in 5′ regulatory region of chicken CBS gene |
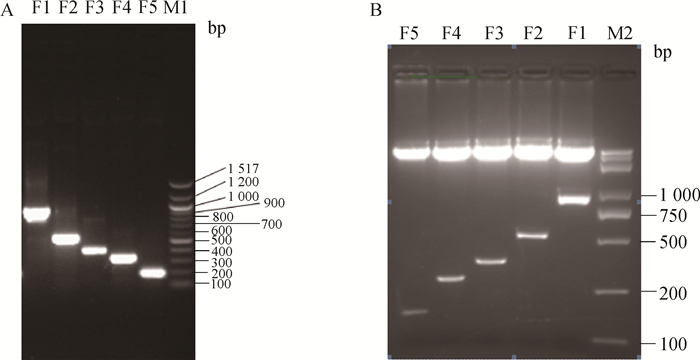
以蛋鸡胫骨总DNA为模板,对CBS基因5′调控区和不同缺失片段进行PCR扩增,用2%琼脂糖凝胶电泳检测,结果表明获得了与预期长度一致的扩增片段(图 4A)。将获得的目的片段和pGL3-basic连接后对鉴定为阳性的克隆进行双酶切,酶切产物电泳结果(图 4B)表明,所获得的质粒为包含预期片段大小的阳性克隆。
|
M1、M2. DNA相对分子质量标准;F1~F5.分别为引物F1、F2、F3、F4、F5扩增的目的片段 M1, M2. DNA marker; F1-F5. Products amplified by primer F1, F2, F3, F4, F5 图 4 不同缺失片段PCR扩增产物(A)和阳性克隆酶切鉴定(B)电泳图谱 Figure 4 Agarose gel photograph of different deletion fragments (A) and restriction enzyme digested positive clones (B) |
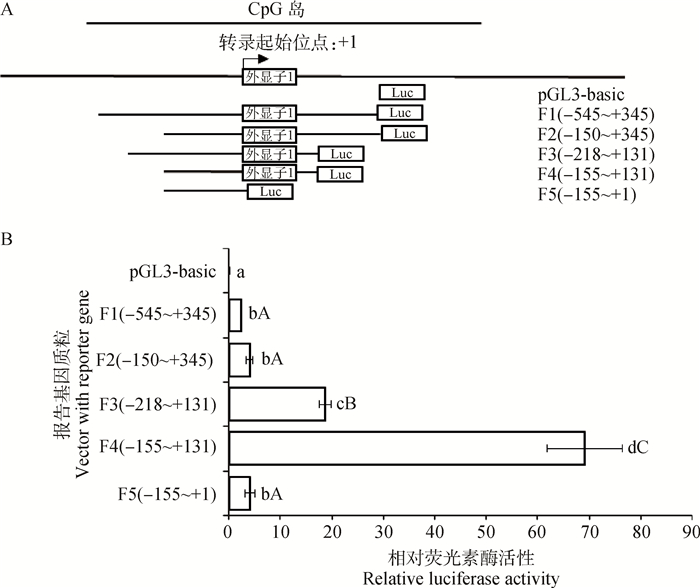
将获得的各缺失表达载体与内参载体pRL-TK进行共转染DF-1细胞,转染48 h后测定荧光素酶活性。结果表明, 所有片段均具有启动子活性,但不同片段活性存在差异(图 5),其中F4片段(-155~+131 bp)具有最高的转录活性,确定该片段为鸡CBS基因的核心启动子区。
|
A.启动子区不同片段位置;B.启动子区不同片段荧光素酶活性:不同小写字母代表差异显著(P < 0.05),不同大写字母代表差异极显著(P < 0.01),相同字母代表差异不显著(P>0.05) A. Positions of different fragments; B. Luciferase activities of different fragments: the different lower case letters indicate significant difference(P < 0.05), the different upper case letters indicate extremely significant difference(P < 0.01), the same letter indicate no significant difference(P>0.05) 图 5 鸡CBS基因启动子区不同片段的荧光素酶活性 Figure 5 Luciferase activities of different fragments in promoter region of chicken CBS gene |
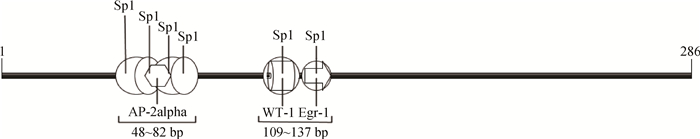
鸡CBS基因核心启动子区序列长度为286 bp(-155~+131),位于预测的CpG岛内。转录因子结合位点预测结果显示(图 6),CBS基因核心启动子区富含GC(含量为67.8%),有6个Sp1结合位点,1个AP-2alpah、Egr-1和WT-1结合位点,且转录因子结合位点存在重叠区。
|
图 6 鸡CBS基因核心启动子预测的转录因子结合位点 Figure 6 The putative transcription factor binding sites in promoter of chicken CBS gene |
启动子在调控基因转录中起着十分重要的作用,调节基因的表达丰度[12]。动物核心启动子一般包含两类,即具有典型TATA框和不含典型TATA框但富含转录因子Sp1结合位点的高GC区域[13]。本研究成功克隆了鸡CBS基因5′调控区890 bp序列,该区域不包含TATA框,但富含多个CpG位点的CpG岛,与人的启动子结构相似[9]。人CBS基因外显子1a和1b上游至少有2个富含GC的TATA-less启动子(包含预测的转录元件Sp1、AP1和AP2等)。启动子区CpG位点易发生甲基化,高度甲基化的启动子通过阻碍转录因子结合或募集甲基CpG结合蛋白引起染色质凝聚,从而调节基因表达[14]。研究证实,人CBS基因启动子区甲基化水平与结肠直肠癌或胃肠癌发生相关[15-17]。在骨骼重塑过程中,甲基化对于骨组织细胞(成骨细胞、破骨细胞和骨细胞)的正常发育和功能起重要作用,成骨细胞分化通过与功能相关的Wnt和BMP信号通路相关基因启动子CpG位点甲基化来调控基因表达,如硬骨素基因启动子高甲基化抑制基因表达;与破骨细胞形成相关的RANK/RANKL信号通路通过相关基因启动子CpG位点高甲基化来抑制基因表达,如RANKL和OPG基因[18]。因此,鸡CBS基因5′调控区CpG岛的存在为研究其甲基化程度与基因表达水平以及骨骼代谢间的关系奠定了基础。
本研究构建了多个荧光素酶报告基因缺失载体,成功鉴定出鸡CBS基因核心启动子位于-155~+131 bp区域,且在该区域包含多个保守的转录因子(Sp1、Egr-1、WT-1等)结合位点,其中转录因子Sp1与启动子结合调节PPARα的表达[19]。转录因子Egr-1调节小鼠骨骼的力学特性[20]。人CBS基因最小的启动子-1 bp(32 bp)中转录因子Sp1/Sp3、核因子Y和USF-1调控启动子基础转录活性,单一Sp1/Egr-1结合位点是HepG2细胞中起始转录所必需的,且转录因子Sp1对其表达起着关键且不可替代的作用[9]。研究也表明,COL1A1基因Sp1结合位点多态与骨密度降低和骨折风险显著增加相关[21-22]。因此,推测这些转录因子对该基因表达起着重要调控作用,进一步研究鸡CBS基因启动子区的转录因子与基因表达水平以及骨骼质量间的关系,并结合凝胶阻滞电泳、染色质免疫沉淀等技术的研究,将为揭示CBS基因在骨骼组织中的表达调控机制提供理论依据。
4 结论本研究构建了多个荧光素酶报告基因缺失载体,成功鉴定出鸡CBS基因核心启动子位于-155~+131 bp区域,且在该区域包含多个保守的转录因子(Sp1、Egr-1、WT-1等)结合位点,蛋鸡CBS基因5′调控区结构特征与核心启动子的鉴定和转录因子结合位点的发现为研究该基因在骨骼中的表达调控机制奠定了基础。
| [1] | WHITEHEAD C C, FLEMING R H. Osteoporosis in cage layers[J]. Poult Sci, 2000, 79(7): 1033–1041. DOI: 10.1093/ps/79.7.1033 |
| [2] | BAIG M, TARIQ S, TARIQ S. Homocysteine and leptin in the pathogenesis of osteoporosis—evidences, conflicts and expectations[M]//Dionyssiotis Y. Advances in Osteoporosis. Rijeka: InTech, 2015. |
| [3] | BLOUIN S, THALER H W, KORNINGER C, et al. Bone matrix quality and plasma homocysteine levels[J]. Bone, 2009, 44(5): 959–964. DOI: 10.1016/j.bone.2008.12.023 |
| [4] | ENNEMAN A W, SWART K M A, ZILLIKENS M C, et al. The association between plasma homocysteine levels and bone quality and bone mineral density parameters in older persons[J]. Bone, 2014, 63: 141–146. DOI: 10.1016/j.bone.2014.03.002 |
| [5] | KALANI A, KAMAT P K, VOOR M J, et al. Mitochondrial epigenetics in bone remodeling during hyperhomocysteinemia[J]. Mol Cell Biochem, 2014, 395(1-2): 89–98. DOI: 10.1007/s11010-014-2114-3 |
| [6] | VACEK T P, KALANI A, VOOR M J, et al. The role of homocysteine in bone remodeling[J]. Clin Chem Lab Med, 2013, 51(3): 579–590. |
| [7] | VIJAYAN V, KHANDELWAL M, MANGLANI K, et al. Homocysteine alters the osteoprotegerin/RANKL system in the osteoblast to promote bone loss: pivotal role of the redox regulator forkhead O1[J]. Free Radic Biol Med, 2013, 61: 72–84. DOI: 10.1016/j.freeradbiomed.2013.03.004 |
| [8] | DAYAL S, LENTZ S R. Homocysteine: a controversial cardiovascular risk factor[M]//WANG H, PATTERSON C. Atherosclerosis: Risks, Mechanisms, and Therapies. London: John Wiley & Sons, Inc, 2015: 53-62. |
| [9] | ETCHES R J. Calcium logistics in the laying hen[J]. J Nutr, 1987, 117(3): 619–628. DOI: 10.1093/jn/117.3.619 |
| [10] | MACLEAN K N, KRAUS E, KRAUS J P. The dominant role of Sp1 in regulating the cystathionine β-synthase -1a and -1b promoters facilitates potential tissue-specific regulation by Kruppel-like factors[J]. J Biol Chem, 2004, 279(10): 8558–8566. DOI: 10.1074/jbc.M310211200 |
| [11] | ZHAO J Y, YANG X Y, SHI K H, et al. A functional variant in the cystathionine β-synthase gene promoter significantly reduces congenital heart disease susceptibility in a Han Chinese population[C]//International Meeting on Human Genome Variation & Complex Genome Analysis. 2012. |
| [12] |
胡慧艳, 贾青, 侯胜奎, 等. 猪DKK1基因启动子区的克隆及其活性分析[J]. 畜牧兽医学报, 2017, 48(6): 1150–1157.
HU H Y, JIA Q, HOU S K, et al. Cloning and activity analysis of the promoter region of swine DKK1 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(6): 1150–1157. (in Chinese) |
| [13] | SAXONOV S, BERG P, BRUTLAG D L. A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters[J]. Proc Natl Acad Sci U S A, 2006, 103(5): 1412–1417. DOI: 10.1073/pnas.0510310103 |
| [14] | ATTWOOD J T, YUNG R L, RICHARDSON B C. DNA methylation and the regulation of gene transcription[J]. Cell Mol Life Sci, 2002, 59(2): 241–257. DOI: 10.1007/s00018-002-8420-z |
| [15] |
涂小煌, 黄少雄, 李文生, 等. 胱硫醚-β-合酶基因启动子区CpG岛甲基化水平与结直肠癌患者临床病理特征的关系[J]. 中华肿瘤杂志, 2013, 35(5): 351–355.
TU X H, HUANG S X, LI W S, et al. Correlation of methylation of CpG island in cystathionine beta synthase promoter and clinicopathological features in colorectal cancer[J]. Chinese Journal of Oncology, 2013, 35(5): 351–355. (in Chinese) |
| [16] | ZHAO H, LI Q S, WANG J, et al. Frequent epigenetic silencing of the folate-metabolising gene cystathionine-beta-synthase in gastrointestinal cancer[J]. PLoS One, 2012, 7(11). |
| [17] | ZHANG Z Z, HE Y, TU X H, et al. Mapping of DNA hypermethylation and hypomethylation induced by folate deficiency in sporadic colorectal cancer and clinical implication analysis of hypermethylation pattern in CBS promoter[J]. Clin Lab, 2017, 63(4): 733–748. |
| [18] | HUSAIN A, JEFFRIES M A. Epigenetics and bone remodeling[J]. Curr Osteoporos Rep, 2017, 15(5): 450–458. DOI: 10.1007/s11914-017-0391-y |
| [19] | DUTTENHOEFER F, BISWAS S K, IGWE J C, et al. Sp1-dependent regulation of PPARα in bone metabolism[J]. Int J Oral Maxillofac Implants, 2014, 29(1): e107–116. DOI: 10.11607/jomi.te49 |
| [20] | REUMANN M K, STRACHNA O, LUKASHOVA L, et al. Early growth response gene 1 regulates bone properties in mice[J]. Calcif Tissue Int, 2011, 89(1): 1–9. DOI: 10.1007/s00223-011-9486-0 |
| [21] | MANN V, RALSTON S H. Meta-analysis of COL1A1 Sp1 polymorphism in relation to bone mineral density and osteoporotic fracture[J]. Bone, 2003, 32(6): 711–717. DOI: 10.1016/S8756-3282(03)00087-5 |
| [22] | GRANT S F A, REID D M, BLAKE G, et al. Reduced bone density and osteoporosis associated with a polymorphic Sp1 binding site in the collagen type Ⅰ α 1 gene[J]. Nat Genet, 1996, 14(2): 203–205. DOI: 10.1038/ng1096-203 |



