2. 乌鲁木齐市动物疾病控制与诊断中心, 乌鲁木齐 830063;
3. 新疆畜牧科学院兽医研究所, 乌鲁木齐 830000;
4. 中国农业科学院兰州兽医研究所, 兰州 730046
2. Animal Disease Control and Diagnosis Center in Urumqi, Urumqi 830063, China;
3. Institute of Veterinary Medicine, Xinjiang Academy of Animal Science, Urumqi 830000, China;
4. Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
金黄色葡萄球菌(Staphylococcus aureus,SA)是引起奶牛乳房炎和子宫内膜炎最重要的病原菌之一,在葡萄球菌中致病力最强,含有多种酶类和毒素[1]。同时,SA也是一种人畜共患菌,特别是随着细菌的不断进化与演变,耐甲氧西林SA(MRSA)在人类和动物之间交叉传播[2-3],越来越多地受到世界卫生组织及各国学者的关注。近年来SA耐药性菌株逐年增多,特别是MRSA流行株的大量出现,引起严重感染的比例也有逐年升高的趋势,给SA感染性疾病的临床治疗带来了极大的困难。
研究发现,SA对抗生素的耐药性主要依赖于自身携带的各种耐药相关基因,不同的耐药基因产生耐药的机制也不同[4],SA常见耐药机制包括药物捕获、药物靶标的修饰、酶的失活和外排泵,均依赖于耐药基因编码的相关蛋白质[5]。而随着抗生素的大量使用,作为治疗MRSA“最后防线”的糖肽类抗生素万古霉素的耐药株不断出现,在中国大陆,W. J. Sun等在2009年发现了一株万古霉素中介敏感金黄色葡萄球菌(VISA)[6],因此对新疆流行株SA的耐药性研究意义重大。SA的致病性主要取决于其毒力相关基因,目前已报道的SA毒力相关基因有40多种[7],毒力因子溶血素,可在宿主细胞膜上形成小孔,造成细胞内液外流而导致细胞破坏。杀白细胞毒素lukED和PVL可以对抗宿主的免疫系统。TST主要与编码基因的一些特定可移动序列有关,可表达TSST-1,是一种超抗原,能够直接活化T淋巴细胞,使其在感染患者体内释放出炎症介质而导致机体发病[8-10]。这些毒力因子(如SA编码的表面蛋白、蛋白酶和毒素等)可协助细菌快速入侵宿主体内,并在宿主体内长时间存活,从而增强SA侵袭宿主的能力[11]。葡萄球菌染色体盒mec(SCCmec)和MLST分子分型是SA分型的两个常用方法,由于编码PBP2a的mecA基因位于可移动元件SCCmec上,且不同的MRSA内的SCCmec结构存在较大差异,因此可分为不同的SCCmec基因型,全球主要有8种SCCmec基因型,其中又分为若干亚型[12]。目前,在MLST数据库中SA可以分成2 840种ST,共收录了4 929株菌株的相关信息,而中国食源性菌株只有91株。经eBURST V3分析显示,中国食源性菌株ST分布存在5个克隆群ST97、ST5、ST398、ST1和ST9,最大克隆群为ST97,主要起源克隆群为ST398[13]。因此SCCmec和MLST分子分型既可作为探讨SA在人-畜-环境间传播途径的重要依据,也是SA流行病学调查研究的重要工具。
新疆是我国五大牧区之一,也是我国重要的奶牛养殖基地,目前奶牛存栏360余万头,奶牛乳房炎和子宫内膜炎已经成为奶牛养殖业最难防控的疫病之一。然而,目前对新疆地区奶牛SA流行株的耐药特性、致病性及流行病学特性研究甚少。鉴于此,本研究通过对新疆地区SA流行株耐药表型、相关耐药基因、相关毒力基因的检测及SCCmec和MLST分子分型进行研究,分析耐药表型与耐药基因之间、不同分子分型与毒力基因之间的相关性,为新疆地区规模化奶牛场临床合理用药和保障牛奶产品的安全提供科学依据。
1 材料与方法 1.1 主要试剂Baird-Parker培养基、BHI液体培养基购自青岛高科园海博生物技术有限公司;大肠杆菌(E. coli) DH5α菌种由本实验室保存;细菌基因组DNA提取试剂盒、pMD19-T载体、DNA Marker均购自TaKaRa公司;生化鉴定管购自杭州滨和微生物试剂有限公司;抗菌药物纸片购自杭州微生物试剂有限公司;质粒小量提取试剂盒和DNA凝胶回收试剂盒购自诺维森(北京)生物科技有限公司。
1.2 样本采集2014—2016年从新疆五家渠、石河子、塔城、伊犁、乌鲁木齐、阿克苏、喀什地区的15个规模化奶牛场共采集临床型乳房炎和子宫内膜炎临床样品337份。采用兰州隐性乳房炎检测法(LMT)检测乳样[14],根据临床型子宫内膜炎的诊断标准[15]收集样品,乳样采集通过温水清洗乳房并使用75%酒精棉球对乳头进行消毒处理,收集第3把奶后的奶样。子宫内膜炎样品通过直肠把握子宫直接采样法收集,放于灭菌的试剂管中,置于冰盒中,运送至实验室进行分离培养。
1.3 SA的分离鉴定将采集的奶牛乳样用接种环接种于Baird-Parker培养基,子宫内膜炎样品用棉签涂布于Baird-Parker培养基,置于37 ℃恒温箱培养12~48 h。挑取具有典型特征的单菌落,在营养琼脂培养基上进行纯化培养。对纯化菌进行涂片、革兰染色、镜检,然后随机选取分离株用SA成套生化鉴定管测定其生化反应特性;根据GenBank中已公布的SA 16S rRNA的序列设计通用引物,对SA分离株进行16S rRNA序列比对分析,鉴定分离株为SA。将分离的SA在BHI肉汤中37 ℃培养24 h,取500 μL所得新鲜菌液加入到500 μL 40%甘油中,振荡混合均匀制成20%甘油菌,-20 ℃保存备用。用无菌接种环挑取单个菌落接种至无菌LB培养液,于37 ℃振荡过夜,取1.5 mL细菌培养液于无菌EP管内在12 000 r·min-1下高速离心,去掉上清液,余下操作步骤按细菌基因组DNA提取试剂盒的操作说明进行。DNA提取结束后,4 μL PCR产物用1%琼脂糖凝胶电泳检测,EB染色后在凝胶成像系统上成像。准备好的DNA模板于-20 ℃保存,用于耐药基因、毒力基因检测和基因分型研究。
1.4 SA新疆流行株的药物敏感性测定用无菌接种环挑取单个菌落,接种于LB培养液于37 ℃培养20~24 h,再用灭菌生理盐水将细菌浓度调至0.5麦氏浊度,取200 μL均匀涂布于MHA培养基,涂布均匀后贴上环丙沙星、苯唑西林、氯霉素、甲氧嘧啶、左氟沙星、青霉素、红霉素、四环素、头孢西叮、呋喃妥因、利福平、替考拉宁、克林霉素、庆大霉素、氟苯尼考、万古霉素、利耐唑胺17种药敏纸片,用镊子轻压纸片使其与培养基表面紧密接触。放入37 ℃恒温培养箱中培养16~24 h后测量抑菌圈直径,依据美国临床实验室标准化研究所(CLSI)标准进行判定。
1.5 MRSA新疆流行株的筛选与鉴定根据文献[16]将在药敏试验中头孢西叮的抑菌圈直径小于或等于21 mm的SA筛选出来,进一步通过PCR方法扩增mecA来确定MRSA阳性菌。
1.6 SA新疆流行株耐药基因的检测采用多重PCR[17]方法对大环内酯类耐药基因(msrA、msrB)、红霉素类耐药基因(ermA、ermC)、乙酰基转移酶基因(vatA、vatB、vatC)、氨基糖苷类耐药基因(aacA-D)、四环素类耐药基因(tetk、tetm)、林可胺类耐药基因(linA)、氯霉素类耐药基因(FexA、FexB)、恶唑烷酮类耐药基因(cfr、optrA)、万古霉素类耐药基因(VgaA、VgaC)进行检测。
1.7 SA新疆流行株毒力基因的检测所有分离株通过多重PCR [18]技术进行毒力基因白细胞毒素基因(PVL、lukED、lukM)、溶血素基因(hla、hlb、hld)、表皮剥脱素基因(eta、etb)、中毒休克综合征毒素基因(tst)、黏附素基因(edin)和新型编码细胞壁锚定蛋白毒力基因(sasX)的检测。
1.8 SA流行株的SCCmecA和MLST分型通过多重PCR方法[19]对MRSA进行SCCmec的Ⅰ、Ⅱ、Ⅲ、Ⅳa、Ⅳb、Ⅳc、Ⅳd、Ⅴ 8个主要的型和亚型的检测,扩增的产物送至北京华大公司测序,然后按照文献[20]描述进行多位点序列分析(MLST)分型方法,根据每个菌株的等位基因和ST型从数据库(http://saureus.beta.mlst.net/)获得,来确定菌株的基因型。
1.9 引物本研究中所用的主要耐药基因、毒力基因、SCCmec分型及MLST分型的引物设计如表 1。
|
|
表 1 试验中用到的引物 Table 1 Primers used in this study |
从新疆15个不同的牛场采集了337份样品,其中乳样207份,子宫内膜炎样品130份,共分离到155株SA,乳样分离出118株,占57.0%(118/207),子宫内膜炎样品分离出37株,占28.5%(37/130),其中MSSA有133株,占85.8%(133/155),MRSA有22株,并且22株菌的mecA基因检测均为阳性。MRSA流行株占14.2%(22/155)。
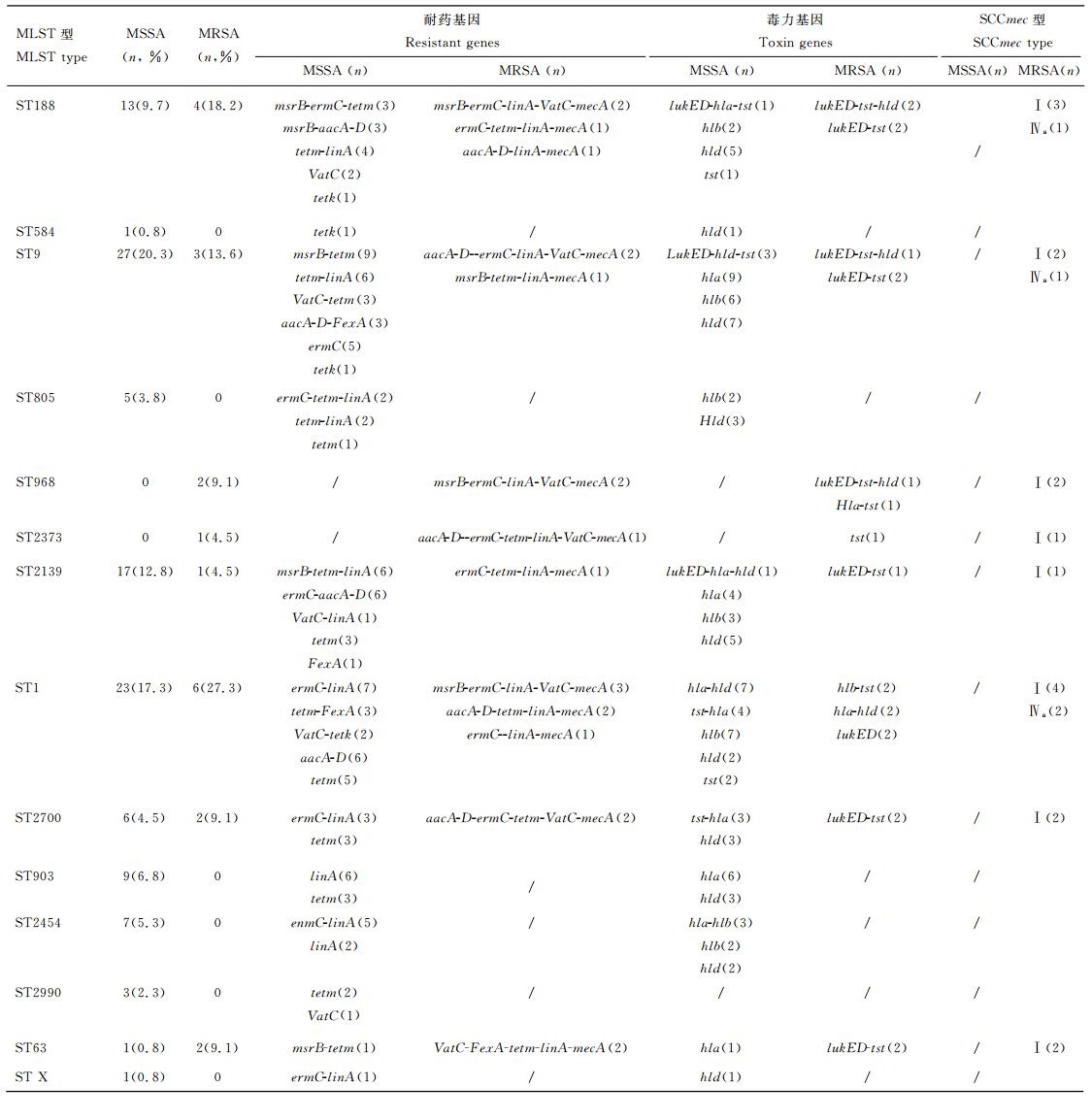
2.2 SA新疆流行株的抗生素敏感试验155株SA分离株中,133(85.8%)株甲氧西林敏感型SA(MSSA),22(14.2%)株MRSA,所有菌株均未检出万古霉素、利奈唑胺的耐药表型,MSSA菌株对青霉素、红霉素、甲氧嘧啶、四环素的耐药率相对较高,对利福平、替考拉宁的耐药率较低;MRSA菌株对青霉素、头孢西叮、四环素、克林霉素的耐药率相对较高,对环丙沙星、左氟沙星、呋喃妥因的耐药率较低(表 2),利福平耐药表型未检出。相比来说,MSSA菌株对抗菌药物的耐药率普遍比MRSA菌株的耐药率低,且MRSA和MSSA对抗菌药物的耐药菌株分布也不同(图 1)。
|
|
表 2 MRSA与MSSA对抗菌药物的耐药率 Table 2 Drug resistance rates of the MRSA and MSSA |
|
图 1 MSSA和MRSA对抗菌药物的耐药菌株分布 Figure 1 Distribution of resistant strains on antimicrobial in MSSA and MRSA |
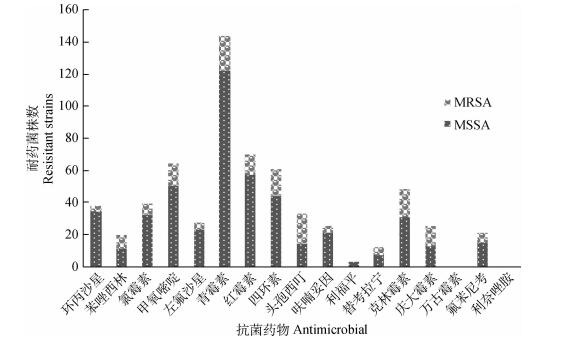
所有菌株均未检测到恶唑烷酮类耐药基因(cfr、optrA)、万古霉素类耐药基因(VgaA、VgaC),其中MSSA菌株中linA(42.1%)、tetm(40.6%)和ermC(30.8%)检出率较高,MRSA菌株中mecA(100%)、linA(90.9%)、ermC(72.7%)和VatC(72.7%)检出率较高,多重PCR检测到九种耐药基因的特征性条带(图 2)。除了四环素类耐药基因tetk只在MSSA菌株中检出,相比之下,MRSA的其他耐药基因检出率明显高于MSSA菌株中耐药基因的检出率(表 3)。
|
M. DNA相对分子质量标准DL2000;1.耐药基因msrB、FexA;2.耐药基因ermC;3.耐药基因aacA-D、tetk;5.耐药基因mecA、tetm、VatC;6.耐药基因linA;4、7.阴性对照 M. DL2000 DNA marker; 1. Resistant gene msrB, FexA; 2. Resistant gene ermC; 3. Resistant gene aacA-D, tetk; 5. Resistant gene mecA, tetm, VatC; 6. Resistant gene linA; 4, 7.Negative control 图 2 耐药基因的PCR扩增 Figure 2 Amplification of resistant genes by PCR |
|
|
表 3 MRSA与MSSA对耐药基因的分布率 Table 3 Distributing rates of antimicrobial genes in the MRSA and MSSA strains |
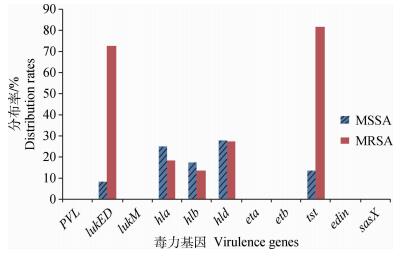
SA新疆流行株检出的主要毒力基因为白细胞毒素基因(lukED)、溶血素基因(hla、hlb、hld)和中毒休克综合征毒素基因tst,其中溶血素基因(hla、hlb、hld)在MSSA菌株中分布率较高,毒力基因lukED和tst在MRSA中分布率较高(图 3),可见,不同的毒力基因在SA中的分布有所差异,在MSSA菌株和MRSA菌株中的分布也有所差异(表 4)。
|
图 3 MRSA与MSSA菌株毒力基因分布 Figure 3 Distributing of toxin genes in the MRSA and MSSA strains |
|
|
表 4 MRSA与MSSA菌株毒力基因携带率 Table 4 Distributing rates of toxin genes in the MRSA and MSSA strains |
所有菌株中主要检出的有SCCmecⅠ和SCCmecⅣa两种分型,多重PCR检测到两种不同特征性条带(图 4),SCCmecⅡ、SCCmecⅢ和SCCmecⅤ均未检出,在MSSA中未检测到任何SCCmec型,MRSA中SCCmecⅠ和SCCmecⅣa的检出率分别为77.3%(17/22)和22.7%(5/22)其中SCCmecⅠ为MRSA的主要流行株。
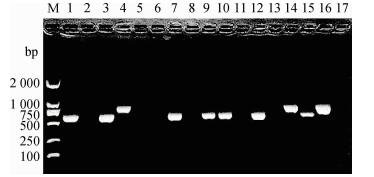
|
M.DNA相对分子质量标准DL2000;1、3、7、9、10、12、15. SCCmecⅠ型;4、14、16.SCCmecⅣa型;2、5、6、8、11、13、17.阴性对照 M. DNA marker DL2000; 1, 3, 7, 9, 10, 12, 15. SCCmecⅠtype; 4, 14, 16. SCCmecⅣa type; 2, 5, 6, 8, 11, 13, 17. Negative control 图 4 SCCmec分型结果 Figure 4 The results of SCCmec genotyping |
155株SA共检测出14种ST型,MSSA菌株检出ST188、ST584、ST9、ST805、ST2139、ST1、ST2700、ST903、ST2454、ST2990、ST63、ST X 12种ST型,ST9为主要流行株,其中有一株菌在MLST数据库中输入7个看家基因的等位基因后未查得所对应的ST型,假定其为ST X型,7种看家基因经凝胶电泳得到7种不同特征的条带(图 5)。MRSA菌株检出ST188、ST9、ST968、ST2139、ST1、ST2700、ST2373、ST63 8种不同ST型,ST1为主要流行株。此外,不同ST型菌株所携带的毒力基因、抗性基因、SCCmec型也存在差异(表 5),并且不同ST型携带耐药基因和毒力基因的多重性也不同(图 6)。
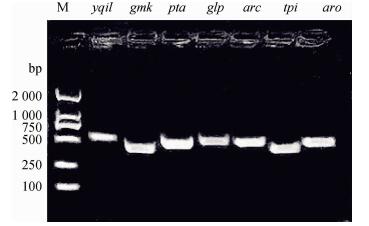
|
M. DL2000 DNA相对分子质量标准;其他条带为7种看家基因 M. DL2000 DNA marker; The other strips are 7 housekeeping genes 图 5 MLST分型电泳图 Figure 5 PCR electrophoretogram of MLST genotyping |
|
|
表 5 SA分离株的MLST型与耐药、毒力基因及SCCmec型的分布 Table 5 Distribution of the ST types and resistant, toxin genes and SCCmec types in SA |
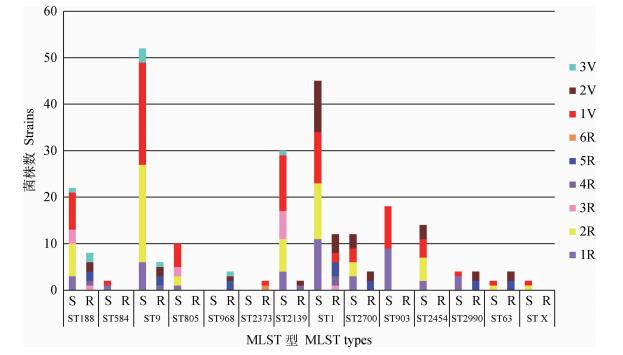
|
S.甲氧西林敏感SA;R.耐甲氧西林SA;1V、2V、3V.携带1、2、3种毒力基因;1R、2R、3R、4R、5R、6R.携带1、2、3、4、5、6种耐药基因 S. MSSA; R. MRSA; 1V, 2V, 3V. Carrying one, two, three kinds of virulence genes; 1R, 2R, 3R, 4R, 5R, 6R. Carrying one, two, three, four, five, six kinds of resistant genes 图 6 ST分型与耐药、毒力基因多重性的分布 Figure 6 Distribution of the ST types and resistant, toxin genes multiplicity |
SA是引起人畜疾病的最重要的病原菌,也是引起人类食物中毒的四大食源性病原菌之一[21-22]。在奶牛养殖业中,SA可引起奶牛乳房炎和子宫内膜炎,成为奶牛养殖业防控最难的病原菌,严重阻碍奶牛业持续、快速、健康发展[23]。本研究通过对新疆不同地区规模化牛场采集的337份样品分离鉴定发现,在分离出的155株SA中,MSSA(85.8%)是引起奶牛感染性疾病的主要流行株,MRSA(14.2%)相比MSSA,多重耐药更加明显。在药敏试验中发现,MSSA对头孢西叮的耐药率为10.5%,MRSA对头孢西叮的耐药率为86.4%,可以看出并不是对头孢西叮耐药的金黄色葡萄球菌一定是MRSA,依据耐药表型来判断MRSA在一定程度上可以作为一种标准,但不是绝对的“金标准”。可能是由于基因介导的作用较弱,也可能受环境因素(如生长温度、培养时间等)的影响,从而干扰纸片法检测的结果。因此需要通过检测mecA基因进一步鉴定。MRSA产生的耐药表型比MSSA多,但所检出的耐药基因与其耐药表型不完全对应,表型敏感却含有耐药基因,可能与其他耐药机制(如生物膜生成)有关,菌株表型耐药却未检测到相关耐药基因,可能是该耐药基因未被激活,提示这些菌株虽然携带耐药基因,可能这些耐药基因并未表达,但作为“储存库”在一定条件下可转化为耐药菌株,可以通过质粒、转座子、耐药岛使SA获得耐药,在细菌之间传播,不仅具有潜在的耐药特性,并且能够使耐药基因蔓延扩散,因此这类菌株在SA耐药性传递和流行中可能具有重要的作用。研究表明SCCmecⅢ型菌株携带氨基糖苷类耐药基因及四环素耐药基因的质粒或转座子,如pT181质粒和Tn554转座子[24],因此可见对于多重耐药的MRSA更多可能的是通过介导的耐药质粒随移动遗传元件在细菌间发生水平传播。
毒力基因编码的毒力因子是SA致病的分子基础。本研究对SA新疆流行株毒力基因检测结果显示,同为MRSA或MSSA的不同株会携带多种不同的毒力基因,如MRSA菌株可同时携带毒力基因hld、lukED和tst;不同毒力基因的分布也有差异,如本试验中通过MLST分型得到的ST2373菌株只携带了毒力基因tst,其他的毒力基因没有分布,提示SA的毒力差异不仅表现在菌株之间,还可能与不同菌株来源、遗传背景以及宿主因素的影响关系密切。有研究报道,SA菌株获得耐药的同时伴随毒力因子的改变,会使毒力因子表达降低[25-26]。本研究中,MSSA菌株溶血素毒力基因的检出率稍高于MRSA,但并无显著差异,而MRSA菌株对白细胞毒素基因和中毒休克综合征毒素基因的检出率高于MSSA,可能是MRSA在获得多重耐药的同时发生了补偿性突变,抵消了溶血素毒力因子,从而降低了溶血素毒力因子的检出率。
目前的研究发现,不同SCCmec基因型其耐药特性及地域分布存在着明显的差异。mecA基因位于可移动元件SCCmec上[24, 27-29]。因此也验证了对于不携带mecA基因的MSSA菌株未检出SCCmec基因型的结果。研究表明,通常认为SCCmecⅠ、SCCmecⅡ、SCCmecⅢ为医院相关性MRSA,SCCmecⅣ或SCCmecⅤ为社区相关性MRSA[30]。本研究中分离到SCCmecⅠ和SCCmecⅣa两种型,其中SCCmecⅠ的检出率较高,SCCmecⅠ型MRSA可能通过牛场养殖工人感染后由医院途径在人畜中传播,SCCmecⅣa型MRSA可能通过环境在人畜间传播,因此切断病原菌在人源-动物源之间的传播对于人MRSA的感染至关重要。
近年来,多位点测序分型(MLST)技术越来越多被用于细菌大规模的流行病学研究,一些新的ST型(如ST2816、ST772)以及在人畜共存的ST型(如ST398)被相继报道[31-33]。在本研究中,155株SA中检出12种ST型,其中MSSA菌株中的ST型比MRSA菌株的ST型多。ST1和ST9作为检出率较大的两种型分布在不同的SA中,目前已有研究报道发现,ST9可以在不同种属的动物源、人源、食物源中分离出[34]。本研究还检测出了一种新的假定ST X基因型,该基因型是否在人-畜间交叉传播尚需进一步深入研究。本研究结果提示,SA在分子水平上存在着人-奶牛-环境之间传播扩散的较大风险。相对于多重耐药的MRSA菌株来说,在引起奶牛临床感染的SA中大多数是MSSA,而MSSA在耐药性、毒力及水平传播上同样占有重要的地位。因此,开展奶牛SA流行株耐药特性、毒力基因及分子分型研究具有重要理论价值和实践意义。
4 结论新疆地区奶牛源金黄色葡萄球菌中主要流行株为甲氧西林敏感型,但耐甲氧西林金黄色葡萄球菌耐药性更强,且毒力基因分布多样,ST9为甲氧西林敏感型金黄色葡萄球菌流行株的主要基因型,ST1-SCCmecⅠ为耐甲氧西林金黄色葡萄球菌流行株的主要基因型。
| [1] | GENG W J, YANG Y H, WU D J, et al. Molecular characteristics of community-acquired, methicillin-resistant Staphylococcus aureus isolated from Chinese children[J]. FEMS Immunol Med Microbiol, 2010, 58(3): 356–362. DOI: 10.1111/j.1574-695X.2009.00648.x |
| [2] | ASⅡMWE B B, BALDAN R, TROVATO A, et al. Prevalence and molecular characteristics of Staphylococcus aureus, including methicillin resistant strains, isolated from bulk can milk and raw milk products in pastoral communities of South-West Uganda[J]. BMC Infect Dis, 2017, 17: 422. DOI: 10.1186/s12879-017-2524-4 |
| [3] | THAPALIYA D, DALMAN M, KADARIYA J, et al. Characterization of Staphylococcus aureus in goose feces from state parks in Northeast Ohio[J]. EcoHealth, 2017, 14(2): 303–309. DOI: 10.1007/s10393-017-1227-z |
| [4] |
潘引君, 谢玲丽, 任志华, 等. 医院与社区获得性金黄色葡萄球菌耐药性分析[J]. 职业与健康, 2014, 30(7): 898–900.
PAN Y J, XIE L L, REN Z H, et al. Analysis on drug resistance of hospital-acquired and community-acquired Staphylococcus aureus[J]. Occupation and Health, 2014, 30(7): 898–900. (in Chinese) |
| [5] | JENSEN S O, LYON B R. Genetics of antimicrobial resistance in Staphylococcus aureus[J]. Future Microbiol, 2009, 4(5): 565–582. DOI: 10.2217/fmb.09.30 |
| [6] | SUN W J, CHEN H B, LIU Y D, et al. Prevalence and characterization of heterogeneous vancomycin-intermediate Staphylococcus aureus isolates from 14 cities in China[J]. Antimicrob Agents Chemother, 2009, 53(9): 3642–3649. DOI: 10.1128/AAC.00206-09 |
| [7] |
杨峰, 王旭荣, 李新圃, 等. 牛源金黄色葡萄球菌耐药性与相关耐药基因和菌株毒力基因的相关性研究[J]. 中国兽医科学, 2016, 46(2): 247–252.
YANG F, WANG X R, LI X P, et al. Study on relationship between resistance and resistance-and virulence-related genes in Staphylococcus aureus from bovine mastitis cases[J]. Chinese Veterinary Science, 2016, 46(2): 247–252. (in Chinese) |
| [8] | MOMTAZ H, HAFEZI L. Meticillin-resistant Staphylococcus aureus isolated from Iranian hospitals:virulence factors and antibiotic resistance properties[J]. Bosn J Basic Med Sci, 2014, 14(4): 219–226. DOI: 10.17305/bjbms.2014.4.34 |
| [9] |
张蓉映, 朱健铭, 翁幸鐾. 耐甲氧西林金黄色葡萄球菌毒力与耐药基因分型研究[J]. 中华医院感染学杂志, 2014, 24(14): 3384–3385, 3388.
ZHANG R Y, ZHU J M, WENG X B. Genotyping method depending on virulence factors and drug-resistant genes in methicillin-resistant Staphylococcus aureus[J]. Chinese Journal of Nosocomiology, 2014, 24(14): 3384–3385, 3388. (in Chinese) |
| [10] | MALACHOWA N, DELEO F R. Mobile genetic elements of Staphylococcus aureus[J]. Cell Mol Life Sci, 2010, 67(18): 3057–3071. DOI: 10.1007/s00018-010-0389-4 |
| [11] | MAGRO G, BIFFANI S, MINOZZI G, et al. Virulence genes of S. aureus from dairy cow mastitis and contagiousness risk[J]. Toxins, 2017, 9(6): 195. DOI: 10.3390/toxins9060195 |
| [12] | UDO E E, AL-SWEIH N, DHAR R, et al. Surveillance of antibacterial resistance in Staphylococcus aureus isolated in Kuwaiti hospitals[J]. Med Princ Pract, 2008, 17(1): 71–75. DOI: 10.1159/000109594 |
| [13] | KEHRENBERG C, CUNY C, STROMMENGER B, et al. Methicillin-resistant and-susceptible Staphylococcus aureus strains of clonal lineages ST398 and ST9 from swine carry the multidrug resistance gene cfr[J]. Antimicrob Agents Chemother, 2009, 53(2): 779–781. DOI: 10.1128/AAC.01376-08 |
| [14] |
郝维聪. 奶牛隐性乳房炎的检测及预防[J]. 湖北畜牧兽医, 2016, 37(5): 25–26.
HAO W C. Detection and prevention of mastitis of dairy cow[J]. Hubei Journal of Animal and Veterinary Sciences, 2016, 37(5): 25–26. (in Chinese) |
| [15] |
秦佳晨, 曹桂彬, 王新庄, 等. 牛子宫内膜炎临床诊断及采样方法的研究[C]//第五届中国牛业发展大会论文集. 滨州: 中国畜牧业协会, 2010: 6.
QIN J C, CAO G B, WANG X Z, et al. Clinical diagnosis and sampling method of endometritis in cattle[C]//National Cattle Industry Association. Binzhou:China Animal Agriculture Association, 2010:6. (in Chinese) |
| [16] |
张晓平. 金黄色葡萄球菌耐药机制与分子流行病学研究[D]. 扬州: 扬州大学, 2012.
ZHANG X P. Antimicrobial resistance and molecular epidemiology of Staphylococcus aureus[D]. Yangzhou:Yangzhou University, 2012. (in Chinese) |
| [17] | DORMANESH B, SIROOSBAKHAT S, KHODAVERDI D E, et al. Methicillin-resistant Staphylococcus aureus isolated from various types of hospital infections in pediatrics:panton-valentine leukocidin, staphylococcal chromosomal cassette mec SCCmec phenotypes and antibiotic resistance properties[J]. Jundishapur J Microbiol, 2015, 8(11): e11341. |
| [18] | STEPHAN R, ANNEMVLLER C, HASSAN A A, et al. Characterization of enterotoxigenic Staphylococcus aureus strains isolated from bovine mastitis in north-east Switzerland[J]. Vet Microbiol, 2001, 78(4): 373–382. DOI: 10.1016/S0378-1135(00)00341-2 |
| [19] | KHEMIRI M, AKROUT ALHUSAIN A, ABBASSI M S, et al. Clonal spread of methicillin-resistant Staphylococcus aureus-t6065-CC5-SCCmecV-agrⅡ in a Libyan hospital[J]. J Glob Antimicrob Resist, 2017, 10: 101–105. DOI: 10.1016/j.jgar.2017.04.014 |
| [20] | ENRIGHT M C, DAY N P J, DAVIES C E, et al. Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones of Staphylococcus aureus[J]. J Clin Microbiol, 2000, 38(3): 1008–1015. |
| [21] | GOSTEV V, KRUGLOV A, KALINOGORSKAYA O, et al. Molecular epidemiology and antibiotic resistance of methicillin-resistant Staphylococcus aureus circulating in the Russian federation[J]. Infect Genet Evol, 2017, 53: 189–194. DOI: 10.1016/j.meegid.2017.06.006 |
| [22] | OU Q, ZHOU J, LIN D, et al. A large meta-analysis of the global prevalence rates of S. aureus and MRSA contamination of milk[J]. Crit Rev Food Sci Nutr, 2017, 7: 1–16. |
| [23] | CONCEIÇÃO T, DE LENCASTRE H, AIRES-DE-SOUSA M. Healthy bovines as reservoirs of major pathogenic lineages of Staphylococcus aureus in portugal[J]. Microb Drug Resist, 2017, 23(7): 845–851. DOI: 10.1089/mdr.2017.0074 |
| [24] | XIAO M, WANG H, ZHAO Y, et al. National surveillance of methicillin-resistant Staphylococcus aureus in China highlights a still-evolving epidemiology with 15 novel emerging multilocus sequence types[J]. J Clin Microbiol, 2013, 51(11): 3638–3644. DOI: 10.1128/JCM.01375-13 |
| [25] | COLLINS J, RUDKIN J, RECKER M, et al. Offsetting virulence and antibiotic resistance costs by MRSA[J]. ISME J, 2010, 4(4): 577–584. DOI: 10.1038/ismej.2009.151 |
| [26] |
童俊, 占志平. 金黄色葡萄球菌毒力基因检测及分子分型研究[J]. 中华微生物学和免疫学杂志, 2015, 35(1): 46–50.
TONG J, ZHAN Z P. Study of the virulence genes and molecular characteristics of Staphylococcus aureus strains[J]. Chinese Journal of Microbiology and Immunology, 2015, 35(1): 46–50. (in Chinese) |
| [27] | VANDENDRIESSCHE S, VANDERHAEGHEN W, LARSEN J, et al. High genetic diversity of methicillin-susceptible Staphylococcus aureus (MSSA) from humans and animals on livestock farms and presence of SCCmec remnant DNA in MSSA CC398[J]. J Antimicrob Chemother, 2013, 69(2): 355–362. |
| [28] |
闫虹, 苟建军, 张志坚, 等. 河南地区耐甲氧西林金黄色葡萄球菌SCCmec分型与耐药性分析[J]. 中华医院感染学杂志, 2016, 26(3): 512–515.
YAN H, GOU J J, ZHANG Z J, et al. Antibiotic resistance and staphylococcal chromosomal cassette mec typing of methicillin-resistant Staphylococcus aureus isolates in Henan[J]. Chinese Journal of Nosocomiology, 2016, 26(3): 512–515. (in Chinese) |
| [29] |
王晓, 俞英. 中国北方奶牛金葡菌乳房炎感染现状及耐药性和流行类型研究进展[J]. 畜牧兽医学报, 2015, 46(9): 1477–1488.
WANG X, YU Y. Infectious status of mastitis in dairy cattle induced by Staphylococcus aureus and its advances on epidemiological patterns and antimicrobial resistance in Northern China[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(9): 1477–1488. (in Chinese) |
| [30] | SAMUTELA M T, KALONDA A, MWANSA J, et al. Molecular characterisation of methicillin-resistant Staphylococcus aureus (MRSA) isolated at a large referral hospital in Zambia[J]. Pan Afr Med J, 2017, 26: 108. |
| [31] | SONG Z, GU F F, GUO X K, et al. Antimicrobial resistance and molecular characterization of Staphylococcus aureus causing childhood pneumonia in Shanghai[J]. Front Microbiol, 2017, 8: 455. |
| [32] | XAVIER A R E O, ALMEIDA A C, SOUZA C N, et al. Phenotypic and genotypic characterization of Staphylococcus aureus isolates in milk from flocks diagnosed with subclinical mastitis[J]. Genet Mol Res, 2017, 16(2): gmr16029709. |
| [33] | LI T M, LU H Y, WANG X, et al. Molecular characteristics of Staphylococcus aureus causing bovine mastitis between 2014 and 2015[J]. Front Cell Infect Microbiol, 2017, 7: 127. |
| [34] | DHUP V, KEARNS A M, PICHON B, et al. First report of identification of livestock-associated MRSA ST9 in retail meat in England[J]. Epidemiol Infect, 2015, 143(14): 2989–2992. DOI: 10.1017/S0950268815000126 |