禽网状内皮组织增生病(reticuloendotheliosis,RE)是由禽网状内皮组织增生病病毒(reticuloendotheliosis virus,REV)感染引起的一种免疫抑制和慢性肿瘤增生性疾病。近年来,国内外鸡群中REV流行有增加趋势,REV常与马立克病病毒(MDV)、J亚群禽白血病病毒(ALV-J)和鸡贫血病病毒(CAV)等几种重要的禽类免疫抑制病病毒混合感染,使感染鸡免疫功能降低甚至丧失,导致免疫抑制[1-2]。我国部分地区的养鸡场普遍存在REV感染,并继发禽流感、新城疫等一些致死性疫病,严重阻碍养殖业的健康发展[3]。细胞周期是细胞生命活动的基本过程,通过细胞周期,细胞进入增殖、分裂、衰老和死亡等生理过程[4]。细胞周期调控是经其不同时相中各种特定的细胞周期蛋白(即细胞周期素)来实现的,其中Cyclin D1是G1期必不可少的启动蛋白,能促使细胞周期从G1期进入到S期[5]。细胞周期调控依赖于细胞周期依赖性激酶(CDK)的活化,Cyclin D1是CDK的正向调节因子,细胞周期依赖性激酶抑制剂(CDKI)是CDK的负向调节因子。p27是CDKI中p21家族重要成员之一,其对CDK具有广谱抑制作用,与CDK-cyclin复合物结合,调控细胞周期进程[6]。研究发现,细胞周期不但参与机体正常的生长、发育以及繁殖,而且与某些病毒感染和肿瘤发生发展密切相关[7]。病毒感染细胞时,病毒编码的DNA或蛋白质会干扰细胞周期的启动,使正常细胞周期紊乱,导致疾病的发生。REV感染对SPF雏鸡血液淋巴细胞细胞周期及其相关因子表达的影响,迄今未见系统报道。故本研究对SPF雏鸡感染REV后,其外周血液中T、B淋巴细胞增殖功能及其细胞周期相关因子表达进行了较全面系统的检测,为深入阐述REV感染雏鸡的分子发病机制和开发抗病毒新药提供理论依据,也可为进一步探讨病毒感染对免疫细胞细胞周期的调控机制提供参考依据。
1 材料与方法 1.1 材料 1.1.1 实验动物1日龄SPF混合雏鸡80只,购自中国农业科学院哈尔滨兽医研究所SPF实验动物中心。
1.1.2 病毒禽网状内皮增生病病毒(REV-T株),购自中国兽医微生物菌种保藏管理中心(CVCC No. CACCAV107),通过鸡胚成纤维(CEF)细胞,对病毒进行复壮,测定TCID50为10-4.62·0.1 mL-1。
1.1.3 主要试剂和仪器鼠抗鸡Cyclin D1抗体(LifeSpan公司);CCK-8试剂盒(碧云天生物有限公司);ELx808酶标仪(美国Biotek公司);LightCycler2. 0荧光定量PCR仪(美国罗氏公司);PTC-200 PCR仪(美国Bio-Rad公司);DYY-6C型电泳仪(北京六一仪器厂);GDS800凝胶成像系统(美国UVP公司)。
1.2 方法 1.2.1 实验动物分组及其处理将80只SPF雏鸡随机分为2组,即对照组(C组)和REV感染组(I组),每组各40只雏鸡。在1日龄时,I组雏鸡经腹腔注射REV稀释液,0.5 mL·只-1;C组雏鸡经腹腔注射等量灭菌生理盐水。两组雏鸡分别饲养于负压隔离器内,按SPF雏鸡要求饲养管理。
1.2.2 被检材料采取及其处理两组雏鸡分别于REV感染后1、3、7、14、21、28和42 d,每组随机抽取5只雏鸡,无菌采取心脏肝素抗凝血液,用于分离淋巴细胞,并将其浓度调整为1×107·mL-1后做如下处理:
(1) 取1 mL细胞悬液,于4 ℃恒温离心机上,2 000 r·min-1,离心5 min。弃上清,加入1 mL Trizol,混匀静止10 min,液氮速冻后,-80 ℃冰箱中保存,用于Cyclin D1和p27 mRNA转录检测。
(2) 同上(1)收集细胞沉淀,加入200 μL裂解液,裂解5 min,10 000 r·min-1离心10 min,吸取上清加入EP管中,置于-80 ℃冰箱中保存,用于Cyclin D1蛋白含量检测。
(3) 取部分细胞悬液于96孔细胞培养板中,每孔加入50 μL,再于每孔中分别加入含20 μg·mL-1 ConA或LPS的RPMI1640培养液50 μL,同时设对照组,且每组3个重复,在饱和湿度、温度37 ℃、5% CO2培养箱中培养44 h后,加入10 μL CCK-8液,继续培养3.5 h后,待检。
1.2.3 检测指标及方法 1.2.3.1Real-Time PCR法检测淋巴细胞Cyclin D1和p27 mRNA变化:取预冻存细胞,Trizol法提取细胞中的总RNA,溶于20 μL DEPC处理水,用于cDNA的合成。根据PrimeScriptTM试剂盒反转录成cDNA,-20 ℃保存。
RT-PCR反应体系20 μL:SYBR® Premix ExTaqTMII 10 μL,上下游引物各0.6 μL,cDNA 2 μL,无菌纯净水6.8 μL。反应程序:预变性95 ℃ 30 s,变性95 ℃ 10 s,退火(Cyclin D1 60℃、p27 58 ℃、β-actin 57 ℃)20 s,延伸72 ℃ 20 s,循环45次,进行荧光信号采集,同时设阴性对照。Cyclin D1、p27 mRNA、β-actin引物序列见表 1,β-actin作为内参基因,所有引物均由上海生物工程有限公司合成。
|
|
表 1 各基因引物序列 Table 1 The primer sequences of genes |
Western Blot检测淋巴细胞Cyclin D1蛋白含量变化:以α-Tubulin作为内参蛋白并用BCA蛋白质浓度测定试剂盒测定蛋白质含量。取40 μg蛋白质经SDS-PAGE电泳后,半干转到NC膜上,5%脱脂乳中37 ℃恒温封闭1.5 h,PBST洗3次膜,10 min·次-1;加入1:500稀释的一抗,4 ℃孵育过夜,PBST洗3次膜,10 min·次-1;加入1:5 000稀释的HRP标记的二抗,37 ℃孵育1 h,PBST洗3次膜,10 min·次-1;使用ECL发光液曝光。
1.2.3.3淋巴细胞增殖能力检测——CCK-8试剂盒法:根据CCK-8检测试剂盒(碧云天)说明书操作,于酶标仪上测定,测定450 nm波长的吸光度值,每个样品设3个重复,每孔重复测量3次,结果取其平均值。
1.3 数据处理全部试验数据,均采用SPSS21.0软件进行数据处理,分析组间差异。结果用“x±s”表示。P < 0.05表示差异显著,P < 0.01表示差异极显著,无标示者表示差异不显著P>0.05。
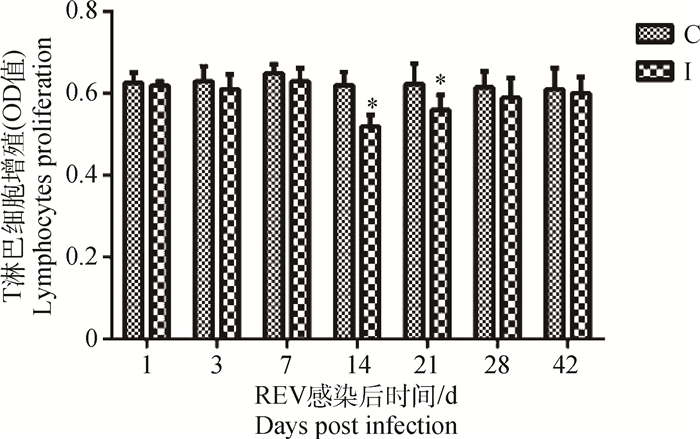
2 结果 2.1 REV感染SPF雏鸡外周血液T、B淋巴细胞增殖能力变化 2.1.1 REV感染SPF雏鸡外周血液的T淋巴细胞增殖能力变化REV感染SPF雏鸡后14~21 d,其外周血液的T淋巴细胞增殖能力显著(P < 0.05)低于相应对照组雏鸡,其余未见统计学意义(P>0.05)(图 1)。
|
C.对照组;I.REV感染组;下同 C.Control group; Ⅰ.Groups infected with REV; The same below 图 1 REV感染雏鸡外周血液的T淋巴细胞增殖能力变化 Figure 1 Changes of T lymphocytes proliferative function in peripheral blood of SPF chicks infected with REV |
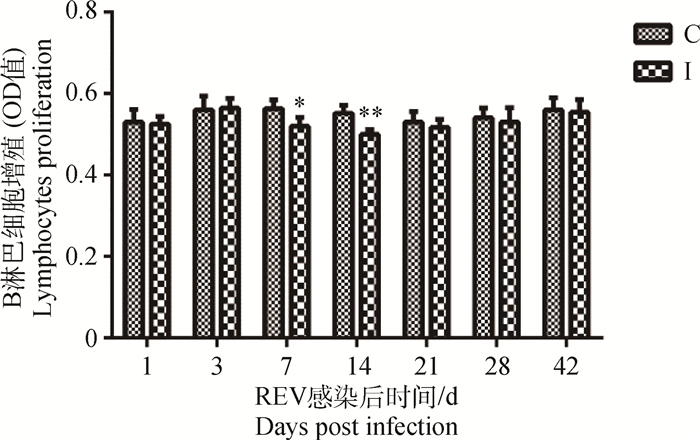
REV感染SPF雏鸡后7~14 d,其外周血液B淋巴细胞增殖能力显著(P < 0.05)或极显著(P < 0.01)低于对照组雏鸡,其余尽管病毒感染雏鸡低于相应对照组雏鸡,但统计学差异不显著(P>0.05)(图 2)。
|
图 2 REV感染雏鸡外周血液的B淋巴细胞增殖能力变化 Figure 2 Changes of B lymphocytes proliferative function in peripheral blood of SPF chicks infected with REV |
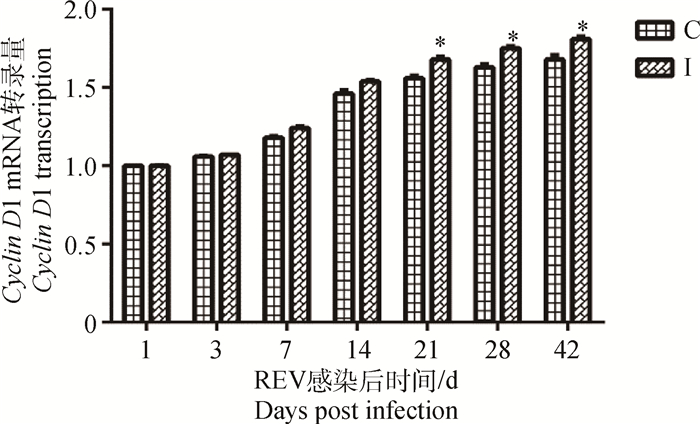
REV感染SPF雏鸡后21~42 d,其外周血液淋巴细胞中Cyclin D1转录显著(P < 0.05)高于对照组雏鸡,其余时间点虽然病毒感染雏鸡不同程度高于对照组雏鸡,但未见统计学差异(P>0.05)(图 3)。
|
图 3 REV感染SPF雏鸡外周血液淋巴细胞Cyclin D1转录变化 Figure 3 Changes of Cyclin D1 transcription of lymphocytes in peripheral blood of SPF chicks infected with REV |
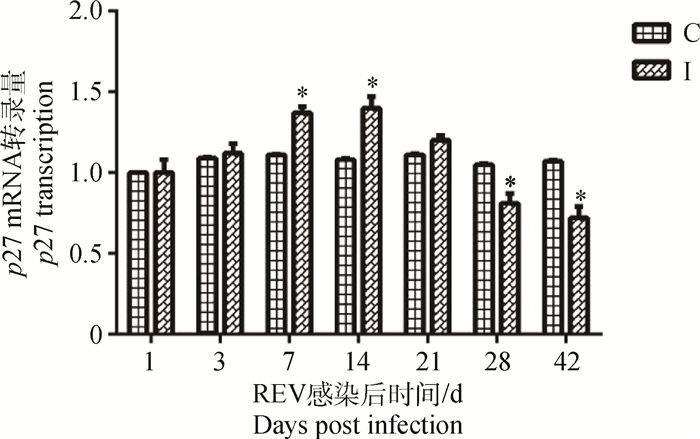
REV感染SPF雏鸡后7~14 d,其外周血液淋巴细胞中p27转录显著(P < 0.05)高于对照组雏鸡,病毒感染后28~42 d,其外周血淋巴细胞中p27转录显著(P < 0.05)低于对照组雏鸡,其余时间点虽然病毒感染雏鸡不同程度高于或低于对照组雏鸡,但未见统计学差异(P>0.05)(图 4)。
|
图 4 REV感染SPF雏鸡外周血液淋巴细胞p27转录变化 Figure 4 Changes of p27 mRNA transcription of lymphocyte in peripheral blood of SPF chicks infected with REV |
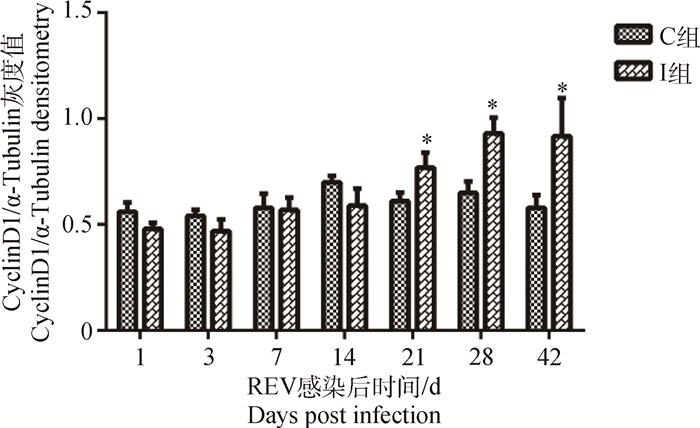
REV感染SPF雏鸡后,其外周血液淋巴细胞中Cyclin D1蛋白含量于病毒感染初期变化不明显,于感染后21~42 d明显(P < 0.05)高于对照组雏鸡(图 5、6)。

|
图 5 REV感染SPF雏鸡外周血中淋巴细胞Cyclin D1蛋白含量变化 Figure 5 Changes of Cyclin D1 content of lymphocytes in peripheral blood of SPF chicks infected with REV |
|
图 6 REV感染SPF雏鸡外周血中淋巴细胞Cyclin D1/α-Tubulin灰度比值变化 Figure 6 Changes of densitometry ratio of Cyclin D1 to α-Tubulin in lymphocytes of peripheral blood of SPF chicks infected with REV |
REV感染后主要侵害机体的免疫器官,引起免疫抑制。本研究发现,REV感染SPF雏鸡后,其外周血液的T、B淋巴细胞增殖能力在病毒感染后7~21 d均呈现不同程度的降低。M. Xue等[8]研究报道,REV感染SPF雏鸡不但使外周血T、B淋巴细胞数量比对照雏鸡减少,而且CD4+/CD8+T淋巴细胞比值也较对照组雏鸡明显下降,抑制机体的细胞免疫。胡峰和孔斌等[9-10]报道,REV感染SPF雏鸡后,其胸腺T淋巴细胞分泌IL-2减少,使无能T细胞激活受抑制,导致T细胞依赖的CTL,尤其是辅助性T淋巴细胞数量减少,进一步抑制其产生IL-2,造成严重的免疫功能障碍。李宏梅等[11]研究发现,REV和ALV-J共感染后,鸡T淋巴细胞功能受到严重抑制。侯宁[12]研究表明,REV感染SPF雏鸡造成胸腺和法氏囊等重要免疫器官细胞大量凋亡,使功能性T淋巴细胞数量减少,引起机体免疫抑制。本研究结果与上述研究报道基本一致。由此表明,REV感染雏鸡后,不仅导致淋巴细胞数量减少,而且可使T淋巴细胞增殖功能降低,从而导致机体的细胞免疫功能低下,最终产生免疫抑制。
Cyclin D1是G1期细胞增殖信号的关键蛋白。在正常细胞周期中,细胞周期蛋白Cyclin、CDK和CDKI三者组成“驱动器”,通过对靶蛋白的调控进而推动细胞周期中各时相的进展与转变[13]。Cyclin D1可与CDK4/6结合,激活一系列与细胞周期S期有关的基因转录,促使细胞通过G1/S期限制点[14]。病毒感染对宿主细胞周期的影响主要表现为促进细胞增殖和抑制细胞增殖。W.G.Feng等[15]发现,ALV-J感染鸡胚成纤维细胞(CEF)通过下调G1/S期的启动因子Cyclin D1及其非依赖性信号转导通路,明显抑制CEF增殖。徐彦波等[16]研究表明,CIV感染雏鸡,其胸腺和骨髓细胞阻滞于G1期,抑制主要免疫细胞和造血干细胞增殖,导致鸡呈现免疫抑制和贫血病理综合征。本研究发现,REV感染1日龄SPF雏鸡后,在病毒感染后期,其外周血液淋巴细胞Cyclin D1在mRNA和蛋白质水平均不同程度地高于对照组雏鸡,而在病毒感染初期淋巴细胞增殖能力受到抑制。RE病毒感染初期,引起宿主细胞损伤,使细胞处于G1期的检查点阻滞,影响细胞周期进程,也可能是病毒感染激活细胞凋亡及其相关信号转导通路促进细胞凋亡,因此会导致淋巴细胞增殖能力降低。然而,在病毒感染后期,Cyclin D1 mRNA表达及其蛋白含量增加,可能与REV特性有关,该病毒是一种病毒性致瘤病毒,其病毒基因及其产物作用于细胞周期蛋白,促使宿主细胞发生转化,转化后的细胞对多种生长抑制信号的反应性减弱或丧失,故而细胞继续增殖,T. Sanda等[17]研究发现,T淋巴细胞白血病病毒能够持续激活NF-κB及其下游信号通路,上调Cyclin D1表达,促进细胞增殖。也可能是REV在机体内的增殖达到峰值,改变宿主细胞的周期进程,为病毒自身增殖创造了微环境,因此Cyclin D1蛋白的表达量增加。李凌云[18]研究发现,人疱疹病毒6型感染HSB2细胞,病毒可改变后者细胞周期进程,为病毒生长繁殖创造了内在环境。在EBV诱导的鼻咽癌中,Cyclin D1蛋白的过表达诱导肿瘤细胞的生长和侵袭[19]。上述肿瘤病毒在宿主细胞中的增殖,都是通过上调Cyclin D1蛋白表达实现的。病毒引发的肿瘤性疾病与Cyclin D1高表达密切相关。
REV感染SPF雏鸡后期,Cyclin D1蛋白含量虽然高表达,但其发挥启动细胞周期活性还需要与CDK结合。CDKI可抑制Cyclin与CDK的结合,作为CDKI家族的主要成员的p27,其可与Cyclin D1竞争性地结合CDK4,也可与Cyclin D1/CDK4复合物结合,从而对细胞增殖发挥负调控作用[20]。迄今为止,关于雏鸡淋巴细胞p27表达的研究尚未见报道。本研究发现,REV感染SPF雏鸡后,其外周血液淋巴细胞p27 mRNA在病毒感染前期明显高于对照组雏鸡。刘润[21]报道,在胃黏膜上皮细胞中,p27通过抑制细胞增殖及诱导细胞凋亡,参与细胞周期调控。Z.Q.Yu等[22]经高通量测序表明,REV感染SPF鸡后,其p27表达明显上调,并促进雏鸡免疫器官的细胞凋亡。本研究还发现,REV感染SPF雏鸡后期,其外周血液淋巴细胞p27 mRNA转录明显下降。p27在增殖能力强的细胞内其含量很低,p27的低表达表明,其抑制细胞分裂、分化及诱导细胞凋亡的能力减弱,其与Cyclin D1-CDK复合物结合量下降[23]。在胸腺恶性肿瘤中,细胞核和细胞质中p27表达的降低,结果促进细胞增殖[24]。在胃腺癌腺细胞中,p27阳性表达率明显低于对照组样本,其与腺细胞增殖异常密切相关[25]。综上研究结果可知,Cyclin D1、p27含量变化的原因可能是:在病毒感染早期,p27表达上调促进免疫细胞凋亡,引起T、B淋巴细胞增殖能力降低;而病毒感染后期,由于病毒的致瘤性,导致Cyclin D1表达增加,p27表达含量明显降低,上述病理改变与REV的免疫致病性及其致瘤性有关。
4 结论REV感染SPF雏鸡后,其外周血液T、B淋巴细胞增殖能力下降、Cyclin D1 mRNA表达及其蛋白质含量增加而p27 mRNA表达下降与REV的免疫致病机制密切相关。
| [1] |
邓小芸, 祁小乐, 高玉龙, 等. 禽网状内皮组织增生症流行现状及检测技术研究进展[J]. 动物医学进展, 2010, 31(9): 93–96.
DENG X Y, QI X L, GAO Y L, et al. Progress on epidemiology and detection technique of reticuloendotheliosis[J]. Progress in Veterinary Medicine, 2010, 31(9): 93–96. (in Chinese) |
| [2] |
张文娟, 裴宗飞, 牛钟相. 禽网状内皮组织增生症病毒env蛋白的表达及其在ELISA方法中的应用[J]. 畜牧兽医学报, 2009, 40(10): 1521–1525.
ZHANG W J, PEI Z F, NIU Z X. Expression of reticuloendotheliosis virus env protein and development of ienv-ELISA for detection of antibody to REV[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(10): 1521–1525. DOI: 10.3321/j.issn:0366-6964.2009.10.015 (in Chinese) |
| [3] |
姜莉莉, 祁小乐, 高玉龙, 等. 野鸭源禽网状内皮组织增生症病毒的分离与鉴定[J]. 畜牧兽医学报, 2013, 44(8): 1277–1282.
JIANG L L, QI X L, GAO Y L, et al. Isolation and identification of reticuloendotheliosis virus in wild birds[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(8): 1277–1282. DOI: 10.11843/j.issn.0366-6964.2013.08.015 (in Chinese) |
| [4] |
卢梦玲, 闫超, 赖多, 等. Cyclin D1与细胞周期调控[J]. 生物技术通报, 2011(10): 55–59.
LU M L, YAN C, LAI D, et al. Cyclin D1 and cell cycle regulation[J]. Biotechnology Bulletin, 2011(10): 55–59. (in Chinese) |
| [5] |
邹向阳, 李连宏. 细胞周期调控与肿瘤[J]. 国际遗传学杂志, 2006, 29(1): 70–73.
ZOU X H, LI L H. Cell cycle control and tumor[J]. International Journal of Genetics, 2006, 29(1): 70–73. (in Chinese) |
| [6] |
罗昆仑. p27与细胞周期调控[J]. 国外医学·肿瘤学分册, 1998, 25(5): 262–265.
LUO K L. P27 and cell cycle regulation[J]. Foreign Medical Sciences. Cancer Section, 1998, 25(5): 262–265. (in Chinese) |
| [7] |
周雪红. 病毒感染对细胞周期调控影响的研究进展[J]. 微生物学免疫学进展, 2012, 40(6): 54–57.
ZHOU X H. Research progress of cell cycle regulation during virus infection[J]. Progress in Microbiology and Immunology, 2012, 40(6): 54–57. (in Chinese) |
| [8] | XUE M, SHI X M, ZHAO Y, et al. Effects of reticuloendotheliosis virus infection on cytokine production in SPF chickens[J]. PLoS One, 2013, 8(12): e83918. DOI: 10.1371/journal.pone.0083918 |
| [9] |
胡峰. 宿主波形蛋白在禽网状内皮组织增生病病毒感染中的作用机制研究[D]. 哈尔滨: 中国农业科学院研究生院(哈尔滨兽医研究所), 2015.
HU F. The molecular mechanism of host vimentin protein contributing to reticuloendotheliosis virus infection[D]. Harbin:Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, 2015. (in Chinese) |
| [10] |
孔斌, 陈雪锋, 唐德宏, 等. 禽网状内皮组织增生症病毒感染肉鸡中鸡白细胞介素18的定量检测[J]. 畜牧兽医学报, 2011, 42(7): 963–966.
KONG B, CHEN X F, TANG D H, et al. Quantitative detection of chicken IL-18 in broiler chickens infected with reticuloendotheliosis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(7): 963–966. (in Chinese) |
| [11] |
李宏梅, 成子强, 刘建柱, 等. REV与AJV-L共感染对肉鸡T淋巴细胞免疫功能与组织病理学的影响[J]. 中国农业科学, 2009, 42(9): 3296–3304.
LI H M, CHENG Z Q, LIU J Z, et al. Effect of co-infection with REV and ALV-J on T lymphocytes bioactivities and histopathology in broiler chickens[J]. Scientia Agricultura Sinica, 2009, 42(9): 3296–3304. DOI: 10.3864/j.issn.0578-1752.2009.09.036 (in Chinese) |
| [12] |
侯宁. REV感染对SPF雏鸡免疫器官细胞凋亡及Bcl-2、C-myc基因表达的影响[D]. 哈尔滨: 东北农业大学, 2016.
HOU N. Influence of reticuloendotheliosis virus to cells apoptosis and gene expression of bcl-2 and C-myc in immune organs of SPF chickens[D]. Harbin:Northeast Agricultural University, 2016. (in Chinese) |
| [13] | GOLIAS C H, CHARALABOPOULOS A, CHARALABOPOULOS K. Cell proliferation and cell cycle control:a mini review[J]. Int J Clin Pract, 2004, 58(12): 1134–1141. DOI: 10.1111/ijcp.2004.58.issue-12 |
| [14] | KIM T H, OH S, KIM S S. Recombinant human prothrombin kringle-2 induces bovine capillary endothelial cell cycle arrest at G0-G1 phase through inhibition of cyclin D1/CDK4 complex:modulation of reactive oxygen species generation and up-regulation of cyclin-dependent kinase inhibitors[J]. Angiogenesis, 2006, 8(4): 307–314. DOI: 10.1007/s10456-005-9020-y |
| [15] | FENG W G, ZHOU D F, MENG W, et al. Growth retardation induced by avian leukosis virus subgroup J associated with down-regulated Wnt/β-catenin pathway[J]. Microb Pathog, 2017, 104: 48–55. DOI: 10.1016/j.micpath.2017.01.013 |
| [16] |
徐彦波, 金华, 甘永华. 鸡贫血病病毒感染雏鸡细胞周期的研究[J]. 中国预防兽医学报, 1999, 21(2): 122–123.
XU Y B, JIN H, GAN Y H. Cell cycle studies on chickens experimentally infected with chicken anemia virus[J]. Chinese Journal of Preventive Veterinary Medicine, 1999, 21(2): 122–123. (in Chinese) |
| [17] | SANDA T, ASAMITSU K, OGURA H, et al. Induction of cell death in adult T-cell leukemia cells by a novel IκB kinase inhibitor[J]. Leukemia, 2006, 20(4): 590–598. DOI: 10.1038/sj.leu.2404129 |
| [18] |
李凌云. 人疱疹病毒6型感染对HSB2细胞周期和细胞凋亡的影响及机制研究[D]. 南京: 南京医科大学, 2010.
LI L Y. Effect of human herpes virus type 6 infection on cell cycle and apoptosis of HSB2 cells and its mechanism[D]. Nanjing:Nanjing Medical University, 2010. (in Chinese) |
| [19] | XU M, CHEUNG C C M, CHOW C, et al. Overexpression of PIN1 enhances cancer growth and aggressiveness with Cyclin D1 induction in EBV-associated nasopharyngeal carcinoma[J]. PLoS One, 2016, 11(6): e0156833. DOI: 10.1371/journal.pone.0156833 |
| [20] | MINARIKOVA P, BENESOVA L, HALKOVA T, et al. Prognostic importance of cell cycle regulators cyclin D1(CCND1) and cyclin-dependent kinase inhibitor 1B (CDKN1B/p27) in sporadic gastric cancers[J]. Gastroenterol Res Pract, 2016, 2016: 9408190. DOI: 10.1155/2016/9408190 |
| [21] |
刘润. p27与胃粘膜上皮细胞周期调控的研究进展[J]. 国外医学·消化系疾病分册, 2003, 23(1): 52–55.
LIU R. The research progress of p27 and gastric mucosal cell cycle regulation[J]. Foreign Medical Sciences. Section of Digestive Diseases, 2003, 23(1): 52–55. (in Chinese) |
| [22] | YU Z Q, GAO X L, LIU C N, et al. Analysis of microRNA expression profile in specific pathogen-free chickens in response to reticuloendotheliosis virus infection[J]. Appl Microbiol Biotechnol, 2017, 101(7): 2767–2777. DOI: 10.1007/s00253-016-8060-0 |
| [23] |
陶金程, 汉丽梅, 刘佳, 等. 细胞周期蛋白激酶抑制因子p27 Kip1研究进展[J]. 动物医学进展, 2011, 32(5): 112–115.
TAO J C, HAN L M, LIU J, et al. Progress on cyclin-dependent kinase inhibitor p27 Kip1[J]. Progress in Veterinary Medicine, 2011, 32(5): 112–115. (in Chinese) |
| [24] | OMATSU M, KUNIMURA T, MIKOGAMI T, et al. Cyclin-dependent kinase inhibitors, p16 and p27, demonstrate different expression patterns in thymoma and thymic carcinoma[J]. Gen Thorac Cardiovasc Surg, 2014, 62(11): 678–684. DOI: 10.1007/s11748-014-0437-3 |
| [25] | KRAVTSOV V G, SHAKHMUROV M G, SUKMANOV O V, et al. Expression of cycline-dependent kinase p27 in the low differentiated gastric adenocarcinoma[J]. Arkh Patol, 2006, 68(5): 14–16. |



