2. 广州市南沙区动物防疫监督所, 广州 511458
2. Servicing Department of Pasturage of Nansha District, Guangzhou 511458, China
禽流感(avian influenza)是由A型流感病毒引起的禽类(家禽和野禽)的感染和/或疾病综合征[1]。禽流感病毒感染、非家禽的鸟类包括野生鸟类高致病性A型流感病毒感染被世界动物卫生组织(OIE)列为法定报告疫病[2]。高致病性禽流感临床症状主要表现为采食量下降、鸡冠发绀、产蛋率下降、精神萎靡、呼吸困难等,剖检常见腺胃、肌胃角膜出血[3]。流行特征主要为潜伏期短,传播快,发病急,死亡率可达100%,同时可引起人感染发病,甚至死亡,因此备受关注。H5N6亚型禽流感病毒曾以低致病性形式在大部分国家的禽类中存在。现在情况已发生变化,监测数据显示,目前在我国南方地区H5N6亚型禽流感病毒监测到的比例增大,禽类、野鸟和活禽市场中都曾分离到,毒株的致病力有逐渐增强的趋势[4-5]。2014年8月23日,黑龙江省哈尔滨市首次发生了鹅感染H5N6禽流感疫情[6]。2015年4月,香港首次从野鸟中检测出H5N6亚型禽流感病毒[7]。根据农业部疫情发布数据统计,2010年1月至2017年7月,我国共发生禽流感疫情37起,H5N6亚型禽流感疫情占到疫情发生数的76.2%,H5N6已取代H5N1成为禽流感病毒优势流行亚型,发生省份或自治区包括湖南、湖北、新疆、四川、甘肃、贵州、广东、江苏等地,呈全国范围流行。2014年5月7日,四川省出现了全球首例人感染H5N6亚型禽流感病毒致死病例,H5N6亚型禽流感也跨越了宿主屏障,对人类健康安全造成了威胁[8]。
新型优势毒株的出现和流行趋势的变化引发了广泛的关注。研究显示,新型H5N6亚型禽流感病毒可能是通过抗原转变的变异方式,由H5N1亚型禽流感病毒与H6N6亚型禽流感病毒重组而来,毒力更强、传播更快、发病率和死亡率更高[9]。近年来流行的H5N6亚型禽流感病毒作为一种新型流感病毒,其进化机制、流行趋势和致病性尚不明晰,需要密切监测、系统和深入的研究与分析。
本研究对2015—2016年广东临床送检的病料进行病毒分离鉴定,得到4株H5N6亚型禽流感病毒,通过点眼滴鼻方式攻毒,研究其对SPF鸡的致病性,为禽流感的防控提供数据参考。
1 材料与方法 1.1 主要试剂与实验动物总RNA抽提试剂盒购自上海飞捷生物技术有限公司;琼脂糖凝胶回收试剂盒购自Magen公司;反转录酶、Ex Taq聚合酶、DL1000 Marker、DL2000 Marker等购自TaKaRa公司;随机引物、反转录引物、PCR扩增引物购自广州艾基生物有限公司;9~11日龄的SPF鸡胚购于广东大华农动物保健品有限公司;4周龄SPF鸡购于新兴大华农SPF实验动物中心。
1.2 试验样品2015—2016年湛江、惠州、清远等地临床送检样品,由人兽共患病防控制剂国家地方联合工程实验室保存。
1.3 病毒分离与鉴定临床病料称重研磨后,按1 g·mL-1加入PBS,冻融3次,10 000 r·min-1离心3 min,取上清接种。每个样品接种3枚9~11日龄SPF鸡胚。每隔12 h照胚,将死亡鸡胚4 ℃保存,收取含有病毒的尿囊液,48 h后通过HA/HI试验鉴定禽流感病毒的HA亚型。抽提病毒RNA。
1.4 基因测序及进化分析利用各基因特异性引物(表 1)进行PCR扩增、纯化,纯化产物克隆到pMD18-T载体上, 阳性克隆送广州艾基生物技术有限公司进行测序。用NCBI Blast进行序列比对;用MEGA6.06软件进行进化树分析;用NetNGlyc 1.0 Server分析序列糖基化位点。
|
|
表 1 扩增引物 Table 1 Primes used for amplification |
尿囊液按照10倍稀释法稀释成10-5~10-9 5个稀释度,每个稀释度各接种5枚9~11日龄非免疫胚,0.2 mL·枚-1,37 ℃培养,弃去12 h内死亡鸡胚,12 h后死亡鸡胚放入4 ℃中保存,48 h后测定所有感染鸡胚的尿囊液血凝活性,来判断该鸡胚是否被感染。通过Reed-Muench法计算病毒EID50。
1.6 对SPF鸡致病性试验及同居试验将4周龄SPF鸡随机分为4组,每组12只(攻毒组6只,同居组6只),另设一组空白对照组(6只),每只鸡戴上脚标登记编号。攻毒组每只鸡经点眼、滴鼻方法接种105 EID50 200 μL病毒尿囊液,同居组和空白对照组不攻毒,随后连续观察9 d,并随时记录各组鸡的临床症状和鸡的死亡情况。饲养期间分别于感染后3、5、7、9 d采集各组鸡的咽、肛拭子,用含有青霉素与链霉素各5 000 IU的PBS缓冲液振荡,各接种3枚9~11日龄的非免疫胚,37 ℃孵化,48 h后测定鸡胚尿囊液的血凝活性,判断是否存在病毒感染。
在攻毒后4 d随机剖杀攻毒组和对照组鸡,无菌采取心、肝、脾、肺、肾、脑6种组织,用含有5 000 IU双抗的无菌PBS液倍比稀释成10-1~10-7 7个稀释度接胚,测定病毒感染SPF鸡后各个组织脏器中病毒复制能力。
1.7 病理组织学观察在攻毒后4 d随机剖杀攻毒组、同居组和对照组鸡,分别取心、肝、脾、肺、肾、脑6种组织,用甲醛浸泡固定,送武汉赛维尔生物科技有限公司进行病理切片分析。
2 结果 2.1 病毒分离2015—2016年临床样品共分离到4株H5N6亚型禽流感病毒(表 2)。
|
|
表 2 H5N6亚型禽流感病毒分离株 Table 2 Isolates of H5N6 subtype AIV |
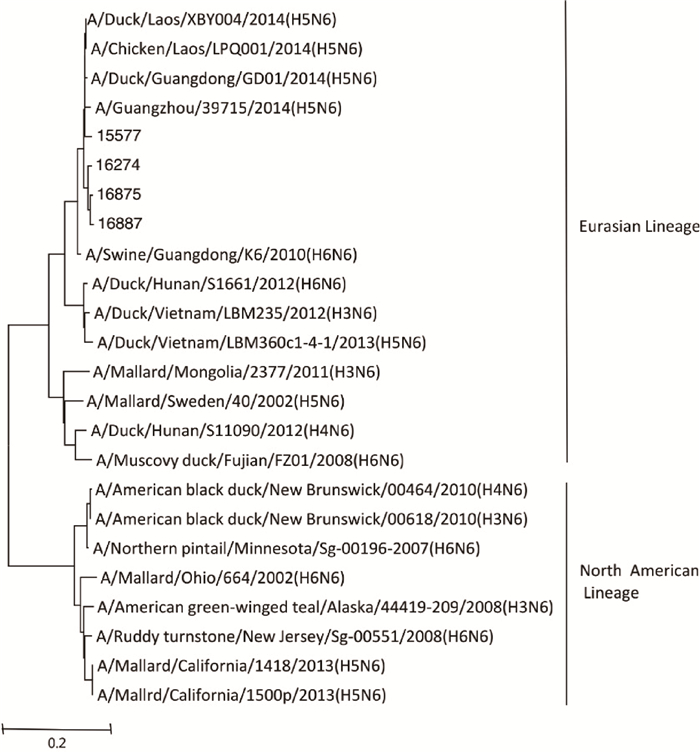
基因序列分析结果显示,分离株HA基因相似性在95.4%~97.1%之间,HA基因位于Clade2.3.4.4 (图 1),NA基因属于欧亚分支(图 2)。

|
图 1 HA基因遗传序列分析 Figure 1 Phylogenetic analysis of HA gene |
|
图 2 NA基因遗传序列分析 Figure 2 Phylogenetic analysis of NA gene |
HA氨基酸序列分析结果表明,HA基因编码567个氨基酸,具有8个潜在糖基化位点(表 3)。HA蛋白的裂解位点处具有多个连续碱性氨基酸,符合高致病性禽流感病毒分子特征。NA基因编码459个氨基酸,具有6~7个潜在糖基化位点(表 4)。HA基因编码HA受体结合位点存在S137A突变;NA蛋白相应位点没有改变;PB1蛋白的L13P位点、PA蛋白的N615K位点、NP蛋白的A184K位点和NS1蛋白的D92E位点发生改变(表 5)。
|
|
表 3 HA蛋白潜在糖基化位点 Table 3 Potential glycosylation sites of HA proteins |
|
|
表 4 NA蛋白潜在糖基化位点 Table 4 Potential glycosylation sites of NA proteins |
|
|
表 5 重要位点分析 Table 5 Gene locus analysis |
试验中所有感染病毒的鸡胚都在12~24 h死亡,病毒EID50结果如表 6。
|
|
表 6 鸡胚半数感染量 Table 6 50% embryo infection dose |
SPF鸡的致病性试验结果发现,攻毒后第2天,16274、16875和16887攻毒组全部死亡,同居组到第3天死亡率达50%以上。15577攻毒组至第5天全部死亡,同居组第9天全部死亡。对照组无鸡死亡(表 7)。
|
|
表 7 试验鸡死亡情况(n=6) Table 7 The death of chicken (n=6) |
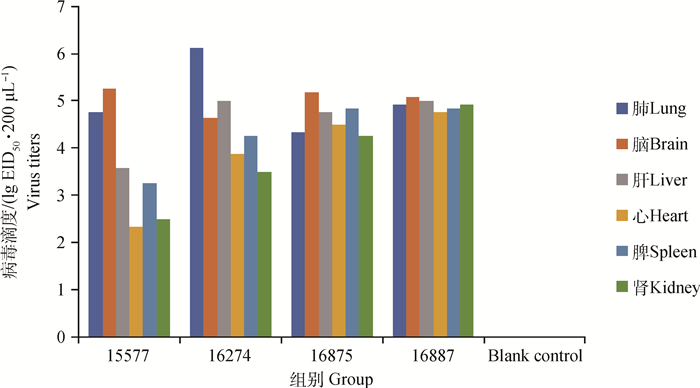
15577攻毒组死亡的鸡脑和肺中病毒滴度较其他脏器高,lg EID50·200 μL-1值大于4.50,而心和肾的病毒滴度较低,为2.25~2.75。16274攻毒组死亡的鸡肺和肝中病毒滴度较其他脏器高些,lg EID50·200 μL-1平均值分别为6.13和5.00,心和肾病毒滴度相对低些,为3.88、3.50。16875和16887攻毒组死亡的鸡6个脏器中病毒滴度值差距不大,病毒滴度都在4.5左右。空白对照组没有检测到病毒滴度(图 3)。
|
图 3 鸡脏器中禽流感病毒滴度 Figure 3 The titer of avian influenza virus in chicken viscera |
15577组的攻毒组和同居组第3天开始都能分到病毒,一直到第9天鸡死亡为止;其余各攻毒组第2天鸡全部死亡,咽、腔拭子无数据;同居组除了16875组咽拭子没检测到病毒外,其余同居组从第3天咽、腔拭子均分离出病毒;空白对照组所有咽、腔拭子都分离不出AIV(表 8)。
|
|
表 8 拭子的病毒分离情况 Table 8 The virus isolation from swab |
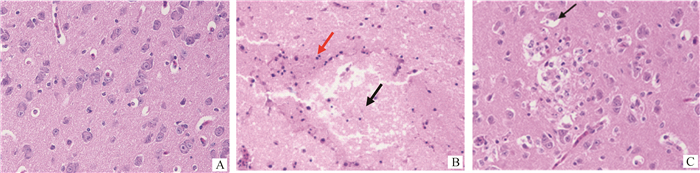
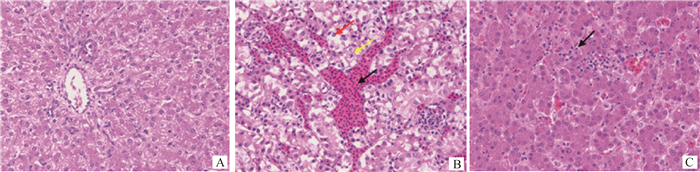
病理切片结果发现,病毒对鸡的肺组织、肝组织、脑组织、脾组织、肾组织和心肌造成了广泛性的损伤。主要的病变:肺和肾充血、出血;肝细胞坏死,淋巴细胞浸润;脑组织坏死,神经胶质细胞增生;脾细胞坏死、减少;心肌纤维坏死、充血(图 4~9)。
|
A.空白对照组;B.感染组,脑组织局灶性坏死(黑色箭头所示),神经元细胞大量减少至消失,坏死灶周围胶质细胞(红色箭头所示)增多;C.感染组,部分神经元水肿,细胞质呈空泡化(黑色箭头所示) A. Blank group; B. Infection group, focal necrosis (indicate by the black arrow), neuronal cells decreased greatly and glial cells increased around the necrotic area (indicate by the red arrow); C. Infection group, some of the neurons are edematous and the cytoplasm was vacuolated (indicate by the black arrow) 图 4 脑组织病理切片结果(260×) Figure 4 The pathological results of brain (260×) |
|
A.空白对照组;B.感染组,肝窦扩张淤血,肝窦中充满大量红细胞(黑色箭头所示),可见大量肝细胞水肿至气球样变,细胞质呈空泡化(红色箭头所示),肝细胞点状坏死(黄色箭头所示);C.感染组,可见少量淋巴细胞浸润(黑色箭头所示) A. Blank group; B. Infection group, hepatic sinus dilation and congestion, and the sinus is full of red blood cells (indicate by the black arrow), a large amount of liver cells are edema to ballooning, cytoplasm vacuolation (indicate by the red arrow), liver cells are necrosis (indicate by the yellow arrow); C. Infection group, a small amount of lymphocytic infiltrates can be seen (indicate by the black arrow) 图 5 肝组织病理切片结果(260×) Figure 5 The pathological results of liver (260×) |
|
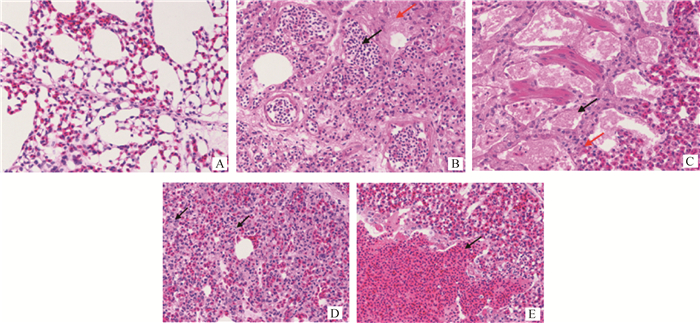
A.空白对照组;B.感染组,肺静脉扩张淤血,血管内大量红细胞(黑色箭头所示),间质轻度水肿,结缔组织疏松(红色箭头所示);C.感染组,肺三级支气管内可见大量炎性渗出物(黑色箭头所示),间质可见少量炎性细胞(红色箭头所示);D.感染组,肺泡上皮细胞点状坏死(黑色箭头所示);E.感染组,局部肺组织大量出血(黑色箭头所示) A. Blank group; B. Infection group, pulmonary veins dilate, congestion, and a large number of red blood cells in the blood vessels (indicate by the black arrow), interstitial edema is mild and connective tissue is loose (indicate by the red arrow); C. Infection group, a large number of inflammatory exudates are seen in the bronchi of grade three of the lung (indicate by the black arrow), small amounts of inflammatory cells are seen on the stroma (indicate by the red arrow); D. Infection group, alveolar epithelial cells show punctate necrosis (indicate by the black arrow); E. Infection group, local lung tissue bleeds profusely (indicate by the black arrow) 图 6 肺组织病理切片结果(260×) Figure 6 The pathological results of lung(260×) |
|
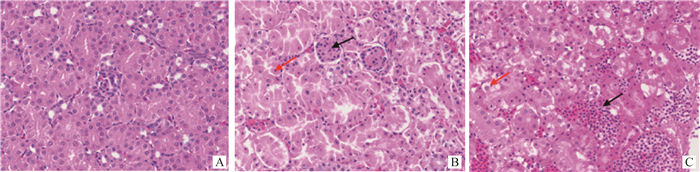
A.空白对照组;B.感染组,肾小球内坏死细胞碎片(黑色箭头所示),大量肾小管上皮细胞坏死,细胞核固缩深染或溶解消失(红色箭头所示);C.感染组,肾毛细血管扩张淤血(黑色箭头所示),部分肾小管上皮细胞气球样变性,细胞质呈空泡化(红色箭头所示) A. Blank group; B. Infection group, glomerular necrosis cell debris (indicate by the black arrow), a large number of tubular epithelial cells are necrosis, pyknosis, or staining and dissolution (indicate by the red arrow); C. Infection group, renal telangiectasia and congestion (indicate by the black arrow), partial tubular epithelial cell ballooning, cytoplasm vacuolation (indicate by the red arrow) 图 7 肾组织病理切片结果(260×) Figure 7 The pathological results of kidney(260×) |
|
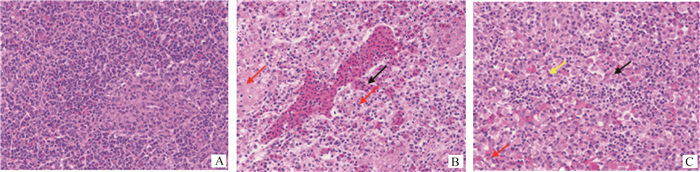
A.空白对照组;B.感染组,脾窦扩张淤血,毛细血管内充满红细胞(黑色箭头所示),大量脾细胞坏死,坏死细胞核碎裂或溶解消失(红色箭头所示);C.感染组,淋巴细胞减少,巨噬细胞大量增多(黑色箭头所示),红细胞崩解,可见少量含铁血黄素沉积(红色箭头所示),少量脾细胞坏死,核碎裂(黄色箭头所示) A. Blank group; B. Infection group, the splenic sinus dilated with congestion and capillaries filled with red blood cells (indicate by the black arrow), a large number of splenic cells are necrotic and necrotic, nuclei fragmented or dissolved (indicate by the red arrow); C. Infection group, the increasing number of macrophages, lymphocytes decreased (indicate by the black arrow), red blood cell disintegrate, a small amount of hemosiderin deposition occurred (indicate by the red arrow), a small amount of spleen cells developed necrosis, nuclear fragmentation (indicate by the yellow arrow) 图 8 脾组织病理切片结果(260×) Figure 8 The pathological results of spleen(260×) |
|
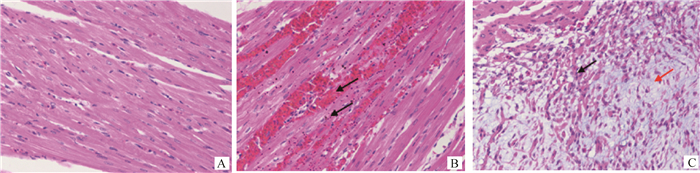
A.空白对照组;B.感染组,心肌出血,心肌纤维间可见大量红细胞并伴有大量含铁血黄素沉积(黑色箭头所示);C.感染组,心肌纤维大量减少,可见坏死心肌细胞(黑色箭头所示),胶原纤维大量增生,纤维化(红色箭头所示) A. Blank group; B. Infection group, Myocardial hemorrhage, large amounts of red blood cells were found between the fibers of the heart and were accompanied by large amounts of ferric deposits (indicate by the black arrow); C. Infection group, a large decrease in myocardial fibers, necrotic myocardial cells were seen (indicate by the black arrow), Collagen fibers were proliferated and fibrotic (indicate by the red arrow) 图 9 心组织病理切片结果(263×) Figure 9 The pathological results of heart(263×) |
禽流感病毒为RNA病毒,有8个片段,RNA酶的复制精确程度比不上DNA酶,存在较多突变,有些突变能增强病毒的感染力,有些突变则是减弱病毒的毒力。有些单一突变能增强病毒的繁殖力和致病力,有些致病力改变需要多片段、多位点共同突变完成,是一个协调作用的过程。总体而言,本研究中的禽流感病毒分离株有多基因片段发生了突变,如PB1的L13P、PA的N615K,NP的A184K、NS的D92E等,导致了禽流感病毒毒力的增强[10-13]。有研究显示HA的Q226L、G228S双位点突变,PB2的E627K、Q591K和D701N突变,NS的G540A独特突变等,可增强病毒在哺乳动物细胞的感染和繁殖能力[14-16]。这些突变在本研究中未发现。
对SPF鸡致病性试验发现,15577株为2015年分离到的毒株,与2016年分离到的另外3个毒株相比,致死性和水平传播力稍弱,是否说明广东H5N6亚型禽流感病毒的毒力在变强,这有待于更多样本数据的研究。
研究发现,4个毒株在感染鸡的心、肝、脾、肺、肾、脑中均检测到禽流感病毒。其中15577株和16274株病毒肺和脑中病毒滴度最高,心、肾中病毒滴度较低;16875株和16887株病毒比较均衡得存在于6个脏器中,各个脏器组织的病毒滴度都很高,引发严重的内脏器官功能障碍,导致机体死亡。在排毒试验中,鸡从开始检测咽、腔拭子排毒情况到死亡之前都能发现持续不间断的排毒,其中泄殖腔排毒是重要的排毒方式,所有鸡泄殖腔拭子都能检测到病毒,提示要做好粪便的无害化处理。
禽流感病毒对机体的损伤主要是通过病毒对脏器组织的损伤,引发功能性障碍,最终出现多器官衰竭而死。在H5N6亚型禽流感病毒感染鸡的剖杀过程中,发现有脑的皮下出血、心包炎、心肌坏死、肝坏死等症状。病理切片可观察到禽流感病毒感染鸡的肺和肾充血、出血;肝细胞坏死,淋巴细胞浸润;脑组织坏死,神经胶质细胞增生;脾细胞坏死、减少;心肌纤维坏死、充血等组织学病变。
4 结论从广东省临床病料中分离到4株H5N6亚型禽流感病毒,遗传序列分析结果表明,分离株HA基因位于2.3.4.4分支,HA蛋白裂解位点具有连续碱性氨基酸序列,属于高致病禽流感病毒。SPF鸡的致病性试验表明,4株禽流感病毒对SPF鸡具有高致病性,致死率为100%,具有致死快、死亡率高的特点。因此,建议加强对H5N6亚型禽流感的监测与防控,严防禽流感疫情的发生。
| [1] |
甘孟侯.
禽流感[M]. 2版. 北京: 中国农业出版社, 2004.
GAN M H. Avian ifluenza[M]. 2nd ed. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [2] | OIE. OIE-Listed diseases, infections and infestations in force in 2017[EB/OL].[2017-07-10]. http://www.oie.int/animal-health-in-the-world/oie-listed-diseases-2017/. |
| [3] |
辛朝安. 禽病的诊断方法[J]. 养禽与禽病防治, 2003(6): 5–11.
XIN C A. The diagnosis method of poultry disease[J]. Poultry Husbandry and Disease Control, 2003(6): 5–11. (in Chinese) |
| [4] | JOOB B, VIROJ W. H5N6 influenza virus infection, the newest influenza[J]. Asian Pac J Trop Biomed, 2015, 5(6): 434–437. DOI: 10.1016/j.apjtb.2015.03.001 |
| [5] | BI Y H, MEI K, SHI W F, et al. Two novel reassortants of avian influenza A (H5N6) virus in China[J]. J Gen Virol, 2015, 96(5): 975–981. DOI: 10.1099/vir.0.000056 |
| [6] |
中华人民共和国农业部. 哈尔滨市双城区发生一起家禽高致病性禽流感疫情[EB/OL]. (2014-09-01)[2017-07-10]. http://www.moa.gov.cn/zwllm/yjgl/yqfb/201409/t20140901_4043080.htm.
Ministry of Agriculture of the People's Republic of China. An outbreak of highly pathogenic avian influenza in Shuangcheng District of Harbin[EB/OL]. (2014-09-01)[2017-07-10]. http://www.moa.gov.cn/zwllm/yjgl/yqfb/201409/t20140901_4043080.htm. (in Chinese) |
| [7] |
国家质量监督检验检疫总局. 香港首次在野鸟中检出H5N6病毒[EB/OL]. (2015-04-20)[2017-07-10]. http://www.aqsiq.gov.cn/xxgk_13386/tzdt/gzdt/201504/t20150420_436726.htm.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Hongkong for the first time in the detection of H5N6 virus in wild birds[EB/OL]. (2015-04-20)[2017-07-10]. http://www.aqsiq.gov.cn/xxgk_13386/tzdt/gzdt/201504/t20150420_436726.htm. (in Chinese) |
| [8] | World Health Organization. WHO China statement on H5N6[EB/OL].[2017-07-10]. http://www.wpro.who.int/china/mediacentre/releases/2014/20140507/en/. |
| [9] | BI Y H, CHEN Q J, WANG Q L, et al. Genesis, evolution and prevalence of H5N6 avian influenza viruses in China[J]. Cell Host Microbe, 2016, 20(6): 810–821. DOI: 10.1016/j.chom.2016.10.022 |
| [10] | HULSE-POST D J, FRANKS J, BOYD K, et al. Molecular changes in the polymerase genes (PA and PB1) associated with high pathogenicity of H5N1 influenza virus in mallard ducks[J]. J Virol, 2007, 81(16): 8515–8524. DOI: 10.1128/JVI.00435-07 |
| [11] |
黎玉莲. 2株H5N6亚型禽流感病毒的序列分析和致病性研究[D]. 广州: 华南农业大学, 2016.
LI Y L. Bioligical characterization and pathogenicity of 2 strains of H5N6 subtype avian influenza viruses[D]. Guangzhou:South China Agricultural University, 2016. (in Chinese) |
| [12] | WASILENKO J L, LEE C W, SARMENTO L, et al. NP, PB1, and PB2 viral genes contribute to altered replication of H5N1 avian influenza viruses in chickens[J]. J Virol, 2008, 82(9): 4544–4553. DOI: 10.1128/JVI.02642-07 |
| [13] | SEO S H, HOFFMANN E, WEBSTER R G. Lethal H5N1 influenza viruses escape host anti-viral cytokine responses[J]. Nat Med, 2002, 8(9): 950–954. DOI: 10.1038/nm757 |
| [14] | YANG Z Y, WEI C J, KONG W P, et al. Immunization by avian H5 influenza hemagglutinin mutants with altered receptor binding specificity[J]. Science, 2007, 317(5839): 825–828. DOI: 10.1126/science.1135165 |
| [15] |
李群辉. 新型重组H5亚型高致病性禽流感病毒的致病性与传播性研究[D]. 扬州: 扬州大学, 2015.
LI Q H. Pathogenicity and transmissibility of the novel reassortant H5 subtype highly pathogenic avian influenza virus[D]. Yangzhou:Yangzhou University, 2015. (in Chinese) |
| [16] | HUANG X F, ZHENG M, WANG P, et al. An NS-segment exonic splicing enhancer regulates influenza A virus replication in mammalian cells[J]. Nat Commun, 2017, 8: 14751. DOI: 10.1038/ncomms14751 |



