2. 河北科技师范学院, 秦皇岛 066004
2. Hebei Normal University of Science & Technology, Qinhuangdao 066004, China
定位于黑素体膜上的跨膜蛋白—多巴色素异构酶(Dopachrometautomerase,DCT),也称作酪氨酸酶相关蛋白2 (TYRP2),参与黑色素的生物合成过程[1-2],1992年被确认为酪氨酸酶相关蛋白家族的第3个成员,具有多巴色素异构酶(DT)活性,催化多巴色素转变为5, 6-二羟基吲哚羧酸(DHICA),具有加速黑色素生成的作用。黑色素细胞中的DCT基因控制着5, 6-二羟基吲哚羧酸与5, 6-二羟基吲哚(DHI)的比例,因此推测,DCT可能对黑色素合成早期阶段的酪氨酸酶催化活性有调节作用,对动物毛色形成发挥重要作用[3-4]。而且,由于中间产物DHI在体内比DHICA有更高的细胞毒性,DCT能使含有羧酸前体的DHICA迅速掺入生物合成的黑色素内,对减少中间产物的细胞毒性有重要意义[5-6]。据前人研究,DCT基因单碱基变异的小鼠,与野生型黑色小鼠相比,DCT活性降低了3~4倍,从而产生了深灰或深棕色小鼠[7]。DCT基因突变的小鼠黑色素细胞过早死亡,可能是由于DCT缺失而产生的细胞毒性中间体所致[8]。也有研究发现,小鼠敲除DCT第一外显子后导致DCT基因mRNA和蛋白质表达量缺失,影响了黑色素细胞的活性和色素沉着,形成深灰色被毛[9]。
鉴于DCT基因表达在动物毛色和生命活动中的重要作用,其表达水平受转录因子调控[10-11],因此,研究DCT基因启动子转录调控机理对于揭示动物毛色形成具有重要作用。SOX10是调控DCT基因表达的一个非常重要的转录因子[12],体外试验表明,SOX10能够激活DCT基因启动转录[13-14]。MITF也是黑色素合成过程中重要的转录因子,有研究认为,DCT基因的表达是依靠MITF与SOX10两种转录因子协同激活的[15-16],也有研究认为,DCT可能存在不依赖于MITF的转录调控[17-19]。人视网膜色素上皮细胞的体外试验发现,转录因子OTX2能够结合到DCT基因的启动子区,抑制内源OTX2的表达导致DCT蛋白含量的减少,说明OTX2能够激活DCT基因启动子[20]。
本试验克隆山羊DCT基因5′UTR区序列,并构建DCT基因系列缺失片段的pGL3-Basic重组质粒,利用点突变方法构建转录因子SOX10、MITF和OTX2结合位点突变的DCT基因系列重组质粒,以Luciferase报告基因系统检测重组质粒的启动活性变化,明确该基因启动子核心调控区和转录因子对DCT基因的表达调控,以期为山羊DCT基因的表达调控提供理论依据。
1 材料与方法 1.1 试验材料pGL3-Basic与pRL-TK载体、双荧光素酶报告基因检测试剂盒为美国Promega公司产品;脂质体Lipofectamine® 2000 Reagent为美国Invitrogen公司产品;Opti-MEM培养基为美国Gibco公司产品;胎牛血清、DMEM培养基为美国Hyclone公司产品;TransStart Taq DNA聚合酶、PCR产物纯化试剂盒、点突变试剂盒为北京全式金公司产品;感受态细胞DH5α、胶回收试剂盒为上海生工生物工程有限公司产品;闪电克隆试剂盒为北京博奥龙免疫技术有限公司产品;内切酶为大连宝生物工程有限公司产品;无内毒素质粒提取试剂盒为北京天根公司产品。引物合成由上海生工生物工程有限公司完成,测序由北京六合华大基因公司完成。
1.2 试验方法 1.2.1 DCT基因启动子系列缺失片段引物设计以山羊DCT基因序列(NCBI收录号:NC_030819.1)为模板,利用在线引物设计程序NEBuilder(http://nebuilder.neb.com/)设计特异引物,在上游引物5′端引入Sac Ⅰ的酶切位点及部分与表达载体的重叠区,下游引物5′端引入Xho Ⅰ的酶切位点及部分与表达载体的重叠区。
利用特异引物(表 1)扩增山羊DCT基因上游序列5′端缺失片段,分别命名为P1、P2、P3、P4和P5。根据第一轮启动子预测片段活性值,以P3片段序列为模板,设计一系列3′端缺失序列引物,分别命名为P6、P7、P8、P9、P10和P11。
|
|
表 1 山羊DCT基因启动子扩增引物 Table 1 Primers amplifying goat DCT gene promoters with different length |
PCR反应体系:10×PCR Buffer 5 μL,dNTP(2.5 mmol·L-1)4 μL,上、下游引物(10 μmol·L-1)各1 μL,DNA模板2.5 μL,TransStart Taq酶(2.5 U·μL-1)0.5 μL,最后ddH2O补足至50 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火温度退火30 s,72 ℃延伸0.5~2 min,共35个循环;72 ℃终延伸10 min;4 ℃终止反应。利用1%琼脂糖凝胶对PCR产物进行电泳检测,若条带单一且为目的条带,直接进行PCR产物纯化,若条带复杂但含有目的条带,将PCR产物进行切胶纯化回收处理。
1.2.3 载体质粒的线性化根据设计引物时所加酶切位点,利用Sac Ⅰ和Xho Ⅰ两种限制性内切酶将载体pGL3-Basic进行双酶切处理,实现载体的线性化。载体双酶切体系:载体质粒1 500 ng,10×M Buffer 6 μL,Sac Ⅰ和Xho Ⅰ各1.5 μL,H2O补足至60 μL,37 ℃反应3~4 h,将反应液进行切胶回收。
1.2.4 重组质粒的构建将回收的山羊DCT基因系列缺失片段与线性化载体进行连接重组,反应体系:目的片段400 ng,载体20 ng,2×Lightening Cloning Master Mix 5 μL,ddH2O补足至10 μL,50 ℃水浴1 h。将反应液转化到DH5α感受态细胞,鉴定为阳性的单菌落送公司测序,确定为阳性克隆,进一步进行重组质粒的大量提取。
1.2.5 转录因子结合位点点突变载体的构建利用转录因子在线分析软件JASPAR(http://jaspar.genereg.net/cgi-bin/jaspar_db.pl)对启动子活性值最高的片段进行转录因子结合位点分析。根据不改变DCT基因其它转录因子结合位点的原则,按照点突变说明书,对启动子活性值最高片段设计突变转录因子SOX10、MITF和OTX2结合位点的引物,命名为TB1、TB2、TB3、TB4、TB5和TB6(表 2)。TB1将-846和-845 bp位置GT突变为TA,TB2将-617和-616 bp位置GT突变为CA,而TB3将-604和-603 bp位置CA突变为AG,从而使三者的SOX10结合位点消失。TB4将-410 bp的C突变为A,TB5将-310 bp的C突变为A,使MITF结合位点消失。TB6将-277 bp的A突变成C,使转录因子OTX2结合位点消失。
|
|
表 2 转录因子结合位点突变引物 Table 2 Primers of point mutation in transcription factor binding site |
根据点突变试剂盒说明书,应用PCR方法实现碱基突变。PCR反应体系:原质粒载体DNA 20~50 ng,上下游引物(10 μmol·L-1)各1 μL,2×TransStart® FastPfu PCR SuperMix 25 μL,ddH2O补足至50 μL。反应程序:94 ℃预变性5 min;94 ℃变性20 s,退火温度退火20 s,72 ℃延伸2 min,共35个循环;72 ℃终延伸10 min;4 ℃终止反应。1%琼脂糖凝胶电泳检测,若有目的条带,加1 μL DMT酶于10 μL PCR产物中,37 ℃消化孵育1 h。将消化产物转化到50 μL DMT感受态细胞中,涂布到含氨苄的培养皿,挑取单菌落,送至华大测序。成功实现突变的载体进行质粒的大量提取,为转染做准备。
1.2.6 山羊DCT基因启动子活性检测A375细胞接种于含10%胎牛血清的DMEM培养基,在5% CO2和37 ℃条件下培养。转染前1 d以每孔1.5×105个细胞的密度接种于24孔培养板,以不含血清及抗生素的培养基进行培养。当细胞融合度达到90%,根据Lipofectamine® 2000 Reagent脂质体转染说明开始转染。脂质体与质粒总量比例为2:1,pGL3-promoter质粒与pRL-TK质粒共转染,转染比例为19:1。转染后48 h裂解细胞,利用双荧光素酶检测试剂盒,GloMax-MultiJr单管型多功能检测仪检测荧光素酶活性。
1.2.7 数据分析利用SPSS 17.0软件的ANOVA对系列缺失片段活性进行分析,采用LSD多重比较对每个检测片段的启动子活性作两两比较。对点突变载体利用独立样本t检验比较突变前后活性变化。P < 0.01表示差异极显著。
2 结果 2.1 山羊DCT基因启动子区调控元件分析NCBI数据库中下载山羊DCT基因(NC_030819.1),并与人和鼠DCT基因启动子序列相比,山羊DCT基因的-648~+73 bp(外显子1第1个碱基记为+1)区域与人的相似度达81%,-472~-28 bp区域与鼠DCT基因启动子序列相似度达78%。
对目的序列进行启动子特征分析,发现多种调控元件(图 1):包含6个TATA box,分别位于-382~-366 bp、-337~-321 bp、-205~-189 bp、-187~-172 bp、-125~-109 bp和+774~+790 bp;位于-138~-123 bp的GC box;位于-188~-175 bp的CAAT box;位于-313~-303 bp的M box和位于-620~-588 bp的32 bp元件。
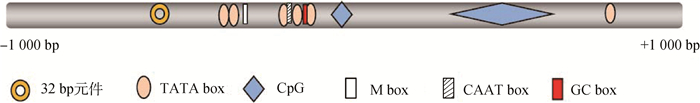
|
图 1 山羊DCT基因序列特征图 Figure 1 Sequence feature of goat DCT gene |
利用在线程序Meth Primer (http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)对山羊DCT基因-2 000~+1 000 bp序列进行CpG岛预测分析,参数设置为Island size ≥100,Obs/Exp ≥0.6,GC Percent ≥50.0。在3 000 bp的序列中,共存在2处CpG岛,分别位于该基因的-93~+7 bp和+309~+603 bp(图 1)。
利用Promoter 2.0预测山羊DCT基因-801、-501和+200 bp 3个位置为启动子位置,分值分别为0.657、0.692和0.621。
2.2 山羊DCT基因启动子缺失片段载体的构建5′和3′系列缺失序列片段的PCR产物1%琼脂糖凝胶电泳检测见图 2,可见目的条带单一,亮度清晰,无杂带。图 2中P1、P2、P3、P4和P5片段分别长2 059、1 598、1 222、775和436 bp,P6、P7、P8、P9、P10和P11片段分别长1 024、778、728、690、650和356 bp。
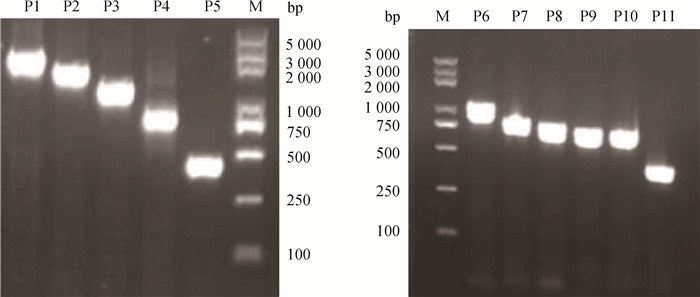
|
M. DNA相对分子质量标准;P1~P11.系列缺失片段 M. DNA marker; P1-P11. The series of deleted fragments 图 2 DCT基因系列缺失片段PCR产物凝胶检测图 Figure 2 Agarose gel electropherogram of PCR products of the serial deleted fragments of DCT gene |
将PCR产物纯化回收,与线性化表达载体混合,加入重组酶,使目的片段与线性化表达载体连接,构建重组质粒,阳性克隆送华大公司测序,测序结果与预期结果一致,证明重组载体构建成功。
2.3 重组质粒启动子活性分析表达载体pGL3-Basic与5′系列缺失片段重组,获得报告基因载体pGL3-P1~pGL3-P5,瞬时转染A375细胞,细胞状态良好,转染后48 h收获并裂解细胞,检测萤火虫荧光素酶荧光值(F)和海肾荧光素酶荧光值(R),计算相对荧光素酶活性,即F/R值。结果显示(图 3),P1(-1 827~+232)、P2(-1 366~+232)、P3(-990~+232)和P4(-543~+232)片段活性均极显著高于阴性对照组(P < 0.01),P3活性极显著高于其它片段(P < 0.01),但P5(-204~+232)活性与阴性对照差异不显著(P > 0.01)。
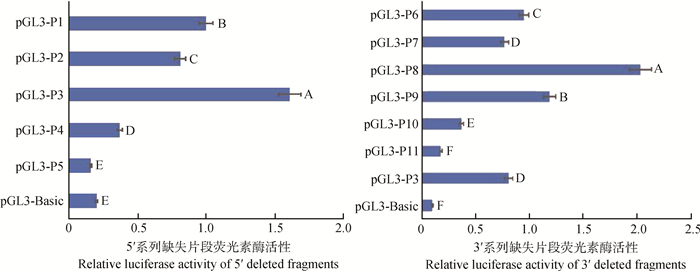
|
不同大写字母代表差异极显著(P < 0.01),相同大写字母代表差异不显著(P>0.01) Columns with different upper case letters mean highly significant difference (P < 0.01); Columns with the same upper case letter mean no significant difference (P>0.01) 图 3 系列缺失片段荧光素酶相对活性值 Figure 3 Luciferase relative activity of serial deleted fragments |
不同片段显示出不同的荧光活性,说明启动子不同区域存在不同作用的重要调控元件。由P5、P4至P3片段长度增加,启动子活性逐渐增加推测,山羊DCT基因核心启动子区可能位于-990~-204 bp范围内,与Promoter 2.0预测的-801和-501 bp启动子位置结论一致;-204~+232 bp区域内可能存在负调控元件,与该区域内的CpG岛(-93~+7 bp)和GC box(-138~-123 bp)有关,或正调控元件不能发挥启动作用。
以-990~+232 bp的P3片段序列为模板,构建系列3′端缺失序列报告基因载体P6~P11,5′端固定在-881 bp位置,3′端依次缩短。如图 1所示,片段P6(-881~+143 bp)包含32 bp元件、M box、CAAT box、GC box、CpG岛和5个TATA box;片段P7(-881~-104 bp)在P6基础上缺少CpG岛;P8(-881~-154 bp)在P7基础上缺少GC box和TATA box;P9(-881~-192 bp)在P8基础上缺少1个CAAT box和2个TATA box;P10(-881~-232 bp)和P9所包含调控元件相同;片段P11(-881~-526 bp)只包含32 bp元件。
图 3显示,片段P6~P10活性值均极显著高于阴性对照组(P < 0.01),P11活性值与阴性对照差异不显著(P>0.01),说明包含预测启动子位置-801 bp的P11片段仅有32 bp元件并不能启动DCT基因的表达,必须与其他调控元件结合共同发挥启动活性。P10片段增加了2个TATA box和1个M box,其启动活性极显著高于P11(P < 0.01)。这不仅验证了5′系列缺失片段活性检测结果,并进一步精确核心启动子区为-881~-232 bp区,说明包含2个预测启动子位置-801和-501 bp的P10,具有32 bp元件(-620~-588 bp)与2个TATA box(-382~-366 bp与-337~-321 bp)和1个M box(-313~-303 bp)组合发挥了基本转录活性。
虽然P9片段的基本调控元件与P10片段相同,但P9却表现出极显著高于P10的启动子活性(P < 0.01),说明-232~-192 bp间存在重要调控元件,1个TATA box(-205~-189 bp),增加DCT基因的转录活性。P8片段增加1个TATA box(-187~-172 bp)和1个CAAT框(-188~-175 bp),其活性表现为最高,比阴性对照高出20.26倍,极显著高于其它所有片段(P < 0.01),推测-192~-154 bp间的CAAT box为DCT基因的关键调控元件,发挥增强子作用。
片段P7和P6增加了GC box(-138~-123 bp)、CpG岛(-93~+7 bp)和1个TATA box,其活性极显著低于P8和P9(P < 0.01),说明-154~+143 bp区域存在的GC box和CpG岛发挥了负调控作用,与5′系列缺失片段发现的-204~+232 bp的负调控结果一致。
2.4 转录因子结合位点点突变报告基因载体构建及活性分析以P8报告基因载体质粒为模板,使用点突变试剂盒构建点突变报告基因片段TB1~TB6,PCR产物为环状,大小为5 525 bp,琼脂糖凝胶电泳检测结果如图 4所示。
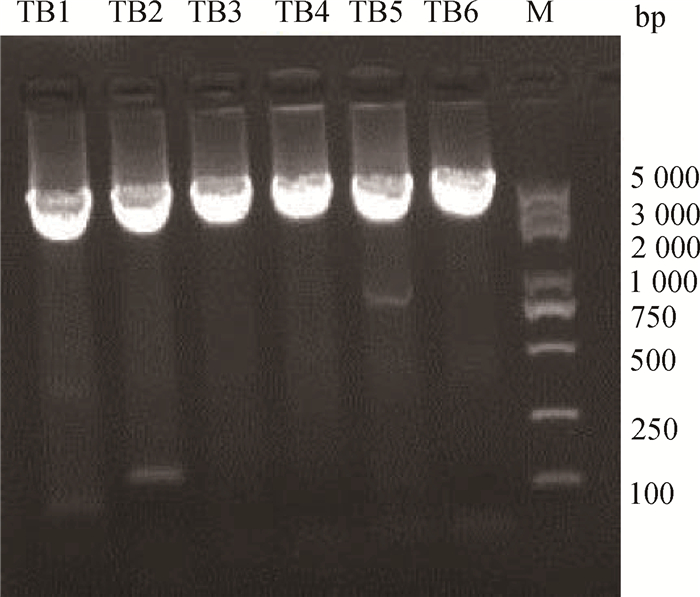
|
TB1~TB6.转录因子结合位点点突变报告基因片段;M. DNA相对分子质量标准 TB1-TB6. Reporter gene fragments with point mutation of transcription factor binding site; M. DNA marker 图 4 转录因子结合位点点突变片段扩增结果 Figure 4 Amplification result of point mutation fragments for transcription factor binding sites |
图 5显示,使SOX10结合位点消失的突变载体TB1(-846和-845 bp)、TB2(-617和-616 bp)和TB3(-604和-603 bp)活性较突变前活性极显著降低(P < 0.01),推测转录因子SOX10与DCT基因在核心启动子区域的结合对转录表达起到正调控作用。而引起MITF和OTX2结合位点消失的突变载体TB4(-410 bp)、TB5(-310 bp)和TB6(-277 bp)启动子活性较突变前极显著增强(P < 0.01),推测转录因子MITF和OTX2对山羊DCT基因的转录表达起到负调控的作用或DCT基因存在不依赖于MITF和OTX2的其他转录调控机制。
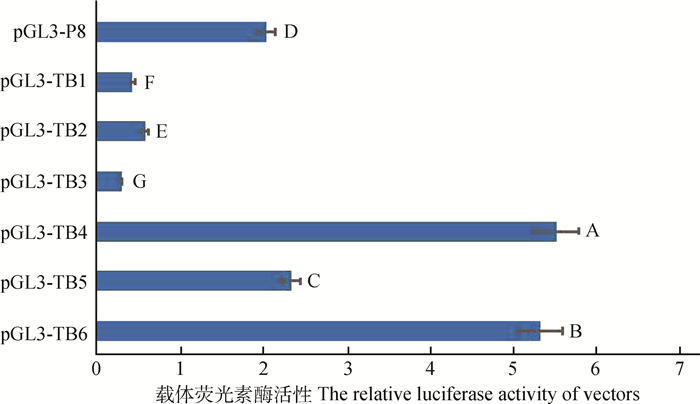
|
图 5 点突变报告基因载体与模板P8载体荧光素酶相对活性 Figure 5 Luciferase relative activity of mutational and original reporter gene vectors and fragment P8 |
启动子的检测方法有多种,最常见的就是报告基因的方法,基本方式就是将生物信息学预测与试验相结合,根据预测结果有目的地设计试验,更快地找到核心启动子区[21-25]。本试验在DCT基因序列中发现了CpG岛、TATA box、GC box、CAAT box、M box和32 bp元件,这些都是启动子附近的标志性元件。而且,通过与GeneCopoeia上公布的人和小鼠DCT基因启动子序列进行比对,发现高度相似性序列也覆盖了这些元件。根据这些序列特征,再参考在线启动子预测结果,首先构建了一系列5′端序列缺失报告基因载体,最长片段为2 059 bp。结果显示,位于-990~+232 bp位置的片段启动子活性值最高,不同缺失片段之间启动子活性都存在极显著差异,根据活性变化情况可推测出-990~-204 bp区域内可能存在正调控元件,在-1 366~-990 bp区域内可能存在负调控元件。结合对基因序列特征的分析,发现片段P4的活性比P3活性显著降低,在P3片段序列中包含32 bp元件,而P4片段中则没有,此元件已被证实是DCT基因在色素细胞表达中所必需的[5],因此可推测,32 bp元件对山羊DCT基因的转录起正调控作用。
根据5′系列启动子缺失片段活性检测结果,在最高活性-990~+232 bp片段的基础上,构建了一系列3′端序列缺失报告基因载体,最长片段为1 024 bp。启动子活性检测发现,-881~-154 bp片段的启动子活性最高,该序列包括32 bp元件、M box和2个TATA box,推测这些调控元件组合可维持山羊DCT基因的基本转录。不同缺失片段启动子活性之间都存在显著差异,根据活性变化情况可推测核心启动子区为-881~-232 bp区,该区域包含2个预测启动子位置,具有32 bp元件、2个TATA box和1个M box,这些元件组合发挥了基本转录活性。-192~-154 bp间的CAAT box为DCT基因的关键调控元件,发挥增强子作用。-154~+143 bp区域存在的GC box和CpG岛,对DCT基因的转录发挥负调控作用。
3.2 利用点突变DCT基因启动子活性片段检测转录因子调控作用本试验在前人对不同物种DCT基因的研究基础上,筛选出了3种与DCT基因转录表达相关的转录因子:SOX10、MITF和OTX2。通过点突变的方法引起转录因子SOX10结合位点消失后的3个片段活性均显著降低,即SOX10能够激活DCT基因的表达,这与前人研究结果一致[12-13]。另外,在5′端系列缺失报告基因载体中,片段P3的启动子活性要显著高于P4,片段P10的启动子活性要显著高于P11,而片段P3和P10序列中都包含了转录因子SOX10的3处结合位点,片段P4和P11则没有SOX10的结合位点,这一结果进一步说明了转录因子SOX10有促进山羊DCT基因转录的作用。
而目前关于转录因子MITF对DCT基因的调控作用尚存在一些争议,有研究认为,MITF能够协同转录因子SOX10刺激并激活DCT基因启动子的转录[14-15],也有研究认为,DCT基因的转录调控不依赖于MITF,或者MITF对DCT基因发挥的是负调控作用[16-18]。本试验共突变了2处转录因子MITF的结合位点,结果显示,突变后片段的启动子活性都显著增强,但在首轮启动子缺失片段中,片段P4序列包含了转录因子MITF的2个结合位点,而片段P5不包含,但片段P4的活性却显著高于片段P5,与MITF结合位点点突变的结果相矛盾,因此产生了2种推测结果:第一,转录因子MITF抑制DCT基因的表达,但由于片段P4序列中含有其它正调控元件,而这些正调控原件发挥了主要作用;第二,DCT基因可能存在其它不依赖MITF的转录调控机制。转录因子OTX2对DCT基因调控作用的研究目前还不是很多,有研究表明,在人视网膜色素上皮细胞中转录因子OTX2能够激活DCT基因的表达,但目前还没有在黑色素细胞中的研究证明[20]。本试验通过定点突变改变转录因子OTX2的结合位点,结果显示,突变后片段启动子活性显著上升,说明转录因子OTX2可能对山羊DCT基因的转录发挥负调控作用。
4 结论本试验成功构建了5个5′端和6个3′端序列缺失启动子报告基因载体,确定山羊DCT基因启动子核心区位于-881~-232 bp区域;-192~-154 bp区域内可能存在正调控元件,发挥增强子作用;-154~+143 bp区域存在的GC box和CpG岛对DCT基因的转录发挥负调控作用。转录因子SOX10对山羊DCT基因转录起正调控作用,而转录因子MITF和OTX2对山羊DCT基因的转录调控作用尚需继续深入研究。
| [1] |
舒文, 毛华明. 黑色素的研究进展[J]. 国外畜牧学:猪与禽, 2003, 23(2): 31–34.
SHU W, MAO H M. Advances in melanin[J]. Animal Science Abroad-Pigs and Poultry, 2003, 23(2): 31–34. (in Chinese) |
| [2] |
刘甲斐, 仇雪梅. 黑色素及其相关基因的研究进展[J]. 生物技术通报, 2007(4): 55–58.
LIU J F, QIU X M. Melanin and its relevant gene research progress[J]. Biotechnology Bulletin, 2007(4): 55–58. (in Chinese) |
| [3] |
刘伟兰, 李祥龙, 周荣艳, 等. 不同物种TYRP2基因完整编码区生物信息学分析[J]. 河南农业科学, 2011, 40(10): 144–148.
LIU W L, LI X L, ZHOU R Y, et al. Bioinformatics analysis of complete coding regions of TYRP2 gene among 21 species[J]. Journal of Henan Agricultural Sciences, 2011, 40(10): 144–148. DOI: 10.3969/j.issn.1004-3268.2011.10.041 (in Chinese) |
| [4] |
白春雨, 高玉花, 庞全海. 影响动物毛色的基因[J]. 国外畜牧学:猪与禽, 2008, 28(5): 71–73.
BAI C Y, GAO Y H, PANG Q H. Gene that affect the coat color of animals[J]. Animal Science Abroad-Pigs and Poultry, 2008, 28(5): 71–73. (in Chinese) |
| [5] | YOKOYAMA K, YASUMOTO K, SUZUKI H, et al. Cloning of the human DOPAchrome tautomerase/tyrosinase-related protein 2 gene and identification of two regulatory regions required for its pigment cell-specific expression[J]. J Biol Chem, 1994, 269(43): 27080–27087. |
| [6] |
郭敏, 张大山, 李祥龙. TYR基因及其与动物毛色关系的研究进展[J]. 黑龙江畜牧兽医, 2017(1): 83–85.
GUO M, ZHANG D S, LI X L. Advances in TYR gene and the relationship with the coat color of animals[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(1): 83–85. (in Chinese) |
| [7] | JACKSON I J, CHAMBERS D M, TSUKAMOTO K, et al. A second tyrosinase-related protein, TRP-2, maps to and is mutated at the mouse slaty locus[J]. EMBO J, 1992, 11(2): 527–535. |
| [8] |
于秀菊, 范阔海. 毛囊的黑色素沉着[J]. 畜牧兽医科技信息, 2009(4): 16–17.
YU X J, FAN K H. melanin pigmentation in hair follicle[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2009(4): 16–17. (in Chinese) |
| [9] | GUYONNEAU L, MURISIER F, ROSSIER A, et al. Melanocytes and pigmentation are affected in dopachrome tautomerase knockout mice[J]. Mol Cell Biol, 2004, 24(8): 3396–3403. DOI: 10.1128/MCB.24.8.3396-3403.2004 |
| [10] |
刘相莲, 乔芳, 黄德玉, 等. 转录因子研究方法进展[J]. 生理科学进展, 2017, 48(1): 73–76.
LIU X L, QIAO F, HUANG D Y, et al. Advances in the Research method of transcription factor[J]. Progress in Physiological Sciences, 2017, 48(1): 73–76. (in Chinese) |
| [11] |
侯琳, 钱敏平, 朱云平, 等. 转录因子结合位点生物信息学研究进展[J]. 遗传, 2009, 31(4): 365–373.
HOU L, QIAN M P, ZHU Y P, et al. Advances on bioinformatic research in transcription factor binding sites[J]. Hereditas, 2009, 31(4): 365–373. (in Chinese) |
| [12] | JALILIAN N, TABATABAIEFAR M A, ALIMADADI H, et al. SOX10 mutation causes Waardenburg syndrome associated with distinctive phenotypic features in an Iranian family:A clue for phenotype-directed genetic analysis[J]. Int J Pediatr Otorhinolaryngol, 2017, 96(5): 122–126. |
| [13] | POTTERF S B, MOLLAAGHABABA R, HOU L, et al. Analysis of SOX10 function in neural crest-derived melanocyte development:SOX10-dependent transcriptional control of dopachrome tautomerase[J]. Dev Biol, 2001, 237(2): 245–257. DOI: 10.1006/dbio.2001.0372 |
| [14] | LUDWIG A, REHBERG S, WEGNER M. Melanocyte-specific expression of dopachrome tautomerase is dependent on synergistic gene activation by the Sox10 and Mitf transcription factors[J]. FEBS Lett, 2004, 556(1-3): 236–244. DOI: 10.1016/S0014-5793(03)01446-7 |
| [15] | JIAO Z X, MOLLAAGHABABA R, PAVAN W J, et al. Direct interaction of Sox10 with the promoter of murine Dopachrome tautomerase (Dct) and synergistic activation of Dct expression with Mitf[J]. Pigm Cell Res, 2004, 17(4): 352–362. DOI: 10.1111/pcr.2004.17.issue-4 |
| [16] | BERTOLOTTO C, BUSCÀR, ABBE P, et al. Different cis-acting elements are involved in the regulation of TRP1 and TRP2 promoter activities by cyclic AMP:pivotal role of M boxes (GTCATGTGCT) and of microphthalmia[J]. Mol Cell Biol, 1998, 18(2): 694–702. DOI: 10.1128/MCB.18.2.694 |
| [17] |
黎钊, 王平, 洪为松. 正常人黑素细胞MITF对酪氨酸酶相关蛋白的转录调控研究[J]. 医学研究杂志, 2013, 42(3): 58–62.
LI Z, WANG P, HONG W S. Effect of MITF transcriptional control on family of tyrosinase-related proteins in normal human melanocytes[J]. Journal of Medical Research, 2013, 42(3): 58–62. (in Chinese) |
| [18] |
刘栋, 朱文元. MITF与黑素细胞的发育、分化和功能调节[J]. 细胞生物学杂志, 2002, 24(6): 346–351.
LIU D, ZHU W Y. The development, differentiation and regulation function of melanocyte with MITF gene[J]. Chinese Journal of Cell Biology, 2002, 24(6): 346–351. (in Chinese) |
| [19] | YASUMOTO K, YOKOYAMA K, TAKAHASHI K, et al. Functional analysis of microphthalmia-associated transcription factor in pigment cell-specific transcription of the human tyrosinase family genes[J]. J Biol Chem, 1997, 272(1): 503–509. DOI: 10.1074/jbc.272.1.503 |
| [20] | TAKEDA K, YOKOYAMA S, YASUMOTO K, et al. OTX2 regulates expression of DOPAchrome tautomerase in human retinal pigment epithelium[J]. Biochem Bioph Res Commun, 2003, 300(4): 908–914. DOI: 10.1016/S0006-291X(02)02934-0 |
| [21] |
汤方, 涂慧珍. 真核启动子研究进展[J]. 林业科技开发, 2015, 29(2): 7–12.
TANG F, TU H Z. Advances in eukaryotic promoter[J]. China Forestry Science and Technology, 2015, 29(2): 7–12. (in Chinese) |
| [22] |
王秋岩, 何淑雅, 马云, 等. 启动子分析方法的研究进展[J]. 现代生物医学进展, 2015, 15(14): 2794–2800.
WANG Q Y, HE S Y, MA Y, et al. Advances in analytical methods of promoter[J]. Progress in Modern Biomedicine, 2015, 15(14): 2794–2800. (in Chinese) |
| [23] |
姚一龙, 李伯江, 李齐发. 牦牛FKBP6基因启动子区克隆、鉴定与分析[J]. 畜牧兽医学报, 2017, 48(1): 52–59.
YAO Y L, LI B J, LI Q F. Cloning and identification of promoter of Yak FKBP6 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(1): 52–59. (in Chinese) |
| [24] |
李丽莎, 彭永东, 郑晓宁, 等. 山羊PMEL基因启动子活性及转录调控元件分析[J]. 畜牧兽医学报, 2017, 48(5): 826–835.
LI L S, PENG Y D, ZHENG X N, et al. Analysis of the promoter activity and transcriptional regulatory elements of goat PMEL gene[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 826–835. (in Chinese) |
| [25] |
胡慧艳, 贾青, 侯胜奎, 等. 猪DKK1基因启动子区的克隆及其活性分析[J]. 畜牧兽医学报, 2017, 48(6): 1150–1157.
HU H Y, JIA Q, HOU S K, et al. Cloning and activity analysis of the promoter region of swine DKK1 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(6): 1150–1157. (in Chinese) |



