2. 中国水产科学研究院长江水产研究所, 武汉 430223
2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China
近年来,作为威胁生猪养殖业中最主要的问题之一,仔猪腹泻在国内甚至全球范围内都造成了极大的经济损失[1]。而最近的调查结果显示,产肠毒素型大肠杆菌(enterotoxic Escherichia coli, ETEC)直接导致了国内接近40%的仔猪腹泻,并且这一数据还逐渐呈上升趋势[2]。同时,ETEC可以通过污染的水和食物进入肠道产生肠毒素导致腹泻[3],也是引起儿童和旅游者腹泻的重要病原,更是造成很多发展中国家幼童死亡的罪魁祸首,已经成为人类公共卫生安全的一个重要威胁[4]。
ETEC肠毒素为外毒素,包括强免疫原性的不耐热肠毒素(LT)和低分子量无抗原性的耐热型肠毒素(ST),ST可抵抗100 ℃至少15 min[5]。LT是由1个A亚型和5个B亚型构成的六聚体,ST又包括溶于甲醇抗蛋白酶的STa(也称为STⅠ)和不溶于甲醇蛋白酶敏感的STb(也称STⅡ)2种完全不同的肠毒素[6]。有研究表明,在ETEC造成的腹泻中超过60%是由产STa型ETEC引起[7],STb对仔猪腹泻影响不大,更多的研究集中于毒性强烈的STa[8]。
大肠杆菌是用于外源蛋白质生产表达的常用宿主菌之一,由于其易于操作、性状稳定,且其成本低廉,可以快速大规模地生产目的蛋白质等优点[9],大肠杆菌表达系统已成为很多外源蛋白质生产表达的首选[10]。随着基因工程技术的发展,表达肠毒素的基因序列已被测序确定。为研究STa对仔猪的损伤影响,王磊于2016年利用大肠杆菌LMG194为宿主,pBAD202/D-topo质粒为载体,成功建立了表达Ⅰ型耐热肠毒素STa的重组大肠杆菌LMG194-STa[11]。
本试验利用该重组菌,以STa对七日龄仔猪肠道结构和功能的作用为目的,研究其对7日龄仔猪肠道免疫、屏障及抗氧化功能的影响,以便进一步研究重组菌及STa对仔猪肠道结构和功能的作用机制及缓解措施。
1 材料与方法 1.1 试验动物和设计选用24头7日龄健康的杜洛克×长白×大白未断奶仔猪,按体重相近原则,采用单因子设计,随机分为4个处理组,每组6个重复,每个重复1头猪,试验期为7 d。四个组分别为对照组(基础日粮)、STa组(基础日粮+2×109 CFU重组菌LMG194-STa)、LMG194组(基础日粮+2×109 CFU大肠杆菌LMG194) 和K88组(基础日粮+2×109 CFU大肠杆菌K88)。表达Ⅰ型耐热肠毒素STa的重组大肠杆菌LMG194-STa来源于武汉轻工大学动物营养与饲料科学湖北省重点实验室,基础日粮使用人工乳(武汉安佑饲料科技有限公司,湖北武汉)饲喂,自由采食和饮水,其营养成分:粗蛋白质≥20.0%,粗脂肪≤10.0%,粗灰分≤9.0%,水分≤10.0%,粗纤维≤0.3%,钙0.4%~1.1%,总磷≥0.3%,赖氨酸≥1.4%。试验预饲期4 d,第5天开始攻毒试验(109 CFU对应种类的大肠杆菌,早晚各灌服1次),第7天屠宰取样。试验在动物营养与饲料科学湖北省重点实验室进行,舍温保持在25~27 ℃,猪栏面积为1.20 m×1.10 m。
1.2 样品采集仔猪屠宰后剖开腹腔,将小肠从其肠系膜处取下并立即放入冰块中。分离出十二指肠、空肠和回肠。十二指肠在距胃贲门5 cm处取样,空肠和回肠分别在其1/2处取样,所取肠段均为10 cm。用剪刀轻轻剖开各肠段,并用冰冻生理盐水轻轻冲洗肠壁内容物,用滤纸吸干水分,而后用载玻片刮取肠黏膜,液氮研磨分装后,转移至-80 ℃冰箱中保存待测。
1.3 测定指标与方法 1.3.1 肠道免疫功能参照梅慧敏等采用的Real-time PCR方法[12],使用试剂盒提取回肠黏膜总RNA并反转录合成cDNA(宝生物工程有限公司,辽宁大连),使用7500 Real-time PCR系统(Foster,美国),以RPL4为内参基因,检测免疫相关基因IFN-γ、IL-4与VNN1相对转录量考察肠道的免疫功能。检测基因与内参基因(RPL4) 引物序列见表 1。各基因的相对表达量通过归一法,以相对于对照组的转录量表示。
|
|
表 1 检测基因引物序列 Table 1 Primers for Real-time PCR analysis |
检测回肠黏膜中黏膜损伤基因Villin与MMP3相对转录量,及空肠黏膜上皮细胞连接蛋白Occludin与Claudin-1的相对表达量考察肠道的屏障功能。基因相对表达量的检测方法同上,引物序列见表 1。蛋白质相对表达量参照伍国华等[13]采用的Western blot方法进行测定,使用抗体Occludin、Claudin-1与内参β-actin(1:5 000,Invitrogen公司,美国),ECL试剂显影(Amersham Biosciences公司,瑞典),于Alpha Innotech Fluor Chem FC2(California,美国)成像系统中检测及分析。
1.3.3 肠道抗氧化功能取十二指肠、空肠、回肠、结肠黏膜制备10%组织匀浆液。匀浆上清液中总蛋白质含量采用考马斯亮蓝法测定。测定谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)及髓过氧化物酶(MPO)等肠黏膜抗氧化相关酶活性及肠黏膜氧化相关产物丙二醛(MDA)的含量。以上指标按试剂盒(南京建成生物技术研究所)方法进行检测。
1.4 统计分析本试验数据采用SPSS 17.0软件进行统计分析,采用单因素方差分析和Duncan氏进行多重比较,结果用“ x±s”表示,以P < 0.05为显著性标准。
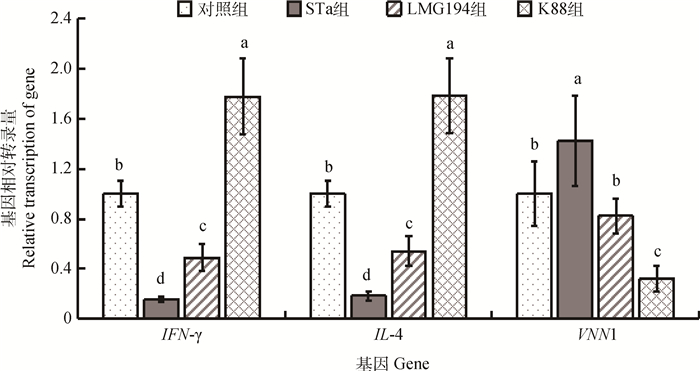
2 结果 2.1 回肠免疫相关基因相对转录量回肠免疫相关基因相对转录量检测结果见图 1。与对照组相比,STa组显著地降低了回肠IFN-γ与IL-4基因的相对转录量(P < 0.05),显著提高了VNN1基因的相对转录量(P < 0.05)。此外,K88组的检测结果与STa组相反。
|
不同小写字母表示差异显著(P < 0.05)。下同 Different letters differ significant (P < 0.05). The same as below 图 1 回肠免疫相关基因IFN-γ、IL-4和VNN1相对转录量 Figure 1 mRNA levels of IFN-γ, IL-4, and VNN1 in ileum |
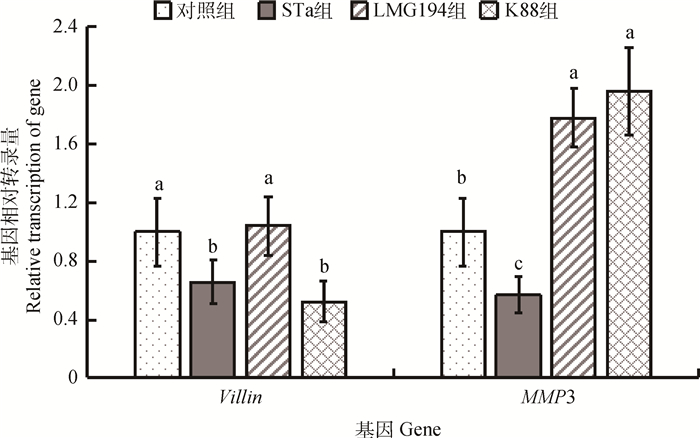
回肠的黏膜损伤基因相对转录量的测定结果见图 2。统计结果显示,与对照组相比,STa组与K88组均可显著降低回肠中Villin基因的相对转录量(P < 0.05),同时,STa组显著降低回肠中MMP3基因的相对转录量(P < 0.05),K88组该基因转录显著上调(P < 0.05)。
|
图 2 回肠黏膜损伤基因相对转录量 Figure 2 mRNA levels of Villin and MMP3 in ileum |
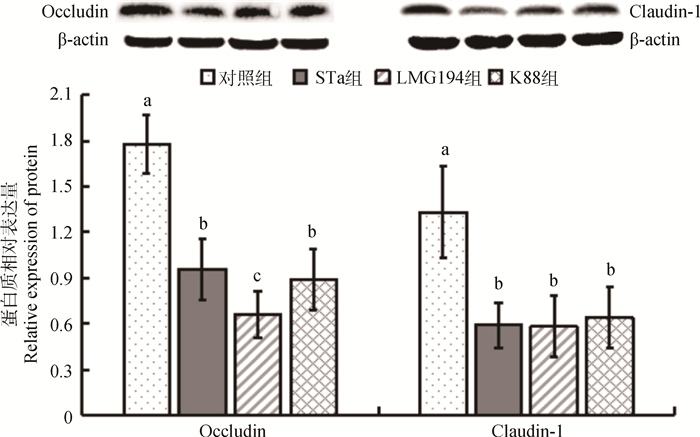
空肠黏膜上皮连接蛋白相对表达量的检测结果见图 3。与对照组相比,STa组与K88组均能显著降低空肠中Occludin与Claudin-1的相对表达量,差异显著(P < 0.05)。
|
图 3 空肠黏膜上皮连接蛋白相对表达量 Figure 3 Expression of protein levels of Occludin and Claudin-1 in ileum |
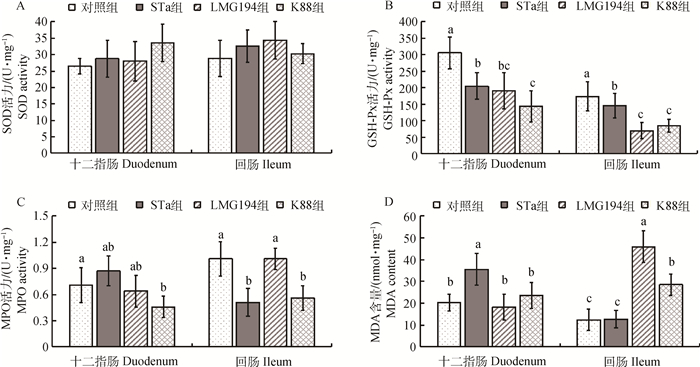
肠黏膜抗氧化相关酶活性与氧化相关产物含量的检测见图 4,与对照组相比,STa组与K88组中十二指肠与回肠的谷胱甘肽过氧化物酶(GSH-Px)活力显著降低(P < 0.05),STa组回肠及K88组十二指肠与回肠的中髓过氧化物酶(MPO)活力显著降低(P < 0.05)。同时,STa组十二指肠与K88组回肠中的丙二醛(MDA)含量显著提高(P < 0.05)。
|
A.超氧化物歧化酶; B.谷胱甘肽过氧化物酶; C.髓过氧化物酶; D.丙二醛 A. SOD; B. GSH-Px; C. MPO; D. MDA 图 4 肠黏膜抗氧化相关酶活力与氧化相关产物含量 Figure 4 Activities of antioxidative enzymes and oxidative related products in duodenum and ileum |
近年来,β-肌动蛋白(ACTB)和甘油醛-3-磷酸脱氢酶(GAPDH)被广泛应用作内参基因进行相对定量的分析研究[14],但是根据大量研究表明,在某些特殊条件下,例如病毒感染、环境等因素,ACTB和GAPDH不能作为稳定的内参基因对目的基因进行定量分析[15]。所以理想的内参基因应该根据特定的试验条件来选择。A. B. Nygard等研究在猪组织基因表达时, β-肌动蛋白(ACTB)和核糖体蛋白L4(RPL4) 对高丰度的转录物是很好的内参基因, 而TATA盒结合蛋白(TBP)和次黄嘌呤磷酸核糖转移酶1(HPRT1) 对低丰度的转录物是很好的内参基因[16]。本试验根据这些研究结果,决定采用RPL4作为内参基因。
干扰素是机体自身产生的一种抵御病毒入侵,维持机体或细胞功能自我稳定的防御性物质[17];干扰素γ(IFN-γ)是由Th1细胞分泌的,可以诱导巨噬细胞产生诱导性一氧化氮合酶(iNOS),促进NO的合成,具有较强的免疫调节作用[18]。白细胞介素-4(IL-4) 是Th2型细胞产生的一种多效应性的免疫活性调节分子,在免疫调节中具有十分重要的作用,可间接介导细胞免疫,对于B细胞、T细胞、肥大细胞、巨噬细胞和造血细胞都具有免疫调节作用[19]。肠上皮细胞参与炎症导致的肠道肿瘤的增殖,在此过程中Vanin-1(VNN1) 是一个关键的作用因子[20];VNN1是一种广泛分布于上皮组织中的具有泛酰巯基乙胺酶活性的胞外酶,主要功能为促进炎症因子的聚集、加剧氧化应激反应和下调PPAR-γ通路,进而导致相关疾病[21]。在本试验中,STa的重组大肠杆菌较对照组显著下调了回肠IFN-γ和IL-4基因的相对转录量,显著上调了VNN1的相对转录量,表明STa的重组大肠杆菌可以激发回肠的炎症反应,降低了免疫功能。值得一提的是,K88组的结果与其相反,可能是由于其毒力激发了机体的免疫效应产生,有待进一步探索。
Villin是一种具有多种功能的钙离子依赖肌动蛋白黏连蛋白,蛋白是肠道细胞分化成熟的标志,也是消化道损伤和肿瘤的重要标志物,在维持肠上皮表型中发挥重要作用[22]。基质金属蛋白酶(MMP)是一类Zn2+依赖性的内肽酶,几乎可以降解所有的细胞外基质成分[23];MMP3是MMPs家族中非常重要的一员,主要存在于上皮细胞、基质纤维母细胞和巨噬细胞等,可为细胞正常的生理功能提供巨大的支持[24]。Occludin和Claudin-1均是肠上皮细胞间连接蛋白。Occludin蛋白作为构成紧密连接的主要蛋白之一,能反映肠道紧密连接及屏障破坏的情况,其分布减少会导致屏障功能障碍,进而导致疾病的发生,在维持紧密连接结构方面具有重要作用[25]。而Claudin-1是保证紧密连接的渗透性具有特异性的主要蛋白,功能主要是对特异的、体积小的离子进行选择性通透,可通过细胞屏障、信号传递等功能,保持细胞内环境的平衡[26]。本试验研究结果表明,与对照组相比,STa组导致回肠Villin和MMP3基因相对转录量以及空肠Occludin和Claudin-1蛋白相对表达量显著下调,说明STa的重组大肠杆菌可以破坏肠黏膜屏障功能,效果显著。同时,除MMP3基因上调外,大肠杆菌K88与其效果相近。
GSH-Px、SOD是体内主要的自由基清除酶[27],能够保护细胞免受氧化损伤,其活性间接反映机体清除氧自由基的能力及机体内源性抗氧化能力。GSH-Px、SOD活力的降低通常表示抗氧化能力的下降[28]。MPO的主要功能是催化反应生成氧化剂,不仅能杀灭吞噬于细胞内的微生物,而且可释放到细胞外,破坏多种靶物质,如肿瘤细胞、血小板、NK细胞、原虫、毒素等,对机体产生和调节炎症反应等多方面发挥作用[29]。MDA是脂质过氧化反应的一种重要分解产物,常被用作脂质过氧化损伤程度的检测指标[30]。本试验研究结果表明,STa的重组大肠杆菌导致十二指肠、回肠GSH-Px以及回肠MPO的活力显著降低,十二指肠MDA产量显著升高;大肠杆菌K88导致十二指肠、回肠GSH-Px和回肠MPO活力显著降低,MDA产量显著升高;反映了仔猪肠道清除氧自由基的能力显著下降,氧化相关产物增多,表明表达耐热肠毒素(STa)的重组大肠杆菌和大肠杆菌K88都能使肠黏膜抗氧化能力降低,但STa组的效果低于K88组。
本试验分别通过测量回肠免疫相关基因IFN-γ、IL-4与VNN1及回肠黏膜损伤基因Villin与MMP3的相对表达量,空肠黏膜上皮连接蛋白Occludin与Claudin-1相对表达量,以及十二指肠、回肠GSH-Px、SOD和MPO的活力与MDA的含量,对于STa的重组大肠杆菌对仔猪肠道免疫、屏障及抗氧化功能的影响进行了研究,其结果表明,表达Ⅰ型耐热肠毒素的重组大肠杆菌可导致7日龄仔猪肠道免疫、屏障及抗氧化功能下降。但重组菌对仔猪造成这一影响的分子调节机制及其相应的缓解措施尚未明了,有待进一步研究。同时,与大肠杆菌K88相比,STa的重组大肠杆菌免疫功能的结果相反,屏障功能结果相近,抗氧化功能结果相对较低,二者的毒力及其作用机制的差异是有待进一步探索的新内容。
4 结论表达Ⅰ型耐热肠毒素的重组大肠杆菌可导致7日龄仔猪肠道免疫、屏障以及抗氧化功能下降。
| [1] | FAIRBROTHER J M, NADEAU É, GYLES C L. Escherichia coli in postweaning diarrhea in pigs:An update on bacterial types, pathogenesis, and prevention strategies[J]. Anim Health Res Rev, 2005, 6(1): 17–39. DOI: 10.1079/AHR2005105 |
| [2] | FLECKENSTEIN J M, HARDWIDGE P R, MUNSON G P, et al. Molecular mechanisms of enterotoxigenic Escherichia coli infection[J]. Microbes Infect, 2010, 12(2): 89–98. DOI: 10.1016/j.micinf.2009.10.002 |
| [3] |
王荣荣, 马永平. 人产肠毒素大肠杆菌基因工程疫苗的研究进展[J]. 中国生物制品学杂志, 2010, 23(5): 544–548.
WANG R R, MA Y P. Progress in development of recombinant human enterotoxigenic Escherichia coli vaccine[J]. Chinese Journal of Biologicals, 2010, 23(5): 544–548. (in Chinese) |
| [4] | ABE A, KOMASE K, BANGTRAKULNONTH A, et al. Trivalent heat-labile-and heat-stable-enterotoxin probe conjugated with horseradish peroxidase for detection of enterotoxigenic Escherichia coli by hybridization[J]. J Clin Microbiol, 1990, 28(12): 2616–2620. |
| [5] | NAGY B, FEKETE P Z. Enterotoxigenic Escherichia coli (ETEC) in farm animals[J]. Vet Res, 1999, 30(2-3): 259–284. |
| [6] | QADRI F, SVENNERHOLM A M, FARUQUE A S, et al. Enterotoxigenic Escherichia coli in developing countries:epidemiology, microbiology, clinical features, treatment, and prevention[J]. Clin Microbiol Rev, 2005, 18(3): 465–483. DOI: 10.1128/CMR.18.3.465-483.2005 |
| [7] | CHAO K L, DREYFUS L A. Interaction of Escherichia coli heat-stable enterotoxin B with cultured human intestinal epithelial cells[J]. Infect Immun, 1997, 65(8): 3209–3217. |
| [8] | EDWARDS R A, SCHIFFERLI D M. Differential regulation of fasA and fasH expression of Escherichia coli 987P fimbriae by environmental cues[J]. Mol Microbiol, 1997, 25(4): 797–809. DOI: 10.1046/j.1365-2958.1997.5161875.x |
| [9] |
祁浩, 刘新利. 大肠杆菌表达系统和酵母表达系统的研究进展[J]. 安徽农业科学, 2016, 44(17): 4–6, 52.
QI H, LIU X L. Research progress of expression systems of Escherichia coli and yeast[J]. Journal of Anhui Agricultural Sciences, 2016, 44(17): 4–6, 52. DOI: 10.3969/j.issn.0517-6611.2016.17.002 (in Chinese) |
| [10] | JAFARI S, BABAEIPOUR V, SEYEDI H A E, et al. Recombinant production of mecasermin in E. coli expression system[J]. Res Pharm Sci, 2014, 9(6): 453–461. |
| [11] |
王磊. 表达单一肠毒素重组大肠杆菌的构建及仔猪腹泻模型的建立[D]. 武汉: 武汉轻工大学, 2016.
WANG L. Construction of recombinant Escherichia coli expressing single enterotoxin and establishing of piglet diarrhea model[D]. Wuhan:Wuhan Polytechnic University, 2016. (in Chinese) |
| [12] |
梅慧敏, 周颖, 张越, 等. 大豆抗原蛋白对仔猪肠道转运通道的影响[J]. 饲料工业, 2016, 37(23): 46–50.
MEI H M, ZHOU Y, ZHANG Y, et al. Effect of soybean allergenic protein on intestinal function of piglets[J]. Feed Industry, 2016, 37(23): 46–50. (in Chinese) |
| [13] |
伍国华, 李娇, 侯永清, 等. N-乙酰半胱氨酸对脂多糖单次刺激仔猪肠黏膜免疫应激的影响[J]. 动物营养学报, 2012, 24(9): 1793–1798.
WU G H, LI J, HOU Y Q, et al. Effects of N-acetylcysteine on intestinal mucosal immune stress of piglets single challenged with lipopolysaccharide[J]. Chinese Journal of Animal Nutrition, 2012, 24(9): 1793–1798. (in Chinese) |
| [14] | SUN Y, LI Y, LUO D Z, et al. Pseudogenes as weaknesses of ACTB (Actb) and GAPDH (Gapdh) used as reference genes in reverse transcription and polymerase chain reactions[J]. PLoS One, 2012, 7(8): e41659. DOI: 10.1371/journal.pone.0041659 |
| [15] | RADONIĆ A, THULKE S, MACKAY I M, et al. Guideline to reference gene selection for quantitative real-time PCR[J]. Biochem Biophys Res Commun, 2004, 313(4): 856–862. DOI: 10.1016/j.bbrc.2003.11.177 |
| [16] | NYGARD A B, JØGENSEN C B, CIRERA S, et al. Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR[J]. BMC Mol Biol, 2007, 8: 67. DOI: 10.1186/1471-2199-8-67 |
| [17] | SURADHAT S, INTRAKAMHAENG M, DAMRONGWATANAPOKIN S. The correlation of virus-specific interferon-gamma production and protection against classical swine fever virus infection[J]. Vet Immunol Immunopathol, 2001, 83(3-4): 177–189. DOI: 10.1016/S0165-2427(01)00389-0 |
| [18] | WALRAVENS K, MARCHÉ S, ROSSEELS V, et al. IFN-γ diagnostic tests in the context of bovine mycobacterial infections in Belgium[J]. Vet Immunol Immunopathol, 2002, 87(3-4): 401–406. DOI: 10.1016/S0165-2427(02)00092-2 |
| [19] | SOKOL C L, BARTON G M, FARR A G, et al. A mechanism for the initiation of allergen-induced T helper type 2 responses[J]. Nat Immunol, 2008, 9(3): 310–318. DOI: 10.1038/ni1558 |
| [20] | NAQUET P, AURRAND-LIONS M, BAZIN H, et al. Vanin-1, a perivascular molecule involved in thymus homing[J]. Immunol Lett, 1997, 56: 7. DOI: 10.1016/S0165-2478(97)85029-8 |
| [21] | JANSEN P A M, KAMSTEEG M, RODIJK-OLTHUIS D, et al. Expression of the vanin gene family in normal and inflamed human skin:induction by proinflammatory cytokines[J]. J Invest Dermatol, 2009, 129(9): 2167–2174. DOI: 10.1038/jid.2009.67 |
| [22] | BRETSCHER A, WEBER K. Villin is a major protein of the microvillus cystoskeleton which binds both G and F actin in a calcium-dependent manner[J]. Cell, 1980, 20(3): 839–847. DOI: 10.1016/0092-8674(80)90330-X |
| [23] | BRINCKERHOFF C E, MATRISIAN L M. Matrix metalloproteinases:A tail of a frog that became a prince[J]. Nat Rev Mol Cell Biol, 2002, 3(3): 207–214. DOI: 10.1038/nrm763 |
| [24] | STERNLICHT M D, LOCHTER A, SYMPSON C J, et al. The stromal proteinase MMP3/stromelysin-1 promotes mammary carcinogenesis[J]. Cell, 1999, 98(2): 137–146. DOI: 10.1016/S0092-8674(00)81009-0 |
| [25] | FURUSE M, FUJITA K, HIIRAGI T, et al. Claudin-1 and -2:novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin[J]. J Cell Biol, 1998, 141(7): 1539–1550. DOI: 10.1083/jcb.141.7.1539 |
| [26] | PELTONEN S, RIEHOKAINEN J, PUMMI K, et al. Tight junction components occludin, ZO-1, and claudin-1, -4 and -5 in active and healing psoriasis[J]. Br J Dermatol, 2007, 156(3): 466–472. DOI: 10.1111/bjd.2007.156.issue-3 |
| [27] | UZAR E, OZAY R, EVLIYAOGLU O, et al. Hydroxycloroquine-induced oxidative stress on sciatic nerve and muscle tissue of rats:A stereological and biochemical study[J]. Hum Exp Toxicol, 2012, 31(10): 1066–1073. DOI: 10.1177/0960327111433183 |
| [28] | WANG M Z, DING L Y, WANG J F, et al. Dietary effects of n-6:n-3 polyunsaturated fatty acid ratios on the antioxidant status of the liver in goslings[J]. J Anim Feed Sci, 2012, 21(2): 372–382. DOI: 10.22358/jafs/66094/2012 |
| [29] | HEINECKE J W, LI W, FRANCIS G A, et al. Tyrosyl radical generated by myeloperoxidase catalyzes the oxidative cross-linking of proteins[J]. J Clin Invest, 1993, 91(6): 2866–2872. DOI: 10.1172/JCI116531 |
| [30] | OBOH G, FALADE A O, ADEMILUYI A O. Effect of thermal oxidation on the physico-chemical properties, malondialdehyde and carotenoid contents of palm oil[J]. Riv Ital Sostanze, 2014, 91(1): 59–65. |



