随着氟喹诺酮类药物(fluoroquinolones,FQs)在兽医临床应用的增多,大肠埃希菌对FQs抗菌药的耐药率也呈逐渐上升的趋势[1]。目前研究认为,细菌耐FQs的主要机制是DNA拓扑异构酶的改变、细菌膜通透性的改变和药物外排泵的外排等[2]。药物外排泵是一类位于细胞膜上的具有特殊结构的膜转运蛋白,其作用机制是当细胞内的药物浓度蓄积达到一定数量时,药物外排泵系统相关基因的mRNA的增加,结果使细胞膜上外排泵的数量增加,导致细胞内的药物被大量泵出,进而引起细菌耐药,外排泵种类较多,作用底物广泛[3-8]。在革兰阴性菌中,过量表达的RND家族外排泵是细菌抗生素耐药性形成的重要原因之一[9]。另有研究表明,亚抑菌浓度的药物对多种细菌的主动外排泵表达具有诱导作用[10-13],使敏感菌转变为耐药菌株。笔者也使用亚抑菌浓度环丙沙星诱导大肠杆菌标准菌株,发现其能诱导外排泵基因的表达[14]。大肠埃希菌临床分离耐药菌株与大肠埃希菌标准质控菌株不同,其本身对多种药物耐药。在临床治疗过程中,由于药物吸收、分布和代谢过程中,浓度发生变化,肯定会有部分时间药物浓度低于最低抑菌浓度,因此,研究亚抑菌浓度抗菌药物对临床耐药细菌的影响具有更重要的临床意义。本研究以临床分离2株耐药大肠埃希菌为研究对象,使用1/2 MIC环丙沙星对耐药菌株进行诱导培养,给这些耐药菌株造成抗生素生存压力,分析亚抑菌浓度环丙沙星诱导后,RND家族主动外排基因acrA、acrB、acrD、acrE、acrF、mdtA及其上游调控基因marA、robA和soxS基因mRNA表达量的变化,以其为临床合理使用抗菌药物剂量,防治细菌耐药提供新思路。
1 材料与方法 1.1 菌株2株菌株为本实验室分离保存大肠埃希菌耐药菌株,环丙沙星对其MIC均为128 μg·mL-1,菌株编号为Y35、J45,质控菌为大肠埃希菌ATCC25922,购自中国科学院微生物研究所。
1.2 试剂与药品SYBR Green real-time PCR premixture为TaKaRa大连宝生物制品有限公司产品;AMV反转录酶系统、RNA提取试剂盒、凝胶回收试剂盒均购自天根生化(北京)有限公司。
1.3 仪器Roche荧光定量PCR仪;Applied Biosystems 2720 Thermal Cycle型PCR仪;核酸定量检测仪为Bio-Rad公司产品;电泳凝胶成像分析系统为Alpha Innotect Corporation出产。
1.4 环丙沙星对标准菌株及耐药菌株的诱导培养无菌吸取Y35、J45耐药菌株菌液,复活培养。将Y35、J45生长培养液中加入1/2 MIC的环丙沙星作为初始诱导浓度,连续传代,每隔5代测定环丙沙星对诱导菌株的MIC,若有改变,调整环丙沙星的浓度值,使其保持1/2 MIC,培养至30代。MIC的测定使用标准菌株ATCC25922进行质控。选择原代菌株及诱导至第10、20、30代的菌株进行荧光定量PCR测定。
1.5 荧光定量PCR测定环丙沙星诱导耐药菌株主动外排基因mRNA转录水平 1.5.1 引物设计根据GenBank中大肠埃希菌耐药基因acrA、acrB、acrD、acrE、acrF、mdtA、marA、robA、soxS和管家基因gapA基因序列,参照文献[14]合成荧光定量扩增引物,具体如表 1所示。
|
|
表 1 主动外排基因荧光定量PCR引物序列 Table 1 The PCR primers for fluorescence quantitative PCR of active efflux pump gene detection |
利用RNAsimple Totle RNA Kit提取大肠埃希菌总RNA。具体步骤参见试剂盒说明书。提取的RNA用DEPC处理的灭菌三蒸水溶解,吸取3 μL进行电泳,同时核酸定量检测仪测定RNA吸收值,根据OD260 nm值计算RNA浓度,以OD260 nm /OD280 nm的比值判断其纯度。
1.5.3 各外排基因和管家基因的RT-PCR扩增按照Tianscript RT kit cDNA第一链合成试剂盒要求,在冰上配制RT反应液,反应体系如下:10×RT-mixture 1 μL,dNTP混合液(2.5 mmol·L-1 each)1 μL,Oligo-dT 1 μL,Quant Reverse Transcriptase 0.5 μL,RNA模板1 μL,RNase-free ddH2O 5.5 μL,总体系10 μL。具体操作方法参照反转录试剂盒说明书进行。以反转录的cDNA为模板,使用各个基因引物进行PCR扩增,PCR反应体系:cDNA模板1 μL,2×Taq mixture 12.5 μL,上下游引物各1 μL,ddH2O 9.5 μL,总体系25 μL。反应条件:94 ℃预变性5 min;94 ℃变性15 s、(各个基因的退火温度不同,反应时间均为15 s)、72 ℃延伸30 s,共30个循环;72 ℃延伸7 min。反应结束后,取5 μL PCR扩增产物,1.5%琼脂糖凝胶进行电泳。
1.5.4 PCR产物的纯化与回收参照TIANgel Midi Purification Kit试剂盒使用说明书,回收纯化PCR产物,具体步骤参见胶回收试剂盒说明书。
1.5.5 标准曲线绘制将各检测基因胶回收PCR产物稀释成10-2、10-3、10-4、10-5、10-6、10-7、10-8共7个梯度,作为模板进行扩增,反应体系为20 μL:2×SYBR RT PCR预混液10 μL,上下游引物分别为0.4 μL,不同浓度稀释的模板2 μL,超纯水补足体积。扩增条件:94 ℃变性2 min;94 ℃ 15 s、62 ℃ 15 s、68 ℃ 30 s,共40个循环,反应结束后分析熔解曲线,每个浓度重复3次,绘制各个目的基因和内参基因标准曲线。
1.5.6 环丙沙星诱导不同代数耐药菌株主动外排基因的mRNA水平检测利用上面建立的荧光定量RT-PCR方法,对环丙沙星诱导不同代数的Y35、J45诱导株的外排相关结构基因和调控基因以及管家基因gapA的mRNA水平进行测定。PCR仪上读取各个样品的Ct值,并由熔解曲线判定PCR反应的特异性。
1.6 统计分析根据Ct值和标准曲线计算定量结果,通过2-△△Ct计算各个主动外排基因在不同诱导代数的相对转录水平,△Ct目的基因=Ct目的基因-Ct持家基因,△△Ct=△Ct不同诱导代数-△Ct未诱导菌株,各基因的mRNA相对转录量以2-△△Ct表示。
2 结果 2.1 诱导菌株MIC测定环丙沙星对Y35、J45菌株及诱导株MIC见表 2。结果显示,Y35第10代环丙沙星诱导株的MIC发生了改变,而J45第15代环丙沙星诱导株发生改变,环丙沙星对二者MIC均变为0代菌株的2倍。经过30代的诱导,环丙沙星对二者30代诱导株的MIC均为256 μg·mL-1,分别与10代和15代数值相同。
|
|
表 2 环丙沙星对Y35、J45菌株及其诱导株的MIC Table 2 Ciprofloxacin resistant strains isolated from clinical and induced strains |
对提取的细菌总RNA进行测定,OD260 nm/OD280 nm在1.8~2.0,电泳结果显示RNA分子完整。图 1为Y35菌株诱导不同阶段提取RNA后的电泳图,泳道1、2、3、4分别代表未诱导、诱导至5代、诱导至25和30代时的RNA电泳结果。
|
1. Y350菌株;2. Y355菌株;3. Y3525菌株;4. Y3530菌株;M. Marker 2000 DNA相对分子质量标准 1. Strain Y350; 2. Strain Y355; 3. Strain Y3525; 4. Strain Y3530; M. Marker 2000 图 1 代表性菌株RNA电泳图 Figure 1 Agarose gel electrophoresis of the partial RNA of E. coli |
所有基因融解曲线只有一个峰,没有引物二聚体,说明引物设计合理,结果准确,符合要求。从扩增曲线来看,相同稀释度的标准品几乎重合,重复性能够达到试验要求,相关系数、扩增效率和回归方程见表 3。
|
|
表 3 主动外排基因相关系数、扩增效率及回归方程 Table 3 The correlation, efficiency and linear regression equations of active efflux pump genes |
采用建立的荧光定量方法,测定了Y35、J45菌株不同诱导阶段的各个基因mRNA转录量,持家基因gapA为内参基因。未诱导菌株的转录量作为“1”,不同诱导阶段菌株均与未诱导菌株进行比较,得到每个诱导菌株各基因的相对转录量,结果见表 4和图 2、3。结果显示,对Y35耐药株来说,诱导至第10代时,除了mdtA基因转录量降低外,其他8种基因转录量与原代菌株相比,均有一定程度的提高,acrD基因转录量提高至诱导前的50.21倍,增加最为明显,其他7个基因的转录量介于1.26~5.10,转录量差异均达到显著水平(P < 0.05或P < 0.01);至20代时,acrA、acrB、marA 3个基因与未诱导前相比,转录量增加,但与对应10代的菌株相比转录量下降;acrE、robA和soxS 3个基因转录量与诱导前和诱导至10代时相比转录量均增加,数值介于1.40~3.81,差异显著(P < 0.05或P < 0.01)。acrD、acrF和mdtA转录量均小于1,且acrD与10代菌株的转录量相比,显著下降(P < 0.05);至30代时,除了mdtA基因转录量小于1以外,其他基因表达量介于1.20~96.07,acrD基因转录量增加最为明显,为原代菌株的96.07倍。
|
|
表 4 Y35、J45菌株及其诱导株主动外排及其调控基因mRNA相对量 Table 4 The mRNA relative transcription of active efflux pump and regulate gene in Y35, J45 and their ciprofloxacin induced E. coli strains |
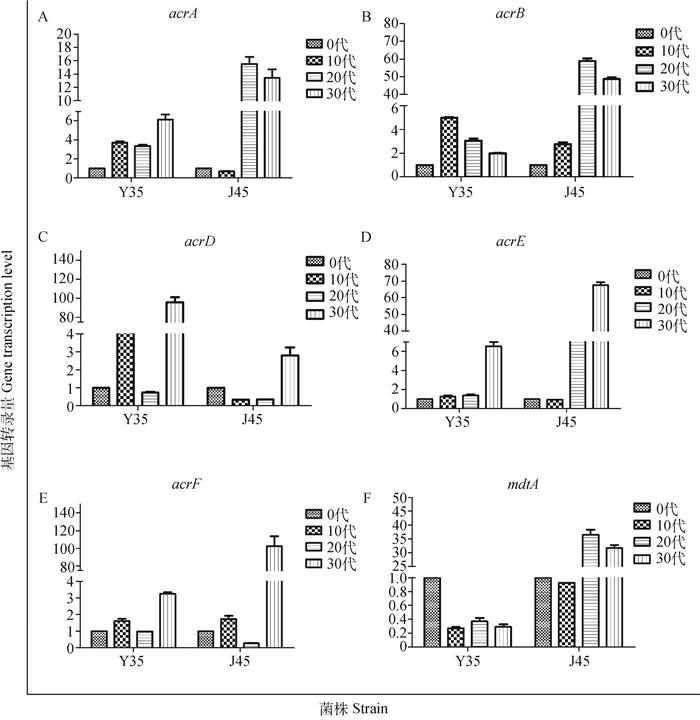
|
A. acrA基因;B.acrB基因;C. acrD基因;D. acrE基因;E. acrF基因;F. mdtA基因 A. acrA gene; B. acrB gene; C. acrD gene; D. acrE gene; E. acrF gene; F. mdtA gene 图 2 环丙沙星不同诱导阶段acrA、acrB、acrD、acrE、acrF和mdtA外排基因转录量 Figure 2 The mRNA relative transcription of acrA, acrB, acrD, acrE, acrF and mdtA in ciprofloxacin induced E. coli |
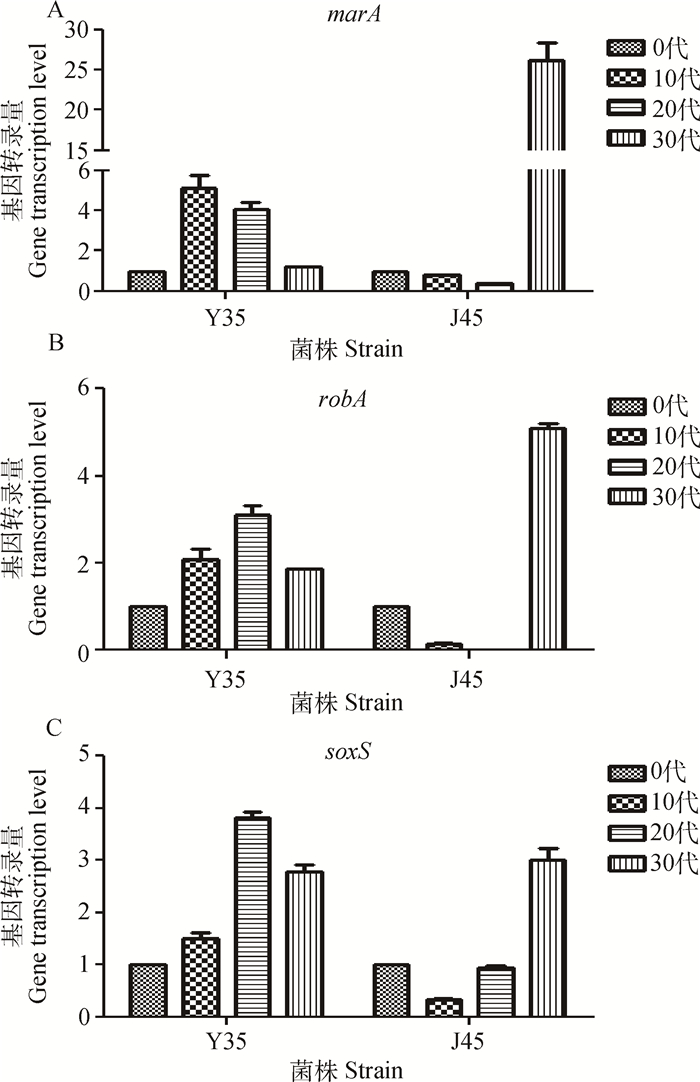
|
A. marA基因;B. robA基因;C. soxS基因 A. marA gene; B. robA gene; C. soxS gene 图 3 环丙沙星不同诱导阶段marA、robA和soxS外排基因转录量 Figure 3 The mRNA relative transcription of marA, robA and soxS in ciprofloxacininduced E. coli |
而对于J45耐药株,至10代时,只有acrB、acrF基因转录量增加,转录量分别为2.76和1.73倍,其他4种外排基因和3种调控基因转录量不仅没有提高,反而有一定程度的下降,转录量的值介于0.15~0.93;至20代时,acrA、acrB、acrE、mdtA基因转录量增加极显著(P < 0.01),分别为原代菌株的15.35、58.89、31.56、36.50倍;至30代时,所有测定基因的转录量均大于1,acrF基因转录量增加最为明显,为原代菌株的102.54倍。
3 讨论普遍的观点认为,与抗菌药物长期接触,是病原菌产生耐药性的关键所在[15]。抗菌药物给细菌的生存环境造成了选择性压力,这种环境压力因素可以通过多种机制导致病原菌对抗菌药物产生更强耐药性[16]。药物外排泵是一类位于细胞膜上的具有特殊结构的膜转运蛋白,当细胞内的药物浓度聚集达到一定数值时,药物外排泵系统相关mRNA的表达增加,结果使细胞膜上外排泵的数量增加,使细胞内的药物被泵出[17]。本研究依据细菌耐药性的原因及机制,人为造成环丙沙星的选择性压力环境,对2株临床耐药菌株进行体外选择性诱导培养,测定诱导过程中,MIC及主动外排基因mRNA相对表达量的变化。结果发现,在这样的生长条件下,菌株的耐药性更强,环丙沙星对其MIC值也相应增加。Y35耐药株培养至10代,J45菌株培养至15代时,其MIC由128 μg·mL-1升至256 μg·mL-1。对诱导出的耐药菌株在无抗菌药物MH肉汤中连续传代培养5 d,MIC无明显改变,说明临床耐药株经过长期不断地接受抗菌药物的压力,可诱导菌株获得稳定的高强度耐药性。陈妍等[18]使用环丙沙星对10株大肠埃希菌进行诱导(包括6株敏感株,MIC≤1 μg·mL-1、1株中介耐药株,MIC=2 μg·mL-1,和3株耐药株,MIC>2 μg·mL-1),结果10株菌株被诱导成高度耐药菌株(MIC≥128 μg·mL-1),诱导后MIC比诱导前增加8~8 205倍。在本研究中,环丙沙星对2株菌株的MIC仅增加了1倍,考虑主要是环丙沙星对选择菌株的MIC初始值较大的原因。
在不同的诱导阶段,两个耐药菌株外排相关基因mRNA表达水平变化不尽相同。至30代时,除了Y35菌株的mdtA基因以外,其余所有基因与原代菌株相比,都有所升高,但并不呈直线上升趋势。在起始诱导阶段,耐药菌株为适应与环丙沙星共生长的环境,有些基因表达量不升反降,诱导株适应了该浓度的环丙沙星以后,其外排基因表达量会出现大幅增加。但若此时环丙沙星对其MIC增加,调整共培养的环丙沙星浓度,诱导株外排相关基因会再次表达下降,生长不良等现象。acrA和acrB作为大肠埃希菌中最为主要的外排基因,其高表达可以造成细菌对抗菌药物耐药。但其表达受到mar操纵子的调控,柳巨雄等[19]报道,大肠埃希菌多重耐药株的acrA和marA的mRNA表达水平与其耐药水平存在相关性。在鼠伤寒沙门菌,缺失acrB基因后,多西环素、庆大霉素、阿米卡星、环丙沙星、恩诺沙星、氟苯尼考、头孢曲松和头孢噻呋的MIC值降低2~128倍[20]。本研究发现,耐药菌株在诱导30代时,6种主动外排基因中,除了Y35菌株mdtA基因表达量减少外,其他基因表达量都有较大程度的提高。3种外排调控基因表达量与原代菌株相比,表达量也有一定程度的增加。J45菌株中,marA的表达量增加倍数显著高于soxS、robA的增加倍数,这与文献报道吻合。具体表达量的变化可能和菌株个体差异有关,Y35耐药株为鸭源菌株,J45耐药株为鸡源菌株,两株菌株原始用药背景不同,这可能是两株耐药株的诱导株个体差异的原因。另外,诱导耐药株耐药的机制是多方面的,可能还存在拓扑异构酶的改变、外膜通透性改变等其他耐药机制[21]。
4 结论经过亚抑菌浓度环丙沙星长时间诱导,能够使临床耐药大肠埃希菌对环丙沙星耐药性增强,并能使多种主动外排相关基因mRNA表达量增加,这为阐明环丙沙星诱导耐药性的产生机制、合理使用抗菌药物剂量提供参考。
| [1] | YAMASAKI E, YAMADA C, JIN X H, et al. Expression of marA is remarkably increased from the early stage of development of fluoroquinolone-resistance in uropathogenic Escherichia coli[J]. J Infect Chemother, 2015, 21(2): 105–109. DOI: 10.1016/j.jiac.2014.10.007 |
| [2] | MOON D C, SEOL S Y, GURUNG M, et al. Emergence of a new mutation and its accumulation in the topoisomerase Ⅳ gene confers high levels of resistance to fluoroquinolones in Escherichia coli isolates[J]. Int J Antimicrob Agents, 2010, 35(1): 76–79. DOI: 10.1016/j.ijantimicag.2009.08.003 |
| [3] | HERNANDO-AMADO S, BLANCO P, ALCALDE-RICO M, et al. Multidrug efflux pumps as main players in intrinsic and acquired resistance to antimicrobials[J]. Drug Resist Updat, 2016, 28: 13–27. DOI: 10.1016/j.drup.2016.06.007 |
| [4] | NIKAIDO E, YAMAGUCHI A, NISHINO K. AcrAB multidrug efflux pump regulation in Salmonella enterica serovar Typhimurium by RamA in response to environmental signals[J]. J Biol Chem, 2008, 283(35): 24245–24253. DOI: 10.1074/jbc.M804544200 |
| [5] | SATO T, YOKOTA S, UCHIDA I, et al. Fluoroquinolone resistance mechanisms in an Escherichia coli isolate, HUE1, without quinolone resistance-determining region mutations[J]. Front Microbiol, 2013, 4: 125. |
| [6] | LAWLER A J, RICCI V, BUSBY S J W, et al. Genetic inactivation of acrAB or inhibition of efflux induces expression of ramA[J]. J Antimicrob Chemother, 2013, 68(7): 1551–1557. DOI: 10.1093/jac/dkt069 |
| [7] | RUIZ C, LEVY S B. Regulation of acrAB expression by cellular metabolites in Escherichia coli[J]. J Antimicrob Chemother, 2014, 69(2): 390–399. DOI: 10.1093/jac/dkt352 |
| [8] | MANJASETTY B A, HALAVATY A S, LUAN C H, et al. Loop-to-helix transition in the structure of multidrug regulator AcrR at the entrance of the drug-binding cavity[J]. J Struct Biol, 2016, 194(1): 18–28. DOI: 10.1016/j.jsb.2016.01.008 |
| [9] | BLAIR J M, PIDDOCK L J. Structure, function and inhibition of RND efflux pumps in Gram-negative bacteria:an update[J]. Curr Opin Microbiol, 2009, 12(5): 512–519. DOI: 10.1016/j.mib.2009.07.003 |
| [10] | KANG H W, WOO G J. Increase of multidrug efflux pump expression in fluoroquinolone-resistant Salmonella mutants induced by ciprofloxacin selective pressure[J]. Res Vet Sci, 2014, 97(2): 182–186. DOI: 10.1016/j.rvsc.2014.07.019 |
| [11] | KIM J Y, KIM S H, JEON S M, et al. Resistance to fluoroquinolones by the combination of target site mutations and enhanced expression of genes for efflux pumps in Shigella flexneri and Shigella sonnei strains isolated in Korea[J]. Clin Microbiol Infect, 2008, 14(8): 760–765. DOI: 10.1111/j.1469-0691.2008.02033.x |
| [12] | FERRARI R G, GALIANA A, CREMADES R, et al. Expression of the marA, soxS, acrB and ramA genes related to the AcrAB/TolC efflux pump in Salmonella enterica strains with and without quinolone resistance-determining regions gyrA gene mutations[J]. Braz J Infect Dis, 2013, 17(2): 125–130. DOI: 10.1016/j.bjid.2012.09.011 |
| [13] |
刘建华, 苑丽, 潘玉善, 等. 3种抗菌药物诱导改变marA、soxS和robA基因mRNA表达水平[J]. 畜牧兽医学报, 2011, 42(10): 1432–1437.
LIU J H, YUAN L, PAN Y S, et al. The changes of marA, soxS and robA gene expression levels in three kinds of antimicrobial agents induced resistant mutants in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(10): 1432–1437. (in Chinese) |
| [14] |
刘建华. 鸭源大肠杆菌主动外排基因及其调控基因的表达水平与多重耐药机制[D]. 郑州: 河南农业大学, 2011.
LIU J H. The expression level of active efflux system related genes and mechanism of multidrug resistance in E. coli isolated from ducks[D]. Zhengzhou:Henan Agricultural University, 2011. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10466-1012275214.htm |
| [15] |
蔡倩, 刘蕾, 艾效曼. 我院2007-2011年抗菌药物使用量与细菌耐药性相关性分析[J]. 中国药房, 2012, 23(42): 3970–3974.
CAI Q, LIU L, AI X M. Correlation analysis of consumption amount of antibacterial drug and drug resistance in our hospital from 2007 to 2011[J]. China Pharmacy, 2012, 23(42): 3970–3974. DOI: 10.6039/j.issn.1001-0408.2012.42.14 (in Chinese) |
| [16] | SHIGEMURA K, TANAKA K, YAMAMICHI F, et al. Does mutation in gyrA and/or parC or efflux pump expression play the main role in fluoroquinolone resistance in Escherichia coli urinary tract infections?:A statistical analysis study[J]. Int J Antimicrob Agents, 2012, 40(6): 516–520. DOI: 10.1016/j.ijantimicag.2012.07.019 |
| [17] | BAY D C, STREMICK C A, SLIPSKI C J, et al. Secondary multidrug efflux pump mutants alter Escherichia coli biofilm growth in the presence of cationic antimicrobial compounds[J]. Res Microbiol, 2017, 168(3): 208–221. DOI: 10.1016/j.resmic.2016.11.003 |
| [18] |
陈妍, 罗予, 毛理纳. 氟喹诺酮类药物体外诱导大肠埃希菌耐药性变化[J]. 医学研究生学报, 2009, 22(6): 596–599.
CHEN Y, LUO Y, MAO L N. Changes in the drug resistance of E. coli induced by fluoroquinolones in vitro[J]. Journal of Medical Postgraduates, 2009, 22(6): 596–599. (in Chinese) |
| [19] |
柳巨雄, 吉淑娟, 杨斌, 等. 不同耐药水平大肠杆菌acrA和marA基因转录水平的比较[J]. 中国兽医学报, 2006, 26(3): 326–328.
LIU J X, JI S J, YANG B, et al. Comparison of acrA mRNA and marA mRNA levels in Escherichia coli with multidrug resistance[J]. Chinese Journal of Veterinary Science, 2006, 26(3): 326–328. (in Chinese) |
| [20] |
黄慧, 刘保光, 孙亚伟, 等. 鼠伤寒沙门菌cpxR和acrB双基因缺失菌株的构建及其对抗菌药物敏感性分析[J]. 畜牧兽医学报, 2016, 47(3): 595–602.
HUANG H, LIU B G, SUN Y W, et al. Construction of cpxR and acrB double gene deletion strain of Salmonella enterica serovar typhimurium and analysis of its susceptibility to antibacterial agents[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(3): 595–602. (in Chinese) |
| [21] | REDGRAVE L S, SUTTON S B, WEBBER M A, et al. Fluoroquinolone resistance:mechanisms, impact on bacteria, and role in evolutionary success[J]. Trends Microbiol, 2014, 22(8): 438–445. DOI: 10.1016/j.tim.2014.04.007 |



