2. 伊犁出入境检验检疫局综合技术服务中心, 伊宁 835000
2. Yili Entry-exit Inspection and Quarantine Bureau, Yining 835000, China
马梨形虫病(equine piroplasmosis,EP)是由马泰勒虫(Theileria equi)[1-2]和/或驽巴贝斯虫(Babesia caballi)[3-4]引起的蜱传血液原虫病[5]。该病主要感染马属动物(马、骡、驴和斑马),呈急性、亚急性或慢性发病等。患病时动物通常呈发烧,贫血,黄疸,肝、脾肿大,血管内溶血,可视黏膜黄染及血红蛋白尿等表征[6],但慢性感染时临床症状不明显[7];患病马匹即使后期治愈后也会终身带虫,作为传染源传播给其他马属动物;该病广泛分布在热带和亚热带地区[8],据联合国粮食和农业组织的数据显示,2013年世界范围内马匹存栏量约1.12亿匹,其中全球大约90%的马属动物分布在马梨形虫病流行地区[9]。近年来,多个国家有马梨形虫病的报道,如韩国、蒙古、委内瑞拉、突尼斯、苏丹、意大利、匈牙利、沙特阿拉伯、墨西哥及美国德克萨斯等[7],对马产业造成重大经济损失;在国际马术竞技比赛中马梨形虫病作为重要的检测项目之一[10]。为保持健康良好的国际性马产业市场,对马梨形虫病的防控至关重要。
补体结合试验(CFT)是常用于检测马泰勒虫病的方法[10],然而因其低灵敏度和检测速率等因素对检测造成一定的限制[12]。间接荧光抗体试验(IFAT)也可用于诊断马泰勒虫感染,但通常受到抗体的检测范围和交叉反应性的影响;除CFT和IFAT之外,基于马泰勒虫裂殖子抗原的ELISA已被用于抗体检测[13]。近几年,通过重组抗原建立的几种ELISA检测方法,已证明其诊断慢性马泰勒虫病感染是非常有效的[14]。新疆作为马泰勒虫病的流行疫区,其急性病例死亡率达30%,制约着新疆马产业的健康发展[15]。笔者拟构建马泰勒虫新疆株EMA-1基因原核表达载体及其间接ELISA方法,为马泰勒虫病的血清学诊断及地方疫区马梨形虫病的检测、监控及综合防控提供技术支撑。
1 材料与方法 1.1 材料马泰勒虫新疆流行虫株Te-Y(伊犁分离株),pGEX-4T-1表达载体及马泰勒虫标准阳性、阴性血清均由新疆农业大学动医学院寄生虫实验室提供;待检血清样品采自于新疆伊犁地区的放牧马。
组织/全血DNA提取试剂盒和琼脂糖凝胶回收试剂盒均购自德国QIAGEN公司;胶回收试剂盒购自美国OMEGA公司;限制性内切酶BamHⅠ、EcoRⅠ、T4连接酶和pMD18-T载体购自宝生物工程(大连)有限公司;大肠杆菌DH5α、BL21感受态细胞为北京全式金生物技术有限公司产品;HRP标记的兔抗马IgG、DAB显色试剂盒和四甲基联苯胺(TMB)购自上海生工生物有限公司;马泰勒虫cELISA检测试剂盒购自美国RMVD公司;其他常规试剂均为国产分析纯;所用水为超纯水。
1.2 引物设计与合成基于马泰勒虫虫株(GenBank登录号AF255730)EMA-1全基因序列设计的PCR引物:EMA1-P1(5′-CGGATCCATGATTTCCAAATCCT-3′)和EMA1-P2(5′-TTGCGGCCGCTTAGTAAAATAGAGTAGAGT-3′),加下划线的序列分别对应BamHⅠ和EcoRⅠ酶切位点,基因片段大小为819 bp。引物由上海生工公司合成。
1.3 EMA-1基因的扩增使用DNA提取试剂盒提取马泰勒虫新疆株(Te-Y)的基因组DNA。通过PCR技术对EMA-1全长基因(819 bp)进行扩增(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s;30个循环),扩增的PCR产物用1%的琼脂糖凝胶电泳加以确证,并用琼脂糖凝胶回收试剂盒进行回收。
1.4 表达载体的构建与鉴定将回收产物连接到pMD18-T载体中,并转化至大肠杆菌DH5α感受态细胞,挑取单菌落接种至含100 μg·mL-1氨苄青霉素的LB液体培养基,收集菌液进行测序。对重组质粒和pGEX-4T-1载体双酶切(BamHⅠ和EcoRⅠ)回收目的片段和空载体,用T4 DNA ligase于16 ℃过夜连接,转化至大肠杆菌DH5α感受态细胞。测序和酶切验证正确的重组质粒pGEX-4T-1/EMA1转化至大肠杆菌菌株BL21(DE3)。
1.5 重组GST-EMA1蛋白的诱导条件筛选及鉴定在含100 μg·mL-1氨苄青霉素的LB培养基(50 mL)中小规模诱导,测定重组蛋白质的表达情况。于37 ℃ 200 r·min-1下进行诱导时间(1、3、5、7和12 h)和诱导剂IPTG浓度(0.2、0.4、0.6、0.8和1.0 mmol·L-1)的最佳条件筛选,通过12%的十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白质表达情况。
1.6 重组蛋白质的纯化及其反应原性测定 1.6.1 蛋白质的纯化根据高慎阳等[16]的KCl染色切胶纯化法稍作改进,收集最佳诱导条件下菌体,样品处理后进行SDS-PAGE电泳,用适量的0.25 mol·L-1的KCl溶液染色后,切下目的条带碾碎加入500 μL PBS涡旋混匀,置于-80 ℃反复冻溶3次后12 000 r·min-1离心2 min取上清,用紫外分光光度仪测定上清中蛋白质浓度,置于-20 ℃保存备用。
1.6.2 Western blot取10 μL重组蛋白质样品(~5 μg的蛋白质含量)进行SDS-PAGE电泳后,半干转印于NC膜上,封闭液(5%脱脂奶,含0.5% Tween的PBS稀释)封闭1 h;加马泰勒虫阳性血清37 ℃反应1.5 h;加二抗(HRP-兔抗马IgG)37 ℃温育1 h。最后,向膜上滴加DAB显色液,避光37 ℃孵育10 min,观察结果。
1.7 重组EMA-1为包被抗原建立间接ELISA 1.7.1 抗原包被浓度和血清稀释倍数的选择采用九宫格的方法:包被质量浓度分别为1、2、3、4、5和6 μg·mL-1,血清稀释倍数分别为1:100、1:200、1:400、1:800。P/N值最大的一组为最佳蛋白质浓度和血清稀释倍数。
1.7.2 最佳酶标二抗稀释倍数的选择以确定的包被浓度和血清稀释倍数为基础,按1:1 000、1:2 000、1:4 000、1:8 000、1:10 000、1:20 000稀释二抗。P/N值最大的一组为二抗最佳稀释倍数。
1.7.3 最佳包被液的选择分别以碳酸盐缓冲液(0.05 mol·L-1 pH9.6,CB)、磷酸盐缓冲液(0.01 mol·L-1 pH7.4,PBS)、Tris-HCl缓冲液(0.05 mol·L-1 pH8.5)、NaOH(0.01 mol·L-1 pH9.6)、生理盐水(0.05 mol·L-1 pH7.0,NS)和双蒸水(dH2O)作为包被液,按照优化好的最佳抗原包被浓度进行包被,每孔100 μL,4 ℃过夜包被,按照优化好的最佳血清稀释浓度进行检测,以P/N值最大为判定标准,即为最佳包被液。
1.7.4 最佳封闭液的选择分别用0.05%脱脂奶、2.0%脱脂奶、5.0%脱脂奶、0.05% BSA、2.0% BSA、5.0% BSA作为封闭液,每孔150 μL,37 ℃封闭1 h,按照上述优化好的条件进行检测,以P/N值最大的一组作为最佳封闭液。
1.7.5 血清稀释液的选择分别以PBS、PBST1(0.05% Tween-20)、PBST2(0.1% Tween-20)、0.1% BSA、5%脱脂奶(SM)和0.05% Tween-20的SM(SMT)作为一抗稀释液。选定最大P/N值一组作为最佳稀释液。
1.7.6 血清反应时间的选择加入稀释的一抗后,分别在37 ℃孵育0.5、1.0、1.5、2.0 h,进行ELISA检测,选定P/N值最大时为最佳反应时间。
1.7.7 酶标抗体反应时间的选择加入稀释的酶标二抗后,分别在37 ℃孵育0.5、1.0、1.5、2.0 h,进行ELISA检测,P/N值最大时选为最佳反应时间。
1.7.8 TMB底物反应时间的选择避光环境下,加入TMB底物溶液后分别于37 ℃培养箱反应10、15、20、25 min,加入50 μL 2 mol·L-1 H2SO4 终止反应,P/N值最大时选为最佳反应时间。
1.7.9 ELISA判定标准的确定用上述优化好的ELISA检测方法,对实验室保存的36份马泰勒虫病阴性血清进行检测,每份血清做3个重复检测,取3份检测孔的平均值,计算检测样品OD450 nm的x±s,根据统计学,当样品的OD450 nm值大于阴性样品OD450 nm值的x±2s时,即可判定样品为阳性,否则为阴性。
1.7.10 敏感性试验将马泰勒虫标准阳性血清按照1:100、1:200……1:12 800倍比稀释,其余条件同ELISA。
1.7.11 特异性试验用ELISA方法同时检测马泰勒虫病、驽巴贝斯虫病阳性血清和健康马血清,判断ELISA与其他马病的病原有无交叉反应。
1.7.12 批内批间重复性试验用同一批次和不同批次纯化的蛋白质包被,分别检测10份阳性血清和5份阴性血清,重复试验3次,分别计算每个样品的平均值、标准方差和变异系数,确定ELISA同批和不同蛋白质抗原的变异系数范围。
1.7.13 符合性试验对采集的96份马血清,分别用建立的间接ELISA和cELISA检测试剂盒检测,结果以商品试剂盒的结果为标准,计算二者的符合率。对结果不一致的样品,以试剂盒的结果为准。
| $ 符合率=\frac{结果相同的样品数}{样品总数}\times 100\% $ |
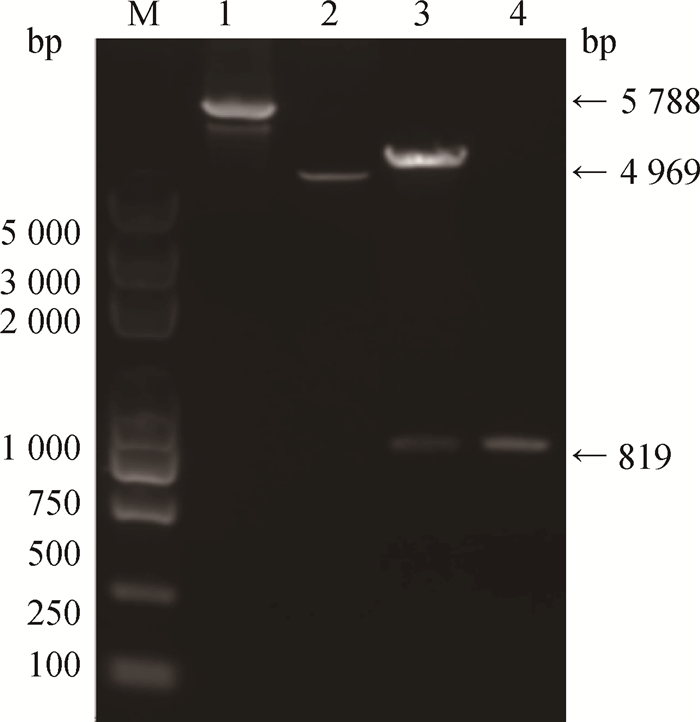
将新疆株EMA-1全基因序列克隆于原核表达载体pGEX-4T-1,构建pGEX-4T-1/EMA1重组质粒,并酶切鉴定(图 1)。
|
M. DL2000 DNA相对分子质量标准;1.pGEX-4T-1/EMA1重组质粒;2. pGEX-4T-1空载体;3.双酶切产物;4. EMA-1酶切后片段 M. DL2000 DNA marker; 1. Recombinant plasmid; 2. pGEX-4T-1; 3. Restrictive digested recombinant plasmid; 4. The digested EMA-1 gene 图 1 GST-EMA1重组表达质粒的酶切鉴定 Figure 1 Identification of enzyme digestion of GST-EMA1 recombinant plasmids |
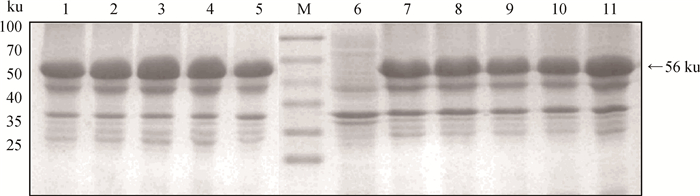
测序和酶切验证正确的重组质粒pGEX-4T-1/EMA1转化至大肠杆菌菌株BL21(DE3) 进行蛋白质表达。最佳诱导条件:加入终浓度1.0 mmol·L-1 IPTG在37 ℃ 200 r·min-1条件下诱导5 h获得最佳表达;通过12%的SDS-PAGE分析蛋白质表达情况,见图 2。
|
M.蛋白质相对分子质量标准;1~5.诱导时间(1、3、5、7、12 h);6~11. IPTG诱导浓度(0、0.2、0.4、0.6、0.8、1.0 mmol·L-1) M. Protein marker; 1-5. Induction time was 1, 3, 5, 7, 12 h, respectirely; 6-11. Induction concentration of IPTG was 0, 0.2, 0.4, 0.6, 0.8, 1.0 mmol·L-1, respectirely 图 2 诱导时间及IPTG浓度对GST-EMA1蛋白表达的影响 Figure 2 Effect of induction time and IPTG concentration on the GST-EMA1 protein expression |
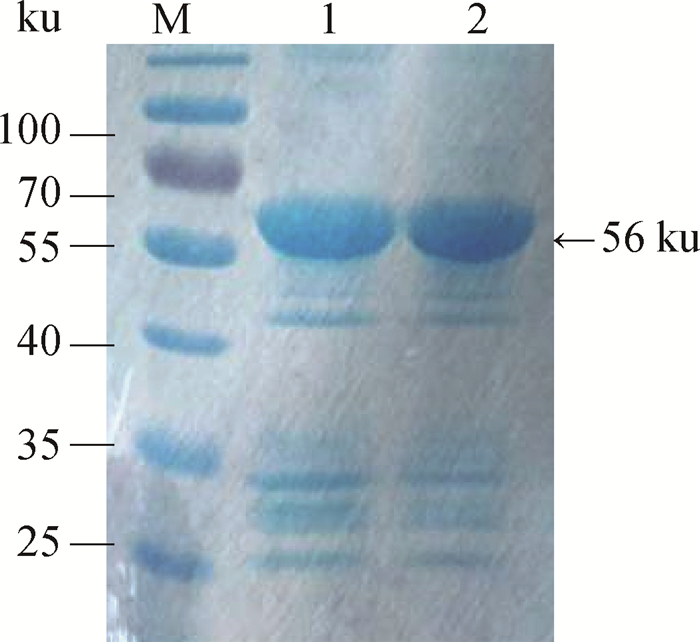
紫外分光光度仪测定纯化后蛋白质质量浓度在0.9~2.1 mg·mL-1。取10 μL处理后样品进行SDS-PAGE电泳验证,见图 3。
|
M.预染蛋白质相对分子质量标准;1、2.纯化后不同浓度的GST-EMA1蛋白 M. Prestained protein marker; 1, 2. Different concentration of purification of GST-EMA1 protein 图 3 纯化的重组蛋白质的SDS-PAGE验证结果 Figure 3 The SDS-PAGE analysis of purification of recombinant protein |
结果表明重组蛋白质能够与马泰勒虫阳性血清反应,具有很好的特异性和反应原性(图 4)。

|
M.预染蛋白质相对分子质量标准;1.纯化后的GST-EMA1蛋白;2.阴性对照 M. Prestained protein marker; 1. Purification of GST-EMA1 protein; 2. Negative control 图 4 纯化的重组蛋白质的Western blot验证结果 Figure 4 The Western blot analysis of purification of recombinant protein |
通过对抗原包被浓度,血清、酶标二抗稀释倍数,最佳反应时间的确定,以及包被液、封闭液、稀释液的选择,确定如下操作程序:① 酶标板每孔加入100 μL 4 μg·mL-1蛋白质,4 ℃包被过夜;② 每孔加入200 μL PBST溶液洗涤5次;③ 加入150 μL 0.05%脱脂奶37 ℃封闭1 h,洗涤同上;④ 每孔按1:400加入血清与5%脱脂奶,37 ℃反应30 min,洗涤同上;⑤ 每孔按1:10 000加入HRP标记兔抗马IgG与5%脱脂奶,37 ℃反应30 min,洗涤同上;⑥ 各孔加入100 μL TMB底物溶液,37 ℃反应15 min;⑦ 每孔加入50 μL 2 mol·L-1 H2SO4;⑧ 在450 nm处测定各孔的OD值。
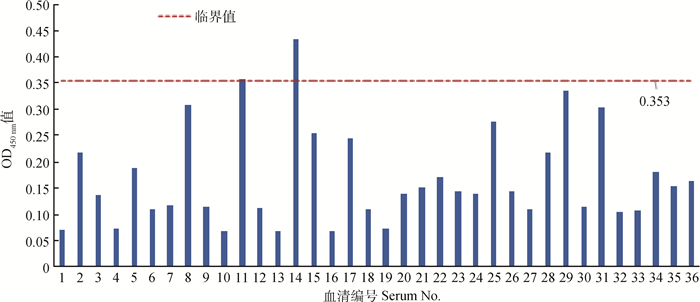
2.5 阴阳性临界值的确定用上述优化好的ELISA检测方法,对实验室保存的马泰勒阴性血清取36份进行检测,每份血清做3个重复检测,取3份检测孔的平均值,计算检测样品OD450 nm的平均值和标准方差,根据统计学,当样品的OD450 nm值大于阴性样品OD450 nm值的x+2s时,即可判定样品为阳性。临界值为0.353,大于0.353为阳性;小于0.353为阴性。见图 5。
|
图 5 以EMA-1蛋白为包被抗原的36份马泰勒虫阴性血清ELISA检测结果 Figure 5 The detection of 36 negative serum of samples by rEMA1-ELISA |
将马泰勒虫标准阳性血清按照1:100、1:200……1:12 800倍比稀释,其余条件同ELISA。最终确定当阳性血清稀释至1:1 600时其结果仍为阳性。
2.6.2 特异性试验用ELISA方法检测的马驽巴贝斯虫病阳性血清和健康马血清,OD450 nm值均在0.2以内,判断ELISA与其他马病的病原有无交叉反应。
2.6.3 重复性试验对采集的10份马泰勒虫阳性血清和5份阴性血清,分别进行3次重复检测试验。其中同一批EMA-1蛋白抗原包被板批内变异系数在1.43%~14.79%,不同批次EMA-1蛋白抗原包被板批间变异系数在1.46%~11.06%。结果表明EMA-1蛋白的稳定性较好,具可重复性。
2.6.4 符合性试验对采集的96份马血清,分别使用建立的ELISA和cELISA试剂盒进行检测:阳性率分别为27.1%(26/96) 和25.0%(24/96);两者间阳性符合率为92.3%,阴性符合率为97.2%,总符合率为95.8%。
3 讨论本试验首次对新疆马泰勒虫地方流行虫株(伊犁分离株)EMA-1基因进行克隆,并成功构建了重组质粒pEGEX-4T-1/EMA1,经优化诱导时间和IPTG浓度后,以包涵体的形式高效表达,虽用尿素溶液变性纯化,但洗涤后蛋白质浓度低,杂蛋白质较多。故后期使用KCl染色切SDS-PAGE胶进行蛋白质回收,提高目的蛋白质的纯度和回收率;经Western blot鉴定,重组GST-EMA1蛋白能够被马泰勒虫阳性血清特异性识别,说明EMA-1抗原能与抗体特异性结合。
ELISA检测马泰勒虫抗体与其他血清学诊断方法(CFT,IFAT)相比[17-19],ELISA方法速度快,对实验条件要求不高,更适用于基层实验室血清学诊断及大规模疫病普查[20]。本研究所建立的间接ELISA具有很好的特异性、敏感性和重复性,与cELISA商品试剂盒相比,两者的符合率可达95.8%,与其他学者建立的间接ELISA检测符合率[21-23]的结果相符。
4 结论基于马泰勒虫重组EMA-1蛋白建立的间接ELISA方法可以用于检测抗马泰勒虫血清抗体效价,虽然不能代表机体的中和抗体效价,但其检测速度快,对实验条件要求不高,安全便捷,在短时间内可以检测大量样品,非常适于基层大批临床马血清样品的检测,为患马泰勒虫病的马匹体内IgG抗体水平监测与检测试剂盒的开发奠定了基础。
| [1] | MEHLHORN H, SCHEIN E. Redescription of Babesia equi Laveran, 1901 as Theileria equi Mehlhorn, Schein 1998[J]. Parasitol Res, 1998, 84(6): 467–475. DOI: 10.1007/s004360050431 |
| [2] | KAPPMEYER L S, THIAGARAJAN M, HERNDON D R, et al. Comparative genomic analysis and phylogenetic position of Theileria equi[J]. BMC Genomics, 2012, 13: 603. DOI: 10.1186/1471-2164-13-603 |
| [3] | DARLING S T. Equine piroplasmosis in Panama[J]. J Infect Dis, 1913, 13(2): 197–202. DOI: 10.1093/infdis/13.2.197 |
| [4] | DARLING S T. Equine piroplasmosis in the canal zone[J]. Science, 1913, 37(949): 370–371. |
| [5] | BRVNING A, PHIPPS P, POSNETT E, et al. Monoclonal antibodies against Babesia caballi and Babesia equi and their application in serodiagnosis[J]. Vet Parasitol, 1997, 68(1-2): 11–26. DOI: 10.1016/S0304-4017(96)01074-6 |
| [6] | GARCÍA-BOCANEGRA I, ARENAS-MONTES A, HERNÁNDEZ E, et al. Seroprevalence and risk factors associated with Babesia caballi and Theileria equi infection in equids[J]. Vet J, 2013, 195(2): 172–178. DOI: 10.1016/j.tvjl.2012.06.012 |
| [7] | WANG M, GUO W, IGARASHI I, et al. Epidemiological investigation of equine piroplasmosis in China by enzyme-linked immunosorbent assays[J]. J Vet Med Sci, 2014, 76(4): 549–552. DOI: 10.1292/jvms.13-0477 |
| [8] | WISE L N, KAPPMEYER L S, MEALEY R H, et al. Review of equine piroplasmosis[J]. J Vet Intern Med, 2013, 27(6): 1334–1346. DOI: 10.1111/jvim.12168 |
| [9] | BHOORA R, BUSS P, GUTHRIE A J, et al. Genetic diversity of piroplasms in Plains zebra (Equus quagga burchellii) and Cape mountain zebra (Equus zebra zebra) in South Africa[J]. Vet Parasitol, 2010, 174(1-2): 145–149. DOI: 10.1016/j.vetpar.2010.08.014 |
| [10] | BALDANI C D, HILARIO E, NAKAGHI A C H, et al. Production of recombinant EMA-1 protein and its application for the diagnosis of Theileria equi using an enzyme immuno assay in horses from São Paulo State, Brazil[J]. Rev Bras Parasitol Vet, 2011, 20(1): 54–60. DOI: 10.1590/S1984-29612011000100011 |
| [11] | FRERICHS W M, HOLBROOK A A, JOHNSON A J. Equine piroplasmosis:complement-fixation titers of horses infected with Babesia caballi[J]. Am J Vet Res, 1969, 30(5): 697–702. |
| [12] | GUIDI E, PRADIER S, LEBERT I, et al. Piroplasmosis in an endemic area:analysis of the risk factors and their implications in the control of Theileriosis and Babesiosis in horses[J]. Parasitol Res, 2015, 114(1): 71–83. DOI: 10.1007/s00436-014-4161-9 |
| [13] | BALDANI C D, MACHADO R Z, BOTTEON P D T L, et al. An enzyme-linked immunosorbent assay for the detection of IgG antibodies against Babesia equi in horses[J]. Ciênc Rural, 2004, 34(5): 1525–1529. DOI: 10.1590/S0103-84782004000500031 |
| [14] | JAFFER O, ABDISHAKUR F, HAKIMUDDIN F, et al. A comparative study of serological tests and PCR for the diagnosis of equine piroplasmosis[J]. Parasitol Res, 2010, 106(3): 709–713. DOI: 10.1007/s00436-009-1669-5 |
| [15] |
巴音查汗. 马梨形虫在新疆地区的感染现状及其防治[C]//2015中国(北京)国际马科技大会学术论文集. 北京: 中国畜牧兽医学会, 2015: 4.
BA Y C H. The infection situation and control of equine piroplasmosis from Xinjiang area[C]. Beijing:Chinese Association of Animal Science and Veterinary Medicine (CAAV), 2015:4. (in Chinese) http://d.g.wanfangdata.com.cn/Conference_8829843.aspx |
| [16] |
高慎阳, 查恩辉, 王珅, 等. 一种"高性价比"切胶纯化原核表达蛋白的方法[J]. 中国农学通报, 2010, 26(22): 24–26.
GAO S Y, ZHA E H, WANG K, et al. A "cost-effective" method for purification of prokaryotic expression proteins in gel slices[J]. Chinese Agricultural Science Bulletin, 2010, 26(22): 24–26. (in Chinese) |
| [17] | KUMAR S, RAKHA N K, GOYAL L, et al. Diagnostic application of recombinant equine merozoite surface antigen-1 in elisa for detection of Theileria equi specific antibodies[J]. Jpn J Vet Res, 2015, 63(3): 129–137. |
| [18] | ROSALES R, RANGEL-RIVAS A, ESCALONA A, et al. Detection of Theileria equi and Babesia caballi infections in Venezuelan horses using competitive-inhibition ELISA and PCR[J]. Vet Parasitol, 2013, 196(1-2): 37–43. DOI: 10.1016/j.vetpar.2013.02.004 |
| [19] | VIANNA A M, GONÇALES R A, DE LARA A P D S S, et al. Expresso heteróloga da EMA-2(equi merozoite antigen) de Theileria equi em Pichia pastoris com potencial utilização em imunobiológicos[J]. Ciênc Rural, 2014, 44(10): 1830–1836. DOI: 10.1590/0103-8478cr20131003 |
| [20] |
曹增国, 王化磊, 盖微微, 等. 埃博拉病毒抗体间接ELISA检测方法的建立及应用[J]. 畜牧兽医学报, 2016, 47(3): 615–619.
CAO Z G, WANG H L, GAI W W, et al. Development of an indirect ELISA for detecting Ebola virus antibody and its application[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(3): 615–619. (in Chinese) |
| [21] |
沈婷, 周斌, 陈溥言. 检测猪乙型脑炎病毒抗体间接ELISA方法的建立与应用[J]. 畜牧与兽医, 2010, 42(4): 1–7.
SHEN T, ZHOU B, CHEN P Y. Development and application of an indirect ELISA method for detection of antibody to porcine Japanese encephalitis virus[J]. Animal Husbandry & Veterinary Medicine, 2010, 42(4): 1–7. (in Chinese) |
| [22] |
宫苗苗, 曾妮, 程朝飞, 等. 狂犬病病毒基质蛋白的原核表达及其间接ELISA方法的建立[J]. 中国人兽共患病学报, 2013, 29(1): 17–22.
GONG M M, ZENG N, CHENG C F, et al. Development of indirect ELISA for detection of antibodies against rabies virus based on prokaryotic expression of matrix protein[J]. Chinese Journal of Zoonoses, 2013, 29(1): 17–22. (in Chinese) |
| [23] |
夏平安, 尹彦涛, 李素平, 等. 猪繁殖与呼吸综合征病毒重组N蛋白的高效表达及间接ELISA方法的建立[J]. 中国兽医学报, 2009, 29(5): 537–541.
XIA P A, YIN Y T, LI S P, et al. High-level expression of N protein of PRRSV Hn-1/06 strain and establishment of ELISA diagnosis based on the recombinant fusion protein[J]. Chinese Journal of Veterinary Science, 2009, 29(5): 537–541. (in Chinese) |



