2. 中国动物卫生与流行病学中心, 青岛 266032;
3. 丽江市动物疫病预防控制中心, 丽江 674100;
4. 玉溪市动物疫病预防控制中心, 玉溪 653100;
5. 云南省畜牧兽医科学院, 昆明 650224
2. China Animal Health and Epidemiology Center, Qingdao 266032, China;
3. Lijiang Control and Prevention Center for Animal Diseases, Lijiang 674100, China;
4. Yuxi Municipal Zoonoses Control Center, Yuxi 653100, China;
5. Yunnan Animal Science and Veterinary Institute, Kunming 650224, China
新城疫(Newcastle disease, ND)是由新城疫病毒(Newcastle disease virus, NDV)强毒株感染引起的一种禽的烈性传染病,以高热、下痢、呼吸困难、神经紊乱和黏膜出血为显著特征,感染率和死亡率可达100%,给世界各国养禽业造成了严重损失,被世界动物卫生组织(OIE)列为法定报告的传染病,我国农业部将其列为一类动物疫病。在《国家中长期动物疫病防治规划(2012—2020)》中,新城疫被列为优先防控的重大动物疫病之一[1]。
新城疫病毒具有遗传学多样性,其中根据病毒基因组特征和F基因高变区序列差异可将NDV分为Ⅰ类(Class Ⅰ)和Ⅱ类(Class Ⅱ),每种类型的病毒又可进一步分为不同的基因型或基因亚型。Ⅱ类NDV流行时间较长,1926年首次出现于印度尼西亚爪哇,最早认为可分为Ⅰ~Ⅸ等9个不同的基因型,但随着新城疫病毒监测的深度和广度不断扩大,越来越多新型的新城疫病毒不断出现,目前的研究证实Ⅱ类的新城疫病毒至少包括18个基因型,历史上4次ND大流行的强毒株和常用弱毒疫苗株均属于此分支[2]。Ⅰ类NDV研究较晚,目前主要分布在活禽市场或野生水禽中,分子流行病学分析证实其至少包括10个基因型,也有专家认为其可分为1a、1b、1c三个不同的亚型[3]。研究表明所有Ⅰ类NDV均为无毒株或弱毒株,但已有学者证实NDV弱毒株可通过在鸡或鸡胚中连续传代增强毒力[4-6]。NDV地理分布广泛,基因型复杂,跨省和跨境传播屡见不鲜。我国的云南地处边境,气候特点适于鸟类繁殖和迁徙,因此在云南省内开展新城疫流行病学调查,长期监测和系统分析家禽中携带的新城疫病毒,对新城疫的防控具有重要意义。本研究于2011—2016年,在云南省6个市48个采样点随机采集家禽口咽/泄殖腔拭子及环境样本,进行新城疫病毒分离与鉴定,并对分离到的52株NDV进行遗传演化分析,为科学防控新城疫提供理论依据。
1 材料与方法 1.1 样品来源在云南大理、丽江、昆明、玉溪、普洱、曲靖6地辖区的农贸市场、批发市场和养殖场等48个不同采样点随机选择不同种类的家禽,采集口咽和泄殖腔双拭子样品及部分环境样品,样品的宿主分布详见表 1、时间分布见表 2。
|
|
表 1 2011—2016年云南地区采集样品的宿主分布 Table 1 Host distribution of samples collected from Yunnan province during 2011-2016 |
|
|
表 2 2011—2016年云南监测样品和病毒时间分布 Table 2 Time distribution of samples and viruses in Yunnan province during 2011-2016 |
将采集的棉拭子样品按照常规方法接种9~11日龄SPF鸡胚。弃去24 h内死亡的鸡胚,常规方法收集24~72 h内死亡的鸡胚和72 h后仍存活的鸡胚,通过血凝(HA)、血凝抑制(HI)试验对分离到的病毒进行鉴定。将鉴定为NDV阳性的尿囊液分装进行进一步鉴定,-80 ℃保存。
1.3 RT-PCR采用High Pure Viral RNA Kit(Roche)提取病毒RNA,提取的RNA立即用于RT-PCR扩增或者于-20 ℃保存。采用Ⅰ类、Ⅱ类NDV鉴定引物(表 3),利用PrimeScriptTM One Step RT-PCR Kit Ver.2(TaKaRa)进行常规RT-PCR扩增。RT-PCR反应条件:42 ℃ 30 min;94 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃ 5 min。扩增产物用1%的琼脂糖凝胶电泳鉴定,鉴定为新城疫病毒阳性的样品送北京六合华大基因科技股份有限公司测序。
|
|
表 3 Ⅰ类、Ⅱ类新城疫病毒鉴定引物 Table 3 Primers used for identification of Class Ⅰ and Class Ⅱ NDVs |
采用DNAMAN、MEGA6等分子生物学软件进行序列拼接与校正,分析各分离株在F蛋白基因裂解位点的氨基酸组成,推测其致病性。将各分离株F基因序列与GenBank中公布的NDV经典毒株进行比对,采用邻位相连法(neighbor-joining)绘制遗传进化树。
2 结果 2.1 新城疫病毒分离与鉴定在云南省大理、丽江、昆明、玉溪、普洱、曲靖等6个市48个采样点共采集家禽口咽/泄殖腔拭子和环境样本2 565份。经病毒分离、RT-PCR和序列测定,共分离到新城疫病毒52株,新城疫病毒个体阳性率为2.03%。经对所有分离株F蛋白基因裂解位点进行分析,发现有17株病毒分离株符合新城疫病毒强毒株裂解位点的典型特征,故有17株为强毒株,强毒株个体阳性率为0.66%(详见表 4)。
|
|
表 4 2011—2016年云南省新城疫病毒分离结果 Table 4 NDVs isolated from Yunnan province during 2011 to 2016 |
分离NDV来源于16个农贸市场和1个批发市场共17个采样点,新城疫病毒的场点阳性率为35.41%,在养殖场和散养户中未分离到新城疫病毒(详见表 5)。17株新城疫病毒强毒株主要来自昆明、大理、丽江和普洱等地区的7个农贸市场,强毒株场点阳性率为14.58%(详见表 5)。在宿主分布方面,新城疫病毒主要来源于鸡(34株),此外,在鸽(13株)、鸭(3株)、鹅(1株)和环境样本(1株)中也分离到NDV。
|
|
表 5 48个采样点分布和病毒分离结果 Table 5 The distribution of 48 sampling unit and the results of virus isolation |
对2011—2016年云南省主动监测中分离的新城疫病毒进行F基因序列测定,并构建系统进化树(图 1)。构建系统进化树所用序列为新城疫病毒F基因编码区1—389位核苷酸。黑色字母毒株为GenBank中下载的参考毒株,彩色字母毒株为本次分离毒株。如图 1所示,52株新城疫病毒可分为两类,其中Class Ⅰ类17株,均属于基因3型;Class Ⅱ类35株,可分为4种基因型,其中基因Ⅰ型2株,基因Ⅱ型16株,基因Ⅵ型13株,基因Ⅶ型4株(基因Ⅶb亚型2株,Ⅶh亚型2株)。17株强毒株中,有13株为鸽副黏病毒1型,属于基因Ⅵb亚型,另外4株为基因Ⅶ型,其中2株Ⅶh亚型分离株与马来西亚、柬埔寨、印度尼西亚等东南亚国家流行的毒株高度同源。这是国内首次从家禽中监测到这种Ⅶh亚型的新城疫病毒。遗传演化分析表明,云南地区目前鸽群当中仅仅有基因Ⅵ型新城疫病毒的流行,而在鹅和鸡当中,则主要流行基因Ⅶ型新城疫病毒,其中包括Ⅶb和Ⅶh两种亚型,因此,在云南地区存在多种不同的基因型同时流行,而且基因型分布也具有一定的宿主特异性。
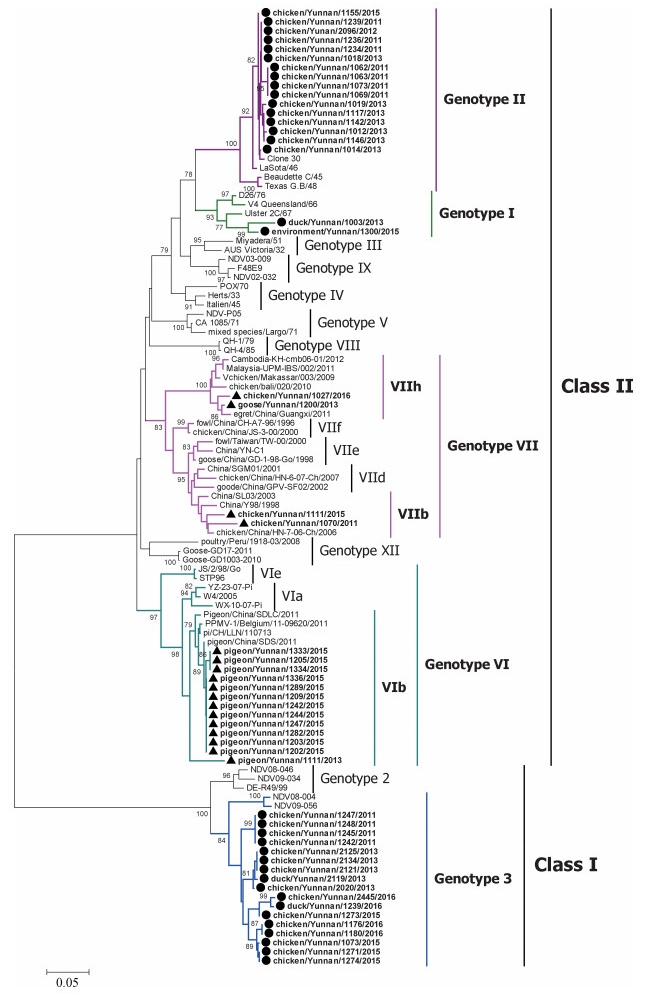
|
黑色字母毒株为GenBank中下载的参考毒株,彩色字母毒株为本次分离毒株。本研究中检测到的强毒株用▲标记,弱毒株用●标记,基因型在右边标出 The strains written in black letters are reference strains downloaded from GenBank, and the strains written in color letters are isolated ones. Virulent NDVs isolated in this study were labeled with ▲, lentogenic NDVs were labeled with ●, and the genotypes were indicated on the right 图 1 2011—2016年云南地区新城疫病毒分离株F基因遗传演化分析 Figure 1 Phylogenetic tree of F gene of NDVs isolated from 2011 to 2016 in Yunnan province |
52株新城疫病毒F基因片段主要功能区(1—389位)核苷酸相似性在61.1%~100%,反映了不同毒株之间核苷酸的差异性。其中17株Class Ⅰ新城疫病毒全部为弱毒株,核苷酸相似性在95.1%~100%,与我国普遍使用的LaSota疫苗相似性在64.2%~65.3%,与V4相似性在66.6%~67.6%。对于4株基因Ⅶ型新城疫病毒,其核苷酸相似性在86.9%~97.9%,其中Ⅶb和Ⅶh亚型之间的相似性仅为86.9%~87.6%,反映出较大的差异性。
3 讨论2011—2016年,自云南省分离的52株NDV分属于5种不同基因型,说明新城疫病毒在该地区具有遗传多样性。值得关注的是,本研究系国内首次从家禽中分离到2株基因Ⅶh亚型NDV,与越南、马来西亚、柬埔寨、印度尼西亚等东南亚国家的分离株高度同源。2011年,我国首次从广西地区的野鸟中分离到这种Ⅶh亚型的新城疫病毒[7]。从云南省家禽中分离到2株同类病毒,说明基因Ⅶh亚型毒株已从周边国家传入我国,并在我国家禽中逐步建立稳定的遗传谱系。国外有专家认为,这种Ⅶh新城疫病毒分布范围非常广泛,具有导致全球新城疫大流行的风险[8]。因此,在这些边境地区应进一步加强病原学监测,分析这种病毒的时间、群间和空间等三间分布规律,评估病毒向内地传播的风险。另外,13株鸽源分离株为鸽副黏病毒1型(占分离毒的25%),均属于基因Ⅵb亚型,该亚型病毒起源于中东,并在20世纪80年代引发第三次ND大流行[9-10]。鸽源NDV于1985年首次出现于我国,随后在我国鸽群中广泛流行,并形成独立的分支[11-13],鸽新城疫的疫苗研究和免疫防控应引起高度重视。
本研究选取的采样场所涉及云南省6个市的农贸市场、批发市场、养殖场和散养户等48个采样点,是云南省主要的活禽交易集散地,市场交易频繁。52株新城疫病毒分别来源于6个地区,16个农贸市场和1个批发市场。研究表明新城疫病毒在云南地区具有无地域特征、分布广、多宿主共存的特征。分离鉴定的17株强毒株,分布地区是大理州、丽江市、昆明市和普洱市,其中12株分离自丽江市,这可能与丽江市的活禽在市场滞留时间长和长途运输有关。丽江市辖区内自给自足的活禽养殖量有限,多数依靠外州市输入,活禽在市场上停留时间平均都在2 d以上,这可能给新城疫病毒繁殖、扩散、重组创造了有利条件。本次强毒分离株全部来源于活禽交易市场,因此,加强活禽市场的兽医卫生管理,定期休市,严格消毒等生物安全措施的落实十分必要。在边境地区,需要进一步加强病原学监测的力度,分析基因Ⅶh等新型新城疫病毒在这些地区的分布,降低传入和扩散风险。
4 结论首次采用基于风险的调查方法证明在云南地区流行的新城疫病毒具有多样性,既有古老的基因型,如基因Ⅵ型,也有从周边国家新传入的Ⅶh等国内新出现的病毒亚型,应高度关注这种新出现的基因型具有导致全球大流行的风险。本研究为分析该地区新城疫流行现状、评估疫病流行趋势提供了科学依据。
| [1] |
刘华雷, 王志亮. 新城疫的流行历史与现状[J]. 中国动物检疫, 2015, 32(6): 1–4.
LIU H L, WANG Z L. The history and current status of Newcastle disease[J]. China Animal Health Inspection, 2015, 32(6): 1–4. (in Chinese) |
| [2] | SNOECK C J, OWOADE A A, COUACY-HYMANN E, et al. High genetic diversity of Newcastle disease virus in poultry in West and Central Africa:cocirculation of genotype XIV and newly defined genotypes XVⅡ and XVⅢ[J]. J Clin Microbiol, 2013, 51(7): 2250–2260. DOI: 10.1128/JCM.00684-13 |
| [3] |
王静静, 吕艳, 赵云玲, 等. 2011~2015年中国I类新城疫病原学监测与遗传进化分析[J]. 病毒学报, 2017, 33(2): 211–215.
WANG J J, LV Y, ZHAO Y L, et al. Pathogenic surveillance and phylogenetic analyses of class-I Newcastle disease viruses from 2011 to 2015[J]. Chinese Journal of Virology, 2017, 33(2): 211–215. (in Chinese) |
| [4] | YU S Q, KISHIDA N, ITO H, et al. Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens[J]. Virology, 2002, 301(2): 206–211. DOI: 10.1006/viro.2002.1539 |
| [5] | KOMMERS G D, KING D J, SEAL B S, et al. Virulence of six heterogeneous-origin Newcastle disease virus isolates before and after sequential passages in domestic chickens[J]. Avian Pathol, 2003, 32(1): 81–93. DOI: 10.1080/0307945021000070750 |
| [6] | ZANETTI F, BERINSTEIN A, CARRILLO E. Effect of host selective pressure on Newcastle disease virus virulence[J]. Microb Pathog, 2008, 44(2): 135–140. DOI: 10.1016/j.micpath.2007.08.012 |
| [7] | DIEL D G, DA SILVA L H A, LIU H L, et al. Genetic diversity of avian paramyxovirus type 1:proposal for a unified nomenclature and classification system of Newcastle disease virus genotypes[J]. Infect Genet Evol, 2012, 12(8): 1770–1779. DOI: 10.1016/j.meegid.2012.07.012 |
| [8] | MILLER P J, HADDAS R, SIMANOV L, et al. Identification of new sub-genotypes of virulent Newcastle disease virus with potential panzootic features[J]. Infect Genet Evol, 2015, 29: 216–229. DOI: 10.1016/j.meegid.2014.10.032 |
| [9] | BALLAGI-PORDÁNY A, WEHMANN E, HERCZEG J, et al. Identification and grouping of Newcastle disease virus strains by restriction site analysis of a region from the F gene[J]. Arch Virol, 1996, 141(2): 243–261. DOI: 10.1007/BF01718397 |
| [10] | UJVÁRI D, WEHMANN E, KALETA E F, et al. Phylogenetic analysis reveals extensive evolution of avian paramyxovirus type 1 strains of pigeons (Columba livia) and suggests multiple species transmission[J]. Virus Res, 2003, 96(1-2): 63–73. DOI: 10.1016/S0168-1702(03)00173-4 |
| [11] | LIU H L, WANG Z L, SONG C P, et al. Characterization of pigeon-origin Newcastle disease virus isolated in China[J]. Avian Dis, 2006, 50(4): 636–640. DOI: 10.1637/7618-042606R1.1 |
| [12] |
胡北侠, 杨少华, 张会娟, 等. 鸽源新城疫病毒全基因组序列分析及致病性研究[J]. 畜牧兽医学报, 2014, 45(2): 255–261.
HU B X, YANG S H, ZHANG H J, et al. Complete genome sequence analysis and pathogenicity of Newcastle disease virus isolated from pigeons[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(2): 255–261. (in Chinese) |
| [13] |
张渭东, 王丹阳, 唐文雅, 等. 秦岭野鸟源新城疫病毒致病性与F、HN基因分子特征分析[J]. 畜牧兽医学报, 2013, 44(1): 152–158.
ZHANG W D, WANG D Y, TANG W Y, et al. Characterization of F, HN Genes of the Newcastle disease virus isolates from wild birds in Qinling Mountains[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(1): 152–158. (in Chinese) |



