2. 山西省右玉县畜牧局, 右玉 037200
2. Animal Husbandry Bureau of Youyu County, Youyu 037200, China
酿酒葡萄皮渣(WGP)是葡萄酒厂的主要副产物,我国每年产量很大但利用率较低,造成了一定的环境压力。随着人们环保意识的增强,有机废物资源化利用成为解决资源、环境与发展之间瓶颈问题的有效手段。WGP因营养价值较高且富含葡多酚而饱受关注,成为畜牧业的一个研究热点。研究发现,WGP可以提高肉鸡抗氧化能力[1];消除仔猪十二指肠上皮炎症,促进仔猪胃肠健康[2]。另外,WGP还可以改变畜产品(如肉、奶)中脂肪酸组分[3],改善畜产品品质[4];提高公绵羊繁殖性能[5];减少反刍动物甲烷排放,减缓温室效应[6]。由此可见,WGP在畜牧业具有广阔的应用前景。
然而,植物多酚是一种抗营养因子,其中单宁、酚酸等的酚基可与饲料中蛋白质、多糖等结合形成不溶性复合物[7-8],并与消化酶结合使其活性丧失[9]。据报道,WGP多酚物质(如单宁和花色素)含量较高,对养分消化与利用具有潜在的抑制作用[10]。作为反刍动物主要消化器官之一,瘤胃的正常代谢与发育对养分的消化至关重要,因此,研究WGP对瘤胃的作用效果,对今后WGP在反刍动物生产中的合理利用具有重要意义。
本试验以杜泊×小尾寒羊杂交一代公羔为研究对象,从绵羊瘤胃发酵、微生物酶活、VFA吸收与代谢相关因子表达量及瘤胃黏膜组织形态学角度研究WGP对绵羊瘤胃代谢及发育的影响,并确定适宜添加水平,为WGP在反刍动物生产中的应用提供科学依据。
1 材料与方法 1.1 试验日粮试验所用WGP购自山西省太谷县怡园干红葡萄酒厂,经自然晾晒后贮存备用。WGP中所含常规营养成分及总多酚含量均在试验开始前测定(表 1)。
|
|
表 1 酿酒葡萄皮渣营养成分(风干基础) Table 1 Nutrient composition of wine grape pomace (air-dry basis) |
基础日粮参照NRC(2007) 绵羊营养需要中体重25 kg,日增重200 g公羔营养需要设计配方,其他3种日粮分别添加5%、10%、20%WGP,调整玉米、豆粕及粗饲料的比例,使这3种日粮能量、蛋白含量与基础日粮一致。试验日粮均制成全混合颗粒饲料。4种试验日粮组成及营养水平见表 2。
|
|
表 2 试验日粮组成及营养成分表(风干基础) Table 2 Composition and nutrient level of diets (air-dry basis) |
选用24只5月龄,体重(25±1) kg的杜泊×小尾寒羊杂交公羔,试验前经过严格检疫。试验羊分4组,每组6只,采用单栏饲养方式,活动范围为0.8 m2。其中,0%WGP组饲喂日粮I(WGP含量为0%),5%WGP组饲喂日粮Ⅱ(WGP含量为5%),10%WGP组饲喂日粮Ⅲ(WGP含量为10%),20%WGP组饲喂日粮Ⅳ(WGP含量为20%)。
1.3 饲养管理试验于2015年5月到8月在山西省右玉县宏宇牧业有限公司种羊养殖场进行。试验预饲期10 d,正式期80 d。试验前对试验羊舍进行清扫消毒,并对试验羊进行免疫注射羊痘、口蹄疫和小反刍兽疫疫苗。在预饲期进行试验羊的分组、编号及驱虫工作,使试验羊适应单栏饲养管理方式,并将5%WGP、10%WGP、20%WGP组的日粮由基础日粮逐渐过渡到其相应的试验日粮。试验期间,试验羊每日分别于08:00和18:00饲喂2次,所有羊自由采食和饮水。
1.4 样品采集试验结束当天下午16:00,对所有试验羊禁食、禁水16 h,并在次日上午08:00进行屠宰。屠宰后,迅速采集瘤胃内容物,四层无菌纱布过滤后立即测定pH,同时取过滤后的瘤胃液20 mL,分装于2个15 mL离心管中,迅速置于液氮中,回实验室后-80 ℃保存备用。
小心剥离瘤胃周围的脂肪,清空瘤胃并用生理盐水冲洗干净,称重,计算其占复胃总重及宰前活重的比重。采集瘤胃左侧背囊,分成两小块(1 cm2左右),其中一块液氮速冻,之后-80 ℃保存备用,另一块于4%多聚甲醛固定,用于制作组织切片。
1.5 测定指标与方法 1.5.1 瘤胃液发酵指标测定瘤胃液pH采用pH计(testo 206-pH1) 当场测定;挥发性脂肪酸利用气相色谱仪(Thermo Fisher,Trace GC)测定;氨态氮采用亚硝基铁氰化钠-次氯酸钠比色法,利用分光光度计(Mapada,UV-1800PC)测定;尿素氮、乳酸含量采用尿素氮检测试剂盒和乳酸检测试剂盒(南京建成生物工程研究所)测定;总蛋白浓度采用BCA蛋白检测试剂盒(Solarbio),利用酶标仪(BioTek,Synergy H1/H1MFD)测定。
1.5.2 瘤胃液消化酶活性测定-淀粉酶活性测定以可溶性淀粉为底物,与瘤胃液于39 ℃,pH6.9的条件下准确反应30 min,加3, 5-二硝基水杨酸(DNS)终止反应,沸水浴10 min,冷却至室温,530 nm处测定吸光度值,以葡萄糖为标准制作标准曲线,计算每分钟水解可溶性淀粉释放1 μmol葡萄糖所需要的酶量。羧甲基纤维素酶、果胶酶、木聚糖酶和β-葡萄糖苷酶活性测定分别以羧甲基纤维素钠、果胶、木聚糖和水杨酸为底物,与瘤胃液于39 ℃,pH6.0的条件下准确反应60 min,加DNS终止反应,沸水浴7 min,540 nm处测定吸光度值,其中木聚糖酶用木糖标准曲线,果胶酶用D-半乳糖醛酸标准曲线,其余用葡萄糖标准曲线,计算每分钟水解底物释放1 μmol还原糖所需要的酶量[11-12]。蛋白酶活性采用胃蛋白酶检测试剂盒(南京建成生物工程研究所)测定[13]。
1.5.3 瘤胃背囊组织VFA吸收相关基因mRNA相对表达量检测称取瘤胃背囊组织50~100 mg,加入750 μL Trizol试剂(Thermo Fisher,Invitrogen)并匀浆,按照Trizol试剂厂家技术说明提取总RNA,检测浓度及完整性后,用PrimeScriptTM RT reagent Kit With gDNA Eraser试剂盒(TaKaRa公司)合成cDNA。引物(表 3)参照GenBank中的绵羊MCT1、MCT4、Na+-K+-ATPase、AE2基因序列,以RPL13为内参基因,利用Primer 3在线设计,由北京六合华大基因科技股份有限公司合成。以反转录产物cDNA为模板进行实时荧光定量PCR,结果根据2-△△CT法计算。
|
|
表 3 基因引物序列 Table 3 Primer sequences used in this study |
4%多聚甲醛固定的样品,经乙醇梯度脱水,二甲苯透明后,以石蜡进行包埋,切片厚度0.5 μm;二甲苯脱蜡,梯度乙醇脱水,苏木精染色3 min,蒸馏水冲洗5~10 min,伊红染色1 min,蒸馏水冲洗5~10 min,乙醇梯度脱水,二甲苯透明,中性树胶封片;在生物显微镜(OLYMPUS)下观察并拍照,用图像处理软件(Image-Pro Plus 7.0) 测量瘤胃背囊黏膜厚度、乳头长度、宽度及角质层厚度。
1.6 数据处理与统计分析数据用Excel 2013初步整理和计算,采用SPSS 22.0进行单因素方差分析,处理间平均值采用Duncan多重比较进行差异显著性检验,P < 0.05表示差异显著。通过回归中的曲线估计对数据随WGP添加量的变化进行直线与二次曲线分析。
2 结果 2.1 日粮WGP添加水平对绵羊瘤胃发酵的影响如表 4所示,WGP的添加水平对绵羊瘤胃液pH和TVFA影响不显著(P>0.05)。乙酸摩尔比随日粮WGP添加水平的提高呈显著线性和二次曲线降低,且20%添加组最低(P < 0.05)。丙酸摩尔比变化趋势与乙酸相反(P < 0.05),乙丙比随WGP添加水平升高而下降,且呈显著线性和二次曲线变化(P < 0.05)。日粮添加WGP可显著提高戊酸比例(P < 0.05),而对丁酸、异丁酸、异戊酸摩尔比无显著影响(P>0.05)。乳酸浓度随WGP的添加而降低,且20%WGP添加组显著低于0%添加组(P < 0.05)。
|
|
表 4 日粮中添加WGP对绵羊瘤胃发酵的影响 Table 4 Effect of dietary WGP supplementation on rumen fermentation of sheep |
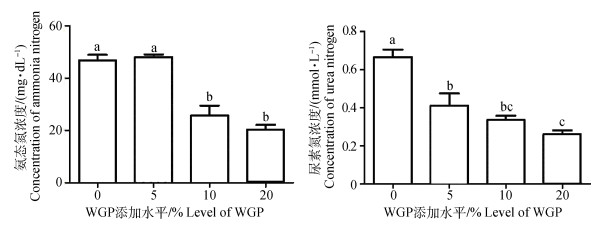
由图 1可知,日粮WGP水平对绵羊瘤胃液氨态氮含量影响显著,其在10%与20%添加组显著低于0%和5%添加组(P < 0.05)。尿素氮含量随WGP添加水平的升高而逐渐降低(P < 0.05),表明WGP可能会改变瘤胃中的氮代谢。
|
图中不同小写字母表示差异显著(P < 0.05)。下同 Different small letters in figures mean significant difference at 0.05 level. The same as below 图 1 日粮WGP添加水平对绵羊瘤胃氨态氮及尿素氮含量的影响 Figure 1 Effect of dietary WGP supplementation on rumen ammonia nitrogen and urea nitrogen concentrations of sheep |
如表 5所示,与0%添加组相比,α-淀粉酶活性在添加WGP后显著下降,且随WGP水平的提高呈显著线性和二次曲线变化(P < 0.05)。各纤维素酶活性在添加WGP后表现出不同的变化趋势。其中,羧甲基纤维素酶、β-葡萄糖苷酶及木聚糖酶都随WGP水平的增加显著线性降低(P < 0.05),而果胶酶的活性在10% WGP添加量时达到最高,其次为0%添加组,显著高于5%和20%添加组(P < 0.05)。蛋白酶活性随WGP的增加而显著降低(P < 0.05)。日粮WGP添加水平对瘤胃液总蛋白浓度无显著影响(P>0.05)。
|
|
表 5 日粮WGP添加水平对绵羊瘤胃液中消化酶活性的影响 Table 5 Effect of dietary WGP supplementation on rumen digestion enzyme activity of sheep |
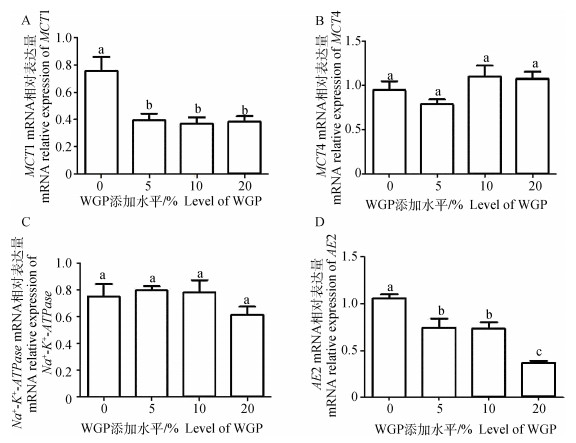
为进一步分析绵羊瘤胃发酵变化对其上皮组织VFA吸收的影响,本研究分析了主要参与瘤胃上皮VFA吸收与代谢的因子(MCT1、MCT4、Na+-K+-ATPase、AE2) 的mRNA相对表达量。结果如图 2所示,MCT1和AE2表达量在5%、10%和20%添加组均显著低于0%添加组(P < 0.05),MCT4和Na+-K+-ATPase在各处理之间无显著变化(P>0.05)。
|
图 2 日粮WGP添加水平对绵羊瘤胃组织MCT1、MCT4、Na+-K+-ATPase、AE2 mRNA相对表达量的影响 Figure 2 Effect of dietary WGP supplementation on relative MCT1, MCT4, Na+-K+-ATPase, AE2 mRNA expression levels in rumen of sheep |
内脏器官的重量在一定程度上可以反映其发育情况。由表 6可见,与0%添加组相比,绵羊瘤胃重量及相对重量在添加WGP后均有升高趋势,但差异不显著(P>0.05)。
|
|
表 6 日粮WGP添加水平对绵羊瘤胃绝对重量及相对重量的影响 Table 6 Effect of dietary WGP supplementation on rumen absolute and relative weight of sheep |
瘤胃乳头能够大大增加瘤胃上皮的表面积,有利于瘤胃壁吸收功能的发挥。由表 7可见,瘤胃组织黏膜厚度及乳头宽度未受日粮WGP添加水平的影响,而乳头长度随日粮WGP水平的增加呈显著线性和二次曲线下降,且20%添加组显著低于其他3组(P < 0.05)。角质层厚度在添加WGP后显著降低,且呈线性和二次曲线变化(P < 0.05)。
|
|
表 7 日粮WGP添加水平对绵羊瘤胃上皮组织发育的影响 Table 7 Effect of dietary WGP supplementation on rumen epithelial tissue development of sheep |
反刍动物瘤胃是一个天然厌氧发酵罐,在食糜的流入与流出、微生物的发酵、瘤胃壁对发酵产物的吸收等诸多因素作用下,瘤胃内环境处于动态平衡。pH是反映反刍动物瘤胃发酵的综合指标[14],受日粮发酵产物,如挥发性脂肪酸、乳酸等影响[10],正常状态下瘤胃液pH的变化范围在5.5~7.5,本研究中,各试验组瘤胃液pH基本都处于正常范围之内,且各组之间无显著差异,这与K.Ishida等[15]研究结果一致。
瘤胃中VFA主要来源于饲料中碳水化合物的发酵,其中85%左右被瘤胃上皮细胞吸收,其余15%左右则随食糜进入肠道[16]。本试验中,瘤胃液TVFA随WGP的添加呈下降趋势,可能与碳水化合物发酵或瘤胃上皮VFA吸收发生改变有关,具体原因还需进一步分析。瘤胃VFA主要包括乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等,其中乙酸、丙酸、丁酸是瘤胃内最重要的挥发性脂肪酸,约占TVFA的95%以上[17]。瘤胃中各种酸的比例会因日粮组成不同而异,一般而言,粗饲料发酵会产生较高比例乙酸,而精饲料发酵则会产生较高比例丙酸[18]。本研究发现,日粮添加WGP后瘤胃乙酸比例下降,丙酸、丁酸、戊酸比例升高,而乙丙比显著降低。这可能是因为WGP中的酚类物改变了微生物活性所致,如酚类物质和黄芪可抑制产琥珀酸丝状杆菌[14],从而粗饲料降解受到抑制,导致乙酸产量降低。丙酸、丁酸、戊酸、异丁酸、异戊酸摩尔浓度在添加WGP后均出现了不同程度的下降(数据未给出),但其降低幅度与TVFA不一致,因而各酸摩尔比表现出不同的变化趋势。从能量利用效率来看,乙丙比例下降将有利于动物增重效率[14],这与本课题组前期研究结论[19]一致。赵栋等[20]研究表明,葡萄皮渣单宁对绵羊瘤胃液总酸浓度和乙酸摩尔比未产生显著影响,显著提高了丙酸摩尔比,而降低了丁酸摩尔比和乙丙比,与本研究结果略有不同。出现差异的原因可能与葡萄皮渣来源及基础日粮不同有关。C.Guerra-Rivas等[10]以瘘管羊为对象,研究葡萄渣(GP)对绵羊瘤胃发酵的影响,结果发现,GP可以显著降低瘤胃液TVFA及乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸浓度,乙丙比有降低趋势,与本研究结果相似。A.Ngamsaeng等[21]报道,植物缩合单宁可显著提高体外发酵丙酸含量,降低TVFA和乙酸含量。汪晓娟等[22]报道,随着人工瘤胃中葡萄渣含量的增加,TVFA及乙酸、丙酸摩尔比显著降低,均与本研究结果相近。
NH3-N是瘤胃中含氮物质分解的终产物,其中部分被瘤胃微生物合成菌体蛋白,剩余部分被瘤胃壁吸收,参与瘤胃尿素再循环。本研究中,NH3-N浓度随WGP添加而显著下降,与C.Guerra-Rivas,K.Ishida,M.Besharati等的研究结果一致[10, 15, 23],可能是因为WGP中的多酚与饲料蛋白质结合,形成单宁-蛋白质复合物,避免了蛋白质被瘤胃微生物降解所致。经瘤胃壁吸收的氨随血液循环进入肝合成尿素,其中大部分都会再循环进入瘤胃,供瘤胃微生物利用[24]。本研究中,瘤胃尿素氮浓度随WGP的添加而显著下降,可能是因为瘤胃NH3-N浓度降低,导致肝合成的尿素量减少,从而导致进入瘤胃的尿素量下降,瘤胃尿素氮浓度随之降低。反刍动物尿氮主要来源于肝合成的尿素,S.L.Greenwood等[25]的研究表明,葡萄酒渣可以减少干奶期尿氮,增加粪氮含量。本研究中,日粮添加WGP后,瘤胃NH3-N和尿素氮均降低,由此推测绵羊尿氮可能会下降,而过瘤胃蛋白的增加可能会增加粪氮含量。因此,日粮中添加WGP可以改变绵羊氮代谢,但具体对氮代谢的影响还需进一步研究。
3.2 日粮WGP添加水平对绵羊瘤胃微生物酶活性的影响成年反刍动物对日粮养分的消化大部分都在瘤胃中酶的作用下完成,这些酶由瘤胃微生物所分泌,其活性与瘤胃微生物的数量和代谢密切相关,羧甲基纤维素酶、β-葡萄糖苷酶、木聚糖酶及果胶酶的活力能够反映瘤胃纤维分解菌的数量和活力,淀粉酶和蛋白酶活性分别反映瘤胃淀粉分解菌和蛋白降解菌的数量和活力[26]。瘤胃微生物酶有胞内酶和胞外酶之分,本试验对不同WGP添加水平下胞外酶的活性进行了研究。结果表明,瘤胃液中淀粉酶、蛋白酶及纤维降解酶(除果胶酶)活性随WGP添加水平的提高而显著降低,这可能是因为:一方面,WGP中的多酚与消化酶结合,使消化酶分子结构发生变化,致使酶活性降低;另一方面,WGP中的抗营养因子不利于某些微生物的生长,导致分泌消化酶的微生物数量较少,活性降低[14]。本研究结果与卢俊姣等[27]关于葡多酚对罗非鱼肠道消化酶的研究结果相反,可能是因为试验动物差异较大,消化酶种类不同所致;也可能因为本研究所用添加物WGP除葡多酚外,还含有大量浓缩单宁,对消化酶和微生物造成了一定的抑制作用。本研究中, 果胶酶活性未随WGP水平增加呈线性变化,可能因为WGP中果胶含量丰富,当日粮中适量(10%)添加时,果胶酶活性会因底物的刺激而表现出上升趋势,但添加量过多(20%)时,多酚对酶活性的抑制超过底物的刺激,果胶酶的活性表现出下降趋势。从整体来看,瘤胃液消化酶活性在日粮添加WGP后均有所降低,减弱了对日粮碳水化合物及蛋白质的发酵作用,可能是本研究中TVFA与氨态氮浓度下降的原因之一。
3.3 日粮WGP添加水平对绵羊瘤胃组织VFA吸收与代谢相关基因表达的影响瘤胃中挥发性脂肪酸的主要去路就是被瘤胃上皮吸收进入血液,此过程由一些蛋白类转运因子协助完成,其中MCT1和MCT4 (Monocarboxylate transporters 1、4) 直接或间接参与VFA的跨膜转运及细胞内代谢[28],MCT1能够将细胞中VFA的降解产物,如β-羟丁酸、乙酰乙酸、乳酸等运送至血液中[29];AE2(Anion exchanger 2) 和Na+-K+-ATPase对保持消化道内皮细胞内稳态有重要作用,尤其与上皮细胞pHi变化密切相关[30-31],同时,AE2还可直接参与VFA的吸收[32]。研究发现,反刍动物日粮结构影响VFA吸收,通过VFA转运因子来调控。本研究通过对以上因子mRNA表达量分析发现,日粮添加WGP后MCT4和Na+-K+-ATPase mRNA表达量没有发生显著变化,但MCT1和AE2 mRNA丰度显著降低了。由此可见,并非因VFA吸收相关基因mRNA表达量升高导致本研究WGP添加组瘤胃液VFA浓度下降。先前研究证明,VFA吸收相关基因表达受瘤胃内环境的影响,尤其是VFA和pH[33]。本研究日粮添加WGP后瘤胃液VFA浓度下降可能是导致部分VFA吸收相关基因表达下降的原因。但是,WGP中的多酚化合物是否会直接对瘤胃上皮组织VFA吸收相关基因的表达起作用还需进一步研究。
3.4 日粮WGP添加水平对绵羊瘤胃发育的影响反刍动物出生后瘤胃开始迅速发育,体积不断增大,8周龄时即能达到相对成年大小,之后在日粮的刺激下仍处于缓慢发育中[34]。本研究中,瘤胃绝对重量和相对重量随WGP的添加呈升高趋势但未达到显著水平,可能是因为本研究所用试验羊为5月龄,已经不是瘤胃快速发育阶段,但添加WGP后试验羊采食量有升高趋势[19],增加了对瘤胃的物理刺激,从而导致瘤胃重量的增加。
反刍动物瘤胃上皮组织结构从胎儿期到出生期直至成年都在不断的发展和完善。据报道,瘤胃上皮的生长发育受遗传、神经内分泌等内部因素和日粮营养水平、环境等外部因素的影响,同时瘤胃内环境的变化对瘤胃上皮的生长发育也有一定的调节作用[35]。研究表明,VFA能够促进瘤胃的发育,是瘤胃组织形态发育的化学刺激因素[36]。本研究瘤胃乳头长度随WGP添加水平提高有降低趋势,可能是因为随WGP添加量的增加,瘤胃VFA浓度降低,对瘤胃上皮的刺激减弱而导致。角质层是瘤胃上皮组织最外层的细胞层,主要对瘤胃起保护作用,但过厚会影响营养物质的吸收[37]。本研究中,瘤胃上皮角质层厚度在添加WGP后显著降低,可能是由于WGP添加组的日粮纤维含量略高,且采食量较大,对瘤胃上皮的摩擦作用大所造成的,具体原因还需进一步分析。
4 结论 4.1日粮添加WGP会在一定程度上降低绵羊瘤胃代谢速率。其中,瘤胃液pH无显著变化;随WGP添加水平的提高,总挥发性脂肪酸浓度有降低趋势,乳酸浓度显著降低,乙酸比例下降,丙酸比例升高,乙丙比下降;氨态氮和尿素氮浓度降低;各消化酶活性下降;部分VFA吸收相关基因表达量降低。
4.2日粮添加WGP能够一定程度上增加瘤胃重量,降低瘤胃上皮角质层厚度,但添加量达到20%时不利于乳头增长。
综上,在本研究条件下,绵羊日粮中添加WGP能够改变瘤胃代谢,有利于瘤胃发育,但添加量不宜超过10%。
| [1] | BRENES A, VIVEROS A, GOÑÍ I, et al. Effect of grape pomace concentrate and vitamin E on digestibility of polyphenols and antioxidant activity in chickens[J]. Poult Sci, 2008, 87(2): 307–316. DOI: 10.3382/ps.2007-00297 |
| [2] | GESSNER D K, FIESEL A, MOST E, et al. Supplementation of a grape seed and grape marc meal extract decreases activities of the oxidative stress-responsive transcription factors NF-κB and Nrf2 in the duodenal mucosa of pigs[J]. Acta Vet Scand, 2013, 55: 18. DOI: 10.1186/1751-0147-55-18 |
| [3] | YI C, SHI J, KRAMER J, et al. Fatty acid composition and phenolic antioxidants of winemaking pomace powder[J]. Food Chem, 2009, 114(2): 570–576. DOI: 10.1016/j.foodchem.2008.09.103 |
| [4] | VASTA V, LUCIANO G. The effects of dietary consumption of plants secondary compounds on small ruminants' products quality[J]. Small Rumin Res, 2011, 101(1-3): 150–159. DOI: 10.1016/j.smallrumres.2011.09.035 |
| [5] |
金亚倩, 刘文忠, 赵俊星, 等. 酿酒葡萄皮渣对单栏饲养方式下公绵羊繁殖性能及睾丸抗氧化性的影响[J]. 畜牧兽医学报, 2016, 47(11): 2228–2239.
JIN Y Q, LIU W Z, ZHAO J X, et al. Effect of dietary wine grape pomace on reproductive performance, antioxidant ability of testis in ram[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(11): 2228–2239. (in Chinese) |
| [6] | PATRA A K, SAXENA J. The effect and mode of action of saponins on the microbial populations and fermentation in the rumen and ruminant production[J]. Nutr Res Rev, 2009, 22(2): 204–219. DOI: 10.1017/S0954422409990163 |
| [7] | MEZZOMO R, PAULINO P V R, DETMANN E, et al. Influence of condensed tannin on intake, digestibility, and efficiency of protein utilization in beef steers fed high concentrate diet[J]. Livest Sci, 2011, 141(1): 1–11. DOI: 10.1016/j.livsci.2011.04.004 |
| [8] | SMITH A H, ZOETENDAL E, MACKIE R I. Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J]. Microb Ecol, 2005, 50(2): 197–205. DOI: 10.1007/s00248-004-0180-x |
| [9] | HENKE A, DICKHOEFER U, WESTREICHER-KRISTEN E, et al. Effect of dietary Quebracho tannin extract on feed intake, digestibility, excretion of urinary purine derivatives and milk production in dairy cows[J]. Arch Anim Nutr, 2017, 71(1): 37–53. DOI: 10.1080/1745039X.2016.1250541 |
| [10] | GUERRA-RIVAS C, GALLARDO B, MANTECÓNÁ R, et al. Evaluation of grape pomace from red wine by-product as feed for sheep[J]. J Sci Food Agric, 2017, 97(6): 1885–1893. DOI: 10.1002/jsfa.2017.97.issue-6 |
| [11] |
孙宏选. 不同来源的蛋白质和非结构性碳水化合物对泌乳奶牛瘤胃微生物酶活性的影响[D]. 北京: 中国农业科学院, 2006.
SUN H X. Effects of protein and nonstructural carbohydrate with different sources on the rumen microbial enzymatic activities of lactating dairy cows[D]. Beijing:Chinese Academy of Agricultural Sciences, 2006. (in Chinese) |
| [12] |
代振威. 硫酸铜和纳米铜对绵羊瘤胃体外发酵的影响[D]. 太谷: 山西农业大学, 2013.
DAI Z W. Effects of copper sulfate and Nano-copper on rumen fermentation of sheep in vitro[D]. Taigu:Shanxi Agricultural University, 2013. (in Chinese) |
| [13] |
张宁. 不同日龄小尾寒羊与滩羊消化器官及其胃消化酶活性的比较研究[D]. 杨凌: 西北农林科技大学, 2008.
ZHANG N. Comparison of the digestive organs and the main digestive enzyme activities in stomach about different days old Small-tail Han sheep and Tan sheep[D]. Yangling:Northwest A&F University, 2008. (in Chinese) |
| [14] |
冯仰廉.
反刍动物营养学[M]. 北京: 科学出版社, 2006.
FENG Y L. Ruminant nutrition[M]. Beijing: Science Press, 2006. (in Chinese) |
| [15] | ISHIDA K, KISHI Y, OISHI K, et al. Effects of feeding polyphenol-rich winery wastes on digestibility, nitrogen utilization, ruminal fermentation, antioxidant status and oxidative stress in wethers[J]. Anim Sci J, 2015, 86(3): 260–269. DOI: 10.1111/asj.2015.86.issue-3 |
| [16] | ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium:Role of fermentation acid absorption in the regulation of ruminal pH[J]. J Anim Sci, 2011, 89(4): 1092–1107. DOI: 10.2527/jas.2010-3301 |
| [17] | NOLAN J V, LENG R A, DOBOS R C, et al. The production of acetate, propionate and butyrate in the rumen of sheep:fitting models to 14C-or 13C-labelled tracer data to determine synthesis rates and interconversions[J]. Anim Prod Sci, 2014, 54(11-12): 2082–2088. |
| [18] |
刘洁, 刁其玉, 赵一广, 等. 饲粮不同NFC/NDF对肉用绵羊瘤胃pH、氨态氮和挥发性脂肪酸的影响[J]. 动物营养学报, 2012, 24(6): 1069–1077.
LIU J, DIAO Q Y, ZHAO Y G, et al. Effects of dietary NFC/NDF ratios on rumen pH, NH3-N and VFA of meat sheep[J]. Chinese Journal of Animal Nutrition, 2012, 24(6): 1069–1077. (in Chinese) |
| [19] |
金亚倩, 郝松华, 赵俊星, 等. 日粮中添加葡萄皮渣对绵羊生长性能、器官指数及血液生化指标的影响[J]. 中国畜牧兽医, 2016, 43(9): 2326–2332.
JIN Y Q, HAO S H, ZHAO J X, et al. Effect of dietary grape pomace on growth performance, organ index and blood biochemical indexes in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(9): 2326–2332. (in Chinese) |
| [20] |
赵栋, 郑琛, 李发弟, 等. 葡萄渣单宁对绵羊养分消化代谢及瘤胃发酵的影响[J]. 草业学报, 2014, 23(4): 285–292.
ZHAO D, ZHENG C, LI F D, et al. Effects of tannins from grape pomace on digestibility, metabolism and rumen fermentation in sheep[J]. Acta Prataculturae Sinica, 2014, 23(4): 285–292. DOI: 10.11686/cyxb20140435 (in Chinese) |
| [21] | NGAMSAENG A, WANAPAT M, KHAMPA S. Evaluation of local tropical plants by in vitro rumen fermentation and their effects on fermentation end-products[J]. Pak J Nutr, 2006, 5(5): 414–418. DOI: 10.3923/pjn.2006.414.418 |
| [22] |
汪晓娟, 李发弟, 赵栋, 等. 葡萄渣对人工瘤胃发酵的影响[J]. 中国草食动物科学, 2013, 33(4): 23–27.
WANG X J, LI F D, ZHAO D, et al. Effects of grape pomace on artificial rumen fermentation[J]. China Herbivore Science, 2013, 33(4): 23–27. (in Chinese) |
| [23] | BESHARATI M, TAGHIZADEH A. Evaluation of dried grape by-product as a tanniniferous tropical feedstuff[J]. Anim Feed Sci Technol, 2009, 152(3-4): 198–203. DOI: 10.1016/j.anifeedsci.2009.04.011 |
| [24] |
王芃芃, 郑楠, 王加启, 等. 瘤胃尿素转运与代谢调控研究进展[J]. 中国农业科学, 2015, 48(S): 86–93.
WANG P P, ZHENG N, WANG J Q, et al. Progresses of research on ruminal urea transport, metabolism and its regulation[J]. Scientia Agricultura Sinica, 2015, 48(S): 86–93. DOI: 10.3864/j.issn.0578-1752.2015.S.010 (in Chinese) |
| [25] | GREENWOOD S L, EDWARDS G R, HARRISON R. Short communication:Supplementing grape marc to cows fed a pasture-based diet as a method to alter nitrogen partitioning and excretion[J]. J Dairy Sci, 2012, 95(2): 755–758. DOI: 10.3168/jds.2011-4648 |
| [26] |
李鹤琼, 刘强, 王聪, 等. 2-甲基丁酸对断奶前后犊牛瘤胃发酵、酶活及纤维分解菌菌群的影响[J]. 畜牧兽医学报, 2015, 46(12): 2218–2226.
LI H Q, LIU Q, WANG C, et al. Effects of 2-methylbutyrate supplementation on rumen fermentation, enzyme activities and cellulolytic bacteria in pre-and post-weaning dairy calves[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(12): 2218–2226. (in Chinese) |
| [27] |
卢俊姣, 翟少伟. 饲料中添加葡多酚对吉富罗非鱼生长性能、肠道消化酶活性、血脂水平和肝胰脏抗氧化能力的影响[J]. 动物营养学报, 2014, 26(4): 1095–1102.
LU J J, ZHAI S W. Effects of grape proanthocyanidins supplementation on growth performance, intestinal digestive enzyme activities, serum lipid levels and hepatopancreas antioxidant capacity of genetic improvement of farmed tilapia (GIFT, Oreochromis niloticus)[J]. Chinese Journal of Animal Nutrition, 2014, 26(4): 1095–1102. (in Chinese) |
| [28] | BENESCH F, DENGLER F, MASUR F, et al. Monocarboxylate transporters 1 and 4:expression and regulation by PPARα in ovine ruminal epithelial cells[J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(12): R1428–R1437. DOI: 10.1152/ajpregu.00408.2013 |
| [29] | MÜLLER F, HUBER K, PFANNKUCHE H, et al. Transport of ketone bodies and lactate in the sheep ruminal epithelium by monocarboxylate transporter 1[J]. Am J Physiol Gastrointest Liver Physiol, 2002, 283(5): G1139–G1146. DOI: 10.1152/ajpgi.00268.2001 |
| [30] | PENNER G B, STEELE M A, ASCHENBACH J R, et al. Ruminant nutrition symposium:Molecular adaptation of ruminal epithelia to highly fermentable diets[J]. J Anim Sci, 2011, 89(4): 1108–1119. DOI: 10.2527/jas.2010-3378 |
| [31] | METZLER-ZEBELI B U, HOLLMANN M, SABITZER S, et al. Epithelial response to high-grain diets involves alteration in nutrient transporters and Na+/K+-ATPase mRNA expression in rumen and colon of goats[J]. J Anim Sci, 2013, 91(9): 4256–4266. DOI: 10.2527/jas.2012-5570 |
| [32] | YABUUCHI H, TAMAI I, SAI Y, et al. Possible role of anion exchanger AE2 as the intestinal monocarboxylic acid/anion antiporter[J]. Pharm Res, 1998, 15(3): 411–416. DOI: 10.1023/A:1011920213991 |
| [33] | YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. J Dairy Sci, 2014, 97(9): 5668–5675. DOI: 10.3168/jds.2013-7807 |
| [34] | LANE M A, BALDWIN R L VI, JESSE B W. Sheep rumen metabolic development in response to age and dietary treatments[J]. J Anim Sci, 2000, 78(7): 1990–1996. DOI: 10.2527/2000.7871990x |
| [35] |
卢劲晔. 日粮能量水平对山羊瘤胃上皮生长的影响及机理研究[D]. 南京: 南京农业大学, 2011.
LU J Y. Effects of dietary energy intake on growth of rumen epithelium and its underlying mechanism in goats[D]. Nanjing:Nanjing Agricultural University, 2011. (in Chinese) |
| [36] | KHAN M A, LEE H J, LEE W S, et al. Starch source evaluation in calf starter:Ⅱ. Ruminal parameters, rumen development, nutrient digestibilities, and nitrogen utilization in Holstein calves[J]. J Dairy Sci, 2008, 91(3): 1140–1149. DOI: 10.3168/jds.2007-0337 |
| [37] |
翁秀秀, 张养东, 李发弟, 等. 不同类型饲粮饲喂下奶牛瘤胃乳头的光镜和透射电镜观察[J]. 动物营养学报, 2013, 25(9): 1998–2004.
WENG X X, ZHANG Y D, LI F D, et al. Light and transmission electron microscopical observation of ruminal papillae of dairy cows receiving different types of diets[J]. Chinese Journal of Animal Nutrition, 2013, 25(9): 1998–2004. (in Chinese) |



