2. 华中农业大学动物科学技术学院/动物医学院, 武汉 430070
2. College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070, China
白细胞介素6(Interleukin 6,IL6) 是一种具有多种生物学效应的细胞因子。1980年J.Weissenbach等[1]发现成纤维细胞经Poly I-C刺激后能产生一种抑制病毒复制的细胞因子,命名为β2干扰素(Interferon-β2,IFN-β2)。T.Hirano等[2]发现一种具有刺激B细胞分化功能的因子,称B细胞分化因子。后又由于其具有不同的生物学功能,还曾被命名为B细胞刺激因子-2(B cell stimulatory factor 2,BSF-2)、溶细胞性T细胞分化因子(Cytolytic T cell differentiation factor,CDF)、血小板生长素(Thrombopoietin)、T细胞替代因子样因子(T cell replacing factor-like factor,TRF-LF)、巨噬细胞-粒细胞诱导蛋白-2(Macrophage-granulocyte-inducing protein-2,MGI-2) 和肝细胞刺激因子(Hepatocyte stimulating factor,HSF)等。后来对上述分子的cDNA进行克隆,证实它们是同一种细胞因子,1986年统一命名为IL6[3]。
IL6的突变可能造成疾病的发生发展。如仇小强等[4]研究发现与IL6 -572位点CC基因型相比,携带GG基因型个体慢性HBV感染风险增加。S.Bek等[5]研究表明IL6多态性rs10499563与炎性肠疾病显著相关。M.Z.Banday等[6]研究发现,IL6启动子-174G/C区域单核苷酸多态性与肠癌风险降低之间存在显著的联系。N.M.Maintinguer等[7]研究表明,IL6基因SNP rs1800795 G等位基因与代谢综合征发病率增加存在相关。IL6和年龄、体重及繁殖等也有关系。I.Wernstedt等[8]发现IL6在人类和啮齿类动物中能通过增加脂肪的消耗而抑制体重的增加,高体重指数人群其血清瘦素也高,其-174位点中纯合子CC比例远高于体重指数低的人。P.F.Todendi等[9]研究表明,超重或肥胖的学龄期儿童有更高的IL6水平。猪的IL6基因位于染色体9上,由5个外显子和4个内含子组成[10]。但有关猪IL6的功能和多态性的研究还较少。因此,本试验在不同猪种中对IL6的部分序列进行了PCR扩增,通过测序比对发现IL6基因的多态性,利用PCR-RFLP检测出内含子3多态位点的基因型,分析其与仔猪生长、腹泻以及种猪繁殖性状之间的关联性,利用Real-time PCR技术分析LPS刺激猪外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)后IL6基因的表达,以期了解IL6基因在猪体内的作用,为其在猪分子遗传育种中的应用奠定基础。
1 材料与方法 1.1 试验材料试验选取(黑龙江省兰西县民猪种猪场)2013年秋季同期出生的281头民猪哺乳仔猪和182头长白哺乳仔猪作为试验动物,仔猪出生~35日龄断奶,每天早上和下午各观察1次各圈舍内仔猪的排粪情况,并逐头检查肛门有无红肿和粪便污染以及猪圈内仔猪粪便状况,然后进行仔猪腹泻评分并记录,评分标准[11]见表 1。根据腹泻评分计算腹泻指数,腹泻指数为仔猪出生~35日龄粪便状况评分之和。在试验期间,同时称量仔猪的出生重、7日龄重、14日龄重、21日龄重、28日龄重和35日龄断奶重,并进行记录和计算日增重,日增重=(35日龄断奶重-出生重)/35。采集仔猪耳组织并放入75%的酒精中,利用Genomic DNA Kit试剂盒(上海生工生物工程股份有限公司)提取基因组DNA。
|
|
表 1 仔猪腹泻评分标准 Table 1 Grading criterion about piglet diarrhea |
本试验还另选取215头杜洛克猪、69头大白猪作为公猪繁殖性能研究的试验对象,对284头公猪的射精量以及精子的活力、活率、密度、畸形率、直线速度、曲线速度等性状进行检测,并提取猪精液基因组DNA。
1.2 引物设计及PCR扩增、测序从NCBI下载猪IL6基因mRNA序列(GenBank登录号:NM_214399.1) 和DNA序列(GenBank登录号:NC_010451.3)。以此序列为模本序列,利用Primer 5.0软件设计PCR扩增引物和Real-time PCR引物(表 2),所有引物由生工生物工程股份有限公司合成。
|
|
表 2 猪IL6基因扩增引物 Table 2 Porcine IL6 gene amplification primers |
PCR反应体系:PCR Mix 12.5 μL,上游、下游引物各1.0 μL(10 μmol·L-1)、模板DNA 2.0 μL,加去离子水至25.0 μL。
PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min;4 ℃保存。
分别选取重度腹泻和健康民猪、长白猪,以其基因组DNA为模板分别进行PCR扩增,经1.5%琼脂糖凝胶电泳检测后,用胶回收试剂盒(生工生物工程股份有限公司)回收目的片段,回收纯化后的PCR产物直接送生工生物工程股份有限公司进行测序。利用Cluster W软件对测序结果进行多重序列比对,分析扩增片段中核苷酸的变异位点。
1.3 PCR-RFLP分析PCR产物酶切反应总体系为10 μL,其中PCR产物8.5 μL,0.5 μL Hpa Ⅱ内切酶(10 U·μL-1),1 μL 10×Buffer。将样品混匀后离心,37 ℃水浴酶切5 h,用1.5%琼脂糖凝胶电泳检测酶切结果,在紫外灯下拍照,判定基因型。
1.4 定量RT-PCR检测IL6基因的表达根据腹泻观察记录,选择3头35日龄断奶健康民猪仔猪,利用含有肝素钠的采血管,无菌采取外周血10 mL。PBMC的分离严格按照猪淋巴细胞分离液(天津灏洋)说明书操作,分离后的PBMC用含10%胎牛血清的RPMI-1640液(Hyclone)重悬,置于6孔板,加入1 mg·mL-1脂多糖(Lipopolysaccharide, LPS)分别刺激0、12和24 h后,收集细胞,以0 h为阴性对照组。利用RNeasy Mini kit试剂盒(QIANGEN)提取总RNA,利用The Prime-Script RT reagent kit with gDNA Eraser (TaKaRa)试剂盒制备cDNA,-20 ℃保存。
以cDNA为模板,利用引物进行Real-time PCR扩增。总反应体系20 μL:SYBR Premix Ex TaqII染料10 μL,cDNA模板0.5 μL,上、下游引物(10 μmol·L-1)各0.5 μL,补灭菌双蒸水至20 μL。反应条件:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s,共40个循环。在65~95 ℃读板,进行熔解曲线分析。
1.5 数据分析根据基因型统计分析结果计算SNP位点的基因型和等位基因频率,并进行遗传多态性分析。采用SAS统计软件(SAS Institute Inc, Version 8.0) GLM程序进行单标记方差分析。仔猪腹泻指数和生长性状的统计模型为Yij=μ+Gi+Fj+eij,公猪繁殖性状的统计模型为Yijkl=μ+Gi+Fj+Sk+Al+eijkl, 其中Yij和Yijkl为性状表型值,μ为群体均值,Gi为基因型效应,Fj为家系效应,Sk为季节效应,Al为年龄效应,eij和eijkl为随机残差效应。
利用2-ΔΔCt法计算基因的相对表达量,基因差异表达的显著性使用双侧t检验来进行统计学分析。
2 结果 2.1 猪IL6基因部分序列扩增利用引物IL6-3,以民猪和长白猪基因组DNA为模板进行PCR扩增,扩增片段包括IL6基因的第3外显子和部分第2、3内含子等。PCR产物使用1.5%琼脂糖凝胶检测(图 1),条带清晰具有特异性,可用于PCR产物测序。
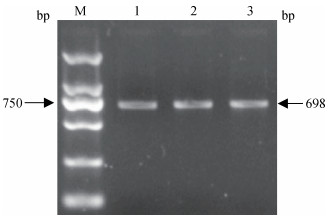
|
M. DNA相对分子质量标准DL 2000;1~3. PCR扩增产物 M. DL 2000 marker; 1-3.PCR products 图 1 PCR扩增产物检测 Figure 1 Detection of PCR amplification products |
PCR扩增后,将PCR产物分别进行回收和纯化,送生工生物工程股份有限公司测序。所得序列利用Cluster W软件进行多重序列比对分析,发现IL6-3引物扩增片段上302 bp(C/T)处存在1个SNP,可引起限制性内切酶Hpa Ⅱ酶切位点(CCGG)的改变(图 2),根据SNP命名法则[12]将其命名为NC_010451.3: g.1704674C>T。
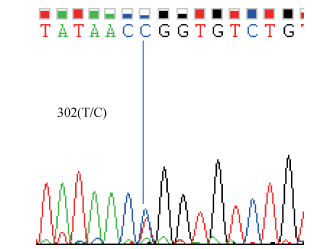
|
图 2 猪IL6基因内含子3中的单核苷酸变异 Figure 2 SNP in intron 3 of porcine IL6 gene |
对不同猪群的个体进行PCR-RFLP检测,PCR产物经Hpa Ⅱ酶切后, 产生TT、TC和CC 3种基因型(图 3)。当NC_010451.3: g.1704674C>T位点为C时,扩增产物能被Hpa Ⅱ酶切,酶切后将产生2个片段,分别为397和301 bp(C等位基因);当NC_010451.3: g.1704674C>T位点为T时,由于Hpa Ⅱ酶切位点消失,扩增产物不能被Hpa Ⅱ酶切,所以仍为698 bp(T等位基因),而当NC_010451.3: g.1704674C>T位点为杂合状态时,即2种等位基因都存在,扩增产物被Hpa Ⅱ酶切后产生3个片段,分别为698、397和301 bp。
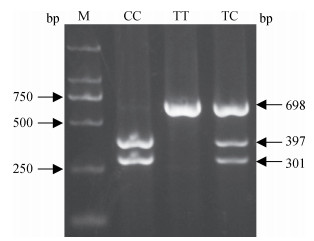
|
M. DNA相对分子质量标准DL 2000 M. DL 2000 marker 图 3 PCR扩增产物Hpa Ⅱ酶切分型结果 Figure 3 The results of Hpa Ⅱ digestion of PCR amplification products |
在民猪、长白猪、杜洛克猪、大白猪群体中,IL6基因g.1704674C>T SNP的基因型频率、等位基因频率见表 3。由表 3可知,在各群体中均存在TT、TC和CC 3种基因型,长白、杜洛克、大白猪群体中以CC型居多,TC型次之,TT型最少,C为优势等位基因;民猪群体中以TC型居多,TT型次之,CC型最少,T为优势等位基因。
|
|
表 3 IL6基因g.1704674C>T SNP在不同猪种中的基因型和等位基因频率 Table 3 Genotype and allele frequencies of SNP g.1704674C>T of IL6 gene in different pig breeds |
遗传杂合度(He)、有效等位基因数(Ne)、多态信息含量(PIC)是评价群体遗传变异的重要指标,不同的遗传参数体现各群体的遗传差异性。对IL6 g.1704674C>T位点进行遗传多态性分析显示(表 4),民猪的杂合度最高,为0.49,表示其遗传多样性较丰富,遗传变异程度较高;而杜洛克猪的杂合度最低,为0.19,遗传变异程度最小。民猪的有效等位基因数接近2,表明等位基因T和C在民猪中分布较均匀。长白猪的多态信息量为0.31,民猪的多态信息量为0.37,大白猪的多态信息量为0.26,均表现为中度多态。
|
|
表 4 IL6 g.1704674C>T SNP的遗传多态性分析 Table 4 The genetic polymorphism of SNP g.1704674C>T of IL6 gene |
民猪群体中,IL6 g.1704674C>T SNP位点不同基因型与仔猪腹泻指数和部分生长性状的关联分析结果见表 5。可以看出,CC型个体的腹泻指数显著高于TT型个体(P < 0.05),CC型个体的14、21、28、35日龄体重及日增重均显著低于TC型个体(P < 0.05),CC型个体的21日龄体重也显著低于TT型个体(P < 0.05),因此,在育种过程中淘汰CC基因型个体可以提高仔猪群体平均抗腹泻能力和断奶体重。
|
|
表 5 IL6基因g.1704674C>T SNP与民猪仔猪腹泻指数和生产性状的关联分析 Table 5 Association analysis between IL6 g.1704674C>T SNP and diarrhea index and growth traits of Min piglets |
长白仔猪群体中IL6 g.1704674C>T SNP不同基因型与仔猪腹泻指数和部分生长性状的关联分析结果见表 6。TT型个体的出生重显著高于CC型个体(P < 0.05),7日龄体重显著高于TC型个体(P < 0.05)。
|
|
表 6 IL6基因g.1704674C>T SNP与长白猪仔猪腹泻指数和生长性状的关联分析表 Table 6 Association analysis between IL6 g.1704674C>T SNP and diarrhea index and growth traits of Landrace piglets |
在杜洛克和大白猪2个品种中,IL6 g.1704674C>T SNP位点不同基因型与公猪繁殖性状关联分析显示:在杜洛克猪中,IL6 g.1704674C>T SNP与射精量呈显著相关(P < 0.05),TT和TC基因型个体射精量显著大于CC基因型个体(表 7)。在大白猪中,IL6 g.1704674C>T SNP与精子密度呈显著相关(P < 0.05),CC基因型个体精子密度显著大于TC基因型个体(表 8)。
|
|
表 7 IL6基因g.1704674C>T SNP与杜洛克公猪繁殖性能的关联分析 Table 7 Association analysis between IL6 g.1704674C>T SNP and reproduction traits of Duroc boars |
|
|
表 8 IL6基因g.1704674C>T SNP与大白公猪繁殖性能的关联分析 Table 8 Association analysis between IL6 g.1704674C>T SNP and reproduction traits of Yorkshire boars |
采用定量RT-PCR检测了LPS刺激PBMC后不同时间段IL6基因的表达量。结果如图 4所示,LPS刺激0、12 h后与刺激24 h后PBMC中IL6基因的表达量之间差异极显著,在LPS刺激下IL6表达量显著增加。
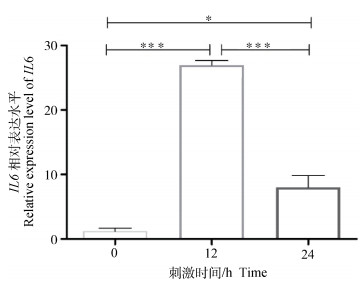
|
*.P < 0.05;***.P < 0.001 图 4 不同的LPS诱导时间下IL6基因的表达量 Figure 4 Expression of IL6 gene at different LPS induction times |
现代养猪生产中,腹泻是造成仔猪生长缓慢和高死亡率主因之一。同时,随着猪的人工授精技术的普及,极大提高了公猪的利用效率,使得公猪的繁殖力对养猪生产的影响更大、更广。不同个体对腹泻抗性(或易感性)存在差异,不同公猪每次射精量、精液品质等也存在较大差异。这些差异受遗传基因等控制,因此,寻找控制腹泻、生长和公猪繁殖力主效基因和分子标记,培育高抗、高生长、高繁品种(系),对养猪业健康发展尤为重要。
IL6是一种由多种细胞产生的具有多种生物功能的细胞因子。IL6能促进细胞活化、增殖和分化,以自分泌、旁分泌、内分泌等形式对不同生理和病理产生不同效应,包括介导炎症反应、免疫反应等,在自身免疫、机体防御、排卵、着床、生长发育等方面存在重要作用[13]。正常情况下IL6在机体内浓度很低,具有调节免疫应答、促进细胞生长分化等多种生理功能[14]。很多刺激下都能诱导不同组织细胞中IL6基因的转录,比如RNA或DNA病毒感染、细菌内毒素、脂多糖、血清以及干扰素(Interferon,IFN)等[15]。本试验对民猪PBMC进行LPS刺激,也发现LPS刺激12和24 h后,IL6基因表达量极显著上升,表明IL6基因表达与机体的免疫存在极显著的相关关系,与以上结果一致。民猪CC型个体的腹泻指数显著高于TT型个体(P < 0.05),长白猪CC型个体的腹泻指数也呈高于TC型个体的趋势。由此推测,CC可能是猪腹泻的不利基因型,提示在育种中淘汰CC型个体可能有利于提高种群的抗腹泻能力,但此结果仍需在更多的样本群中验证。民猪与长白猪腹泻指数相比,发现民猪3个基因型个体的腹泻指数都低于长白猪,表明民猪的抗腹泻能力强于长白猪,这与王希彪等的试验结果也一致[16]。
近年来,V.Wallenius等[17]发现,敲除IL6基因的小鼠在成熟后会表现肥胖病,而在使用IL6处理18 d后,小鼠的体重又明显下降。此外,M.Szydlowski等[18]在IL6和TNF两个基因的启动子区发现了3个SNP,关联性分析发现它们与猪的肥胖有关。K.L.Baumgartel等[19]研究也表明IL6多态性与粪便钙卫蛋白(Fecal calprotectin)、增重等相关。由此可见,IL6基因可能与猪的生长性状存在相关,因此本试验将IL6内含子3区域多态性与仔猪部分生长性状进行了关联性分析。结果发现,长白猪群中,TT型个体出生重显著高于CC型个体(P < 0.05),7日龄体重显著高于TC型个体(P < 0.05)。在民猪群体中,TC型个体的14日龄、21日龄、28日龄、35日龄体重及日增重显著高于CC型个体(P < 0.05),TT型个体的21日龄体重也显著大于CC型个体(P < 0.05),这与CC型个体的腹泻指数较高也是较一致的,说明腹泻会导致仔猪生长变慢。由此推测在育种过程中,特别是在民猪保种和生产中,淘汰CC型个体可能有利于增加仔猪的断奶重和哺乳期日增重,提高猪群的生产性能。
另外,IL6也可以由生殖细胞、支持细胞、睾丸间质细胞以及睾丸间质的巨噬细胞等多种睾丸细胞产生,与动物生殖关系密切[20-25]。H.Hakovirta等[26]在小鼠中研究发现,IL6是生精上皮阶段性、特异性的旁分泌调节剂,能够特异性的抑制减数分裂过程中DNA的合成。还有研究发现,不育症患者的血清IL6水平显著高于正常人,IL6的表达水平与精子浓度之间为负相关[27],也有报道指出,IL6能够促进精子获能,激发顶体反应等[28]。这些都表明IL6可能影响雄性个体的繁殖性能,但目前IL6基因与种猪繁殖性能的相关研究还比较少。因此本试验分析了其与种猪繁殖性能的关联性,结果发现,在杜洛克猪中IL6基因与射精量呈显著相关(P < 0.05),TT和TC基因型个体射精量明显大于CC基因型个体,说明在射精量性状上,T等位基因为优势等位基因。而在大白猪中,IL6基因与精子密度呈显著相关(P < 0.05),CC基因型个体精子密度明显大于TC基因型个体。可见,IL6基因g.1704674C>T SNP对公猪繁殖性状也存在一定影响,但能否作为新遗传标记,仍需后续大样本量群体或不同品种、世代验证。
4 结论本试验在IL6基因的内含子3检测到了一个SNP位点IL6 g.1704674C>T,并建立了针对此位点的PCR-HpaⅡ-RFLP分型技术。性状关联分析发现,猪IL6 g.1704674C>T的多态性与民猪仔猪的抗腹泻能力、断奶重和日增重等性状显著相关,对长白仔猪的出生重存在显著影响。此外,IL6 g.1704674C>T位点也影响杜洛克公猪的射精量和大白公猪的精子密度。这些结果也显示了IL6基因的多种生物学效应,为其在猪中的应用奠定了基础。
| [1] | WEISSENBACH J, CHERNAJOVSKY Y, ZEEVI M, et al. Two interferon mRNAs in human fibroblasts:in vitro translation and Escherichia coli cloning studies[J]. Proc Natl Acad Sci U S A, 1980, 77(12): 7152–7156. DOI: 10.1073/pnas.77.12.7152 |
| [2] | HIRANO T, YASUKAWA K, HARADA H, et al. Complementary DNA for a novel human interleukin (BSF-2) that induces B lymphocytes to produce immunoglobulin[J]. Nature, 1986, 324(6092): 73–76. DOI: 10.1038/324073a0 |
| [3] |
蓝天. 白细胞介素6及下游JAK/STAT3信号通路在前列腺相关疾病中的作用及机制研究[D]. 西安: 第四军医大学, 2011.
LAN T. The functions and mechanism of interleukin-6 and downstream JAK/STAT3 signaling pathway in prostatic diseases[D]. Xi'an:Medical University of the Air Force, 2011. (in Chinese) |
| [4] |
仇小强, 贝春华, 余红平, 等. 广西地区人群IL-6及IL-10单核苷酸多态性与HBV相关肝癌关联研究[J]. 中华流行病学杂志, 2011, 32(5): 510–513.
QIU X Q, BEI C H, YU H P, et al. Study on the relationship between single-nucleotide polymorphisms in IL-6, IL-10 genes and HBV-related hepatocellular carcinoma[J]. Chinese Journal of Epidemiology, 2011, 32(5): 510–513. (in Chinese) |
| [5] | BEK S, NIELSEN J V, BOJESEN A B, et al. Systematic review:Genetic biomarkers associated with anti-TNF treatment response in inflammatory bowel diseases[J]. Aliment Pharmacol Ther, 2016, 44(6): 554–567. DOI: 10.1111/apt.2016.44.issue-6 |
| [6] | BANDAY M Z, BALKHI H M, SAMEER A S, et al. Strong association of interleukin-6-174G/C promoter single nucleotide polymorphism with a decreased risk of colorectal cancer in ethnic Kashmiri population:A case control study[J]. Tumour Biol, 2017, 39(3): 1010428317695940. |
| [7] | MAINTINGUER N M, OKI E, FERREIRA CARIOCA A A, et al. Influence of IL1B, IL6 and IL10 gene variants and plasma fatty acid interaction on metabolic syndrome risk in a cross-sectional population-based study[J]. Clin Nutr, 2017. DOI: 10.1016/j.clnu.2017.02.009.(inPress) |
| [8] | WERNSTEDT I, ERIKSSON A L, BERNDTSSON A, et al. A common polymorphism in the interleukin-6 gene promoter is associated with overweight[J]. Int J Obes Relat Metab Disord, 2004, 28(10): 1272–1279. DOI: 10.1038/sj.ijo.0802763 |
| [9] | TODENDI P F, POSSUELO L G, KLINGER E I, et al. Low-grade inflammation markers in children and adolescents:Influence of anthropometric characteristics and CRP and IL6 polymorphisms[J]. Cytokine, 2016, 88: 177–183. DOI: 10.1016/j.cyto.2016.09.007 |
| [10] | BRUCH J, RETTENBERGER G, LEEB T, et al. Mapping of type I loci from human chromosome 7 reveals segments of conserved synteny on pig chromosomes 3, 9, and 18[J]. Cytogenet Cell Genet, 1996, 73(3): 164–167. DOI: 10.1159/000134331 |
| [11] | KELLY D, O'BRIEN J J, MCCRACKEN K J. Effect of creep feeding on the incidence, duration and severity of post-weaning diarrhoea in pigs[J]. Res Vet Sci, 1990, 49(2): 223–228. |
| [12] | DEN DUNNEN J T, DALGLEISH R, MAGLOTT D R, et al. HGVS recommendations for the description of sequence variants:2016 Update[J]. Hum Mutat, 2016, 37(6): 564–569. DOI: 10.1002/humu.22981 |
| [13] |
苗平, 陆梅生, 张冬青. IL-6/IL-6受体与类风湿关节炎关联性研究新进展[J]. 免疫学杂志, 2011, 27(4): 355–360.
MIAO P, LU M S, ZHANG D Q. Recent progresses of the association research on IL-6/IL-6R and rheumatoid arthritis[J]. Immunological Journal, 2011, 27(4): 355–360. (in Chinese) |
| [14] |
任芳芳. 野生和人工繁育树鼩CD4以及IL-6分子的克隆与分析[D]. 北京: 北京协和医学院, 2015.
REN F F. Cloning and analysis of CD4 and IL-6 in the wild and laboratory tree shrews[D]. Beijing:Peking Union Medical College, 2015. (in Chinese) |
| [15] |
王宇昕. IL-6受体与EGF受体相互作用增强IL-6诱导的STAT3信号转导作用研究[D]. 兰州: 兰州大学, 2013.
WANG Y X. STAT3 activation in response to IL-6 is prolonged by the binding of IL-6R to EGFR[D]. Lanzhou:Lanzhou University, 2013. (in Chinese) |
| [16] |
王希彪, 李建敏, 许愿, 等. 哺乳仔猪腹泻发生时间和程度的品种间差异及对增重的影响[J]. 东北农业大学学报, 2014, 45(9): 79–83.
WANG X B, LI J M, XU Y, et al. Variations between breeds of suckling piglets in diarrhea occurrence time and degree and effect on weight gain[J]. Journal of Northeast Agricultural University, 2014, 45(9): 79–83. (in Chinese) |
| [17] | WALLENIUS V, WALLENIUS K, AHRÉN B, et al. Interleukin-6-deficient mice develop mature-onset obesity[J]. Nat Med, 2002, 8(1): 75–79. DOI: 10.1038/nm0102-75 |
| [18] | SZYDLOWSKI M, BUSZKA A, MACKOWSKI M, et al. Polymorphism of genes encoding cytokines IL6 and TNF is associated with pig fatness[J]. Livest Sci, 2011, 136(2): 150–156. |
| [19] | BAUMGARTEL K L, GROER M W, COHEN S M, et al. Maternal interleukin genotypes are associated with NICU outcomes among low-birth-weight infants[J]. Biol Res Nurs, 2016, 19(1): 36–44. |
| [20] | BOOCKFOR F R, WANG D, LIN T, et al. Interleukin-6 secretion from rat Leydig cells in culture[J]. Endocrinology, 1994, 134(5): 2150–2155. DOI: 10.1210/endo.134.5.8156916 |
| [21] | BRYNIARSKI K, SZCZEPANIK M, PTAK M, et al. Modulation of testicular macrophage activity by collagenase[J]. Folia Histochem Cytobiol, 2005, 43(1): 37–41. |
| [22] | CUDICINI C, KERCRET H, TOUZALIN A M, et al. Vectorial production of interleukin 1 and interleukin 6 by rat sertoli cells cultured in a dual culture compartment system[J]. Endocrinology, 1997, 138(7): 2863–2870. DOI: 10.1210/endo.138.7.5289 |
| [23] | KERN S, ROBERTSON S A, MAU V J, et al. Cytokine secretion by macrophages in the rat testis[J]. Biol Reprod, 1995, 53(6): 1407–1416. DOI: 10.1095/biolreprod53.6.1407 |
| [24] | POTASHNIK H, ELHIJA M A, LUNENFELD E, et al. Interleukin-6 expression during normal maturation of the mouse testis[J]. Eur Cytokine Netw, 2005, 16(2): 161–165. |
| [25] | RIVAL C, THEAS M S, GUAZZONE V A, et al. Interleukin-6 and IL-6 receptor cell expression in testis of rats with autoimmune orchitis[J]. J Reprod Immunol, 2006, 70(1-2): 43–58. DOI: 10.1016/j.jri.2005.10.006 |
| [26] | HAKOVIRTA H, SYED V, JÉGOU B, et al. Function of interleukin-6 as an inhibitor of meiotic DNA synthesis in the rat seminiferous epithelium[J]. Mol Cell Endocrinol, 1995, 108(1-2): 193–198. DOI: 10.1016/0303-7207(95)03475-M |
| [27] |
林文龙. 白细胞介素6与血清生殖激素及精子浓度的相关性分析[J]. 中国计划生育学杂志, 2012, 20(4): 250–252.
LIN W L. Correlation analysis of plasma interleukin 6 level with serum reproductive hormones and sperm concentration[J]. Chinese Journal of Family Planning, 2012, 20(4): 250–252. (in Chinese) |
| [28] | LAFLAMME J, AKOUM A, LECLERC P. Induction of human sperm capacitation and protein tyrosine phosphorylation by endometrial cells and interleukin-6[J]. Mol Hum Reprod, 2005, 11(2): 141–150. DOI: 10.1093/molehr/gah142 |



