精液中病原菌的存在已经成为限制生猪改良及实施联合育种的重要因素之一。部分研究表明, 健康猪精液中不存在细菌[1],目前猪精液中病原菌的来源因素尚未确定,如日常采精器具、稀释液及保存环境等人为过程中缺乏相应的卫生条件[2],尤其是猪自身皮毛、皮肤碎屑、外生殖器及泌尿生殖感染等因素均可能导致精液被细菌污染[3]。另外,猪精液作为一种天然培养基,本身适合细菌及真菌的生长与扩繁,猪精液含有病原菌已经成为较为普遍的现象。因此,随着精液细菌污染的加剧,对猪精液质量以及人工输精利用率产生严重影响,细菌对猪精子的危害已经引起研究者的普遍关注。
不同种属细菌对精子保存过程中的影响程度不同。绿脓杆菌(Pseudomonas aeruginosa)感染猪精子,能造成精子活力参数、质膜完整性显著降低[4],同时发现在顶体素成熟过程中,促进前顶体素转化为顶体素的p32蛋白酪氨酸磷酸化明显降低,出现“似获能”改变的现象[5-6];阴沟肠杆菌(Enterobacter cloacae)处理精子,渗透压、精子质量、质膜完整性均发生显著性改变[7];阴沟肠杆菌(Clostridium perfringens)[8]和大肠杆菌(E.coli)[9]处理精子,与对照组相比,精子形态不存在显著性差异,但活力参数显著降低。表明,猪精液体外保存过程中由于细菌污染致使精子质量特性发生变化,影响猪精子的受精潜能。
细菌污染精液后,引起精子活力的变化已经得到广泛认可,但是有关细菌引起精子生理特性机理研究较少,尤其是精子感染后,自身的生理功能变化相关研究鲜有报道。精液中细菌研究主要集中在精子活力、凋亡及获能等指标变化[6, 10-11];细菌感染精子机理主要涉及细菌利用甘露糖受体黏附精子[12]、分泌溶血素破坏细胞膜[13]和脂质过氧化[14]等方面。对于精子而言,活力能量供应源于糖代谢途径及线粒体氧化磷酸化产生的ATP[15],同时受蛋白磷酸化修饰水平的影响[16]。细菌降低精子活力是否与精子能量代谢、蛋白磷酸化修饰水平有关,目前尚未有相关研究报道。因此,本研究为探究细菌影响精子活力的分子机制,利用不同浓度梯度金黄色葡萄球菌感染精子,在活力参数指标检测基础上,测试猪精子糖代谢GAPDH活性、ATP、cAMP和蛋白磷酸化水平变化,从精子能量代谢、蛋白磷酸化修饰角度阐述金黄色葡萄球菌影响猪精子活力的分子机理。
1 材料和方法 1.1 精液来源及试验设计选取12头上海浦东新区祥欣种猪场中繁殖性能及生长状态良好的杜洛克公猪精液样品,样品精子活力高于80%,密度约为(2~3)×108个·mL-1,37 ℃恒温条件下,2 h内运回实验室进行后续试验。试验分为空白对照组以及添加不同菌落浓度的处理组。所用稀释液为商业稀释液(中牧南京动物药业有限公司),所有样品按照精液:稀释液=1:2体积比稀释,金黄色葡萄球菌处理组中,精液中所含葡萄球菌菌落终浓度分别为103、104、105和106 CFU·mL-1。在17 ℃恒温培养箱中保存,为防止精子在培养瓶底部沉积,每天定时摇匀两次。金黄色葡萄球菌菌种源于猪精液样品分离纯化所得。
1.2 抗体和试剂酪氨酸磷酸化抗体,丝氨酸/苏氨酸磷酸化抗体和二抗购买于CST公司,β-tubulin抗体购自上海欧酷生物科技有限公司,555抗兔荧光二抗、488抗鼠荧光二抗、花生凝集素(PNA)和碘化丙啶(PI)均购自Invitrogen,PVDF膜购自Milipore公司、化学发光液购自GE healthcare公司,其他药品均购自Sigma公司。
1.3 精子活力检测样品于37 ℃水浴锅孵育20 min后,利用CASA检测及分析精子各项活力参数。参数包括精子活力(MOT),快速前向性运动率(PRO),平均路径速度(VAP),平均曲线运动速度(VCL)[17]4个指标,保证每个视野观察精子数不少于200个。
1.4 细胞内GAPDH活性、ATP及cAMP水平检测猪精子细胞经PBS清洗和超声波处理。降解后的精子与GAPDH酶促反应混合液混合,在340 nm下快速读取吸光度值。操作过程中严格按照试剂盒说明书的要求,尽量避免样品被污染。猪精子经PBS清洗及生物性发光ATP检测试剂盒(FLASC,Sigma)检测精子内ATP浓度,提取ATP,并与荧光霉素试剂盒混合后,读取相应吸光度值。根据cAMP化学免疫荧光试剂盒说明书测定精子内cAMP水平。
1.5 SDS-PAGE和Western blot分析蛋白上样量80 μg·孔-1,经10% SDS-PAGE分离后转膜,室温封闭1 h,一抗溶液4 ℃振荡孵育过夜,加入相应的二抗溶液,4 ℃震荡孵育1 h。按照化学发光检测试剂盒说明书配制ECL发光液,均匀覆盖于PVDF膜上,利用ECL发光仪检测结果。以β-tubulin为内参蛋白衡量每个泳道蛋白上样量的一致性,把相应的蛋白膜用Strip缓冲液振荡,TBST漂洗,加入封闭液封闭、一抗(β-tubulin)和相对应的二抗进行孵育,Western blot进行检测。
1.6 细胞免疫荧光分析将样品固定于10%的甲醛中待用。取出固定的样品,用PBS清洗后,均匀涂于准备好的载玻片上,自然风干,用3.7%甲醛室温固定,洗脱液清洗后,加渗透液渗透5 min,洗脱液清洗后,室温封闭,分别加入丝/苏氨酸抗体和酪氨酸磷酸化抗体,孵育后,利用洗脱液清洗,加入555抗兔荧光二抗、488抗鼠荧光二抗和荧光染料(PNA和PI),室温下避光孵育后洗脱,加入抗荧光猝灭剂后封片,激光共聚焦显微镜观察(德国Leica公司TCS SP5,20×)。
1.7 数据分析利用Excel 2013和SPSS软件处理相关数据,进行方差分析,显著性水平为P < 0.05,极显著性水平为P < 0.01。
2 结果 2.1 不同浓度金黄色葡萄球菌对猪精子运动性能的影响不同菌落浓度金黄色葡萄球菌处理对猪精子运动性能影响如图 1所示。结果显示,随着保存天数的延长,精子运动性能指标如MOT、PRO、VAP、VCL均有不同程度的降低。体外17 ℃保存3、5 d时,处理组(103 CFU·mL-1)精子活力参数中能动性(MOT)显著低于对照组能动性(P < 0.05);随着金黄色葡萄球菌浓度的增加,处理组(104、105和106 CFU·mL-1)精子能动性极显著低于对照组能动性(P < 0.01)。与MOT结果相类似,菌落浓度大于104 CFU·mL-1处理组中精子PRO、VAP、VCL等活力参数极显著低于对照组中相关参数(P < 0.01)。结果表明,精子运动性能的降低与细菌存在一定的浓度依赖性,而且随着精子保存时间延长,细菌对精子运动性能的降低效果愈明显。
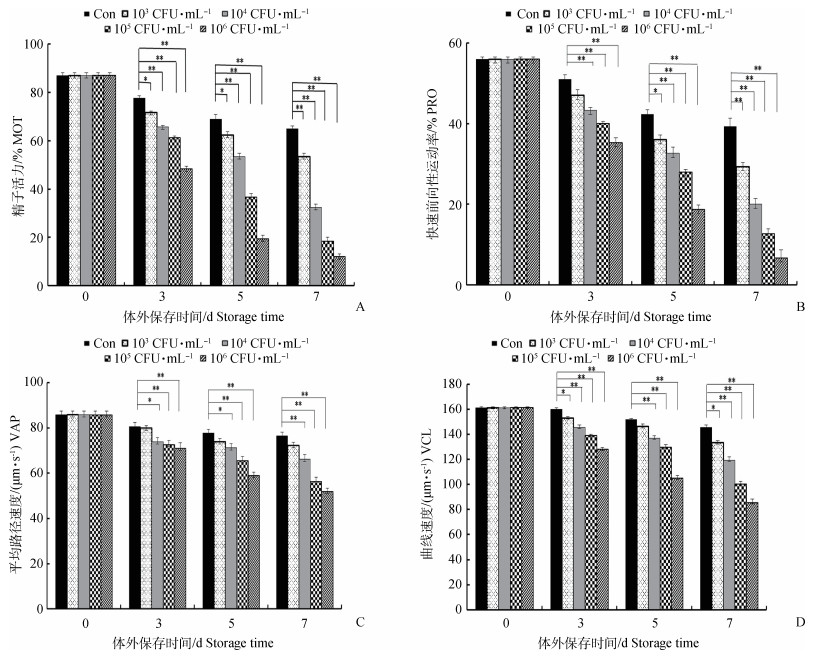
|
*.P < 0.05;**.P < 0.01,n=12,下图同 *.P < 0.05;**.P < 0.01, n=12, The same as below 图 1 不同浓度金黄色葡萄球菌处理对猪精子活力的影响 Figure 1 Effects of different concentrations of S. aureus on boar sperm motility |
猪精子对照组及不同浓度金黄色葡萄球菌处理组精子细胞内ATP水平和GAPDH活性的变化状况见图 2。结果表明,同对照组相比,103 CFU·mL-1处理组精子ATP水平、GAPDH活性均无显著性差异;其他浓度处理组精子ATP水平、GAPDH活性均差异极显著(P < 0.01),而且随着金黄色葡萄球菌浓度的增加,对细胞内ATP水平和GAPDH活性降低愈明显。说明猪精液中金黄色葡萄球菌对精子细胞内ATP供能及参与相关能量代谢供能途径酶活性有重要影响。
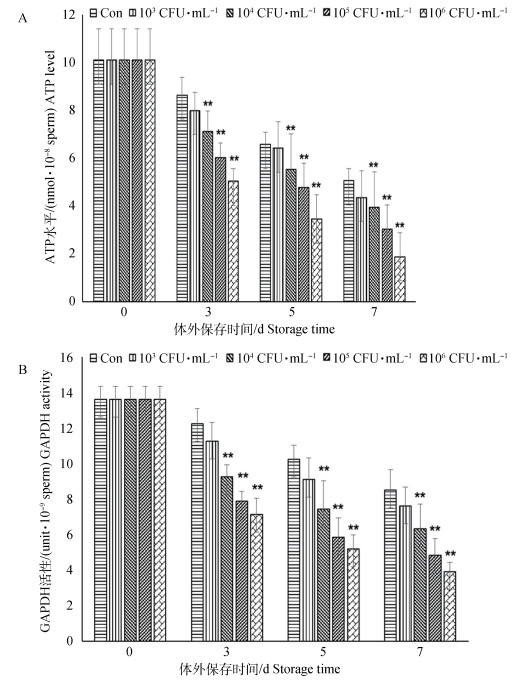
|
图 2 猪精子细胞内ATP水平(A)、GAPDH活性(B)检测 Figure 2 The detection of intracellular ATP level (A), GAPDH activity (B) in boar sperm |
通过不同浓度梯度金黄色葡萄球菌处理猪精子细胞内cAMP水平分析可知(图 3),对照组与103 CFU·mL-1处理组未存在显著性差异;104、105和106 CFU·mL-1处理组均与对照组比差异极显著(P < 0.01),除了同浓度处理组进行天数对比外,随着金黄色葡萄球菌浓度的增加,高浓度处理组与低浓度处理组、对照组之间cAMP含量变化明显。说明金黄色葡萄球菌可能对猪精子获能及繁殖潜能方面产生影响。
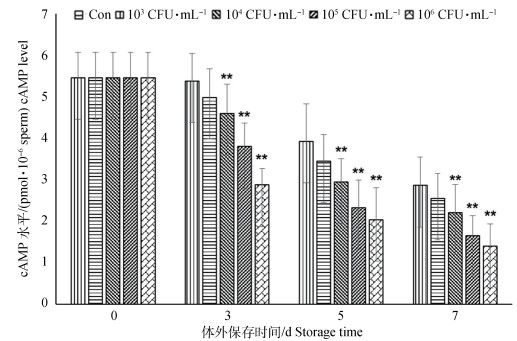
|
图 3 猪精子细胞内cAMP水平检测 Figure 3 The detection of intracellular cAMP level in boar sperm |
金黄色葡萄球菌对猪精子蛋白丝氨酸/苏氨酸、酪氨酸磷酸化水平的变化情况见图 4。图 4A、C结果表明,7 d对照组及处理组蛋白丝氨酸/苏氨酸、酪氨酸磷酸化水平相比,均呈现降低趋势。猪精子蛋白灰度值分析见图 4B、D,纵坐标表示灰度值相对量;全蛋白灰度值/内参灰度值,其中以对照组全蛋白灰度值/内参灰度值为1,其他按照比例计算。图 4B分析结果表明,7 d对照组与处理组蛋白丝氨酸/苏氨酸、酪氨酸磷酸化水平,对照组与处理组(103、104、105、106 CFU·mL-1)之间存在显著性差异;处理组(103 CFU·mL-1)与处理组(104、105、106 CFU·mL-1)存在显著性差异;处理组(104、105 CFU·mL-1)与处理组(106 CFU·mL-1)存在显著性差异(P < 0.05);图 4D表明,对照组与处理组(103、104 CFU·mL-1)之间差异不显著,与处理组(105、106 CFU·mL-1)之间存在显著性差异;处理组(103、104 CFU·mL-1)与处理组(105、106 CFU·mL-1)之间存在显著性差异(P < 0.05)。由此说明金黄色葡萄球菌可以明显抑制蛋白丝氨酸/苏氨酸、酪氨酸磷酸化水平,并呈现浓度依赖趋势,对猪精子获能造成不可逆破坏作用。
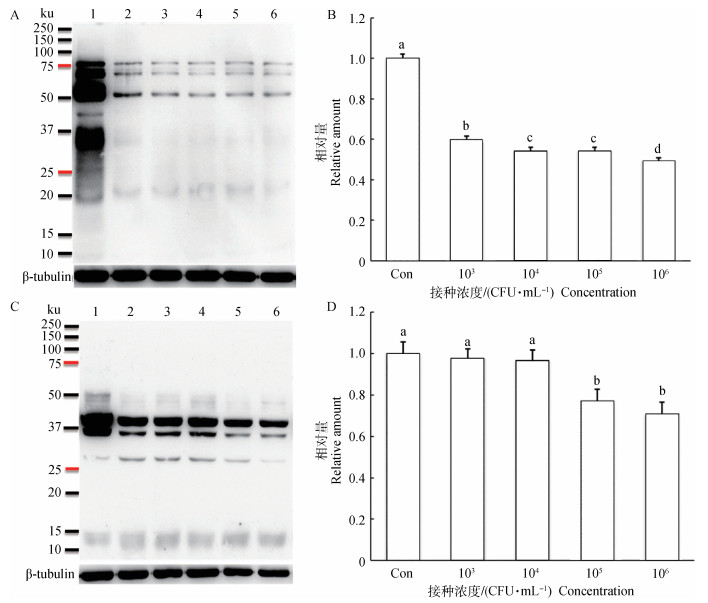
|
不同字母表示差异显著(P < 0.05);1~6号泳道依次分别为蛋白质marker, 对照组、103、104、105、106 CFU·mL-1猪精子蛋白SDS-PAGE Different letters represent the significant difference (P < 0.05); lanes 1 to 6. Protein marker, control group, 103, 104, 105 and 106 CFU·mL-1 boar sperm protein SDS-PAGE 图 4 猪精子蛋白丝氨酸/苏氨酸(A)、酪氨酸(C)磷酸化水平检测及对应比较分析(B、D)(n=8) Figure 4 Boar sperm protein serine/threonine (A), tyrosine (C) phosphorylation levels and the corresponding comparative analysis (B, D) (n=8) |
精子细胞免疫荧光技术分析磷酸化蛋白的细胞亚组分定位见图 5。丝/苏氨酸磷酸化水平分布在精子头部的核后区及鞭毛区,酪氨酸磷酸化水平主要集中在精子头部赤道段和鞭毛区。7 d对照组丝/苏氨酸磷酸化(图 5A),酪氨酸磷酸化(图 5B)分别与7 d 106 CFU·mL-1丝/苏氨酸磷酸化(图 5C),酪氨酸磷酸化(图 5D)相比较,结果表明,经过金黄色葡萄球菌处理后,猪精子头部核后区、赤道段及鞭毛区部位会受到明显抑制作用。
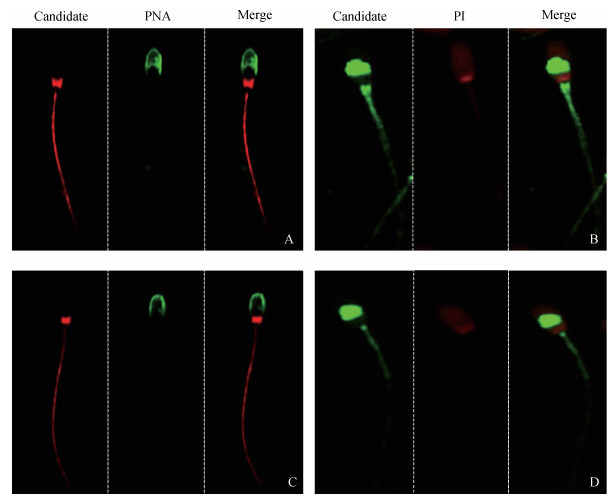
|
A、B.7 d对照组精子,C、D.7 d 106 CFU·mL-1金黄色葡萄球菌处理组精子;Candidate.目标蛋白;PNA.标记顶体;PI.标记精子细胞核; Merge.合并图 A, B.7 d control group of sperm; C, D. 7 d 106 CFU·mL-1 Staphylococcus aureus treatment group of sperm; Candidate. Target protein; PNA. Localization of acrosome; PI. Sperm nucleic was determined; Merge.Combined diagram 图 5 猪精子蛋白丝氨酸/苏氨酸(A、C)、酪氨酸(B、D)磷酸化蛋白免疫荧光定位(n=8)(40×10) Figure 5 Localization of serine/threonine (A, C) and tyrosine (B, D) phosphorylated protein immunofluorescence in boar sperm (n=8) (40×10) |
哺乳动物精子活力的维持主要依靠代谢提供能量,同时受自身结构蛋白磷酸化修饰水平的影响。在精子能量代谢过程中,关键酶活性可以直接影响ATP的生成,进一步调控精子活力;蛋白磷酸化与精子活力存在直接联系,同时影响获能与顶体反应。猪精液中细菌影响精子活力参数、顶体完整性等常规性指标,对精子受精潜能产生一定的影响[18]。细菌感染精子导致活力显著降低是目前公认的结论,然而有关精子受金黄色葡萄球菌感染后自身活力降低的分子机制尚未明确。因此,结合精子被感染后自身生理功能的变化,笔者推测,金黄色葡萄球菌可能对精子能量代谢和蛋白修饰有重要影响,从而导致精子运动性能明显下降。为了验证这一推测,本研究首次从活力、能量代谢、蛋白磷酸化修饰3方面,重点分析金黄色葡萄球菌影响精子能量代谢与自身蛋白磷酸化修饰水平变化,深入探究金黄色葡萄球菌降低精子活力的分子机理。
研究表明,精子ATP主要来源于糖酵解与线粒体氧化磷酸化两个途径,其中糖代谢参与调控精子活力、获能及顶体反应等生理功能,主要为精子头部、主段及尾段提供能量;氧化磷酸化过程集中在中段区域线粒体,主要为精子中段提供能量[19]。本研究对不同浓度的处理组精子的ATP水平、糖代谢GAPDH活性进行分析测试。结果表明,ATP含量随着细菌浓度增加显著降低,同时与精子活力的降低趋势基本保持一致,由此证实,细菌含量与精子活力、ATP水平存在显著负相关。而在糖代谢过程中GAPDH活性常作为糖酵解评估检测的主要指标,细胞免疫荧光技术定位GAPDH基因主要位于精子尾段纤维鞘,敲除小白鼠GAPDH基因后,其精子活力与生育力显著降低[20]。本研究结果显示,不同细菌浓度处理组精子GAPDH活性变化趋势与ATP水平相似,且随着细菌含量的增加其活性降低更加明显。在金黄色葡萄球菌作用下,猪精子GAPDH活性降低,致使糖代谢过程中ATP的生成减少,进一步说明可能是导致精子活力降低的主要原因。对于线粒体氧化磷酸化供能而言,有必要系统分析验证相关蛋白翻译后修饰水平及电子传递链等过程。
在猪精子获能过程中发现,蛋白磷酸化与精子活力之间联系紧密,蛋白磷酸化水平的变化与其对应的精子各项活力参数指标存在相似变化趋势[21-22],表明,细菌造成精子活力降低与蛋白磷酸化水平密不可分。采用假单胞菌在38.5 ℃,5% CO2体外培养精子3 h,发现精子p32蛋白酪氨酸磷酸化修饰水平显著降低,调节精子获能与受精作用。蛋白磷酸化与精子活力存在直接联系,其中酪氨酸磷酸化是精子获能的标志性事件,同时伴随超激活运动与顶体反应[23],其遵循sAC-cAMP-PKA信号通路,由环化腺苷酸酶(sAC)催化ATP生成cAMP,随后cAMP作为第二信使引发一系列级联反应[24]。因此,随着体外保存条件的延长,细菌对精子全蛋白修饰水平改变程度会加剧。本研究结果表明,随着细菌浓度增加,精子蛋白丝氨酸/苏氨酸及酪氨酸磷酸化水平均显著下调,提示金黄色葡萄球菌对猪精子的获能及受精潜能方面存在严重危害。细菌降低精子活力是否严格遵循sAC-cAMP-PKA信号通路仍有待于进一步确定,所以,本研究经后续cAMP含量检测,再次验证了金黄色葡萄球菌降低精子活力可能遵循sAC-cAMP-PKA信号通路。
本研究结果表明,金黄色葡萄球菌通过抑制糖代谢酶GAPDH活性,减少ATP的生成进而降低精子活力,同时,作用于精子细胞头部核后区、赤道段及鞭毛区相关蛋白,对应蛋白磷酸化修饰水平与cAMP-PKA精子获能信号通路密切相关,最终降低猪精子活力。对于下游蛋白磷酸化修饰水平的抑制,笔者推测糖代谢过程ATP减少导致蛋白磷酸化的降低;金黄色葡萄球菌通过广泛抑制酶活性,包括影响腺苷酸环化酶(sAC)活性抑制磷酸化。根据金黄色葡萄球菌感染精子的结果,笔者从能量代谢和自身蛋白磷酸化方面出发,结合GAPDH活性、ATP及cAMP水平测定,展示金黄色葡萄球菌抑制精子活力的相关分子机理,以期该作用机理的提出从能量代谢与蛋白修饰方面为精液体外保存奠定一定理论基础。
4 结论本研究首次从能量代谢与自身蛋白磷酸化修饰的角度对金黄色葡萄球菌感染精子的分子机理进行阐述。金黄色葡萄球菌通过抑制精子细胞头部核后区、赤道段及鞭毛区,降低糖代谢过程中GAPDH活性,抑制ATP的生成,进而降低精子活力等特性。同时结合精子能量代谢方面,发现自身蛋白磷酸化修饰水平降低精子活力,尤其是磷酸化遵循的sAC-cAMP-PKA经典信号通路,推测ATP的减少或sAC活性降低,进一步抑制精子活力、获能与超激活运动。
| [1] | ALTHOUSE G C, LU K G. Bacteriospermia in extended porcine semen[J]. Theriogenology, 2005, 63(2): 573–584. DOI: 10.1016/j.theriogenology.2004.09.031 |
| [2] | ALTHOUSE G C, KUSTER C E, CLARK S G, et al. Field investigations of bacterial contaminants and their effects on extended porcine semen[J]. Theriogenology, 2000, 53(5): 1167–1176. DOI: 10.1016/S0093-691X(00)00261-2 |
| [3] | MAROTO MARTÍN L O, MUÑOZ E C, DE CUPERE F, et al. Bacterial contamination of boar semen affects the litter size[J]. Anim Reprod Sci, 2010, 120(1-4): 95–104. DOI: 10.1016/j.anireprosci.2010.03.008 |
| [4] | SEPÚLVEDA L, BUSSALLEU E, YESTE M, et al. Effects of different concentrations of Pseudomonas aeruginosa on boar sperm quality[J]. Anim Reprod Sci, 2014, 150(3-4): 96–106. DOI: 10.1016/j.anireprosci.2014.09.001 |
| [5] | DONG H T, SHI W S, TIAN Y, et al. Expression and tyrosine phosphorylation of sp32 regulate the activation of the boar proacrosin/acrosin system[J]. Genet Mol Res, 2015, 14(1): 2374–2383. DOI: 10.4238/2015.March.27.23 |
| [6] | SEPÚLVEDA L, BUSSALLEU E, YESTE M, et al. Effect of Pseudomonas aeruginosa on sperm capacitation and protein phosphorylation of boar spermatozoa[J]. Theriogenology, 2016, 85(8): 1421–1431. DOI: 10.1016/j.theriogenology.2015.12.025 |
| [7] | PRIETO-MARTÍNEZ N, BUSSALLEU E, GARCIA-BONAVILA E, et al. Effects of Enterobacter cloacae on boar sperm quality during liquid storage at 17℃[J]. Anim Reprod Sci, 2014, 148(1-2): 72–82. DOI: 10.1016/j.anireprosci.2014.05.008 |
| [8] | SEPÚLVEDA L, BUSSALLEU E, YESTE M, et al. How do different concentrations of Clostridium perfringens affect the quality of extended boar spermatozoa?[J]. Anim Reprod Sci, 2013, 140(1-2): 83–91. DOI: 10.1016/j.anireprosci.2013.04.013 |
| [9] | BUSSALLEU E, YESTE M, SEPU'LVEDA L, et al. Effects of different concentrations of enterotoxigenic and verotoxigenic E. coli on boar sperm quality[J]. Anim Reprod Sci, 2011, 127(3-4): 176–182. DOI: 10.1016/j.anireprosci.2011.07.018 |
| [10] | FRACZEK M, HRYHOROWICZ M, GACZARZEWICZ D, et al. Can apoptosis and necrosis coexist in ejaculated human spermatozoa during in vitro semen bacterial infection?[J]. J Assist Reprod Genet, 2015, 32(5): 771–779. DOI: 10.1007/s10815-015-0462-x |
| [11] | DIEMER T, HUWE P, MICHELMANN H W, et al. Escherichia coli-induced alterations of human spermatozoa. An electron microscopy analysis[J]. Int J Androl, 2000, 23(3): 178–186. DOI: 10.1046/j.1365-2605.2000.00224.x |
| [12] | WOLFF H, PANHANS A, STOLZ W, et al. Adherence of Escherichia coli to sperm:a mannose mediated phenomenon leading to agglutination of sperm and E. coli[J]. Fertil Steril, 1993, 60(1): 154–158. DOI: 10.1016/S0015-0282(16)56054-3 |
| [13] | QIANG H, JIANG M S, LIN J Y, et al. Influence of enterococci on human sperm membrane in vitro[J]. Asian J Androl, 2007, 9(1): 77–81. DOI: 10.1111/ajan.2007.9.issue-1 |
| [14] | FRACZEK M, SZUMALA-KAKOL A, JEDRZEJCZAK P, et al. Bacteria trigger oxygen radical release and sperm lipid peroxidation in in vitro model of semen inflammation[J]. Fertil Steril, 2007, 88(Suppl 4): 1076–1085. |
| [15] | DU PLESSIS S S, AGARWAL A, MOHANTY G, et al. Oxidative phosphorylation versus glycolysis:what fuel do spermatozoa use?[J]. Asian J Androl, 2015, 17(2): 230–235. DOI: 10.4103/1008-682X.135123 |
| [16] | JHA K N, SHIVAJI S. Protein serine and threonine phosphorylation, hyperactivation and acrosome reaction in in vitro capacitated hamster spermatozoa[J]. Mol Reprod Dev, 2002, 63(1): 119–130. DOI: 10.1002/(ISSN)1098-2795 |
| [17] | ZHEN L Q, WANG L R, FU J L, et al. Hexavalent chromium affects sperm motility by influencing protein tyrosine phosphorylation in the midpiece of boar spermatozoa[J]. Reprod Toxicol, 2016, 59: 66–79. DOI: 10.1016/j.reprotox.2015.11.001 |
| [18] | KUSTER C E, ALTHOUSE G C. The impact of bacteriospermia on boar sperm storage and reproductive performance[J]. Theriogenology, 2016, 85(1): 21–26. DOI: 10.1016/j.theriogenology.2015.09.049 |
| [19] | MUKAI C, OKUNO M. Glycolysis plays a major role for adenosine triphosphate supplementation in mouse sperm flagellar movement[J]. Biol Reprod, 2004, 71(2): 540–547. DOI: 10.1095/biolreprod.103.026054 |
| [20] | MIKI K, QU W D, GOULDING E H, et al. Glyceraldehyde 3-phosphate dehydrogenase-S, a sperm-specific glycolytic enzyme, is required for sperm motility and male fertility[J]. Proc Natl Acad Sci U S A, 2004, 101(47): 16501–16506. DOI: 10.1073/pnas.0407708101 |
| [21] | OH S A, PARK Y J, YOU Y A, et al. Capacitation status of stored boar spermatozoa is related to litter size of sows[J]. Anim Reprod Sci, 2010, 121(1-2): 131–138. DOI: 10.1016/j.anireprosci.2010.05.019 |
| [22] | MATÁS C, SANSEGUNDO M, RUIZ S, et al. Sperm treatment affects capacitation parameters and penetration ability of ejaculated and epididymal boar spermatozoa[J]. Theriogenology, 2010, 74(8): 1327–1340. DOI: 10.1016/j.theriogenology.2010.06.002 |
| [23] | URNER F, SAKKAS D. Protein phosphorylation in mammalian spermatozoa[J]. Reproduction, 2003, 125(1): 17–26. DOI: 10.1530/rep.0.1250017 |
| [24] | VISCONTI P E. Understanding the molecular basis of sperm capacitation through kinase design[J]. Proc Natl Acad Sci U S A, 2009, 106(3): 667–668. DOI: 10.1073/pnas.0811895106 |



