2. 河北科技师范学院动物科技学院, 昌黎 066600
2. The Animal Science Department of Hebei Normal University of Science and Technology, Changli 066600, China
提高饲料转化率,降低饲料成本是目前我国家禽育种的重要目标之一。饲料转化效率的提高涉及饲料、品种、环境等多种因素。其中,营养物质在肝中的转化是影响饲料营养在机体内吸收利用的一个重要因素。
肝是机体物质代谢的主要器官,动物的生长发育、物质代谢都与肝代谢途径相关。家禽脂肪的合成、转运及相关脂质代谢都是在肝中进行的[1]。肝合成的大部分脂肪以极低密度脂蛋白形式转运到肝外,作为卵黄前体物质沉积到卵泡中[2]。经肠道吸收的营养物质,通过肝转化促进机体生长和满足产蛋的营养需要,因此,研究鸡肝内代谢过程对饲料转化率(Feed conversion ratio, FCR)的影响就显得尤为重要。有研究表明,鸡产蛋后的饲料转化率比产蛋前有了明显的提高[3]。近几年,已在鸡染色体上检测到了37个与采食量(FI),进食净效应(RFI)和FCR有关的数量性状位点(Quantitative trait locus, QTL)[4]。然而,由于较差的连锁分析能力与生物学候选基因的检测偏差,导致这些QTL和候选基因的研究仍然不足[5-6]。因此,本试验选择产蛋前1周与产蛋后1周试验鸡的体重、小肠长度和吸收面积等性状相对稳定的白来航鸡作为研究对象,检测其不同时期的肝转录组,获得影响营养物质代谢相关的功能基因,为提高饲料利用率提供进一步的相关数据。
近年来,RNA测序技术发展迅速。该技术可以用前所未有的分辨率和敏感度来量化基因表达水平,并且在全基因组水平上进行详细的转录本分析[7-8]。与传统的测序技术相比较,RNA-seq有一些明显的优势,如更宽动态范围的表达水平,更高的准确性和再现性,较低的背景噪音和侦测新的转录本的能力[8-10]。
本研究应用RNA-seq技术测定了白来航蛋鸡产蛋前后肝转录组表达,获得鸡产蛋前后2个时期肝的高质量RNA-seq数据,采用多种生物信息学手段,分析了这2个时期与肝功能相关基因的差异表达,得出影响肝物质代谢变化的基因和它们所涉及的代谢通路的同时,尽可能挖掘出与FCR表型相关的功能基因,为提高饲料利用率提供进一步的帮助。
1 材料与方法 1.1 样品选择与组织获取试验鸡群由白来航母雏组成20个全同胞家系,每个家系至少包括6只母鸡,共132只。为了尽可能降低环境和饲料营养因素对肝基因表达的影响,本研究对试验鸡采取全期单笼饲养,自由饮水和采食,全程所有试验鸡饲喂相同饲料。饲料营养水平兼顾蛋鸡青年期和产蛋期饲料的营养需要。经抽检分析,其实际营养成分为:水分12.98%、粗灰分9.65%、粗蛋白18.56%、粗纤维3.87%、粗脂肪2.67%、钙1.92%、磷0.73%。从14周开始,每日记录个体采食量,每周定时称量试验鸡体重(Body weight, BW),以个体为单位,记录首次产蛋日期,并随后详细记录每次产蛋时间和蛋重(Egg weight, EW),所有数据用于计算个体的饲料转化率。
试验鸡选取从第17周开始,并以全同胞为单位。首先,根据鸡腹部的容积和鸡冠的发育状况来选取符合产蛋前1周外部特征的试验鸡。然后剖检观察其卵巢中卵泡的发育情况,同时测定其相关生长数据,如果卵泡直径在4~6 mm之间,则可以确定此试验鸡处于产前1周的生理时期。产蛋后1周的生理时期以试验鸡产蛋个体的第一个产蛋日来推定。根据此判断方法,从剖检的数据中选取符合这2个生理时期的试验鸡肝样品各15个,并选择其相对应的生长数据用于统计分析。
将试验鸡进行静脉采血,离心获得的血清用于激素的测定;然后取其肝组织保存于液氮中,用于后续总RNA的提取。为了尽量避免个体差异,不仅用了全同胞试验设计,而且从冗余的产蛋前1周样本中选取最符合这一生理时期的3个样本作为生物学重复,同时选取其全同胞处于产蛋后1周相应的3个个体的肝样本。这样共选取6只鸡的肝总RNA样品进行转录组测序研究。
1.2 RNA提取、文库构建和测序取1 g冻存肝样品置于盛有液氮的研钵中,研磨至粉末状。约取300 mg粉末样品置于预加Trizol裂解液的2 mL离心管中,按照Trizol(Tiangen公司,中国)使用说明进行总RNA的提取。对每个RNA样品进行质量检验后,采用Tru-seq RNA样品制备试剂盒(Illumina公司,美国)对样品进行测序的前期处理。主要步骤:(1) 将含有oligo-dT的磁珠与mRNA上的Ploy-A结合纯化出mRNA,然后用化学试剂加高温的方法片段化mRNA,得到150 bp左右的片段;(2) 合成双链cDNA并对DNA双末端进行修复,为了保证DNA片段和接头能够通过“A”“T”互补配对连接,将DNA片段3′端引入“A”碱基;(3) 用AMpureXP磁珠(Beckman Coulter公司,美国)纯化连接产物。(4) 用核酸染料Pico green(Thermo Fisher, 美国)和荧光分光光度计对扩增的DNA文库进行定量后,使用Agilent2100生物分析仪(Agilent公司,美国)对PCR富集片段进行质量控制;(5) 将得到的DNA文库稀释定量至4~5 pmol·L-1,采用Illumina NextSeq500测序仪(Illumina公司,美国)进行测序。
1.3 原始数据处理及分析为了减少原始数据中低质量序列信息对后续分析的影响,按照去除片段接头序列、长度小于50 bp序列、序列中含有不定碱基和平均质量小于Q20的低质量序列等数据过滤标准处理原始数据。将过滤后得到的高质量序列数据用在线软件FastQC(http://www.bioinformatics.babraham.ac.uk/project/fastqc/)进行质控分析,同时将过滤后的序列片段比对到Ensembl数据库公布的鸡基因组上(ftp://ftp.ensembl.org/pub/release-79/fasta/gallus_gallus/dna/), 使用分析软件tophat2(http://tophat.cbcb.umd.edu)将比对到基因组上的序列片段进行分析。基因组上用RPKM法(Reads Per Kilobase per Million mapped reads, RPKM)计算基因的表达水平。通过HTSeq(http://www.huber.embl.de/users/anders/HTSeq)统计比对到基因组上的数值,然后通过DESeq(http://www.huber.embl.de/users/anders/DESeq)分析表达差异基因,使用Benjamini-Hochberg方法控制在RNA测序中产生的基因错误率(False discovery rate, FDR),将得到的P值按倍数检测调整[11]。分析2组中所有差异表达的基因,表达水平差异在2倍以上且P-value<0.05、padj≤1范围内的基因被确定为表达差异显著基因。同时,应用R软件(http://www.r-project.org)对部分差异表达基因进行整体表达量的绘制与分析。然后将差异表达基因进行GO功能与KEGG代谢途径分析。
2 结果 2.1 肝转录组差异表达分析本研究获得了产蛋前后1周肝表达的2个转录本,测序得到转录本序列质量较高,其中测序序列可以定位在鸡基因组上的序列数均值分别为33 379 083和31 689 886条,且净序列在所测得的序列中所占比例分别是98.96%和98.93%。
在产蛋前后的2个时期共鉴定出15 508个基因。经RPKM值得出的基因表达量结果显示(图 1),在产蛋前后差异表达基因有222个(P<0.05,表达差异大于2倍)。其中,与产蛋前1周相比较,产蛋后1周有147个基因表达显著上调,75个基因表达显著下调。
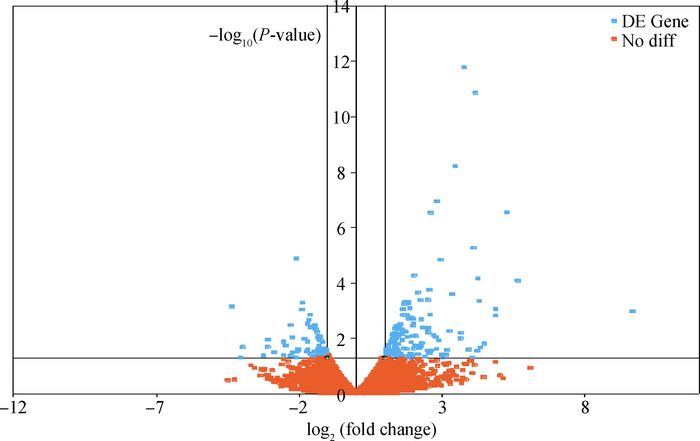
|
蓝色散点是差异表达基因,橙色散点是非差异表达基因 Blue scatter dots are differentially expressed genes; Orange scatter dots aren't differentially expressed gene 图 1 差异表达基因火山图 Figure 1 The volcano plot of differentially expressed genes |
对222个差异表达基因进行表达差异筛选后,得出表达量变化最大的20个基因,包括产蛋后比产蛋前上调表达的10个基因和下调表达的10个基因(表 1)。通过对20个差异基因的聚类分析得出(图 2),产蛋前后的6个个体共聚为2类。其中,上调表达的基因主要有RNF186、VTG1和FABP3等,涉及了脂蛋白的生成、脂肪酸浓度的调节等功能,下调表达的基因主要有LPL、CETP和ACSL6等基因,它们大部分都参与了细胞内脂肪的合成和转运,在脂肪代谢中起到重要作用。
|
|
表 1 产蛋前后1周差异表达变化的前20个基因 Table 1 Top 20 differentially expressed genes before and after laying eggs |
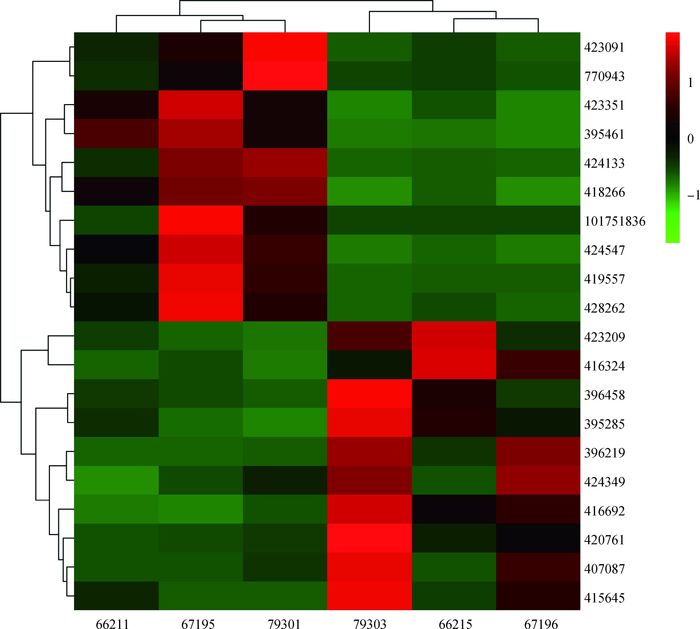
|
79303、66215和67196是产蛋前1周的肝样本;79301、67195和66211是产蛋后1周的肝样本。图右侧的数字为基因编号 The liver samples of one week before laying are 79303, 66215 and 67196; 79301, 67195 and 66211 are the liver samples of one week after laying. The numbers on the right side of the heatmap are gene ID 图 2 20个差异表达基因热图 Figure 2 The heatmap of 20 differentially expressed genes |
GO富集分析是将所得的基因与GOslim数据库进行比对,得到基因的功能注释信息。GO数据库包括3个一级功能数据库,分别是:细胞组分(Cellular component, CC)数据库、分子功能(Molecular function, MF)数据库和生物学过程(Biological process, BP)数据库。
为了研究差异表达显著基因的功能相关性,将222个差异表达基因与整个基因组表达背景进行比较。最终确定了103个GO功能分类项,涉及细胞分化、细胞增殖等功能,显著富集的功能分类主要有5项,即生物过程、脂代谢过程、转运、细胞外间隙和脂质结合。其中,生物过程、脂质代谢和转运属于生物学过程类别中,它们的差异表达基因占总差异表达基因数的比例分别为8.35%、1.10%和3.35%;细胞外间隙属于细胞组分类别中,其差异表达基因比例是0.88%;在分子功能类别中,脂质结合的差异表达基因比例为0.77%(图 3)。
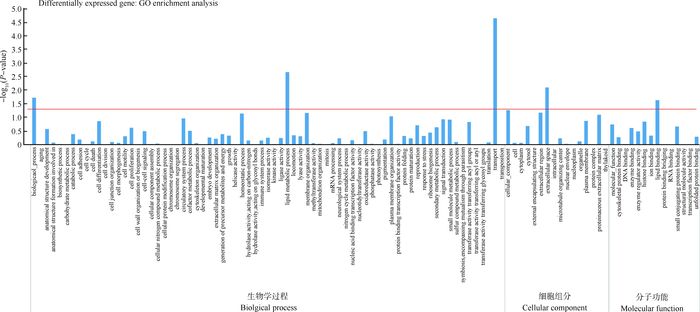
|
横轴为基因GO功能分类,纵轴为超几何分布计算的富集度显著性P-value,红线代表P-value = 0.05 The horizontal axis is the GO functional classification, the vertical axis is the hypergeometric distribution of the degree of enrichment of P-value, redline representsP-value=0.05 图 3 GO富集分析柱状图 Figure 3 GO enrichment analysis histogram |
KEGG是从基因和分子水平上理解生物系统高级功能的公用数据库资源,如细胞和有机体等。KEGG Pathway数据库主要分为代谢、遗传信息过程、环境信息过程和细胞过程组织系统和人类疾病等6大代谢通路。
经KEGG通路分析,差异表达基因共涉及31条代谢途径。其中,在新陈代谢通路中,主要富集脂质代谢和氨基酸代谢2条代谢途径(P<0.05)。它们的差异表达基因占总差异表达基因数的比例分别为9.52%和8.73%,消化系统代谢途径富集在生物系统通路中,其差异表达基因所占比例是7.14%(图 4)。
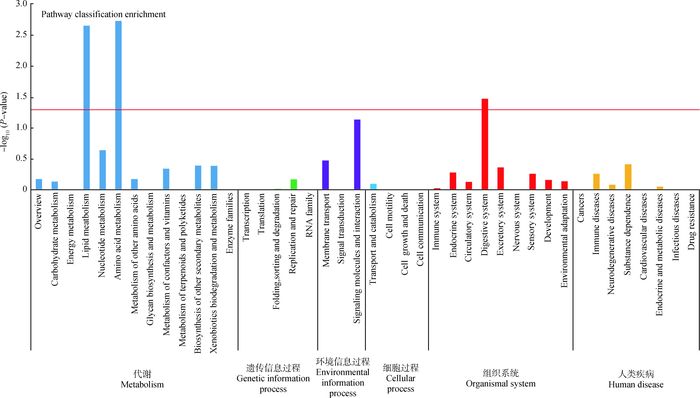
|
横轴为KEGG通路,纵轴为超几何分布计算的富集度显著性P-value,红线代表P-value=0.05 The horizontal axis is the KEGG pathway, the vertical axis is the hypergeometric distribution of the degree of enrichment of P-value, redline represents P-value=0.05 图 4 KEGG富集分析柱状图 Figure 4 KEGG enrichment analysis histogram |
在脂质代谢的脂肪酸降解途径中,长链脂酰CoA合成酶(Acyl-CoA synthetase long-chain, ACSL)[EC:6.2.1.3]在产蛋前表达量是产蛋后的5.78倍(经产蛋前后基因的表达量计算得到)。长链脂酰CoA合成酶是脂肪酸降解途径中的关键酶,在信号通路中具有双向作用,一方面参与催化脂肪酸的合成;另一方面催化合成脂酰CoA。
在脂肪消化与吸收的途径中,ATP结合盒亚家族G成员5基因(ATP binding cassette subfamily G member 5, ABCG5) 在产蛋前1周的表达量为产蛋后1周表达量的2.24倍。而载脂蛋白B-48(Apolipoprotein B-48, ApoB-48) 基因则在产蛋后1周显著上调表达3.25倍。
动物体内的色氨酸主要有2条代谢途径:一条是5-羟色胺代谢途径,另一条是复杂的犬尿氨酸代谢途径[12]。色氨酸代谢途径中,共有4个差异表达基因影响这条通路。
其中,单胺氧化酶(Monoamine oxidase, MAO)基因在产蛋前的表达量(1 901拷贝)显著高于产蛋后一周的表达量(834拷贝)。细胞色素P450(Cytochrome P450, family 1, subfamily A, polypeptide 1, CYP1A1) 基因在产蛋前和产蛋后1周的表达量分别为5 130和1 635拷贝。他们在色氨酸的代谢途径中分别起到催化喹啉类衍生物和吲哚类衍生物的合成与褪黑素转化生成6-羟褪黑素的作用。
在色氨酸代谢途径中,间接促进烟酰胺代谢的是3-羟基酸双加氧酶(3-hydroxyanthranilate 3, 4-dioxygenase, HAAO)[EC:1.13.11.6]和促进苯甲酸降解的氨基羧基粘康酸半醛脱羧酶(Akaomino carboxymuconate semialdehyde decarboxylase, ACMSD)[EC:4.1.1.45]。这2个基因在产蛋后的表达量相对于产蛋前有显著的提高,分别提高了2.19和5.09倍。
3 讨论本研究分析白来航蛋鸡在产蛋前后肝中的基因表达差异,可以得出肝在这2个不同生理时期表达发生变化的具体基因,以及由它们引起的营养物质代谢的生理功能发生的变化,还可以了解肝细胞在这些物质代谢功能转化过程中的分子机制。我们对鸡首次产蛋前后的肝转录组差异表达基因进行了功能注释分析,发现一些差异表达基因参与了脂质代谢和色氨酸代谢等生理过程。
本研究获得的差异显著的序列与NCBI数据库对比获得基因注释。环指蛋白186是在产蛋后上调最显著的基因,其表达量比产蛋前1周上升了823.87倍。环指蛋白186是典型的C3HC4型环状结构的小分子蛋白,基因结构具有较高的保守性,这表明它可能在基本的生物学功能方面发挥重要作用[13]。环指蛋白186大部分存在于高等哺乳动物的组织和细胞中,且在人的小肠及肾组织中表达相对较高[14]。有报道指出,环指蛋白186可以显著引起内质网应激通路中一些关键蛋白的表达上调,使细胞质中的Ca2+浓度增加,导致细胞内代谢紊乱或诱发细胞凋亡等生理现象[15]。目前,在家禽营养代谢领域并未发现有该基因功能研究的相关报道。本研究结果表明,环指蛋白186基因在鸡产蛋后的显著上调可能影响到肝细胞内质网的应激反应,其涉及到的代谢功能在产蛋前后可能产生较大的变化。因此,该基因在肝细胞中相关功能的进一步研究可能会在家禽产蛋的营养代谢方面带来新的发现。
家禽脂肪酸合成主要是在肝中进行,体脂肪的积累过程均表现出合成迅速和积累量增大等特点。在产蛋后1周下调最显著的脂蛋白脂肪酶(LPL)基因是机体内脂肪沉积的重要参与者。动物各组织脂肪的沉积能力不仅由脂肪的合成与分解速率决定,还取决于脂肪酸与甘油三酯的转运速度。而脂蛋白脂肪酶在脂肪酸和甘油三酯的转运中起着关键的调节作用,其通常会以同源二聚体的形式发挥甘油三酯水解酶的作用并在受体介导的脂蛋白摄入时作为配体或桥接因子[16]。有报道显示,脂蛋白脂肪酶是水解极低密度脂蛋白中甘油三酯(TG)的主要酶,是参与脂肪代谢的关键酶[17]。本研究发现,在产蛋后,脂蛋白脂肪酶出现了明显的下调,降低了脂肪分解速率。此结果表明,在产蛋后1周脂蛋白脂肪酶的下调可以维持或增加其体内适量的脂肪含量,从而满足卵黄等营养物质形成的需要。
在脂质代谢过程中,参与脂质代谢的差异表达基因有7个,分别是:细胞色素P450亚1家族多肽1(Cytochrome P450, family 1, subfamily A, polypeptide 1, CYP1A1)、脂蛋白脂肪酶(Lipoprotein lipase, LPL)、膜结合酰基转移酶域1/2(Membrane bound O-acyltransferase domain containing 2 1/2, MBOAT1_2)、前列腺素D2合成酶21kda (Prostaglandin D2 synthase 21kDa, PTGDS)、焦磷酸酶7 (Ectonucleotide pyrophosphatase, ENPP7)、分泌型磷脂酶A2(Secretory phospholipase A2, PLA2) 和长链脂酰CoA合成酶(Acyl-CoA synthetase long-chain, ACSL)。它们涉及脂肪酸降解、类固醇激素合成、甘油酯代谢和醚酯类代谢等9条代谢通路。其中,分泌型磷脂酶A2(PLA2) 在磷脂的消化和新陈代谢、宿主的防御和信号转导过程中发挥重要的作用,PLA2G12A是分泌型磷脂酶A2(PLA2) 家族中的一种分泌型磷脂酶,涉及到甘油脂类、花生四烯酸代谢等5条通路,但其主要功能目前仍不明确。分泌型磷脂酶A2的另一个分泌磷脂酶PA2G12B能使血清中的胆固醇、HLD胆固醇以及积累在肝中的脂滴有所降低[18]。长链脂酰CoA合成酶(ACSL)基因家族中的长链脂酰CoA合成酶1(ACSL1) 在与能量代谢有关的组织细胞中,如肝、肌肉和脂肪中表达量较高,是合成甘油三酯提供脂酰CoA底物的最重要的基因[19]。提高长链脂酰CoA合成酶1(ACSL1) 的表达量能够增加细胞内脂肪的沉积量[20]。载脂蛋白B-48是低密度脂蛋白中一个主要结构蛋白,富含胆固醇和甘油三酯。该蛋白对能量的吸收和繁殖性能有重要作用,能直接或间接参与脂类代谢、生长发育和脂肪酸的转运[21-22]。
这些基因在产蛋前后通过调节肝中脂质代谢的变化,从而提高了蛋鸡在产蛋前后对饲料中营养物质的利用效率并将其转化成产蛋所需的营养物质。
产蛋前后受差异表达基因影响的另一个途径是色氨酸代谢途径。色氨酸在肝功能中起着重要的作用,其涉及到蛋白质合成、糖代谢和脂类代谢等。在蛋鸡日粮中补充适量的色氨酸,不仅会影响血浆中甘油三酯和胆固醇酯的含量,还会使鸡肝总脂含量降低[23]。同时,有研究表明,饲料中色氨酸的浓度对禽类的采食量有一定的调节作用[24]。
在本研究中,我们发现在色氨酸代谢途径中的单胺氧化酶[EC:1.4.3.4]基因参与了多条信号通路并大量累积,催化了喹啉类衍生物和吲哚类衍生物的大量表达。单胺氧化酶是体内参与胺类代谢的主要酶,其活性与机体的寿命有密切的关系[25];同时,细胞色素P450 [1.41.41.1]在褪黑素转化生成6-羟褪黑素的过程中大量积累,催化6-羟褪黑素的大量表达。有研究证明,6-羟褪黑素对性成熟及生殖、衰老、免疫反应和氧化应激等都有调节作用[26]。色氨酸代谢途径中显著下调表达的2个基因是3-羟基酸双加氧酶[EC:1.13.11.6]和氨基羧基粘康酸半醛脱羧酶[EC:4.1.1.45],它们在色氨酸的代谢途径中分别起到促进烟酰胺代谢和苯甲酸降解的功能。在一定的浓度范围内,烟酰胺对肝细胞能量代谢有一定的促进作用,并且能在一定程度上降低肝脂率[27-28]。这些基因通过调节色氨酸代谢缩短机体达到性成熟的时间并增加了体内脂肪的含量,从肝代谢的方面为蛋鸡从产蛋前到产蛋后的生理机能转变提供了物质代谢的保障。
4 结论本研究基于高质量RNA-seq技术对鸡产蛋前后肝的差异表达基因进行了表达量变化和基因功能的分析。研究发现,环脂蛋白186(RNF186) 基因可作为进一步研究肝代谢功能及影响产蛋性能的候选基因开展相关研究。一些在产蛋前后肝中表达量差异显著的基因直接与脂类代谢有关。因此,这些基因如何通过改变营养物质在肝中的代谢途径或效率来影响饲料转化效率需要展开进一步的研究。本试验结果可以为家禽肝组织对营养物质转化利用方面的研究提供详实的研究基础。
| [1] |
王星果. 鸡肝脏和骨骼肌miRNA表达和功能研究[D]. 苏州: 扬州大学, 2013.
WANG X G. The expression and function of miRNAs in chicken liver and skeletal muscle[D]. Suzhou:Yangzhou University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-11117-1014115346.htm |
| [2] |
张金伟. 能量来源对产蛋鸡肝脏脂肪代谢的影响及其机制研究[D]. 成都: 四川农业大学, 2009.
ZHANG J W. Effects of dietary energy sources on lipid metabolism and deposition in the liver of laying hens[D]. Chengdu:Sichuan Agricultural University, 2009. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-2010244290.htm |
| [3] | KIM E J, PURSWELL J L, EVANS J D, et al. Production characteristics of Hy-Line W36 laying hens hatched from white and tinted eggs[J]. Poult Sci, 2014, 93(8): 2123–2128. DOI: 10.3382/ps.2013-03647 |
| [4] | YUAN J W, WANG K H, YI G Q, et al. Genome-wide association studies for feed intake and efficiency in two laying periods of chickens[J]. Genet Sel Evol, 2015, 47(1): 82. DOI: 10.1186/s12711-015-0161-1 |
| [5] | TABOR H K, RISCH N J, MYERS R M. Candidate-gene approaches for studying complex genetic traits:practical considerations[J]. Nat Rev Genet, 2002, 3(5): 391–397. DOI: 10.1038/nrg796 |
| [6] | FAN B, DU Z Q, GORBACH D M, et al. Development and application of high-density SNP arrays in genomic studies of domestic animals[J]. Asian Australas J Anim Sci, 2010, 23(7): 833–847. DOI: 10.5713/ajas.2010.r.03 |
| [7] | OZSOLAK F, MILOS P M. RNA sequencing:advances, challenges and opportunities[J]. Nat Rev Genet, 2011, 12(2): 87–98. DOI: 10.1038/nrg2934 |
| [8] | CORNEY D C, BASTUREA G N. RNA-seq using next generation sequencing[J]. Mater Methods, 2013, 3: 203. |
| [9] | NOOKAEW I, PAPINI M, PORNPUTTAPONG N, et al. A comprehensive comparison of RNA-Seq-based transcriptome analysis from reads to differential gene expression and cross-comparison with microarrays:a case study in Saccharomyces cerevisiae[J]. Nucleic Acids Res, 2012, 40(20): 10084–10097. DOI: 10.1093/nar/gks804 |
| [10] | MCART D C, DUNNE P D, BLAYNEY J K, et al. Connectivity mapping for candidate therapeutics identification using next generation sequencing RNA-seq data[J]. PLoS One, 2013, 8(6): e66902. DOI: 10.1371/journal.pone.0066902 |
| [11] | BENJAMIN Y, HOCHBERG Y. Controlling the false discovery rate:a practical and powerful approach to multiple testing[J]. J Roy Stat Soc Ser B, 1995, 57(1): 289–300. |
| [12] |
李伟华, 祝倩, 吴灵英, 等. 色氨酸的生理功能及其在畜禽饲粮中的应用[J]. 动物营养学报, 2016, 28(3): 659–664.
LI W H, ZHU Q, WU L Y, et al. Physiological function and dietary application of tryptophan in livestock and poultry[J]. Chinese Journal of Animal Nutrition, 2016, 28(3): 659–664. (in Chinese) |
| [13] | DESHAIES R J, JOAZEIRO C A P. RING domain E3 ubiquitin ligases[J]. Ann Rev Biochem, 2009, 78(1): 399–434. DOI: 10.1146/annurev.biochem.78.101807.093809 |
| [14] | FUJIMOTO K, KINOSHITA M, TANAKA H, et al. Regulation of intestinal homeostasis by the ulcerative colitis-associated gene RNF186[J]. Mucosal Immunol, 2017, 10(2): 446–459. DOI: 10.1038/mi.2016.58 |
| [15] |
王鹏. RING结构泛素连接酶RNF186的功能研究[D]. 合肥: 中国科学技术大学, 2013.
WANG P. Studies on RNF186, a ubiquitin E3ligase with a ring domain[D]. Hefei:University of Science and Technology of China, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10358-1014121231.htm |
| [16] |
邢成锋, 阎萍, 梁春年, 等. 脂蛋白脂肪酶基因的研究进展[J]. 华北农学报, 2008, 23(S2): 84–87.
XING C F, YAN P, LIANG C N, et al. Research progress of lipoprotein lipase gene[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(S2): 84–87. DOI: 10.7668/hbnxb.2008.S2.018 (in Chinese) |
| [17] |
刘锐. LPL作为鸡脂肪性状候选基因分析[D]. 北京: 中国农业大学, 2004.
LIU R. Analysis of LPL as a candidate gene of chicken fat traits[D]. Beijing:China Agricultural University, 2004. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10019-2004078329.htm |
| [18] | ALJAKNA A, CHOI S, SAVAGE H, et al. Pla2g12b and Hpn are genes identified by mouse ENU mutagenesis that affect HDL cholesterol[J]. PLoS One, 2012, 7(8): e43139. DOI: 10.1371/journal.pone.0043139 |
| [19] | MUOIO D M, LEWIN T M, WIEDMER P, et al. Acyl-CoAs are functionally channeled in liver:potential role of acyl-CoA synthetase[J]. Am J Physiol Endocrinol Metab, 2000, 279(6): E1366–E1373. |
| [20] | MASHEK D G, LI L O, COLEMAN R A. Long-chain acyl-CoA synthetases and fatty acid channeling[J]. Future Lipidol, 2007, 2(4): 465–476. DOI: 10.2217/17460875.2.4.465 |
| [21] |
张森, 李辉. 载脂蛋白B研究进展[J]. 国际遗传学杂志, 2006, 29(5): 364–367.
ZHANG S, LI H. Advances in the research of apolipoprotein B[J]. International Journal of Genetics, 2006, 29(5): 364–367. (in Chinese) |
| [22] | ZHANG S, SHI H, LI H. Cloning and tissue expression characterization of the chicken APOB gene[J]. Anim Biotechnol, 2007, 18(4): 243–250. DOI: 10.1080/10495390701574887 |
| [23] | AKIBA Y, TAKAHASHI K, HORIGUCHI M, et al. L-tryptophan alleviates fatty liver and modifies hepatic microsomal mixed function oxidase in laying hens[J]. Comp Biochem Physiol, 1992, 102(4): 769–774. DOI: 10.1016/0300-9629(92)90738-C |
| [24] |
吴妙宗, 蔡辉益. 动物色氨酸与烟酸互作关系研究进展[J]. 动物营养学报, 2002, 14(2): 5–8.
WU M Z, CAI H Y. Research advances in tryptophan-niacin relationship in animal nutrition[J]. Acta Zoonutrimenta Sinica, 2002, 14(2): 5–8. (in Chinese) |
| [25] |
裘月, 杜冠华, 张均田. 单胺氧化酶及与疾病的关系[J]. 中国药学杂志, 1994, 29(10): 596–599.
QIU Y, DU G H, ZHANG J T. Relationship between monoamine oxidase and disease[J]. Chinese Pharmaceutical Journal, 1994, 29(10): 596–599. (in Chinese) |
| [26] | BOB P, FEDOR-FREYBERGH P. Melatonin, consciousness, and traumatic stress[J]. J Pineal Res, 2008, 44(4): 341–347. DOI: 10.1111/j.1600-079X.2007.00540.x |
| [27] |
臧坤, 刘晓牧, 宋恩亮, 等. 烟酰胺对小鼠肝细胞能量代谢的影响[J]. 华北农学报, 2009, 24(S1): 115–118.
ZANG K, LIU X M, SONG E L, et al. The effect of nicotinamide on energy metabolism of mice hepatoeytes in vitro[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(S1): 115–118. DOI: 10.7668/hbnxb.2009.S1.029 (in Chinese) |
| [28] |
陈承祯. 烟酰胺、胆碱对肉仔鸡生长性能及脂肪代谢的影响[D]. 长春: 中国人民解放军军需大学, 2002.
CHEN C Z. Effects of niacinamide and choline on growth performance and fat metabolism in broiler chickens[D]. Changchun:The Quartermaster University of PLA, 2002. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-90029-2003060510.htm |



