卵泡发育受到卵巢内生长因子、垂体促性腺激素和类固醇激素协同作用,其过程主要表现为卵泡的生长和闭锁。在参与卵巢卵泡生长和闭锁的众多因子中,抑制素起重要作用[1-3]。抑制素(Inhibin,INH)主要由卵巢颗粒细胞分泌,是α、β亚基通过二硫键构成的糖蛋白质激素,通过反馈抑制垂体促卵泡素(FSH)的释放,调节卵泡的发育[4]。INH可以通过自分泌和旁分泌的方式,抑制次级卵泡生长,参与优势卵泡的选择。抑制素缺失会使小鼠卵巢颗粒细胞过度增殖,产生颗粒细胞瘤,出现卵泡发育障碍,导致不育[5-7]。
RNAi作为研究基因功能的主要工具,可用于研究抑制素对垂体细胞和颗粒细胞的局部调节作用。研究表明,INHα表达的抑制通过影响Bax/ Bcl2家族和Caspase家族基因的表达,促进垂体细胞和颗粒细胞的凋亡[8-10]。细胞周期可以直接反映细胞的增殖状况,抑制素通过改变鹅颗粒细胞和小鼠支持细胞的周期(G0/G1、S、G2/M)分布影响细胞增殖[10-11]。因此,抑制素对卵泡发育和颗粒细胞功能有重要的调节作用,但目前大多的体外研究均是以小鼠为模型,利用siRNA干扰抑制素来研究绵羊颗粒细胞周期和凋亡相关基因变化的报道尚未见。本试验利用RNAi技术,构建靶向INHα基因的siRNA,转染原代培养的绵羊颗粒细胞,从分子水平研究RNA干扰INHα基因对绵羊颗粒细胞周期、周期相关基因(CyclinD1、CyclinB1和p21)、促凋亡因子(Bax、p53和Caspase3) 和抗凋亡因子(Bcl-2) 表达的影响,以探讨卵泡抑制素对绵羊颗粒细胞的局部调节作用,为今后提高动物的繁殖力奠定基础。
1 材料与方法 1.1 主要试剂、仪器和试验材料 1.1.1 主要试剂和仪器DMEM/F12培养基、胎牛血清、胰蛋白酶、DPBS缓冲液、青链霉素混合液(100×)(Gibco,美国),超净工作台(苏净集团安泰公司,中国),CO2培养箱(Sanyo,日本),离心机(上海手术器械厂,中国),倒置显微镜(Olympus IX71,日本),培养瓶、六孔板(康宁,美国),离心机(Sigma,德国),超纯水仪(香港,力康),ABI Step One PlusTM(Life technologies,美国),SybrGreen qPCR mastermix(DBI,德国),Trizol®Reagent、OptiMEM®Medium、LipofectamineTM RNAiMAX(Invitrogen,美国),NanoDrop分光光度计ND-2000(Thermo,Waltham,MA),RT-PCR kit(宝生物,大连)。
1.1.2 试验材料从河北省唐县屠宰场采集1.0~1.5岁小尾寒羊的卵巢,立即放入盛有37 ℃生理盐水的保温瓶中(含双抗),并于3 h内运到实验室。
1.2 方法 1.2.1 siRNA的设计和合成根据NCBI数据库已知的绵羊INHα(NM_001308579.1) 基因序列,按照siRNA设计原则,应用Invitrogen公司在线设计工具,设计并合成1对针对INHα基因的siRNA前体寡核苷酸序列:siINHα, 5′-GCCTCTTCACGTATGTGTT-3′,阴性对照(siNC)购自广州锐博生物科技公司。
1.2.2 卵巢颗粒细胞的分离与培养颗粒细胞的分离参照J.Y. Peng等[12]的处理方法,选取直径3~7 mm的卵泡,用10 mL注射器的针头将卵泡扎破释放并收集颗粒细胞,加入含10% FBS和1%青链霉素混合液的DMEM/F12培养液重悬细胞。调整细胞密度后,于37 ℃、5% CO2条件下培养。
1.2.3 siRNA转染绵羊颗粒细胞将绵羊原代颗粒细胞接种在12孔细胞培养板中培养,待细胞汇合度达到70%~80%时,采用转染试剂LipofectamineTM RNAiMAX转染siRNA,具体步骤参照说明书进行。将siINHα和siNC(阴性对照)转染颗粒细胞,以未转染的细胞为空白对照(Control),处理48 h后,提取总RNA。
1.2.4 细胞周期检测绵羊颗粒细胞转染48 h后,用0.25%不含EDTA胰蛋白酶消化处理,离心收集细胞,预冷的PBS离心洗两次(1 000 r·min-1,5 min),加入预冷的70%乙醇,4 ℃过夜处理,固定细胞,固定后的细胞用预冷的PBS离心洗两次,加入500 μL的PI/RNase溶液,室温避光孵育15 min。用流式细胞仪进行检测,每一次计数>20 000个细胞,结果用细胞周期和软件ModFit进行分析。
1.2.5 荧光定量RT-PCR检测相关基因mRNA表达吸出培养板中的培养液,每孔加1 mL Trizol提取细胞总RNA。经琼脂糖电泳和ND-2000分光光度计检测后,按反转录试剂盒说明书,将总RNA反转录为cDNA。使用荧光定量PCR仪进行检测。反应体系:SybrGreen qPCR mastermix 10 μL,cDNA模板1 μL,上、下游引物(10 μmol·L-1)各0.5 μL,ddH2O 8 μL,总体积为20 μL。反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火延伸60 s,共40个循环。以GAPDH基因为内参,利用2-ΔΔCT的方法将原始Ct值转换为相对基因表达量。利用Oligo6.0软件分别设计目的基因INHα、细胞周期相关基因(CyclinD1、CyclinB1和p21)、促凋亡基因(Bax、p53和Caspase3) 和抗凋亡基因(Bcl-2) 的荧光定量引物及GAPDH内参基因的引物,引物由上海生物工程有限公司合成。荧光定量RT-PCR引物序列见表 1。
|
|
表 1 荧光定量RT-PCR分析所用的引物 Table 1 Oligonucleotide primers used for quantitative real-time PCR |
采用SPSS 19.0统计软件One-way ANOVA进行方差分析与显著性检验。试验数据以“平均值±标准差(mean±SD)”表示。*P<0.05为差异显著。
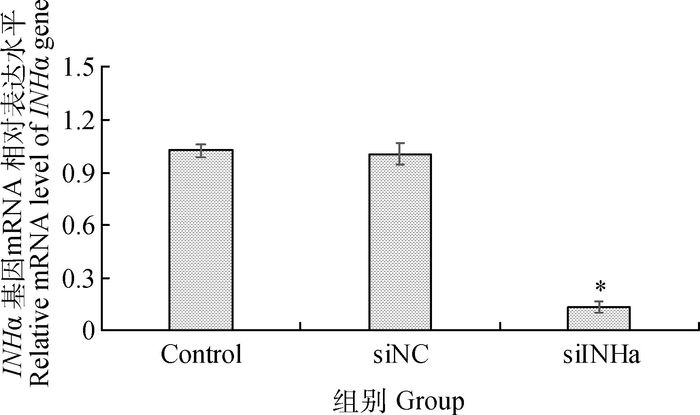
2 结果 2.1 siRNA的干扰效率siINHα转染对INHα基因的抑制效果见图 1。与阴性对照和空白对照相比,INHα的mRNA水平显著降低(P<0.05),抑制率>85%。
|
siINHα、siNC和Control分别代表转染siINHα、阴性对照的颗粒细胞和空白对照,*.P<0.05。下同 siINHα, siNC and Control indicate the granulosa cells transfected with siINHα, negative control and without treatment, respectively. *.P < 0.05. The same as below 图 1 转染siRNA 48 h后绵羊颗粒细胞INHα基因mRNA的表达 Figure 1 mRNA expressions of INHα at 48 h after siRNA transfection |
干扰INHα基因48 h后,经流式细胞仪检测结果见表 2,细胞周期的分布显著改变。其中,与阴性对照和空白对照相比,干扰组G0/G1期(细胞静止期和DNA合成前期)细胞比例显著升高(P<0.05),S期(DNA合成期)细胞比例显著降低(P<0.05),G2期细胞比例未发生显著变化,各时期细胞比例阴性对照和空白对照相比差异不显著(P>0.05)。
|
|
表 2 干扰INHα基因对绵羊颗粒细胞各时期细胞比例的影响 Table 2 The effects of silencing INHα gene on the percentage of cells at different phases of sheep granulosa cells |
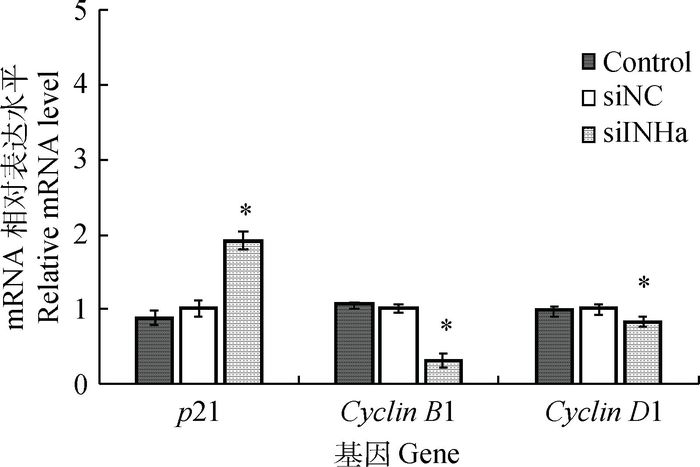
干扰INHα基因对绵羊颗粒细胞周期相关基因表达的影响如图 2所示,荧光定量RT-PCR检测结果显示,与阴性对照相比,干扰INHα基因的表达,细胞周期蛋白CyclinD1和 CyclinB1的mRNA水平分别降低了0.2倍和0.7倍(P<0.05),细胞周期抑制因子p21的mRNA水平升高了0.9倍(P<0.05),各基因表达量在阴性对照与空白对照组间无显著差异(P>0.05)。
|
图 2 干扰INHα基因后绵羊颗粒细胞周期相关基因mRNA的表达 Figure 2 Effects of silencing INHα gene by RNAi on the mRNA expressions of cell cycle related genes in sheep granulosa cells |
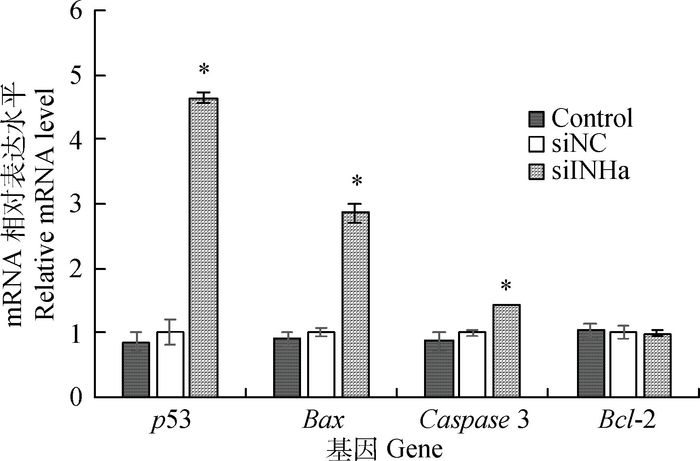
采用荧光定量RT-PCR检测细胞凋亡相关基因在INHα基因干扰组、阴性对照和空白对照组的相对表达量(图 3)。结果表明,各基因表达量在阴性对照和空白对照组间没有明显差别(P>0.05),干扰INHα基因48 h后,Bax、p53和Caspase3基因的相对表达量分别比阴性对照升高了1.8倍、3.6倍和0.4倍(P<0.05),而Bcl-2基因的表达未发生显著变化(P>0.05)。
|
图 3 干扰INHα基因后绵羊颗粒细胞凋亡基因mRNA的表达 Figure 3 Effects of silencing INHα gene by RNAi on the mRNA expressions of apoptosis related genes in sheep granulosa cells |
抑制素是影响卵泡中颗粒细胞增殖、分化和周期控制的重要调节因子之一,它可以通过影响细胞周期的分布,进而反映细胞的增殖状况。研究表明,抑制INHα的表达显著增加了小鼠颗粒细胞、垂体细胞和睾丸支持细胞中G1期的细胞数量,同时减少了S期细胞的数量,抑制增殖[8-9, 11]。F.J.Chen等[10]研究发现,干扰鹅颗粒细胞INHα基因的表达,使G1期降低,S期升高。抑制素的添加对母鸡颗粒细胞增殖有温和的促进作用,而活化素可以抑制卵泡颗粒细胞增殖[13]。本研究中,干扰绵羊颗粒细胞中INHα基因的表达,增加了G1期的细胞数量,同时S期的细胞数量减少,可见INHα主要参与了绵羊颗粒细胞G1~S期的转变,对G2/S的转变影响较小。但有研究发现,抑制素α缺失会导致抑制素与活化素之间糖蛋白异二聚体平衡紊乱,失去对活化素的抑制作用,引起卵巢颗粒细胞过度增殖,形成卵巢瘤[5, 14-15]。此外,L.Y.Geng等[16]研究发现,超表达抑制素抑制牛中腔卵泡颗粒细胞的增殖,对小腔卵泡颗粒细胞的增殖没影响;L.P. Cai等[17]研究表明,抑制素抗体的添加促进猪颗粒细胞的增殖。与本试验结果相反,其原因可能由于卵泡发育的时期不同导致。
CyclinD家族是重要的细胞周期调控蛋白,对细胞由G1期向S期过渡阶段具有重要的作用[18-19]。K.L.Cai等[11]研究表明,干扰小鼠支持细胞中INHα的表达,通过下调CyclinD1的表达和上调p21的表达影响G1/S的转变。本研究发现,干扰绵羊颗粒细胞中INHα基因的表达,显著降低了Cyclin D1和CyclinB1基因的表达,升高了 p21基因的表达。CyclinB1也是正常细胞向前推进的重要调节因子,在一个细胞周期结束时,可以使Cdkl失活,促使有丝分裂结束,进入下一次细胞分裂[20]。但也有研究表明,抑制素的添加上调了CyclinD1和CyclinD2 mRNA表达,促进细胞增殖[17]。综上表明,INHα通过细胞周期中相关因子的影响对绵羊颗粒细胞周期起调控作用,调节了颗粒细胞的增殖进而影响卵泡的发育及排卵。
3.2 siRNA干扰INHα对细胞凋亡相关基因表达的影响卵泡发育过程中,仅有少部分卵泡可以通过募集、选择优势化过程发育成熟,大部分则在卵泡发育各阶段逐渐闭锁退化,其中卵巢颗粒细胞的凋亡在卵泡闭锁中起重要的作用[21-23],而颗粒细胞凋亡又分别是由Caspase3酶的活性、促凋亡和抗凋亡蛋白决定的[24]。研究表明,抑制INHα的表达后,通过上调Caspase3、Bax和Bcl-2的表达,促进了小鼠垂体细胞的凋亡;同时在小鼠颗粒细胞研究中也得到了同样结果[8-9]。此外,抑制素可以促进己烯雌酚处理鼠卵巢有腔卵泡的凋亡[25];沉默抑制素α基因可以增加鹅颗粒细胞的凋亡指数[10]。本研究结果表明,沉默绵羊颗粒细胞INHα基因的表达,上调Bax、Caspase3和p53基因的表达,不影响Bcl-2基因的表达。但也有研究表明,抑制素对牛颗粒细胞和山羊颗粒细胞的凋亡有促进作用[16, 26],可能由于抑制素对细胞凋亡的调控作用是涉及到多因子参与的,其调控机制比较复杂,其作用还需进一步的研究。
4 结论siRNA可有效干扰INHα基因的表达。干扰INHα基因的表达后,抑制了绵羊颗粒细胞的增殖,影响了细胞凋亡相关基因的表达。INHα通过调控绵羊颗粒细胞的生长和凋亡参与绵羊卵泡排卵的过程。
| [1] | FINDLAY J K, DRUMMOND A E, DYSON M L, et al. Recruitment and development of the follicle; the roles of the transforming growth factor-β superfamily[J]. Mol Cell Endocrinol, 2002, 191(1): 35–43. DOI: 10.1016/S0303-7207(02)00053-9 |
| [2] | MCMULLEN M L, CHO B N, YATES C J, et al. Gonadal pathologies in transgenic mice expressing the rat inhibinα-subunit[J]. Endocrinology, 2001, 142(11): 5005–5014. DOI: 10.1210/endo.142.11.8472 |
| [3] | KANDIEL M M M, WATANABE G, LI J Y, et al. Physiological roles of inhibin in regulation of FSH secretion and follicular development during early pregnancy in goats[J]. Domest Anim Endocrin, 2008, 35(2): 157–163. DOI: 10.1016/j.domaniend.2008.03.003 |
| [4] | BILEZIKJIAN L M, BLOUNT A L, DONALDSON C J, et al. Pituitary actions of ligands of the TGF-β family:activins and inhibins[J]. Reproduction, 2006, 132(2): 207–215. DOI: 10.1530/rep.1.01073 |
| [5] | MYERS M, MIDDLEBROOK B S, MATZUK M M, et al. Loss of inhibin alpha uncouples oocyte-granulosa cell dynamics and disrupts postnatal folliculogenesis[J]. Dev Biol, 2009, 334(2): 458–467. DOI: 10.1016/j.ydbio.2009.08.001 |
| [6] | MATZUK M M, KUMAR T R, SHOU W, et al. Transgenic models to study the roles of inhibins and activins in reproduction, oncogenesis, and development[J]. Recent Prog Horm Res, 1996, 51: 123–154. |
| [7] | STELLER M D, SHAW T J, VANDERHYDEN B C, et al. Inhibin resistance is associated with aggressive tumorigenicity of ovarian cancer cells[J]. Mol Cancer Res, 2005, 3(1): 50–61. |
| [8] | HAN L, WU C J, RIAZ H, et al. Characterization of the mechanism of inhibin α-subunit gene in mouse anterior pituitary cells by RNA interference[J]. PLoS One, 2013, 8(10): e74596. DOI: 10.1371/journal.pone.0074596 |
| [9] | KADARIYA I, WANG J X, REHMAN Z U, et al. RNAi-mediated knockdown of inhibin α subunit increased apoptosis in granulosa cells and decreased fertility in mice[J]. J Steroid Biochem Mol Biol, 2015, 152: 161–170. DOI: 10.1016/j.jsbmb.2015.05.006 |
| [10] | CHEN F J, JIANG X P, CHEN X P, et al. Effects of downregulation of inhibin α gene expression on apoptosis and proliferation of goose granulosa cells[J]. J Genet Genomics, 2007, 34(12): 1106–1113. DOI: 10.1016/S1673-8527(07)60126-X |
| [11] | CAI K L, HUA G H, AHMAD S, et al. Action mechanism of inhibin α-subunit on the development of Sertoli cells and first wave of spermatogenesis in mice[J]. PLoS One, 2011, 6(10): e25585. DOI: 10.1371/journal.pone.0025585 |
| [12] | PENG J Y, XIN H Y, HAN P, et al. Expression and regulative function of tissue inhibitor of metalloproteinase 3 in the goat ovary and its role in cultured granulosa cells[J]. Mol Cell Endocrinol, 2015, 412: 104–115. DOI: 10.1016/j.mce.2015.06.001 |
| [13] | JOHNSON P A, WOODCOCK J R, KENT T R, et al. Effect of activin A and inhibin A on expression of the inhibin/activin β-B-subunit and gonadotropin receptors in granulosa cells of the hen[J]. Gen Comp Endocrinol, 2006, 147(2): 102–107. DOI: 10.1016/j.ygcen.2005.12.008 |
| [14] | MATZUK M M, FINEGOLD M J, SU Y G J, et al. α-inhibin is a tumour-suppressor gene with gonadal specificity in mice[J]. Nature, 1992, 360(6402): 313–319. DOI: 10.1038/360313a0 |
| [15] | LEWIS K A, GRAY P C, BLOUNT A L, et al. Betaglycan binds inhibin and can mediate functional antagonism of activin signalling[J]. Nature, 2000, 404(6776): 411–414. DOI: 10.1038/35006129 |
| [16] | GENG L Y, FANG M, YI J M, et al. Effect of overexpression of inhibin α (1-32) fragment on bovine granulosa cell proliferation, apoptosis, steroidogenesis, and development of co-cultured oocytes[J]. Theriogenology, 2008, 70(1): 35–43. DOI: 10.1016/j.theriogenology.2008.02.013 |
| [17] | CAI L P, SUN A D, LI H, et al. Molecular mechanisms of enhancing porcine granulosa cell proliferation and function by treatment in vitro, with anti-inhibin alpha subunit antibody[J]. Reprod Biol Endocrin, 2015, 13: 26. DOI: 10.1186/s12958-015-0022-3 |
| [18] | SHERR C J, ROBERTS J M. CDK inhibitors:positive and negative regulators of G1-phase progression[J]. Gene Dev, 1999, 13(12): 1501–1512. DOI: 10.1101/gad.13.12.1501 |
| [19] | BALDIN V, LUKAS J, MARCOTE M J, et al. Cyclin D1 is a nuclear protein required for cell cycle progression in G1[J]. Gene Dev, 1993, 7(5): 812–821. DOI: 10.1101/gad.7.5.812 |
| [20] | LINDQVIST A, VAN ZON W, ROSENTHAL C K, et al. Cyclin B1-Cdk1 activation continues after centrosome separation to control mitotic progression[J]. PLoS Biol, 2007, 5(5): e123. DOI: 10.1371/journal.pbio.0050123 |
| [21] | MATSUDA F, INOUE N, MANABE N, et al. Follicular growth and atresia in mammalian ovaries:regulation by survival and death of granulosa cells[J]. J Reprod Dev, 2012, 58(1): 44–50. DOI: 10.1262/jrd.2011-012 |
| [22] | MATSUDA-MINEHATA F, INOUE N, GOTO Y, et al. The regulation of ovarian granulosa cell death by pro-and anti-apoptotic molecules[J]. J Reprod Dev, 2006, 52(6): 695–705. DOI: 10.1262/jrd.18069 |
| [23] | QIU M N, QUAN F S, HAN C Q, et al. Effects of granulosa cells on steroidogenesis, proliferation and apoptosis of stromal cells and theca cells derived from the goat ovary[J]. J Steroid Biochem, 2013, 138(10): 325–333. |
| [24] | DENKOVA R, BOURNEVA V, STANEVA-DOBROVSKI L, et al. in vitro effects of inhibin on apoptosis and apoptosis related proteins in human ovarian granulosa cells[J]. Endocr Regul, 2004, 38(2): 51–55. |
| [25] | VITALE A M, GONZALEZ O M, PARBORELL F, et al. Inhibin A increases apoptosis in early ovarian antral follicles of diethylstilbestrol-treated rats[J]. Biol Reprod, 2002, 67(6): 1989–1995. DOI: 10.1095/biolreprod.102.003673 |
| [26] |
陈守云. 抑制素被动免疫对羊生殖激素及卵泡颗粒细胞凋亡的影响[D]. 雅安: 四川农业大学, 2008.
CHEN S Y. Effects of passive immunization against inhibin on hormone profile of ewes and apoptosis of follicular granulosa cell in vitro[D]. Ya'an:Sichuan Agricultural University, 2008. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-2008198403.htm |



