2. 新疆天康畜牧生物技术股份有限公司, 乌鲁木齐 830000
2. Xinjiang Tiankang Livestock Biotechnology Co., Ltd, Urumqi 830000, China
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(FMDV)感染引起的偶蹄类动物共患的传染病,发病后口、蹄部位出现大量水疱,高烧不退,导致牲畜产量锐减,在易感动物中传播迅速,世界动物卫生组织将其作为世界上最重要的动物疾病之一[1]。目前,在大多数发展中国家,广泛接种口蹄疫病毒灭活疫苗是控制疫情唯一可行的办法[2],但由于较差的免疫原性,这些灭活疫苗中需要添加佐剂才能提高免疫效果。然而,大多数佐剂的有效性常常和佐剂的毒性呈现正相关,例如弗氏完全佐剂。因此,寻找安全有效,延长疫苗作用时间进而减少接种次数的佐剂很有必要。
研究表明中药及其成分具有免疫增强作用。因此,许多研究人员已经成功地使用中草药作为疫苗佐剂[3-4]。而且,中草药佐剂有很多优点,包括自然资源丰富,可靠的有效率,副作用少,以及毒性低等特点。例如由于多糖、苯乙醇苷类化合物、有机酸、生物碱等有效成分具有多种生物活性而引起研究者们的关注。国内外研究者们提取了多种传统中草药中的多糖成分,研究了其佐剂效果,如荔枝果肉多糖、川牛膝多糖、白术多糖、一枝蒿多糖等发现其具有很好的佐剂活性,通过不同的作用途径增强免疫反应,使其成为新型疫苗的候选佐剂[5-9]。例如,川牛膝多糖[6]通过增强小鼠的抗体滴度、淋巴细胞增殖、细胞因子和CTL反应来提高FMD疫苗的免疫作用;新疆野生一枝蒿多糖[10]可以通过提高小鼠抗体水平和脾中CD4+CD44+和CD8+CD44+ T淋巴细胞的数量来增强流感疫苗的免疫效果。
新疆野生荒漠肉苁蓉(Wild Cistanche deserticola Y. C. Ma)是常用的中草药,又名大芸,国家一类野生珍稀植物保护物种,列当科多年生草本植物,生长于荒漠干旱地区。其主要成分包括多糖、苯乙醇苷类化合物、有机酸、生物碱等,其中多糖含量较高,具有抗病毒、调节免疫系统、抗氧化等多种功能[11]。近年来,国内外针对荒漠肉苁蓉多糖的化学结构和药理活性方面开展了大量的研究工作,其中包括多糖的分离,单糖的组成及种类,相对分子质量的测定,糖基的连接方式等。但对荒漠肉苁蓉多糖的免疫佐剂作用研究较少,本实验室前期的研究结果表明WCDCP能够增强流感疫苗和小鼠体内树突状细胞(dendritic cells,DCs)的免疫效果,显著提高小鼠体内CD11c+ DCs表面CD86和MHCII上调表达,且效果与阳性对照组LPS相当,对流感疫苗具有显著的免疫增强作用[10, 12]。因此本研究首先用不同剂量的WCDCP与FMDV灭活抗原配伍免疫小鼠,其次,将合适剂量的WCDCP与FMD疫苗配伍免疫小鼠,通过ELISA和流式细胞术探究新疆荒漠肉苁蓉粗多糖长期的免疫佐剂效果,为研究其作为安全有效的FMD疫苗佐剂提供实验依据。
1 材料与方法 1.1 实验材料新疆野生荒漠肉苁蓉(市售)。FMDV灭活抗原、FMDV纯化浓缩抗原、FMD疫苗(包含ISA 206佐剂)均由新疆天康生物技术公司提供;辣根过氧化物酶标记的山羊抗鼠IgG、IgG1、IgG2a购自美国Southbiotech公司;N-四甲基联苯胺(TMB)购自上海蓝季科技发展有限公司;胎牛血清购自四季青公司;RPMI-1640培养液购自HyClone公司;APC-CD4、FITC-CD8a、PE-CD44均购自美国BD公司。其他试剂均为国产分析纯。
1.2 WCDCP的提取及制备将新疆野生荒漠肉苁蓉切成小块后于60 ℃烘箱中干燥,待干燥后粉碎为粉末。100 g粉末中加入1 L乙醇溶液,混合后于超声仪中超声1 h,将药渣与石油醚混合后继续超声1 h,将超声后的药渣烘干,加入1.5 L蒸馏水超声,将溶液旋蒸至200 mL,向浓缩液中加入乙醇溶液,至乙醇终体积分数为80%,4 ℃沉降24 h后抽滤烘干即得新疆荒漠肉苁蓉粗多糖,研磨后即得粉末[13]。将所得的粗多糖用Sevage法[14]除蛋白质,对除蛋白质后的粗多糖进行干燥,蒽酮-硫酸法测定新疆荒漠肉苁蓉粗多糖中的多糖含量59.58%,后续试验中将所得到的粗多糖溶于0.9% NaCl溶液中,浓度为20 mg·mL-1,用于免疫小鼠。
1.3 实验动物及免疫试验1:雌性ICR小鼠,6~8周,18~22 g,购自新疆医科大学实验动物中心。36只ICR小鼠随机分为6组,每组6只小鼠,分别为空白对照组(Control)、WCDCP高剂量组(WCDCP-H)、FMD疫苗组、FMDV灭活抗原+WCDCP 100 μg低剂量组(WCDCP-L)、FMDV灭活抗原+WCDCP 400 μg中剂量组(WCDCP-M)、FMDV灭活抗原+WCDCP 800 μg高剂量组(WCDCP-H);灭活抗原免疫用量为0.2 μg·mL-1,采用皮下2~3点免疫法免疫小鼠,免疫总体积是150 μL,共免疫两次,间隔2周。第一次免疫后14 d及随后各间隔1周进行眼眶采血,ELISA法检测血清中的IgG抗体水平。
试验2:检测WCDCP对FMD疫苗的免疫佐剂作用以及WCDCP对小鼠体重的影响,取24只ICR小鼠,随机分为4组(表 1),皮下免疫法免疫小鼠,共免疫两次,间隔两周。第一次免疫后14 d及随后各间隔一周进行眼眶采血,ELISA检测,测定诱导的IgG及IgG1、IgG2a抗体水平,每次免疫之前称取小鼠体重。
|
|
表 1 免疫小组分组表 Table 1 The group of immunization |
试验3:30只ICR小鼠,随机分为生理盐水组、FMD疫苗组、FMD疫苗+WCDCP-L组、FMD疫苗+WCDCP-M组、FMD疫苗+WCDCP-H组,每组6只,分别于0和14 d进行皮下注射免疫小鼠,用于检测WCDCP对淋巴结细胞中CD4+CD44+和CD8+CD44+ T细胞表达量的影响。
1.4 ELISA法检测WCDCP免疫后的抗体及抗体分型水平间接ELISA法测定初免后各时间点血清中的抗体及分型水平。简述如下:将一定浓度的FMDV灭活抗原包被液加入到ELISA板中,每孔100 μL,然后将ELISA板放于4 ℃过夜。次日,将包被板从4 ℃取出,加入200 μL·孔-1 PBST洗板2次,每次2~3 min。洗涤结束后加入封闭液(5%的脱脂奶粉,用PBS溶解),100 μL·孔-1,37 ℃孵育1 h。封闭结束后用PBST洗板2次,每次2~3 min。随后加入一抗(稀释后的待测小鼠血清),每孔100 μL,37 ℃孵育1~1.5 h(所用稀释液为5%的脱脂奶粉稀释2.5倍,用PBS稀释)。孵育结束后用PBST洗板2次,每次2~3 min。加二抗稀释液(二抗为HRP标记的抗鼠IgG、IgG1、IgG2a),每孔加100 μL,37 ℃孵育1 h,(所用稀释液为5%的脱脂奶粉稀释2.5倍,用PBS稀释)。孵育结束后用PBST洗板3~5次,每次2~3 min。后加显色液显色,每孔加入四甲基联苯胺(TMB)底物溶液100 μL,避光显色10~15 min。最后每孔加入50 μL 2 mol·L-1 H2SO4终止液。于酶标仪450 nm/655 nm双波长下检测光吸收值。
1.5 流式细胞术检测T细胞表面分子初免后21 d,取小鼠淋巴结研磨后经裂解红细胞制成单细胞悬液。取1×106个淋巴细胞加入到8 mL PBS/0.5%FBS中,1 200 r·min-1离心7 min后弃上清,用PE-CD44、APC-CD4、FITC-CD8a进行染色,于常温下避光染色15~20 min,染色结束后加入8 mL PBS/0.5%FBS终止染色,1 200 r·min-1,离心7 min弃上清,用400 μL PBS重悬后经200目的铜网过滤,流式细胞仪检测不同T淋巴细胞亚群的百分比。
1.6 数据分析采用FlowJo 7.6软件处理流式细胞术检测结果,GraphPad Prism 5.0进行分析,数据均采用x±s表示,数据进行单因素方差分析和多组均数间比较,*P<0.05表示差异显著,** P<0.01表示差异极显著。
2 结果 2.1 WCDCP对FMDV灭活抗原诱导小鼠IgG抗体水平的影响为探究WCDCP对FMDV灭活抗原的佐剂效应,间接ELISA法检测WCDCP配伍FMDV灭活抗原第一次免疫后21、28、42和49 d小鼠IgG抗体水平。结果如图 1所示,除低剂量组21、42和49 d外, 不同剂量的WCDCP均可显著提高FMDV特异性IgG抗体水平(P<0.05),中剂量、高剂量WCDCP配伍FMDV灭活抗原组与FMD疫苗组具有极显著差异(P<0.01或P<0.001),因此,表明WCDCP能够提高FMDV灭活抗原的抗体水平。
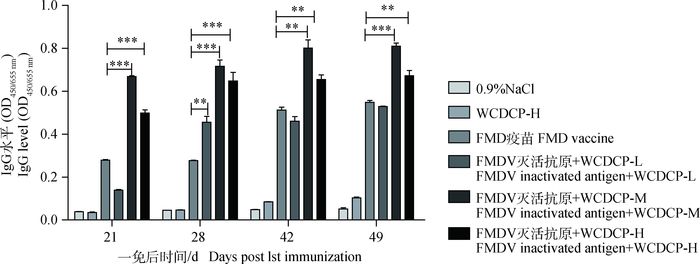
|
与FMD疫苗单独免疫组相比较,*.P<0.05;**.P<0.01;***.P<0.001 Compared with FMD vaccine immunization group, *.P < 0.05;**.P < 0.01;***P < 0.001 图 1 WCDCP对FMDV灭活抗原特异性抗体的增强效果 Figure 1 WCDCP enhanced effect of FMDV inactivation of antigen-specific antibody |
为检测WCDCP对FMD疫苗的免疫作用以及是否具有长效性,ELISA法检测WCDCP-M配伍FMD疫苗第一次免疫后28、35、42、63、84、107 d FMDV特异性IgG抗体水平。结果如图 2所示,免疫后28~42 d抗体水平逐渐升高,FMD疫苗与FMDV灭活抗原相比较抗体水平显著升高(P<0.05或P<0.01),FMD疫苗+WCDCP-M组与FMDV灭活抗原组相比较抗体水平极显著升高(P<0.01),42~107 d抗体水平虽缓慢下降,但总体趋势没有发生变化。FMD疫苗+WCDCP-M组的抗体水平持续到免疫后107 d仍然高于FMD疫苗组,因此,可以说明WCDCP不仅能够增强FMD疫苗的抗体水平,而且具有长效性。
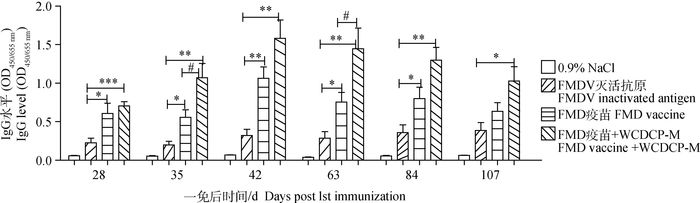
|
与FMDV灭活抗原单独免疫组相比较,*.P<0.05;**.P<0.01;***P<0.001。与FMD疫苗单独免疫组相比较,#.P<0.05 Compared with FMDV inactivated antigen immunization group; *.P < 0.05; **.P < 0.01; ***P < 0.001. Compared with FMD vaccine immunization group, #.P < 0.05 图 2 WCDCP对FMD疫苗特异性抗体的长期增强效果 Figure 2 WCDCP long-term enhance the specific antibody of foot-and-mouth disease vaccine |
间接ELISA法检测初免后63 d小鼠血清中抗体IgG及分型,结果如图 3所示,FMD疫苗配伍WCDCP之后,抗体IgG水平显著高于FMD疫苗组(P<0.05),而且IgG1及IgG2a的表达量也高于FMD疫苗组(P>0.05)。
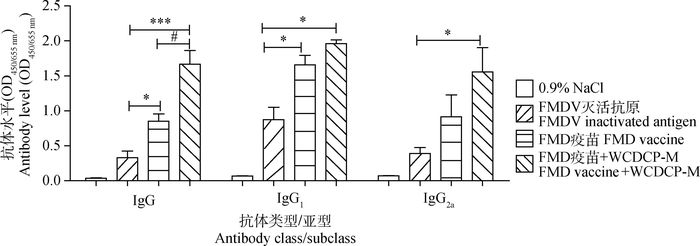
|
与FMDV灭活抗原单独免疫组相比较,*.P<0.05;**.P<0.01;***P<0.001。与FMD疫苗单独免疫组相比较,#.P<0.05 Compared with FMDV inactivated antigen immunization group, *.P < 0.05; **.P < 0.01; ***P < 0.001. Compared with FMD vaccine immunization group, #.P < 0.05 图 3 间接ELISA法检测初免后63 d小鼠血清中抗体IgG及亚型 Figure 3 Detection of IgG and subclasses in serum by indirect ELISA at 63 d after first immunization |
流式细胞术检测WCDCP配伍FMD疫苗初免后21 d,淋巴结细胞中CD4+CD44+和CD8+CD44+T细胞的百分含量。结果如图 4A-D所示,FMD疫苗+WCDCP-M免疫组小鼠淋巴结细胞中CD4+CD44+和CD8+CD44+T细胞的百分含量显著高于FMD疫苗单独免疫组(P<0.05)。结果说明,WCDCP能够显著促进T淋巴细胞的激活。
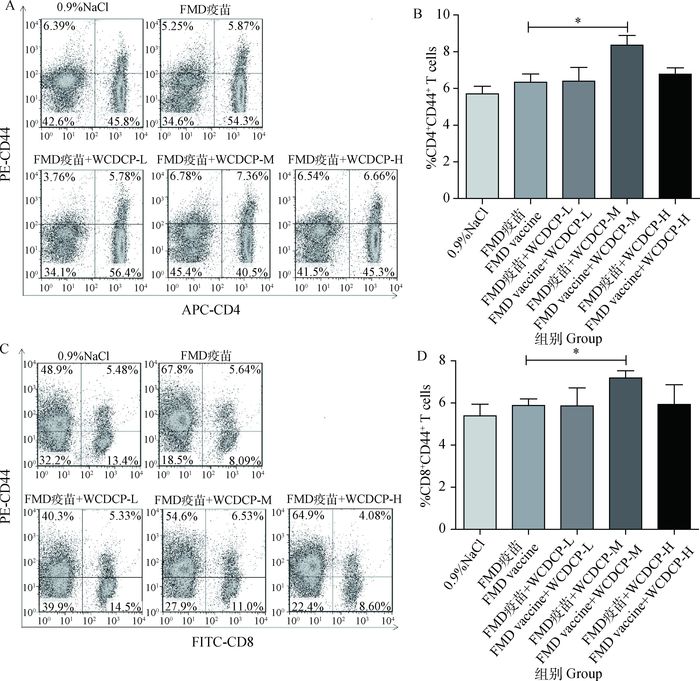
|
与FMD疫苗单独免疫组相比较,*.P<0.05 Compared with FMD vaccine immunization group, *.P < 0.05 图 4 WCDCP对FMD疫苗免疫后小鼠淋巴结中CD44+ T细胞百分比的影响 Figure 4 The percentage of CD44+ T cell in the lymph nodes of mice immunized with FMD vaccine mixed WCDCP |
为检测WCDCP免疫后对小鼠的生长是否具有影响,对初免后0、7、14、21、35、49、63、107 d小鼠的体重进行了长期的测定。结果如表 2所示,同一时间点,以FMD疫苗组作为对照组,WCDCP与其之间的差异不显著(P>0.05),表明WCDCP长期作用对小鼠的正常生长不会造成影响,具有一定的安全性。
|
|
表 2 WCDCP免疫后不同时间点小鼠体重的变化情况(x±s, n=6) Table 2 Changes of body weights on mice at different time points after WCDCP immunization (x±s, n=6) |
越来越多的研究表明大多数中草药的主要有效成分通过增强抗体水平、激活T、B淋巴细胞、诱导细胞因子的分泌、促进干扰素的生成、活化DC细胞,而发挥高活性的免疫调节作用,几乎涉及到机体免疫系统的各个方面,而对正常细胞没有毒副作用。多糖是中草药提取物的主要组成成分,在各种疾病中发挥着至关重要的作用,由于多糖具有丰富的生物活性,例如具有抗氧化活性、神经保护、抗病毒活性、免疫调节作用、抗凝活性、降低糖尿病活性、降血脂作用,而被应用于多种药物的开发[15]。本研究发现WCDCP免疫小鼠后,小鼠无异常行为和副作用,并且各组小鼠的体重之间没有显著差异,表明WCDCP具有一定的安全性。IgG含量高低可以反映机体的防御能力[16]。本研究首先检测了WCDCP对FMDV灭活抗原的免疫增强作用,并筛选出最优的剂量,结果表明,WCDCP配伍FMDV灭活抗原第一次免疫小鼠后28~42 d,WCDCP+FMDV灭活抗原组的抗体IgG水平均显著高于FMD疫苗组,表明WCDCP可以提高体液免疫反应,具有免疫增强作用。
如果免疫FMD疫苗后能够激发持久的免疫力,不仅能够减少免疫次数,降低生产成本;而且在遇到口蹄疫大暴发时,被免疫动物能够及时被保护,减少损失。因此,进行了WCDCP增强抗体水平和持久性的试验,间接ELISA法测定初免后28~107 d小鼠血清中的抗体IgG水平结果表明,FMD疫苗+WCDCP-M免疫组的抗体IgG水平显著高于FMD疫苗组,且总体呈现升高的趋势,107 d抗体水平虽呈现下降的趋势,但FMD疫苗+WCDCP-M免疫组的抗体IgG水平仍高于FMD疫苗组。因此,WCDCP协同FMD疫苗免疫小鼠可以促进小鼠FMDV抗体的产生,延长抗体在体内的维持时间,进而达到减少免疫次数目的。
在小鼠体内,IgG1是依赖于Th2途径免疫应答的特征性标志分子,而IgG2a是依赖于Th1途径免疫应答的特异性标志分子[17]。ELISA法测定初免后63 d小鼠血清中抗体分型IgG1和IgG2a结果表明,FMD疫苗+WCDCP-M免疫组的抗体分型IgG1及IgG2a的水平显著高于FMD疫苗组,说明WCDCP显著促进Th1/Th2混合型免疫应答,而且具有长效性。
细胞免疫在病毒性疾病免疫中发挥着重要的作用。T淋巴细胞是体内重要的免疫调节和效应细胞,如果数量不足或亚群失衡将导致广泛的免疫系统功能紊乱[18],而细胞免疫主要由T淋巴细胞介导,T淋巴细胞及其亚群在根除病毒、持久防御病毒方面发挥着至关重要的作用[19]。T淋巴细胞按其表达的不同表面分子标志分成不同的亚群,如CD4+CD44+和CD8+CD44+ T细胞亚群[20-21]。CD4+ T细胞是Th2型细胞, 能够分泌抗体或细胞因子,促进B细胞成熟或增强抗原提呈细胞提呈的能力。CD8+ T细胞是Th1型细胞,能够发挥细胞免疫直接杀伤靶细胞。CD4+CD44+和CD8+CD44+的细胞分别代表了CD4+和CD8+效应T细胞。本研究通过流式细胞术检测了淋巴结细胞中CD4+CD44+和CD8+CD44+ T细胞含量,结果表明WCDCP-M能显著提高FMD疫苗免疫的CD4+CD44+和CD8+CD44+ T细胞的百分率含量,说明WCDCP能通过影响T淋巴细胞亚群的分化增强机体免疫能力。
4 结论新疆荒漠肉苁蓉粗多糖配伍FMDV灭活抗原免疫小鼠后可以增强体液免疫反应,配伍FMD疫苗免疫小鼠后,不仅可以增强体液免疫反应和细胞免疫反应,而且还具有持久的免疫增强作用,提高特异性T细胞的表达量。因此,新疆荒漠肉苁蓉粗多糖可以用于FMD疫苗免疫佐剂的研究,为开发安全、长效的新型免疫佐剂提供实验依据。
| [1] | WARD M P, HIGHFIELD L D, VONGSENG P, et al. Simulation of foot-and-mouth disease spread within an integrated livestock system in Texas, USA[J]. Prev Vet Med, 2009, 88(4): 286–297. DOI: 10.1016/j.prevetmed.2008.12.006 |
| [2] | SHI X J, WANG B, WANG M. Immune enhancing effects of recombinant bovine IL-18 on foot-and-mouth disease vaccination in mice model[J]. Vaccine, 2007, 25(7): 1257–1264. DOI: 10.1016/j.vaccine.2006.10.017 |
| [3] | CHEN X L, CHEN X Y, QIU S L, et al. Effects of epimedium polysaccharide-propolis flavone oral liquid on mucosal immunity in chickens[J]. Int J Biol Macromol, 2014, 64: 6–10. DOI: 10.1016/j.ijbiomac.2013.11.015 |
| [4] | DU X S, ZHAO Z Q. On fixed point theorems of mixed monotone operators[J]. Fixed Point Theory Appl, 2011, 2011: 563136. |
| [5] | HUANG F, ZHANG R F, LIU Y, et al. Dietary litchi pulp polysaccharides could enhance immunomodulatory and antioxidant effects in mice[J]. Int J Biol Macromol, 2016, 92: 1067–1073. DOI: 10.1016/j.ijbiomac.2016.08.021 |
| [6] | FENG H B, DU X G, TANG J, et al. Enhancement of the immune responses to foot-and-mouth disease vaccination in mice by oral administration of a novel polysaccharide from the roots of Radix Cyathulae officinalis Kuan (RC)[J]. Cell Immunol, 2013, 281(2): 111–121. DOI: 10.1016/j.cellimm.2013.02.004 |
| [7] | SUN W J, MENG K, QI C H, et al. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohyd Polym, 2015, 126: 91–96. DOI: 10.1016/j.carbpol.2015.03.034 |
| [8] |
张爱莲, 王丹阳, 赵淑述, 等. 新疆野生一枝蒿粗多糖对流感疫苗小鼠免疫增强效果的分析[J]. 畜牧兽医学报, 2016, 47(10): 2089–2097.
ZHANG A L, WANG D Y, ZHAO S S, et al. The analysis of immune enhancement effect of Xinjiang wild Artemisia rupestris L. crude polysaccharides on influenza viruses vaccines in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2089–2097. (in Chinese) |
| [9] | ZHANG A L, YANG Y, WANG Y, et al. Adjuvant-active aqueous extracts from Artemisia rupestris L. improve immune responses through TLR4 signaling pathway[J]. Vaccine, 2017, 35(7): 1037–1045. DOI: 10.1016/j.vaccine.2017.01.002 |
| [10] |
赵兵, 张爱莲, 王丹阳, 等. 新疆野生荒漠肉苁蓉粗多糖皮下免疫对流感病毒疫苗的免疫效果[J]. 中华微生物学和免疫学杂志, 2017, 37(1): 22–27.
ZHAO B, ZHANG A L, WANG D Y, et al. Wild Cistanche deserticol Y. C. Ma crude polysaccharides enhance the efficacy of influenza virus vaccine in mice via subcutaneous immunization[J]. Chinese Journal of Microbiology and Immunology, 2017, 37(1): 22–27. (in Chinese) |
| [11] | JIANG Y, TU P F. Analysis of chemical constituents in Cistanche species[J]. J Chromatogr A, 2009, 1216(11): 1970–1979. DOI: 10.1016/j.chroma.2008.07.031 |
| [12] |
杨秀梅, 杨雨, 王丹阳, 等. 新疆野生及栽培荒漠肉苁蓉提取物免疫活性研究[J]. 生物技术通报, 2016, 32(1): 131–137.
YANG X M, YANG Y, WANG D Y, et al. The study of immune activities of extracts from wild and cultivated Cistanche deserticola in Xinjiang[J]. Biotechnology Bulletin, 2016, 32(1): 131–137. (in Chinese) |
| [13] |
王丹阳, 杨雨, 赵兵, 等. 新疆野生一枝蒿粗多糖作为流感病毒疫苗佐剂的免疫效果[J]. 中华微生物学和免疫学杂志, 2016, 36(3): 230–234.
WANG D Y, YANG Y, ZHAO B, et al. Efficacy of using Xinjiang wild Artemisia rupestris L. crude polysaccharides as an immunologic adjuvant for influenza virus vaccine[J]. Chinese Journal of Microbiology and Immunology, 2016, 36(3): 230–234. (in Chinese) |
| [14] |
刘玉佳, 孔繁东, 刘兆芳, 等. 桔梗多糖Sevag法除蛋白工艺的研究[J]. 中国调味品, 2014, 39(4): 5–7.
LIU Y J, KONG F D, LIU Z F, et al. Research on technology of deproteinization from polysaccharide of platycodon grandiflorum by Sevag method[J]. China Condiment, 2014, 39(4): 5–7. (in Chinese) |
| [15] | DONG Q Q, LIN X, SHEN L, et al. The protective effect of herbal polysaccharides on ischemia-reperfusion injury[J]. Int J Biol Macromol, 2016, 92: 431–440. DOI: 10.1016/j.ijbiomac.2016.07.052 |
| [16] |
董耀泽, 李晓云, 张晋强, 等. 复方中药对猪嗜血支原体感染预防作用的研究[J]. 畜牧兽医学报, 2016, 47(2): 404–410.
DONG Y Z, LI X Y, ZHANG J Q, et al. Prophylactic effect of compound Chinese herbal medicine on Mycoplasma suis infection[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(2): 404–410. (in Chinese) |
| [17] | HUBER V C, MCKEON R M, BRACKIN M N, et al. Distinct contributions of vaccine-induced immunoglobulin G1(IgG1) and IgG2a antibodies to protective immunity against influenza[J]. Clin Vaccine Immunol, 2006, 13(9): 981–990. DOI: 10.1128/CVI.00156-06 |
| [18] |
徐占云, 秦睿玲, 褚耀诚, 等. 枸杞多糖对雏鸡淋巴细胞体外增殖及分泌IL-2的影响[J]. 畜牧兽医学报, 2013, 44(2): 322–328.
XU Z Y, QIN R L, CHU Y C, et al. Effects of Lycium barbarum polysaccharide on cell proliferation of chicken lymphocytes and IL-2 excretion in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(2): 322–328. (in Chinese) |
| [19] | UYANGAA E, CHOI J Y, PATIL A M, et al. Functional restoration of exhausted CD4+ and CD8+ T cells in chronic viral infection by vinegar-processed flos of Daphne genkwa[J]. Comp Immunol Microbiol Infect Dis, 2015, 39: 25–37. DOI: 10.1016/j.cimid.2015.02.001 |
| [20] |
胡友军, 林映才, 周桂莲, 等. 补益类中草药提取物对黄羽肉鸡生产性能和T淋巴细胞亚群的影响[J]. 中国畜牧杂志, 2004, 40(9): 23–25.
HU Y J, LIN Y C, ZHOU G L, et al. Effects of Chinese herb extraction on growth performance and T lymphocyte subsets of yellow feather type broiler[J]. Chinese Journal of Animal Science, 2004, 40(9): 23–25. (in Chinese) |
| [21] |
王鹏鹏, 柴长斌, 汪洋. CD8+ T细胞激活和免疫记忆形成的分子调节机制[J]. 中华微生物学和免疫学杂志, 2015, 35(7): 541–545.
WANG P P, CHAI C B, WANG Y. The molecules regulatory mechanism of CD8+ T cell activation and immune memory formation[J]. Chinese Journal of Microbiology and Immunology, 2015, 35(7): 541–545. (in Chinese) |



