2. 山东省动物疫病预防与控制中心, 济南 250022
2. Shandong Animal Disease Prevention and Control Center, Jinan 250022, China
禽波氏菌(Bordetella avium, B. avium)与引起哺乳动物鼻炎和支气管肺炎的支气管败血波氏杆菌同属于产碱杆菌科波氏杆菌属[1-4],可引起禽类高度接触性上呼吸道感染[5-11],还可导致孵化场种蛋的死胚率增加和孵化率降低等现象[12]。最早于1967年加拿大R. Filion等发现火鸡的禽波氏菌病[13],在我国朱瑞良等1990年在患眼炎鸡中分离到了该菌[14]。
近几年来,实验室在进行种禽孵化场蛋源性疫病病原调查分析的过程中,不断在鸡胚中分离到禽波氏菌,且经常与免疫抑制性病毒共感染存在[15-19]。免疫抑制性病毒单独感染,鸡体往往不表现明显的临床症状,但会破坏机体的免疫系统,导致机体呈现不同程度的免疫抑制状态,对抗原的免疫应答能力低下甚至缺失,并干扰其他疫苗的免疫效果,造成免疫失败,同时对其他条件性病原的易感性增强,从而给养殖场造成巨大的经济损失[20-22]。
在鸡群的免疫抑制性病毒中,网状内皮组织增殖病病毒(REV)的免疫抑制作用最强,目前在鸡群中感染普遍,且既能垂直传播,也能水平传播,是弱毒疫苗生产中潜在的污染源[23-24]。感染时间越早,致病作用越强。特别是经胚垂直传染或经污染的弱毒疫苗感染,将会对整个鸡群造成严重的威胁。
笔者将REV接种鸡胚模拟REV垂直感染后雏鸡的免疫抑制状态,继而研究该状态下共感染禽波氏菌对雏鸡的致病性,为研究临床多发性的混合感染提供借鉴。
1 材料与方法 1.1 REV毒株和单抗REV SNV-ori-p3株及其REV单克隆抗体11B154株,均由山东农业大学崔治中教授惠赠。试验中所使用REV病毒液为鸡胚成纤维细胞传代的细胞上清液,经间接免疫荧光方法检测,Reed-Muench法计算,上清液的TCID50为106.3·mL-1。
1.2 菌株禽波氏菌LL09鸡胚分离株,为山东农业大学预防兽医学实验室2009年分离鉴定,并于-80 ℃保存,23S rRNA的GenBank收录号为HM545299。
1.3 鸡胚240枚SPF鸡胚购于山东斯帕法斯(SPAFS)公司,严格消毒条件下孵化。
1.4 引物参考文献[12]中禽波氏菌、沙门菌、大肠杆菌和绿脓杆菌四重PCR和葡萄球菌单项PCR反应使用引物序列,具体信息如表 1中所示,由金斯瑞有限公司合成。
|
|
表 1 试验中PCR引物 Table 1 PCR primers used in this experiment |
脑心肉汤(BHI),美国Difco公司生产;切片石蜡,上海宏钛生产;醇溶伊红Y,Solarbio公司生产;DNA提取试剂盒、DNA Marker DL2000、PCR反应试剂盒,大连宝生物公司生产;电泳级琼脂糖,美国Sigma公司生产;其他均为国产分析纯。
1.6 REV感染鸡胚及检测240枚SPF鸡胚随机选取120枚在3日龄时经卵黄囊接种103 TCID50 REV,12日龄时随机采集鸡胚5枚,制备CEF,并用间接免疫荧光反应检测REV的感染。其余鸡胚继续孵化,雏鸡孵出后以备禽波氏菌的感染。
1.7 禽波氏菌LL09的复苏增殖及LD50检测将-80 ℃保存的禽波氏菌LL09接种于5%绵羊血琼脂平板,复苏后接种于脑心浸液肉汤,37 ℃摇床振摇培养,取18 h对数生长期的肉汤培养物,检测凝集1%豚鼠红细胞的能力。参照文献方法[25]进行细菌计数,调整菌液浓度后腹腔接种1日龄雏鸡,按Reed-Muench法计算LD50。
1.8 禽波氏菌感染雏鸡及致病性检测从胚期未感染REV的鸡胚孵出的雏鸡中随机选取体型大小均一的雏鸡96只,分成2组,其中一组作为无感染对照(标记为control),另一组在1日龄稳定12 h时经鼻腔接种100 LD50禽波氏菌,作为禽波氏菌单纯感染对照(标记为B. avium)。胚期感染过REV的雏鸡同样随机选取96只,分成2组,其中一组作为单纯REV感染对照(标记为REV),另一组在1日龄时经鼻腔感染100 LD50禽波氏菌,作为REV和禽波氏菌的共感染组(标记为REV-B. avium)。4组雏鸡分别置于不同隔离罩中饲养,饲料、饮水均经高压灭菌处理,自由饮水、采食,10日龄全部免疫NDV灭活苗。
攻毒后每周从4组中随机选取8只称重监测雏鸡体重的变化,然后采血分离血清,分别用间接血凝试验和平板凝集试验测定NDV和禽波氏菌的抗体水平;攻毒后第3~10天每组采血并剖杀3只,分别从气管、肺、心、肝等器官进行细菌分离培养,检测禽波氏菌感染不同组织的最早时间;3、5、8周每组随机剖杀8只,采集胸腺、脾和法氏囊等免疫器官称重并分别计算各免疫器官指数,同时采集各组织病料,部分提取DNA,多重PCR检测组织中禽波氏菌的感染及是否有其他细菌的继发感染,另外部分放入10%福尔马林(即3.7%~4.0%甲醛)固定,HE染色,观察组织的病理变化。
1.9 数据统计分析试验中所采集的所有数据均经Excel 2007统计,并用DPS数据处理系统中的LSD法进行差异分析和多重比较确定不同处理间的差异显著性。
2 结果 2.1 REV感染检测及鸡胚的孵化采集感染REV的12日龄鸡胚制备CEF,培养2 d后用单克隆抗体间接免疫荧光检测到明亮荧光,表明鸡胚已经成功感染REV。REV感染鸡胚的孵化率为92.5%,与未感染组的94.1%相比略低。
2.2 雏鸡的生长抑制检测不同感染组对雏鸡体重的影响如图 1所示。2周时3个感染组与对照组相比差异显著(P<0.05);随着感染时间的延长,REV感染组和REV-B. avium感染组与对照组差异显著(P<0.05),而B. avium单纯感染组生长抑制作用较弱。
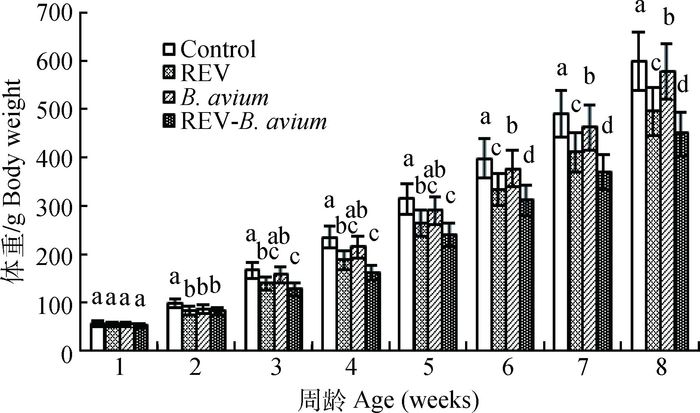
|
各组间,标注不同字母者差异显著(P<0.05),标注含相同字母者差异不显著(P>0.05),下图同 Among the groups, the columns with different letters differ significantly, the columns with the same letters didn't differ significantly (P > 0.05), the same as below 图 1 REV免疫抑制状态下感染禽波氏菌对雏鸡体重的影响 Figure 1 Effect of B. avium infection in REV immunosuppressive state on body weight |
不同感染组对雏鸡各免疫器官指数的影响如图 2~4所示。3周时禽波氏菌感染组的免疫器官指数与对照组相比增大,差异显著(P<0.05),但随着雏鸡日龄的增加,逐渐接近对照组;REV感染组的免疫器官指数与对照组相比减小,差异显著(P<0.05);REV免疫抑制状态下感染禽波氏菌雏鸡的免疫器官指数在3周时介于二者之间,但到8周时甚至低于REV感染组,胸腺指数、脾指数和法氏囊指数与未感染对照组及禽波氏菌单纯感染组相比差异显著(P<0.05)。
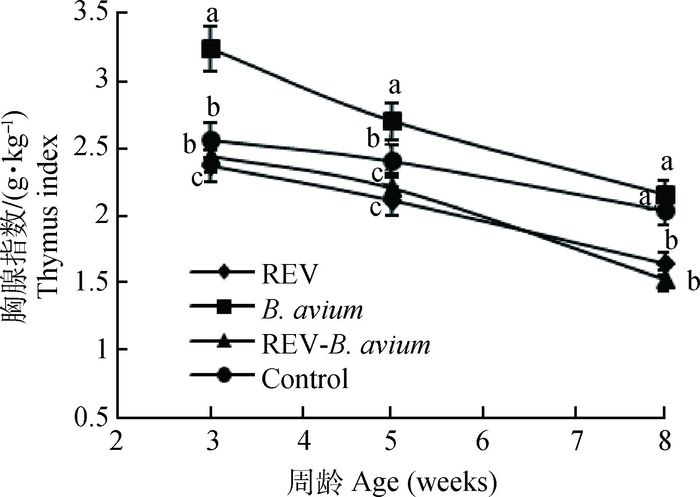
|
图 2 REV免疫抑制状态下感染禽波氏菌对胸腺指数的影响 Figure 2 Effect of B. avium infection in REV immunosuppressive state on thymus index |
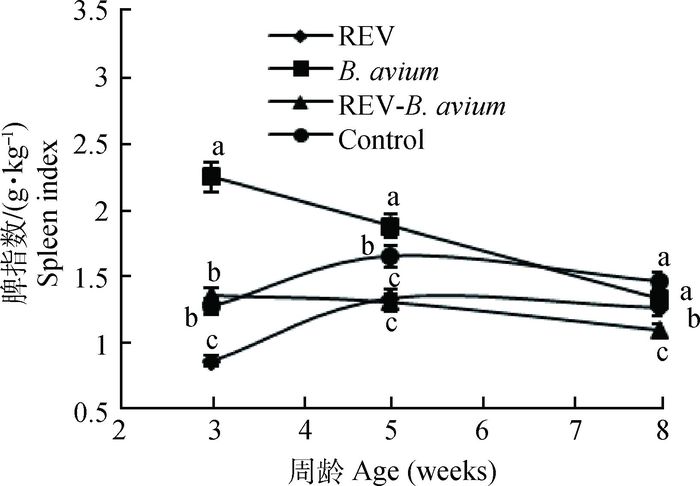
|
图 3 REV免疫抑制状态下感染禽波氏菌对脾指数的影响 Figure 3 Effect of B. avium infection in REV immunosuppressive state on spleen index |
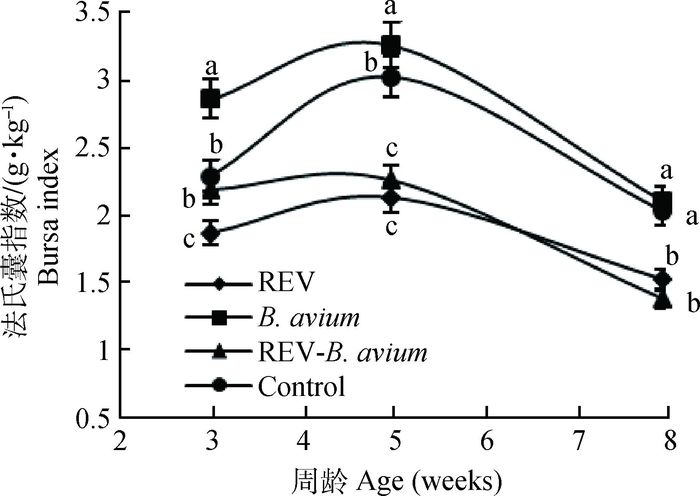
|
图 4 REV免疫抑制状态下感染禽波氏菌对法氏囊指数的影响 Figure 4 Effect of B. avium infection in REV immunosuppressive state on bursa index |
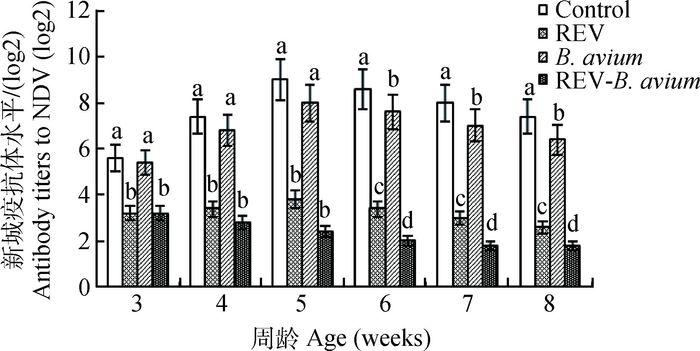
不同感染组对新城疫灭活苗免疫后抗体水平增长的影响如图 5所示。禽波氏菌单纯感染对NDV抗体水平仅有轻微的抑制作用;REV感染组和混合感染组在3周时即开始呈现明显的抑制作用,与对照组差异显著(P<0.05);从4周开始,REV感染组的NDV抗体水平虽低于对照组,但稍有上升,而共感染组的NDV抗体水平持续下降,二者对于抗体水平的抑制具有协同作用。
|
图 5 REV免疫抑制状态下感染禽波氏菌对NDV抗体水平的影响 Figure 5 Effect of B. avium infection in REV immunosuppressive state on antibody titers to NDV |
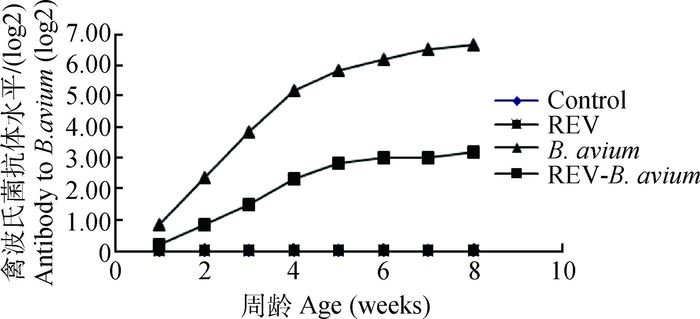
REV免疫抑制状态对禽波氏菌抗体应答的影响如图 6所示。胚期感染REV后,严重影响了雏鸡对抗原的正常免疫应答反应,REV免疫抑制状态下禽波氏菌抗体水平显著低于禽波氏菌的单纯感染组(P<0.05)。
|
图 6 REV免疫抑制状态对禽波氏菌抗体水平的影响 Figure 6 Effect of REV immunosuppressive state on antibody to B. avium |
不同感染组对禽波氏菌在鸡体各组织中最早检出时间的影响如表 2所示。对照组及REV感染组均没有检出禽波氏菌;禽波氏菌单纯感染和共感染组在气管、肺和脾中检出禽波氏菌的最早时间没有差异,但在肝、心和肾中共感染组比单纯感染组提前1 d检测到了禽波氏菌。在血液及其他组织中未检测到禽波氏菌。
|
|
表 2 组织中禽波氏菌的最早检出时间 Table 2 The first time points to detect B. avium in different tissues post-infection |
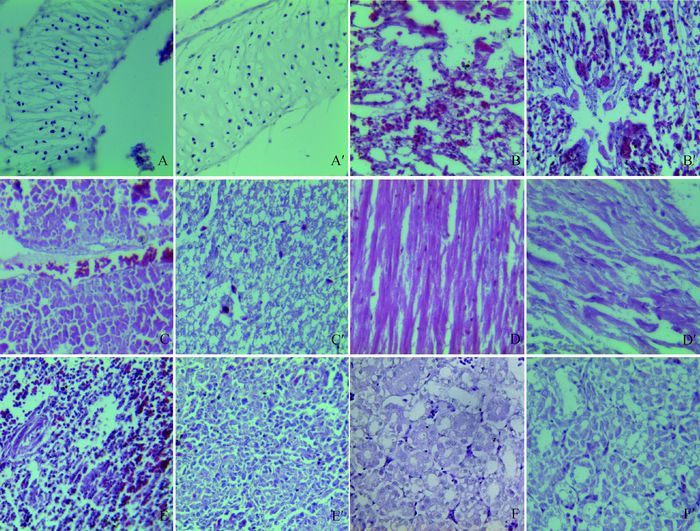
禽波氏菌单纯感染组织的病理变化如图 7中A~F所示,REV免疫抑制状态下感染禽波氏菌的组织病理变化如A′~F′所示。单纯感染组气管黏膜部分脱落入管腔中,肺充血、水肿,肝淤血,心肌细胞变性,脾小体淋巴细胞缺失,肾小管上皮细胞变性坏死;REV免疫抑制状态下感染禽波氏菌气管黏膜完全脱落,肝细胞大面积变性、坏死,肝固有结构消失,心肌细胞除变性外还有坏死现象;脾增生,白髓淋巴细胞缺失、坏死,肾小管上皮细胞呈现广泛性变性坏死。而胸腺、法氏囊等组织未检出禽波氏菌感染,病理变化与REV单纯感染组没有差异。
|
A~F.分别为禽波氏菌单纯感染雏鸡气管、肺、肝、心、脾和肾的病理变化;A′~F′.分别为REV免疫抑制状态下感染禽波氏杆菌雏鸡气管、肺、肝、心、脾和肾的病理变化 A-F. Pathological changes of trachea, lung, liver, heart, spleen and kidney induced by B. avium; A′-F′. Pathological changes of trachea, lung, liver, heart, spleen and kidney induced by B. avium in REV immunosuppressive state 图 7 雏鸡REV免疫抑制状态下感染禽波氏菌组织的病理变化(400×,HE染色) Figure 7 Pathological changes of tissues induced by B. avium in REV immunosuppressive state(400×, HE staining) |
不同感染组雏鸡的细菌继发感染状况如表 3所示。3周时开始有细菌继发感染病例出现,5周时REV感染组和混合感染组的继发感染病例数高于禽波氏菌感染组,8周时混合感染组的继发感染病例数超过了二者的单纯感染组。在继发感染细菌种类上共检出大肠杆菌和绿脓杆菌两种,对照组未检出继发感染细菌。
|
|
表 3 雏鸡继发细菌感染状况 Table 3 Ratio of secondary bacterial infection |
REV是导致禽类免疫抑制性疾病的重要病原之一,据相关资料表明在已知的几种免疫抑制性病毒中所造成的免疫抑制作用最强[20]。近年来,REV在全球范围内广泛流行,已呈世界性分布,国内鸡群感染也日益严重[21-24]。REV本身并不直接导致禽类死亡,但能够破坏机体的免疫系统,导致机体的免疫功能下降,从而为其他病原的入侵提供了便利。而禽波氏菌是一种典型的条件性致病菌,单纯感染致病力并不强。但REV和禽波氏菌二者之间一旦出现交集,“分工合作”将给禽类养殖造成巨大的经济损失。
试验中发现REV对雏鸡具有较强的生长抑制作用,单纯禽波氏菌感染作用较弱,REV免疫抑制状态下感染禽波氏菌对生长抑制具有明显的促进作用,与报道中B亚型禽白血病病毒与禽波氏菌共感染的生长抑制作用相似[26]。不同之处是REV免疫抑制状态下感染禽波氏菌造成鸡群个体之间差异增大,且提高了鸡群中“僵鸡”的比例。
综合试验中对免疫器官指数、新城疫灭活苗免疫后抗体水平以及禽波氏菌抗体水平的检测结果,可以看出禽波氏菌单纯感染仅有轻微的免疫抑制作用,而REV感染可引起严重的免疫抑制状态,在这种免疫抑制状态下禽波氏菌的感染促进了雏鸡免疫器官的萎缩,不止抑制了新城疫抗体水平的上升,还使抗体的有效时间缩短,原因应该与禽波氏菌感染引起细胞损伤有关。二者的混合感染明显加重了免疫抑制状态,与资料报道结果相似[27],同时REV感染还抑制了鸡体禽波氏菌的抗体水平。
与禽波氏菌单纯感染相比,混合感染组的气管、肺和脾中禽波氏菌的最早检出时间没有变化,但在肝、心和肾中的最早检出时间提前了1 d。说明在REV造成的免疫抑制状态下,雏鸡对禽波氏菌的免疫应答水平降低,使禽波氏菌入侵组织并扩散的能力增强。同时禽波氏菌被鸡体清除的速度减慢,延长了其在组织中的持续感染时间,并且导致其他细菌继发感染的病例数增多,这些状况都与REV感染产生的免疫抑制状态直接相关。
4 结论REV感染导致雏鸡的免疫抑制状态,降低了鸡体对禽波氏菌的免疫应答反应,使禽波氏菌在组织中的检出时间提前,并促进了其在组织中的扩散,加重了病理变化,增强了禽波氏菌对雏鸡的致病性。
| [1] | WANG C W, LIU L P, ZHANG Z, et al. Immunological and protective effects of Bordetella bronchiseptica subunit vaccines based on the recombinant N-terminal domain of dermonecrotic toxin[J]. Int Immunopharmacol, 2015, 28(2): 952–959. DOI: 10.1016/j.intimp.2015.08.018 |
| [2] | SRIGLEY J A, GOLDFARB D M, PERNICA J M. Bordetella species other than Bordetella pertussis[J]. Clin Microbiol Newsletter, 2015, 37(8): 61–65. DOI: 10.1016/j.clinmicnews.2015.03.004 |
| [3] |
李洪广, 王芳, 姜平, 等. 兔支气管败血波氏杆菌PRN基因缺失突变株的构建及特性研究[J]. 畜牧兽医学报, 2012, 43(2): 299–305.
LI H G, WANG F, JIANG P, et al. Construction of defined mutations of PRN of rabbit Bordetella bronchiseptica and property research[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(2): 299–305. (in Chinese) |
| [4] |
覃娟娟, 顾凡, 蔡雨涵, 等. 副猪嗜血杆菌毒力菌株和猪支气管败血波氏杆菌毒力菌株双重PCR检测方法的建立及应用[J]. 中国兽医学报, 2015, 35(8): 1217–1222.
QIN J J, GU F, CAI Y H, et al. Establishment and application of duplex PCR for detecting virulent strains of Haemophilus parasuis and Bordetella bronchiseptica[J]. Chinese Journal of Veterinary Science, 2015, 35(8): 1217–1222. (in Chinese) |
| [5] | BEACH N M, THOMPSON S, MUTNICK R, et al. Bordetella avium antibiotic resistance, novel enrichment culture, and antigenic characterization[J]. Vet Microbiol, 2012, 160(1-2): 189–196. DOI: 10.1016/j.vetmic.2012.05.026 |
| [6] | LOKER S B, TEMPLE L M, PRESTON A. The Bordetella avium BAV1965-1962 fimbrial locus is regulated by temperature and produces fimbriae involved in adherence to turkey tracheal tissue[J]. Infect Immun, 2011, 79(6): 2423–2429. DOI: 10.1128/IAI.01169-10 |
| [7] | SEBAIHIA M, PRESTON A, MASKELL D J, et al. Comparison of the genome sequence of the poultry pathogen Bordetella avium with those of B. bronchiseptica, B. pertussis, and B. parapertussis reveals extensive diversity in surface structures associated with host interaction[J]. J Bacteriol, 2006, 188(16): 6002–6015. DOI: 10.1128/JB.01927-05 |
| [8] | MIYAMOTO D M, RUFF K, BEACH N M, et al. Bordetella avium causes induction of apoptosis and nitric oxide synthase in turkey tracheal explant cultures[J]. Microbes Infect, 2011, 13(10): 871–879. DOI: 10.1016/j.micinf.2011.04.011 |
| [9] | MORENO L Z, KNÖBL T, GRESPAN A A, et al. Draft genome sequence of Bordetella avium Nh1210, an outbreak strain of lockjaw syndrome[J]. Genome Announc, 2015, 3(2): e00120-15. DOI: 10.1128/genomeA.00120-15 |
| [10] | RAFFEL T R, REGISTER K B, MARKS S A, et al. Prevalence of Bordetella avium infection in selected wild and domesticated birds in the eastern USA[J]. J Wildlife Dis, 2002, 38(1): 40–46. DOI: 10.7589/0090-3558-38.1.40 |
| [11] | NOVIKOV A, SHAH N R, ALBITAR-NEHME S, et al. Complete Bordetella avium, Bordetella hinzii and Bordetella trematum lipid A structures and genomic sequence analyses of the loci involved in their modifications[J]. Innate Immun, 2014, 20(6): 659–672. DOI: 10.1177/1753425913506950 |
| [12] |
谭燕玲, 朱瑞良, 王慧, 等. 鸡胚胎性病原菌多重PCR检测方法的建立[J]. 中国预防兽医学报, 2011, 33(5): 374–377.
TAN Y L, ZHU R L, WANG H, et al. Establishment of multiplex PCR detection for pathogens of chicken embryos[J]. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(5): 374–377. (in Chinese) |
| [13] | FILION R, CLOUTIER S, VRANCKEN E R, et al. Infection respiratoire du dindonneau causée par un microbe apparenté au Bordetella bronchiseptica[J]. Can J Comp Med Vet Sci, 1967, 31(5): 129–134. |
| [14] |
朱瑞良, 张绍学, 唐珂心. 鸡波氏杆菌病研究初报[J]. 山东农业大学学报, 1991, 22(1): 91–94.
ZHU R L, ZHANG S X, TANG K X. Primary study on the disease caused by Bordetella avium in chickens[J]. Journal of Shandong Agricultural University, 1991, 22(1): 91–94. (in Chinese) |
| [15] | LIANG M F, ZHAO Q Y, LIU G H, et al. Pathogenicity of Bordetella avium under immunosuppression induced by Reticuloendotheliosis virus in specific-pathogen-free chickens[J]. Microb Pathog, 2013, 54: 40–45. DOI: 10.1016/j.micpath.2012.09.003 |
| [16] | GUO F X, XUE C, WU C, et al. Effects of polysaccharide on chicks co-infected with Bordetella avium and Avian leukosis virus[J]. Carbohydr Polym, 2014, 109: 71–76. DOI: 10.1016/j.carbpol.2014.03.048 |
| [17] | LIU L P, YU C L, WANG C W, et al. Immuno-enhancement of Taishan Pinus massoniana pollen polysaccharides on recombinant Bordetella avium ompA expressed in Pichia pastoris[J]. Microb Pathog, 2016, 95: 54–61. DOI: 10.1016/j.micpath.2016.03.002 |
| [18] | ZHU F J, LIU X, SUN Z H, et al. Immune-enhancing effects of Taishan Pinus massoniana pollen polysaccharides on DNA vaccine expressing Bordetella avium ompA[J]. Front Microbiol, 2016, 7: 66. |
| [19] | ZHAO X, LIANG M F, YANG P P, et al. Taishan Pinus massoniana pollen polysaccharides promote immune responses of recombinant Bordetella avium ompA in BALB/c mice[J]. Int Immunopharmacol, 2013, 17(3): 793–798. DOI: 10.1016/j.intimp.2013.09.008 |
| [20] | FAIZ N M, CORTES A L, GUY J S, et al. Efficacy of various Marek's disease vaccines protocols for prevention of Marek's disease virus-induced immunosuppression[J]. Vaccine, 2016, 34(35): 4180–4187. DOI: 10.1016/j.vaccine.2016.06.061 |
| [21] |
李凯, 高立, 祁小乐, 等. 禽网状内皮组织增生病病毒感染对SPF鸡免疫器官和疫苗免疫效果的影响[J]. 畜牧兽医学报, 2016, 47(2): 340–345.
LI K, GAO L, QI X L, et al. The influence of reticuloendotheliosis virus infection on immune organs and immune efficacy in SPF chickens[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(2): 340–345. (in Chinese) |
| [22] |
陈瑞爱, 李延鹏, 郭凯, 等. 禽网状内皮组织增生症病毒p30-gp90串联表达蛋白及其免疫原性[J]. 微生物学报, 2014, 54(3): 352–358.
CHEN R A, LI Y P, GUO K, et al. Immunogenicity of co-expressed p30-gp90 against reticuloendotheliosis virus[J]. Acta Microbiologica Sinica, 2014, 54(3): 352–358. (in Chinese) |
| [23] |
庄萍萍, 王小满, 孟薇, 等. 网状内皮增生症病毒感染改变外泌体蛋白质组成和免疫调节功能[J]. 中国细胞生物学学报, 2016, 38(6): 682–690.
ZHUANG P P, WANG X M, MENG W, et al. The infection of reticuloendotheliosis virus changed the protein composition and immunomodulation of exosome[J]. Chinese Journal of Cell Biology, 2016, 38(6): 682–690. DOI: 10.11844/cjcb.2016.06.0021 (in Chinese) |
| [24] |
王一新, 栾怀彪, 许书珍, 等. 禽网状内皮组织增生症病毒LN1201株的全基因组序列分析及其U3区的独特性[J]. 中国预防兽医学报, 2016, 38(11): 855–859.
WANG Y X, LUAN H B, XU S Z, et al. Genome analysis of a reticuloendotheliosis virus and the unique insertion in U3 region[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(11): 855–859. (in Chinese) |
| [25] |
杨萍萍, 刘静静, 赵雪, 等. 间接免疫酶组化检测禽波氏杆菌在感染鸡体内的抗原定位[J]. 中国兽医学报, 2013, 33(12): 1832–1837.
YANG P P, LIU J J, ZHAO X, et al. Study on localization of Bordetella avium in infected chickens by indirect immunoperoxidase technique[J]. Chinese Journal of Veterinary Science, 2013, 33(12): 1832–1837. (in Chinese) |
| [26] |
郭繁霞, 朱瑞良, 吴村, 等. B亚型禽白血病病毒所致免疫抑制条件下共感染禽波氏杆菌对雏鸡的影响[J]. 中国兽医学报, 2014, 34(7): 1072–1077, 1093.
GUO F X, ZHU R L, WU C, et al. Effect of pathogenicity of Bordetella avium under immunosuppression induced by avian leukosis virus in chickens[J]. Chinese Journal of Veterinary Science, 2014, 34(7): 1072–1077, 1093. (in Chinese) |
| [27] |
梁漫飞, 朱瑞良, 高秀妹, 等. 禽波氏杆菌与REV共感染对SPF鸡免疫系统的影响[J]. 中国兽医学报, 2013, 33(6): 833–837.
LIANG M F, ZHU R L, GAO X M, et al. Effects of co-infection of REV and B. avium on immune system in SPF chicken[J]. Chinese Journal of Veterinary Science, 2013, 33(6): 833–837. (in Chinese) |



