2. 省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室, 南京 210014
2. Key Lab of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Nanjing 210014, China
猪支原体肺炎(Mycoplasmal pneumonia of swine)的主要病原是猪肺炎支原体(Mycoplasma hyopneumoniae, M. hyopneumoniae),是一种慢性、高传染性、可接触性的动物呼吸道疾病[1-2],发病率高、死亡率低,在世界各地的猪场广泛流行和传播[3-6],引起的猪呼吸道疾病综合征(porcine respiratory disease complex, PRDC)又加重了病情,严重危害规模化养猪业的健康发展[7-8]。M. hyopneumoniae被认为是最难净化[9],流行范围最广,也最容易受其他病原影响的动物病原之一。
猪鼻支原体(Mycoplasma hyorhinis, M. hyorhinis)属于一种常在的寄生菌,常存在于病猪的鼻腔、气管和支气管分泌物中,被认为是猪支原体肺炎的第二致病病原[10]。M. hyorhinis主要通过呼吸道和直接接触传播,感染率高,在猪免疫力下降时,是猪多发性浆膜炎、胸膜炎、腹膜炎、肺炎、心包炎、关节炎、咽鼓管炎、中耳炎等的主要病原[11-13],常与一些病毒、细菌混合感染,给养猪业造成巨大的经济损失。另外,M. hyorhinis是细胞培养中常见的污染物[14],一旦受到污染很难被清除掉;而且与人类的某些肿瘤疾病的发生有关[15-16]。
M. hyopneumoniae和M. hyorhinis的检测方法主要是依靠临床诊断(屠宰场监测)、分离培养、血清学和分子生物学诊断方法[17-23]。基于荧光定量PCR技术具有敏感性好、特异性高、快速、定量精确等优点,现已成为疾病诊断的良好工具。本研究建立一种同时针对M. hyopneumoniae、M. hyorhinis的双重荧光定量PCR方法,有助于快速地定性和定量监测M. hyopneumoniae和M. hyorhinis的感染,为动物疫病的防控提供平台技术。
1 材料与方法 1.1 材料 1.1.1 菌株M. hyopneumoniae、M. hyorhinis、猪滑液支原体(M. hyosynoviae)、猪絮状支原体(M. flocculare)、猪流感病毒(swine influenza virus,SIV)、猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)、猪圆环病毒2型(porcine circovirus type 2,PCV2)、副猪嗜血杆菌(Haemophilus parasuis, HPS)、猪细小病毒病(porcine parvovirus infection,PPI)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、鸡毒支原体(Mycoplasma Gallisepticum, MG)、金黄色葡萄球菌(Staphylococcus aureus,SAU)、大肠杆菌(Escherichia coli,E. coli)均由江苏省农业科学院兽医研究所猪病防控研究室保存。
1.1.2 主要试剂及仪器动物DNAout试剂盒、柱式细菌DNAout试剂盒、一管式病毒DNA-RNAout试剂盒,均购自北京天恩泽基因科技有限公司;AceQ qPCR probe master mix购自南京诺唯赞生物科技有限公司;常规PCR反应试剂盒购自宝生物工程(大连)有限公司;QuantStudio 5荧光定量PCR仪为美国Thermofisher Scientific公司产品。
1.1.3 引物和探针合成M. hyopneumoniae序列P97[24]和M. hyorhinis序列P37[25]荧光定量PCR方法的探针采用相同的荧光信号,因此对M. hyorhinis序列P37探针进行了优化,使用Texas Red标记取代了FAM。荧光定量PCR所用的探针、引物由TaKaRa公司合成,普通PCR[19, 26]引物由金斯瑞生物科技有限公司合成。
1.2 方法 1.2.1 荧光定量PCR方法建立与优化在已建立的M. hyopneumoniae和M. hyorhinis荧光定量PCR方法[24-25]基础上对双重荧光定量PCR反应的引物浓度、探针浓度进行优化,建立最佳反应体系。荧光定量PCR反应体系(20 μL)组成如下:AceQ qPCR probe master mix 10 μL,M. hyopneumoniae和M. hyorhinis引物、探针终浓度5 μmol·L-1,模板1 μL,ddH2O补足至20 μL。反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s、60 ℃ 60 s,40个循环。根据以上的基本反应及扩增条件,分别以M. hyopneumoniae和M. hyorhinis DNA为模板,对引物浓度范围(3~10 μmol·L-1)、探针浓度范围(0.5~5 μmol·L-1)和退火温度(50~60 ℃)进行优化。
1.2.2 敏感性检测M. hyopneumoniae和M. hyorhinis阳性质粒分别以10倍梯度稀释的标准品为模板,经优化好的反应体系和反应条件检测该方法的灵敏度。
1.2.3 特异性检测参照柱式细菌DNAout试剂盒、一管式病毒DNA-RNAout试剂盒说明书提取M. hyopneumoniae、M. hyorhinis、M. hyosynoviae、M. flocculare、SIV、APP、PCV2、HPS、PPI、PRRSV、MG、SAU、E. coli阳性样本的DNA,并用优化好的多重PCR检测体系和条件来评价该检测方法的特异性。
1.2.4 重复性试验以3个不同浓度的M. hyopneumoniae质粒和3个不同浓度的M. hyorhinis质粒合并将混合物作为模板,分别进行3次批内、批间的平行试验,通过计算变异系数(CV)来判定该方法的重复性。
1.2.5 临床样本的采集及检测10份肺组织样本、50份鼻拭子、12份支气管肺泡灌洗液样本采集自江苏省多个发病猪场。肺组织样本的采集,需要将待检猪剖杀,采取新鲜猪肺,并用无菌PBS冲洗干净,剪切正常与病变交界处;鼻拭子样本的采集,先将待检猪绑定后,棉签轻轻碰到鼻中隔,刺激猪打喷嚏3~5次后,迅速拔出棉签得到鼻拭子样本;支气管肺泡灌洗液样本的采集需将待检猪剖杀,收集新鲜肺,从气管灌入无菌PBS溶液,轻轻揉捏肺,使PBS充分浸入肺,收集灌洗液样本[27]。
样本处理后,应用所提取基因组DNA为模板。用优化好的双重荧光定量PCR体系进行检测,并同时做M. hyopneumoniae、M. hyorhinis普通PCR,比较两种方法的检出率。
2 结果 2.1 荧光定量PCR方法建立与优化以10倍梯度稀释的M. hyopneumoniae、M. hyorhinis质粒的混合物为模板进行双重荧光定量PCR扩增。通过优化,确定双重荧光定量PCR反应体系引物、探针的最佳配比:P97F(10 μmol·L-1) 0.5 μL、P97R(10 μmol·L-1)0.5 μL、P97P(10 μmol·L-1)0.5 μL、P37F(10 μmol·L-1)0.5 μL、P37R(10 μmol·L-1)0.5 μL、P37P(10 μmol·L-1) 1.5 μL,模板1 μL,ddH2O补足至20 μL。优化的反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s、60 ℃ 60 s,40个循环。
2.2 荧光定量PCR标准曲线的建立将1×106拷贝·μL-1的M. hyopneumoniae、M. hyorhinis的重组质粒10倍系列稀释,以1×101~1×106拷贝·μL-1的稀释液为模板进行双重荧光定量PCR扩增,扩增结果浓度为横坐标,对应的Ct值为纵坐标,得到2条标准曲线(图 1);M. hyopneumoniae的斜率(Slope)、线性相关系数R2和扩增效率E分别为-3.381 5、0.998、97.58%;M. hyorhinis的Slope、R2和E分别为-3.433 6、0.995 4、95.55%,扩增产物的Ct值与浓度之间线性关系良好。
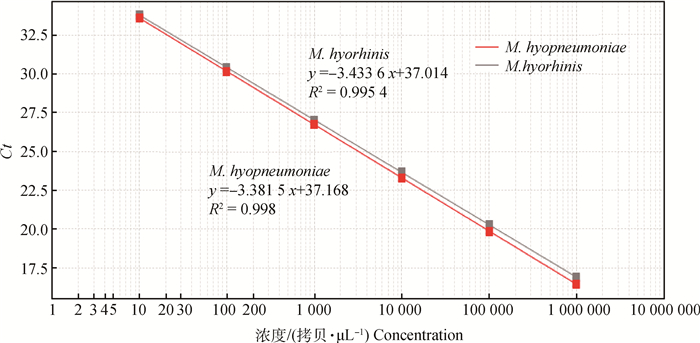
|
图 1 双重荧光定量PCR体系标准曲线 Figure 1 Standard curve of duplex real-time PCR |
以M. hyopneumoniae、M. hyorhinis、M. hyosynoviae、M. flocculare、SIV、APP、PCV2、HPS、PPI、PRRSV、MG、SAU、E. coli阳性样本的DNA为模板,进行双重荧光定量PCR检测。结果如图 2所示。用所建立的方法检测M. hyosynoviae、M. flocculare、SIV、APP、PCV2、HPS、PPI、PRRSV、MG、SAU、E. coli结果均为阴性,无扩增曲线,该方法能特异性检测M. hyopneumoniae、M. hyorhinis。
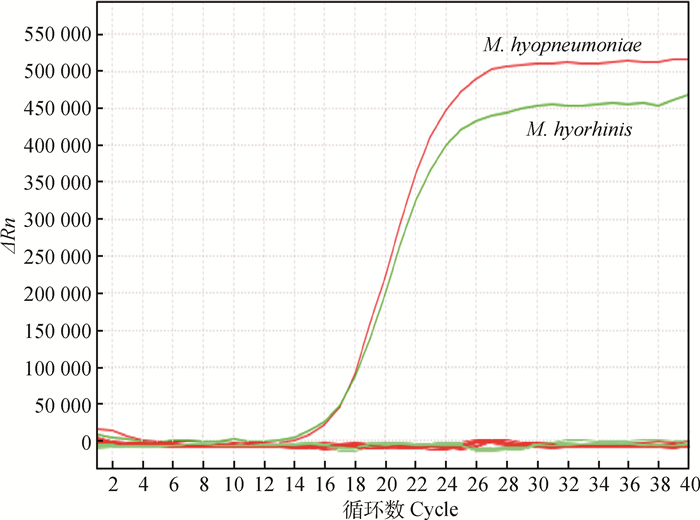
|
图 2 Mhp特异性试验结果曲线 Figure 2 The amplification curve of speicific experiments |
M. hyopneumoniae、M. hyorhinis重组质粒以1×101~1×106拷贝·μL-1的稀释液为模板,进行荧光定量PCR扩增,检验该体系敏感性,由扩增曲线可以确定1×101拷贝·μL-1为最低检出量(图 3)。
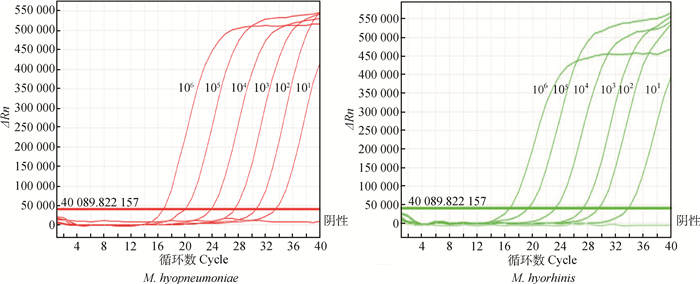
|
图 3 荧光定量PCR体系敏感性试验 Figure 3 Sensitivity test of the real-time PCR |
将1×106、1×105、1×104拷贝·μL-13个不同浓度的M. hyopneumoniae质粒和3个不同浓度的M. hyorhinis质粒合并将混合物作为模板,进行3次批内和批间平行试验,根据计算变异系数(CV),衡量该方法的重复性。如表 1所示,该方法批内试验和批间试验的变异系数均小于5%[28-33]。本研究所建立的M. hyopneumoniae和M. hyorhinis双重荧光定量PCR检测方法具有很好的重复性。
|
|
表 1 荧光定量PCR的批内和批间检测结果 Table 1 The intra and inter detection result of duplex real-time PCR |
10份肺样本、50份鼻拭子、12份支气管肺泡灌洗液DNA经双重体系检测出M. hyopneumoniae肺阳性率80%,鼻拭子阳性率22%,支气管肺泡灌洗液阳性率58.33%;M. hyorhinis肺阳性率40%,鼻拭子阳性率66%,支气管肺泡灌洗液阳性率41.67%,如表 2所示。
|
|
表 2 双重荧光定量PCR和普通PCR检测临床样品的结果 Table 2 The results of the duplex real-time PCR and conventional PCR tested of clinical samples |
通过试验对比,本研究建立的M. hyopneumoniae和M. hyorhinis双重荧光定量PCR比普通PCR方法更敏感、特异,且具有较好的临床实用性,可用于临床样品的检测。
3 讨论M. hyopneumoniae和M. hyorhinis已成为猪场的常见病和多发病,常发生混合感染及其后的继发感染[34],严重危害养猪业的发展。越来越多的研究人员开始研究其致病机制,而如何有效地防控猪支原体疾病,也已成为重要的课题。近年来,新的检测方法不断应用于猪源支原体的检测。现阶段实验室检测主要以分离培养、ELISA等免疫学方法,PCR及荧光定量PCR等常规分子生物学方法为主。支原体较难分离培养,且培养速度缓慢,需要1周甚至更长时间才能在显微镜下观察到支原体的形态;另外,在样本采集后,运输过程、分离、培养等各环节都需要苛刻的温度和湿度,很容易在培养过程中发生死亡或丢失,导致分离培养失败,出现假阳性的结果,因此不能为临床提供及时的诊断。普通PCR仪器和试剂相对较廉价,对于条件相对简单的基层实验室,普通PCR检测方法仍有一定的实用性,但敏感性低,无法对未知样本进行定量,因此很大程度上限制了PCR的应用。荧光定量PCR操作简便,敏感性好,不需要PCR后处理,降低了污染的可能性,还实现了对检测样本的准确定量。双重荧光定量PCR是在荧光PCR基础上衍生出来的更加高效、经济、操作便捷的检测技术,对待检病原的不同基因做不同荧光标记,以达到一次PCR反应就可以检测多种病原,目前双重荧光定量PCR广泛应用于动物疫病的检测及诊断、食品安全检验等领域。
根据实验室前期研究,M. hyopneumoniae和M. hyorhinis普通PCR均可检测到104拷贝·μL-1;单重的荧光定量PCR均可检测到10拷贝·μL-1[19, 26]。本研究参照E. L. Strait等[24]、武昱孜等[19, 25]建立的荧光定量PCR检测方法,通过荧光信号强度较高且干扰较小的FAM和Texas Red两种不同的荧光信号,建立双重荧光定量PCR检测方法,能在2 h内同时鉴定区分M. hyopneumoniae和M. hyorhinis,且敏感性也可达到单重荧光定量PCR的最低检出限10拷贝·μL-1。双重荧光定量PCR检测M. hyopneumoniae和M. hyorhinis的标准曲线的相关系数分别达0.998、0.995 4,具有较高的准确性和良好的稳定性。检测不同浓度的DNA样本时,M. hyopneumoniae和M. hyorhinis基因在同一个体系中进行PCR,扩增效率基本相同,且FAM、Texas Red这2种荧光信号同时收集不存在相互干扰的现象,稳定性良好,更有效地简化了试验过程。国内外尚未见有关于荧光定量PCR方法同时检测M. hyopneumoniae和M. hyorhinis两种猪支原体的研究报道。本研究建立同时鉴别诊断2种猪主要支原体检测方法,大大缩短检测时间,提高了检测的准确性,很有应用前景。
应用所建立的方法对江苏省发病猪场采集的10份肺样本、50份鼻拭子、12份支气管肺泡灌洗液进行了检测,双重荧光定量PCR可以显著提高临床样本中M. hyopneumoniae和M. hyorhinis的检出率,定量方法的阳性率明显高于定性方法。两种方法的结果显示,多数的样本同时感染了M. hyopneumoniae和M. hyorhinis,可能此次采集的几个猪场发病猪存在混合感染的现象。猪群中混合感染及其后的继发感染现象比较普遍,用此方法检测M. hyopneumoniae和M. hyorhinis可以大大缩短检测时间。本次研究所收集的临床样本数量有限,后期将会收集更多的临床样品进行验证,进一步改进和完善本方法的临床应用。
4 结论根据猪肺炎支原体P97序列和猪鼻支原体P37序列的特异性引物,分别标记FAM和Texas Red荧光报告基团的2条Taqman探针,优化双重实时荧光定量PCR反应条件和体系,建立了同时鉴别诊断猪肺炎支原体和猪鼻支原体的双重荧光定量PCR。该方法这两种病原体的最低检测值均为10拷贝·μL-1;与猪源致病菌、病毒和其他常见细菌均无交叉反应;重复性好。临床样本检测结果表明建立的双重荧光定量PCR方法比普通PCR更加敏感,实用性强,可用于临床样品的检测。
| [1] | OTAKE S, DEE S, CORZO C, et al. Long-distance airborne transport of infectious PRRSV and Mycoplasma hyopneumoniae from a swine population infected with multiple viral variants[J]. Vet Microbiol, 2010, 145(3-4): 198–208. DOI: 10.1016/j.vetmic.2010.03.028 |
| [2] |
于艳霞, 王成达, 王芳. 浅谈猪支原体肺炎的控制综合防控措施[J]. 吉林畜牧兽医, 2012, 33(12): 38.
YU Y X, WANG C D, WANG F. Research progress and the integrated prevention and control techniques of mycoplasma pneumonia[J]. Jilin Animal Husbandry and Veterinary Medicine, 2012, 33(12): 38. DOI: 10.3969/j.issn.1672-2078.2012.12.019 (in Chinese) |
| [3] |
邵国青. 我国主要动物支原体病研究述略与展望[J]. 畜牧与兽医, 2000, 32(2): 37–38.
SHAO G Q. Brief review of research in important animal Mycoplama diseases in China[J]. Animal Husbandry & Veterinary Medicine, 2000, 32(2): 37–38. (in Chinese) |
| [4] | MAKHANON M, TUMMARUK P, THONGKAMKOON P, et al. Comparison of detection procedures of Mycoplasma hyopneumoniae, Mycoplasma hyosynoviae, and Mycoplasma hyorhinis in lungs, tonsils, and synovial fluid of slaughtered pigs and their distributions in Thailand[J]. Trop Anim Health Prod, 2012, 44(2): 313–318. DOI: 10.1007/s11250-011-0022-z |
| [5] |
程跃红, 余华, 邓小红, 等. 猪支原体病的流行及防控策略[J]. 安徽农业科学, 2013, 41(36): 13921–13924, 13931.
CHENG Y H, YU H, DENG X H, et al. Strategy of prevention and control of Mycoplasma hyopneumoniae[J]. Journal of Anhui Agricultural Sciences, 2013, 41(36): 13921–13924, 13931. DOI: 10.3969/j.issn.0517-6611.2013.36.042 (in Chinese) |
| [6] |
华利忠, 邵国青, 周勇岐. 以疫苗免疫为核心的猪气喘病控制与净化技术[J]. 中国兽药杂志, 2012, 46(7): 50–53.
HUA L Z, SHAO G Q, ZHOU Y Q. Control and eradication of Mycoplasma hyopneumoniae based on vaccine immunization[J]. Chinese Journal of Veterinary Drug, 2012, 46(7): 50–53. (in Chinese) |
| [7] | WOESTE K, GROSSE BEILAGE E. Transmission of agents of the porcine respiratory disease complex (PRDC) between swine herds:a review. Part 1--diagnosis, transmission by animal contact[J]. Dtsch Tierarztl Wochenschr, 2007, 114(9):324-326, 328-337. |
| [8] |
顾玉芳, 谢磊. 猪支原体肺炎临床病例病理分析[J]. 长江大学学报:自然科学版, 2012, 9(2): 12–13.
GU Y F, XIE L. Clinical pathological analysis of Mycoplasma hyopneumoniae[J]. Journal of Yangtze University:National Science Edition, 2012, 9(2): 12–13. (in Chinese) |
| [9] |
杨莉, 杨茂生, 吴位珩, 等. 猪气喘病的研究进展[J]. 上海畜牧兽医通讯, 2011(6): 7–9.
YANG L, YANG M S, WU W H, et al. The research progress of pig asthma[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2011(6): 7–9. (in Chinese) |
| [10] |
王占伟, 熊琪琰, 邵国青. 猪鼻支原体与猪地方性肺炎[J]. 中国人兽共患病学报, 2012, 28(10): 1036–1039.
WANG Z W, XIONG Q Y, SHAO G Q. Mycoplasma hyorhinis infection and swine enzootic pneumoniae[J]. Chinese Journal of Zoonoses, 2012, 28(10): 1036–1039. DOI: 10.3969/cjz.j.issn.1002-2694.2012.10.016 (in Chinese) |
| [11] | PALZER A, HAEDKE K, HEINRITZI K, et al. Associations among Haemophilus parasuis, Mycoplasma hyorhinis, and porcine reproductive and respiratory syndrome virus infections in pigs with polyserositis[J]. Can Vet J, 2015, 56(3): 285–287. |
| [12] | CHEN D J, WEI Y W, HUANG L P, et al. Synergistic pathogenicity in sequential coinfection with Mycoplasma hyorhinis and porcine circovirus type 2[J]. Vet Microbiol, 2016, 182: 123–130. DOI: 10.1016/j.vetmic.2015.11.003 |
| [13] | KIM B, LEE K, HAN K, et al. Development of in situ hybridization for the detection of Mycoplasma hyorhinis in formalin-fixed paraffin-embedded tissues from naturally infected pigs with polyserositis[J]. J Vet Med Sci, 2010, 72(9): 1225–1227. DOI: 10.1292/jvms.10-0062 |
| [14] | ZINÖCKER S, WANG M Y, GAUSTAD P, et al. Mycoplasma contamination revisited:mesenchymal stromal cells harboring Mycoplasma hyorhinis potently inhibit lymphocyte proliferation in vitro[J]. PLoS One, 2011, 6(1): e16005. DOI: 10.1371/journal.pone.0016005 |
| [15] | YANG H, QU L K, MA H C, et al. Mycoplasma hyorhinis infection in gastric carcinoma and its effects on the malignant phenotypes of gastric cancer cells[J]. BMC Gastroenterol, 2010, 10(1): 132. DOI: 10.1186/1471-230X-10-132 |
| [16] | URBANEK C, GOODISON S, CHANG M, et al. Detection of antibodies directed at M. hyorhinis P37 in the serum of men with newly diagnosed prostate cancer[J]. BMC Cancer, 2011, 11: 233. DOI: 10.1186/1471-2407-11-233 |
| [17] | LIU M J, DU G M, BAI F F, et al. A rapid and sensitive loop-mediated isothermal amplification procedure (LAMP) for Mycoplasma hyopneumoniae detection based on the p36 gene[J]. Genet Mol Res, 2015, 14(2): 4677–4686. DOI: 10.4238/2015.May.4.27 |
| [18] | BARATE A K, LEE H Y, JEONG H W, et al. An improved multiplex PCR for diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis[J]. Korean J Vet Res, 2012, 52(1): 39–43. |
| [19] |
武昱孜, 张旭, 白方方, 等. 猪鼻支原体3种核酸检测方法的临床应用比较[J]. 中国预防兽医学报, 2013, 35(12): 985–988.
WU Y Z, ZHANG X, BAI F F, et al. Evaluation on clinical application of three nucleic acid amplification assays for the detection of Mycoplasma hyorhinis[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(12): 985–988. (in Chinese) |
| [20] | DU G M, LIU M J, WU Y Z, et al. Development of a loop-mediated isothermal amplification assay for rapid detection of Mycoplasma hyorhinis[J]. Clin Lab, 2013, 59(11-12): 1363–1371. |
| [21] | MAINGI J W, XIONG Q Y, WEI Y N, et al. Detection, isolation and identification of M. hyorhinis isolates and comparison of their antimicrobial susceptibility, immunogenicity and virulence[J]. Veterinaria, 2014, 2(1): 1–8. |
| [22] | TOCQUEVILLE V, FERRE S, NGUYEN N H P, et al. Multilocus sequence typing of Mycoplasma hyorhinis strains identified by a real-time TaqMan PCR assay[J]. J Clin Microbiol, 2014, 52(5): 1664–1671. DOI: 10.1128/JCM.03437-13 |
| [23] | KANG I, KIM D, HAN K, et al. Optimized protocol for multiplex nested polymerase chain reaction to detect and differentiate Haemophilus parasuis, Streptococcus suis, and Mycoplasma hyorhinis in formalin-fixed, paraffin-embedded tissues from pigs with polyserositis[J]. Can J Vet Res, 2012, 76(3): 195–200. |
| [24] | STRAIT E L, MADSEN M L, MINION F C, et al. Real-time PCR assays to address genetic diversity among strains of Mycoplasma hyopneumoniae[J]. J Clin Microbiol, 2008, 46(8): 2491–2498. DOI: 10.1128/JCM.02366-07 |
| [25] |
白方方, 武昱孜, 刘茂军, 等. 猪鼻支原体TaqMan MGB探针荧光定量PCR方法的建立[J]. 中国预防兽医学报, 2013, 35(10): 833–836.
BAI F F, WU Y Z, LIU M J, et al. Development of TaqMan MGB probe real-time PCR for detection of Mycoplasma hyorhinis[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(10): 833–836. DOI: 10.3969/j.issn.1008-0589.2013.10.14 (in Chinese) |
| [26] |
刘茂军, 李冬梅, 邵国青, 等. 猪肺炎支原体PCR鉴定方法的建立[J]. 金陵科技学院学报, 2008, 24(3): 99–101.
LIU M J, LI D M, SHAO G Q, et al. Establishment of PCR method for the identification of Mycoplasma hyopneumoniae[J]. Journal of Jinling Institute of Technology, 2008, 24(3): 99–101. (in Chinese) |
| [27] |
张旭, 白方方, 武昱孜, 等. PCR技术检测猪肺炎支原体的研究进展[J]. 生物技术通报, 2012(5): 54–60.
ZHANG X, BAI F F, WU Y Z, et al. Research advances on the detection of Mycoplasma hyopneumoniae by PCR[J]. Biotechnology Bulletin, 2012(5): 54–60. (in Chinese) |
| [28] | DE CARVALHO N L, GONÇALVES J L, BOTARO B G, et al. Detection and enumeration of Streptococcus agalactiae from bovine milk samples by real-time polymerase chain reaction[J]. Curr Microbiol, 2015, 71(3): 363–372. DOI: 10.1007/s00284-015-0855-1 |
| [29] | JEONG S, KIM J O, JEONG S H, et al. Evaluation of peptide nucleic acid-mediated multiplex real-time PCR kits for rapid detection of carbapenemase genes in gram-negative clinical isolates[J]. J Microbiol Methods, 2015, 113: 4–9. DOI: 10.1016/j.mimet.2015.03.019 |
| [30] | CHEN Z G, TONG Y Q, LI Y, et al. Development and validation of a 3-Plex RT-qPCR assay for the simultaneous detection and quantitation of the three PML-RARa fusion transcripts in acute promyelocytic leukemia[J]. PLoS One, 2015, 10(3): e0122530. DOI: 10.1371/journal.pone.0122530 |
| [31] | DAI M M, FENG M, LIU D, et al. Development and application of SYBR Green Ⅰ real-time PCR assay for the separate detection of subgroup J Avian leukosis virus and multiplex detection of avian leukosis virus subgroups A and B[J]. Virol J, 2015, 12(1): 52. DOI: 10.1186/s12985-015-0291-7 |
| [32] | TANAKA H, YAMAMOTO S, NAKAMURA A, et al. Hands-off preparation of monodisperse emulsion droplets using a poly (dimethylsiloxane) microfluidic chip for droplet digital PCR[J]. Anal Chem, 2015, 87(8): 4134–4143. DOI: 10.1021/ac503169h |
| [33] | HE K W, WEN L B, WANG Y S, et al. Development of real-time PCR assay for detection of porcine circovirus-like virus P1 in domestic pigs in China[J]. BMC Vet Res, 2015, 11(1): 240. DOI: 10.1186/s12917-015-0509-3 |
| [34] | LEE J A, OH Y R, HWANG M A, et al. Mycoplasma hyorhinis is a potential pathogen of porcine respiratory disease complex that aggravates pneumonia caused by porcine reproductive and respiratory syndrome virus[J]. Vet Immunol Immunopathol, 2016, 177: 48–51. DOI: 10.1016/j.vetimm.2016.06.008 |



