世界范围内对羔羊肉需求持续增加,促进了肉羊产业的迅速发展[1]。在中国,尤其是北方牧区,肉羊养殖已逐渐从传统放牧转为舍饲育肥。此举既便于饲养管理,提高生产效率,又可减轻环境与生态压力。舍饲圈养的缺点之一是限制了肉羊的自由活动范围,可能造成氧化应激,引起生理变化,并影响生产性能。羔羊舍饲育肥是否对羊肉品质造成影响尚未明确。
酿酒葡萄渣(WGP)主要由葡萄皮、葡萄籽、葡萄茎与叶组成,其总重量可占葡萄压榨产物的20%~25%,是红酒产业的主要副产品。WGP中含有丰富的多酚类物质,包括酚酸、类黄酮、原花青素、白藜芦醇和花色素苷等[2]。模式动物中研究结果表明,WGP具有消炎、抗氧化、抗癌等生物学功能[3]。此外,WGP中含有的较高粗蛋白和粗脂肪量为其在畜牧业中的合理利用提供了可能。研究发现,肉鸡日粮中添加WGP可改善鸡肉抗氧化性,且作用效果类似于日粮中添加的维生素E[4]。生猪日粮中添加WGP可改善肉品质[5]、提高生长性能与营养利用率,并改变皮下脂肪中脂肪酸的组成[6]。此外,肉类加工产品中直接添加葡萄籽提取物可提高肉质抗氧化性,延长产品保质期[7-9]。
我国是世界十大葡萄酒生产国家之一,年产80万吨以上的酿酒葡萄渣,除部分利用外,大部分废弃。如能在肉羊生产中合理利用WGP,不仅可产生经济效益,也可以减轻对环境的压力。本试验以杜泊×小尾寒羊杂交一代公羔为研究对象,研究日粮中添加不同浓度WGP对单栏饲养方式下绵羊肌肉抗氧化性及肉品质的影响,为合理利用废渣与功能性饲料的开发提供科学依据。
1 材料与方法 1.1 试验设计及饲养管理酿酒葡萄渣购自山西省太谷县怡园干红葡萄酒厂,经自然晾晒后贮存备用。WGP中所含常规营养成分、总多酚含量与基础日粮成分详见参考文献[10]。
本试验于2015年5月-8月在山西省右玉县宏宇牧业有限公司完成。试验随机选取24只5月龄,体重为(25±1) kg的杜泊×小尾寒羊的杂交一代公羔,采用完全随机设计原则平均分为4组。其中,第一组为自由活动组,饲喂基础日粮;其余3组为单栏饲养,每栏(0.8 m2)1只,并在日粮中添加不同浓度的WGP(0、5%和10%,DM)。试验前,注射羊痘、口蹄疫和小反刍兽疫疫苗进行免疫。试验预饲期10 d,试验期80 d。试验结束后,屠宰取样,取左侧背最长肌(LD)中间部分,投入液氮冷冻备用。在右侧相同解剖学位置取样,置于4%多聚甲醛(PFA)中固定,用于石蜡包埋。其余LD置于4 ℃保存,用于肉品质分析。
1.2 分析方法 1.2.1 肉质分析与IMF含量测定屠宰后0与24 h,用pH计(pH-STAT, SFK-Technology,丹麦)测定背最长肌pH,用色差仪(Konica Minolta Inc,日本)测定肉色变化。蒸煮损失测定方法:首先称量约300 g LD,在沸水中煮35 min,取出样品,滤纸吸干水分后再次称重。蒸煮损失用蒸煮前后减少的重量与蒸煮之前重量的比值表示。Warner-Bratzler剪切力(WBSF)测定依据前人方法进行[11]:剪取约2.54 cm厚LD样品,置于177 ℃烤箱中烤熟,当样品中心温度达到70 ℃时,取出样品冷却至室温,1 ℃条件下保存24 h。使用钻孔机取6块圆柱形样品(直径为1.27 cm),利用剪切力测定仪(Mecmesin, West Sussex,英国)进行WBSF测定。IMF含量测定根据索氏提取法进行[12]:取1 g左右LD样品,冻干干燥至恒重后,在索氏提取器中利用乙醚进行脂肪分离。8 h后,真空干燥样品并称重,样品损失的重量即为肌内脂肪含量。
1.2.2 Masson三色染色与胶原含量分析Masson Trichrome染色方法参照M.Foidart等[13]的研究进行:LD肌肉样品经4% PFA(pH 7.4,24 h)固定后,酒精梯度脱水(70% 30 min,80% 30 min,95% 30 min 3次,100% 30 min 3次),酒精/二甲苯混合液(1:1,30 min)处理,二甲苯透明(20 min,3次),石蜡浸泡(2 h,3次),包埋并切片(Leica RM 2265,德国),切片厚度为7 μm。样品经二甲苯脱蜡(10 min,2次)、复水(100%酒精5 min,95%酒精5 min,70%酒精5 min,ddH2O 5 min)后,进行三色染色,其中,肌纤维为红色,细胞核为黑色,胶原为蓝色。切片置于显微镜下拍照(Leica DMi8,德国)。LD中胶原含量测定方法:将LD在液氮中磨碎,称取100 mg粉末,60 ℃烘箱烘干后置于1 mL HCl(6 mol·L-1)中,110 ℃水解18 h。随后,样品按J.F.Jr.Woessner[14]提供的方法进行处理,并计算胶原含量。
1.2.3 肌肉中酶活、ROS与MDA含量检测称取500 mg LD样品,加入0.9%预冷生理盐水(1:9,mg·μL-1),经组织匀浆仪匀浆后离心(2 500 g,4 ℃,10 min),上清液用于相关酶活性与ROS及MDA含量测定(ELASA法)。各试剂盒信息:GSH-PX(HY-60005)、SOD(HY-60001)、catalase(HY-60015)、T-AOC(HY-60021)、MDA(HY-60003) 等试剂盒均购自北京华英生物技术研究所,ROS(E004) 购买自南京建成生物工程研究所。吸光度的测定采用全功能微孔板检测仪(BioTek Synergy H1/H1MFD,美国)完成。
1.2.4 荧光定量PCR称取100 mg LD样品,加入500 μL Trizol溶液并匀浆,总RNA的提取按照厂家技术说明进行。RNA提取完成后,利用NanoDrop ND-1000进行浓度与完整性检测,OD260 nm/OD280 nm为1.9~2.0者用于后续试验。经DNA酶处理后,取1 μg RNA进行cDNA反转录,并进行荧光定量PCR(Applied Biosystems 7500,美国)分析。PCR循环参数:95 ℃ 20 s, 55 ℃ 20 s, 72 ℃ 20 s,共35个循环。结果根据2-ΔΔCT法计算,PRL13为内参基因。引物信息如表 1所示。
|
|
表 1 引物信息 Table 1 Primer sequences for real-time PCR |
取0.1 g样品,加入500 μL预冷裂解液(20 mmol·L-1 Tris-HCl,2% SDS,1% Triton X-100,5.0 mmol·L-1 EDTA,5.0 mmol·L-1 EGTA,1 mmol·L-1 DTT,100 mmol·L-1 NaF,2 mmol·L-1钒酸钠,0.5 mmol·L-1苯甲磺酰氟,匀浆后离心(12 000 r·min-1,4 ℃,15 min)。取上清液,并加入等体积的2倍上样缓冲液(150 mmol·L-1 Tris-HCl,20%甘油,2 mmol·L-1巯基乙醇,0.004%溴酚蓝),经煮沸后备用。蛋白经SDS-PAGE分离后(Bio-Rad Mini-RPOTEAN,美国),转膜于硝基纤维素膜(100 V,1 h)。经5%脱脂奶粉封闭1 h后,加入一抗(1:1 000),4 ℃过夜。使用PBST洗膜4次,每次5 min,室温下加入二抗(1:10 000,1 h)。膜经PBST洗净后,使用ECL发光试剂盒(北京康为世纪生物科技有限公司)进行曝光。用Image Lab软件进行蛋白浓度定量,β-actin作为内参。目的蛋白质的相对表达量=目的蛋白质含量/β-actin蛋白质含量。抗体信息:SOD(No.:sc-8637),catalase(No.: sc-34281),GPx-4(No.: sc-50497) 与Donkey anti-Rabbit secondary antibody(sc-2313) 购买自Santa Cruz Biotechnology, Inc.(Santa Cruz,CA,USA)。Nrf2(No.: LS-C31637) 购自Lifespan Biosciences Inc(Seattle, WA, USA),β-actin(No.: 4970) 购自Cell Signaling(Danvers,MA,USA)。
1.3 数据分析数据使用“平均值±标准误”表示,并采用Graphpad Prism 6软件进行统计分析。其中,不同饲养方式对氧化应激及体重影响分析采用Student’s双尾t检验,其他数据采用单因素方差分析,并用Duncan法进行多重比较。P < 0.05视为差异显著,P < 0.01视为差异极显著。
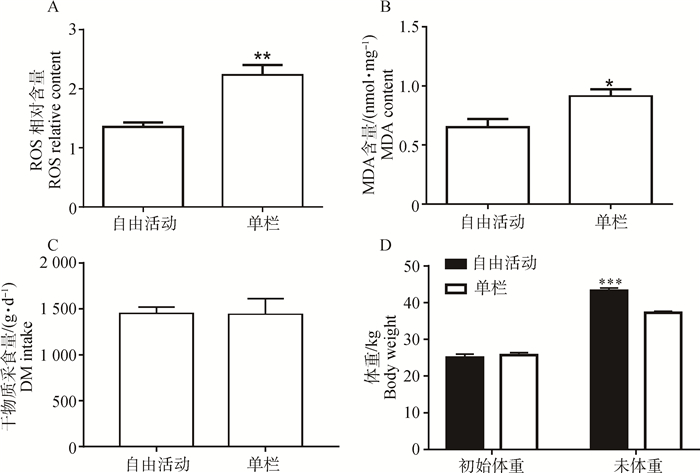
2 结果 2.1 不同饲养方式对肉羊骨骼肌氧化应激及体重的影响如图 1所示,与自由活动组相比,单栏圈养公羔(0% WGP)LD中ROS含量极显著上升(图 1A,P < 0.01),而MDA含量显著上升(图 1B,P < 0.05)。虽然干物质采食量与初始体重未见明显差异(图 1C,D),但单栏饲养下的公羔(0% WGP)末体重极显著低于自由活动组(图 1D,P < 0.001)。
|
*. P < 0.05; **. P < 0.01; ***. P < 0.001 图 1 饲养方式对绵羊骨骼肌ROS(A)、MDA(B)、干物质采食量(C)及体重(D)的影响 Figure 1 Effect of feeding manners on ROS (A), MDA (B) contents, DMI (C) and body weight (D) |
如表 2示,日粮中添加WGP并未对0与24 h的pH及肉色产生显著影响。5%与10%WGP添加可显著降低WBSF(P < 0.05),但在WGP添加组之间剪切力并未出现显著差异。此外,不同分组间的肌内脂肪含量(IMF)及蒸煮损失未见显著差异。
|
|
表 2 日粮中添加WGP对肉品质的影响 Table 2 Effect of dietary WGP supplementation on the meat quality of lambs |
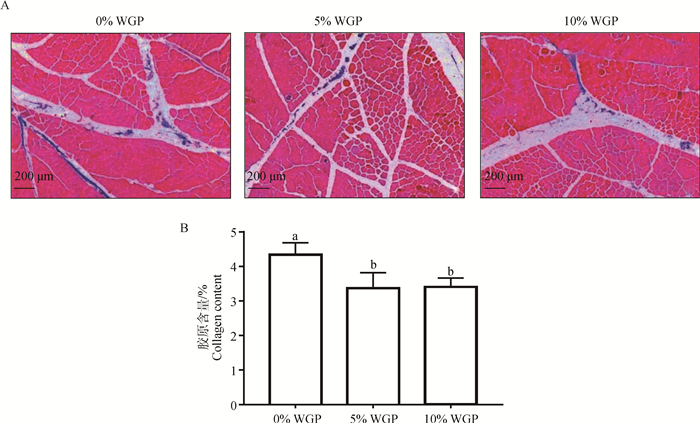
Masson三色染色结果表明,日粮中添加5%与10%WGP可明显降低骨骼肌中胶原的含量(图 2A)。羟脯氨酸含量检测进一步证明,日粮中添加WGP可以显著降低LD中胶原含量(P < 0.05,图 2B),而5%与10%WGP添加组间无显著差异(P>0.05)。
|
A.三色染色结果;B.胶原含量。不同字母表示差异显著,下同 A. Masson Trichrome staining; B. Collagen content. The different letters indicate significant difference, the same as below 图 2 日粮中添加WGP对骨骼肌中胶原含量的影响 Figure 2 Effect of dietary WGP supplementation on collagen content in LD muscle |
如表 3所示,日粮中添加不同浓度的WGP未改变LD中葡萄糖的浓度。同时,肌糖原浓度未见显著变化,乳酸与6-磷酸-葡萄糖的浓度也未受日粮中WGP添加的影响。
|
|
表 3 日粮中添加WGP对肉羊骨骼肌中糖酵解潜能的影响 Table 3 Effect of dietary WGP supplementation on glycolytic potential in LD muscle of lambs |
如表 4所示,WGP的添加并未改变LD中catalase活性(P=0.29)。10%WGP添加量可显著提高骨骼肌中GPx4与T-AOC活性(P < 0.05),但5%添加量并无显著效果。此外,日粮中添加5%与10%WGP均可显著提高SOD活性(P < 0.05)。
|
|
表 4 日粮中添加WGP对骨骼肌中抗氧化酶活性的影响 Table 4 Effect of dietary WGP supplementation on antioxidative enzyme activity in LD muscle of lambs |
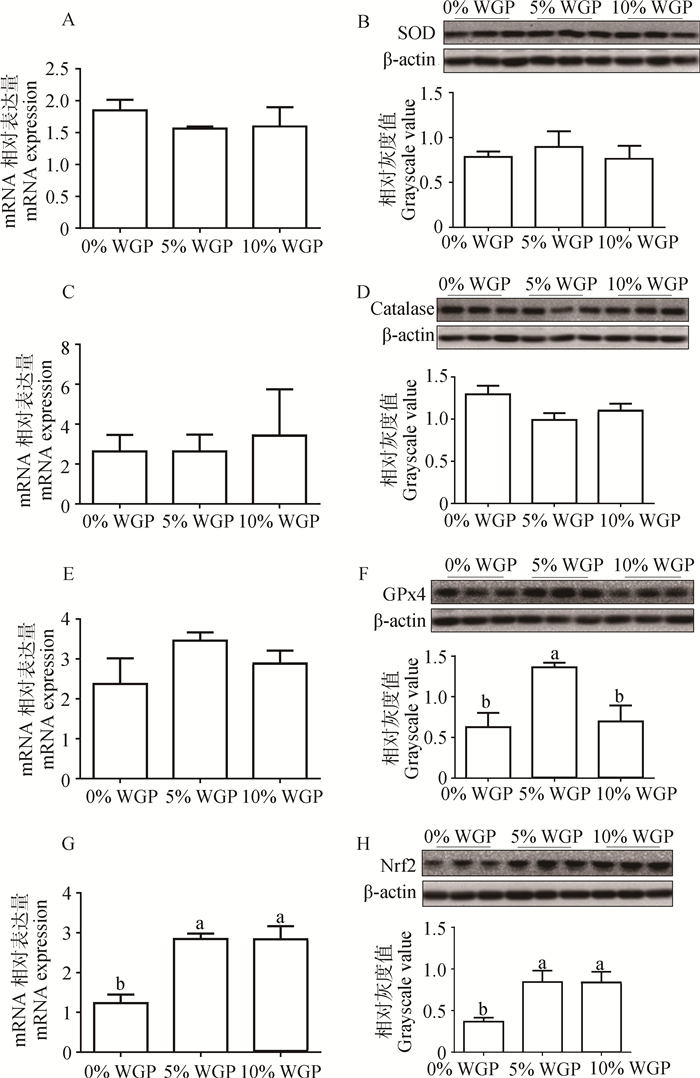
在mRNA水平,日粮中添加WGP可显著提高Nrf2表达(图 3,P < 0.05),但并未对catalase、SOD与GPx4 mRNA表达造成影响。在蛋白质水平,日粮中添加WGP不改变SOD与catalase表达,而5%WGP可显著提高GPx4蛋白质浓度(P < 0.05)。此外,添加5%与10% WGP显著增加了Nrf2蛋白质的浓度(P < 0.05)。
|
A. SOD mRNA;B. SOD蛋白;C. Catalase mRNA;D. Catalase蛋白;E. GPx4 mRNA;F. GPx4蛋白;G. Nrf2 mRNA;H. Nrf2蛋白 A. SOD mRNA; B. SOD protein; C. Catalase mRNA; D. Catalase protein; E. GPx4 mRNA: F. GPx4 protein; G. Nrf2 mRNA; H. Nrf2 protein 图 3 日粮中添加WGP对肉羊骨骼肌抗氧化酶表达的影响 Figure 3 Effect of dietary WGP supplementation on mRNA and protein abundance of antioxidant enzymes in LD muscle of ram lambs |
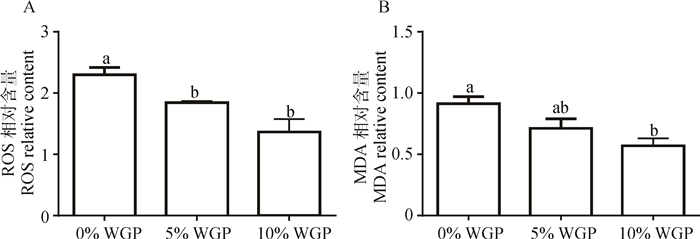
如图 4所示,日粮中添加5%和10% WGP可显著降低LD中ROS含量(P < 0.05)。对于MDA,虽然5%WGP的添加量不足以使其降低,但日粮中添加10% WGP可显著降低其含量(P < 0.05)。
|
图 4 日粮中添加WGP对单栏饲养下羔羊骨骼肌中ROS与MDA含量的影响 Figure 4 Effect of dietary WGP supplementation on SOD and MDA contents in LD muscle of pen-raised lambs |
近年来,肉羊生产已逐渐发展为集约化舍饲养殖,但此举限制了羔羊的活动范围,并可能影响生产性能。小鼠中研究表明,限制活动会造成氧化损伤,进而影响生理机能[15]。圈养是否对羔羊产生氧化应激,以及是否对肉品质造成影响尚不清楚。
氧化还原反应是机体最重要的化学反应之一。氧化反应会产生带有活性氧的自由基,包括超氧根阴离子(O2 · -)、氢氧根离子(OH-)、羟自由基(·OH)、过氧化氢(H2O2)、单线态氧(·O2)和过氧化物自由基(ROO·)等,这类物质统称为ROS。ROS可通过一系列的生化反应损伤细胞内大分子,如蛋白质、脂类、DNA和酶等[16]。在应激状态下,机体ROS水平急剧上升,造成氧化损伤与细胞功能失调,影响人或动物健康。本试验中,单栏饲养方式在不改变采食量的情况下,造成了肉羊体重的下降,说明舍饲对羔羊生产性能造成了一定的影响。出现此现象的原因可能是由于肉羊受活动范围所限,导致了机体消化、代谢相关酶类活性发生改变,影响了营养物质的消化与吸收。活性氧(Reactive oxygen species,ROS)是代表机体氧化应激的指标之一[17],而MDA是脂类氧化的第二产物[18],二者含量均反映了动物的氧化应激水平。单栏饲养方式造成肉羊骨骼肌产生氧化应激,这可能是由于肉羊活动能力下降,体内清除氧化应激产物的相关酶活性降低所导致。随着日粮中WGP的添加,LD中MDA和ROS水平均呈下降趋势,证明WGP可减缓由于圈养带来的氧化应激。
脂类氧化是自发性过程,对于肉品质有重要影响[19]。研究表明,在日粮中添加天然抗氧化物质可以降低脂类超氧化过程,从而达到改善产品抗氧化状态,提高肉品质的目的[20]。由于葡萄籽提取物较维生素E和C有更强的抗氧化能力[21],因此WGP可作为改善肉产品抗氧化性的添加剂。T-AOC水平能够反映机体总体抗氧化能力[22],本试验中,T-AOC水平的提高证明了WGP的添加可提高肉羊机体的抗氧化性。
生物进化过程中,形成了酶促和非酶促两套氧化应激保护体系,以清除对细胞有害的氧自由基。非酶促体系包括谷胱甘肽、维生素A、维生素C和维生素E等,而酶促系统由SOD、GPx、catalase构成[23]。当机体ROS较高时,SOD能与O2 · -发生反应,生成H2O2[24]。GPx特异性催化还原型谷胱甘肽对H2O2的还原反应,催化过氧化物转化为无毒物质,从而保护细胞膜的结构和功能免受过氧化物的干扰[25]。此外,catalase能够催化H2O2分解为对生物体无害的H2O和O2[26]。为了更好地解释WGP消除氧化应激的机制,本试验检测了上述酶的酶活、蛋白质和mRNA表达。日粮中添加WGP对SOD活性的影响并不依赖于表达调控。对catalase而言,WGP的添加未改变酶活,说明catalase并未参与WGP调节的抗氧化。日粮中添加WGP对GPx4酶活的影响可能源于其对GPx4 mRNA与蛋白质的影响。
Nrf2是细胞内调控氧化应激的转录因子,在多聚酚复合物存在的情况下,Nrf2可诱导二相解毒/抗氧化酶的表达(Phase Ⅱ detoxifying/antioxidant)[27],如醌氧化还原酶、谷胱苷肽S-转移酶,从而将醌类还原为氢醌类,减少ROS的形成,减轻对机体的影响。日粮中添加WGP改变了Nrf2表达,进一步证实WGP可减缓氧化应激。
骨骼肌中含有较高含量的肌红蛋白,易受氧化应激损伤的影响[28]。如果发生严重的氧化应激,则肌红蛋白会被氧化,从而影响肉的颜色[29]。同时,由于羊肉中含有较高含量的不饱和脂肪酸,致其更易发生氧化。因此,通过日粮添加一定的抗氧化剂,有望达到降低氧化酸败、延长保质期的目的。研究表明,猪日粮中添加葡萄籽提取物,可有效改变肉色[30]。本试验中,包括L*、a*、b*在内的肉色各项指标均未发生显著变化,这与前人在羔羊日粮中添加葡萄籽提取物的试验结果相一致[8]。日粮中添加WGP及其提取物对不同动物肉色影响的差异还有待进一步研究。
肉pH是影响其品质的关键因素之一,可通过改变系水力影响肉的多汁性[31]。本试验中,添加WGP并未改变pH,这与前人报道的关于猪日粮中添加葡萄籽提取物对肉pH的影响结果相一致[30]。同时,蒸煮损失率未发生变化,说明了系水力未发生显著变化。pH由宰后肉中糖酵解能力决定;如果肉中含有较高的糖酵解潜能,则会提高肉中乳酸含量,导致肉在熟化的过程中pH下降过快,影响肉品质[32]。本研究中,骨骼肌内葡萄糖、糖元、乳酸等的含量未出现明显变化,进一步证明了肉羊日粮中添加WGP不影响肉pH。在本试验中,日粮中添加WGP后导致LD中剪切力减小。
肉嫩度是决定肉品质的关键因素之一。前人研究证实,剪切力的大小受到多种因素的影响,包括屠宰前后的操作、肌节的长度、年龄、品种及肌肉类型等[33-34]。肌肉中结缔组织由成纤维细胞分泌,其中的胶原含量及其交联程度是影响肉嫩度的重要因素[35]。通过Masson三色染色以及Hydroxyproline试验,证明日粮中WGP的添加降低了肉羊LD中胶原含量。此外,骨骼肌中IMF含量也是影响剪切力的关键因素之一,日粮中添加WGP并未对IMF含量产生影响,进一步说明了剪切力的减小可能源自WGP对胶原含量的影响。
4 结论与传统放牧方式相比,单栏圈养造成公羔骨骼肌的氧化应激,同时伴随着ROS及MDA含量的升高,且日增重下降。日粮中添加适量酿酒葡萄皮渣可有效改善上述反应。当日粮中添加10%WGP时,绵羊体内T-AOC、GPx4与SOD的活性升高。同时,Nrf蛋白质和mRNA表达量均显著提高。此外,日粮中添加10%WGP还可有效降低骨骼肌中胶原含量,提高肉嫩度。综上,酿酒葡萄皮渣可有效应用于肉羊生产中,其含量为10%为宜。
| [1] | MORRIS S T. Economics of sheep production[J]. Small Rumin Res, 2009, 86(1-3): 59–62. DOI: 10.1016/j.smallrumres.2009.09.019 |
| [2] | XIA E Q, DENG G F, GUO Y J, et al. Biological activities of polyphenols from grapes[J]. Int J Mol Sci, 2010, 11(2): 622–646. DOI: 10.3390/ijms11020622 |
| [3] | COTTART C H, NIVET-ANTOINE V, BEAUDEUX J L. Review of recent data on the metabolism, biological effects, and toxicity of resveratrol in humans[J]. Mol Nutr Food Res, 2014, 58(1): 7–21. DOI: 10.1002/mnfr.v58.1 |
| [4] | GOÍ I, BRENES A, CENTENO C, et al. Effect of dietary grape pomace and vitamin E on growth performance, nutrient digestibility, and susceptibility to meat lipid oxidation in chickens[J]. Poult Sci, 2007, 86(3): 508–516. DOI: 10.1093/ps/86.3.508 |
| [5] | ZHANG C, LUO J Q, YU B, et al. Dietary resveratrol supplementation improves meat quality of finishing pigs through changing muscle fiber characteristics and antioxidative status[J]. Meat Sci, 2015, 102: 15–21. DOI: 10.1016/j.meatsci.2014.11.014 |
| [6] | YAN L, KIM I H. Effect of dietary grape pomace fermented by Saccharomyces boulardii on the growth performance, nutrient digestibility and meat quality in finishing pigs[J]. Asian-Australas J Anim Sci, 2011, 24(12): 1763–1770. DOI: 10.5713/ajas.2011.11189 |
| [7] | GARRIDO M D, AUQUI M, MARTÍ N, et al. Effect of two different red grape pomace extracts obtained under different extraction systems on meat quality of pork burgers[J]. LWT-Food Sci Technol, 2011, 44(10): 2238–2243. DOI: 10.1016/j.lwt.2011.07.003 |
| [8] | JERÓNIMO E, ALFAIA C M M, ALVES S P, et al. Effect of dietary grape seed extract and Cistus ladanifer L. in combination with vegetable oil supplementation on lamb meat quality[J]. Meat Sci, 2012, 92(4): 841–847. DOI: 10.1016/j.meatsci.2012.07.011 |
| [9] | BRANNAN R G. Effect of grape seed extract on physicochemical properties of ground, salted, chicken thigh meat during refrigerated storage at different relative humidity levels[J]. J Food Sci, 2008, 73(1): C36–C40. |
| [10] |
金亚倩, 郝松华, 赵俊星, 等. 日粮中添加葡萄皮渣对绵羊生长性能、器官指数及血液生化指标的影响[J]. 中国畜牧兽医, 2016, 43(9): 2326–2332.
JIN Y Q, HAO S H, ZHAO J X, et al. Effect of dietary grape pomace on growth performance, organ index and blood biochemical indexes in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(9): 2326–2332. (in Chinese) |
| [11] | ZHAO J X, LIU X D, ZHANG J X, et al. Effect of different dietary energy on collagen accumulation in skeletal muscle of ram lambs[J]. J Anim Sci, 2015, 93(8): 4200–4210. DOI: 10.2527/jas.2015-9131 |
| [12] | ZHANG M, LIU Y L, FU C Y, et al. Expression of MyHC genes, composition of muscle fiber type and their association with intramuscular fat, tenderness in skeletal muscle of Simmental hybrids[J]. Mol Biol Rep, 2014, 41(2): 833–840. DOI: 10.1007/s11033-013-2923-6 |
| [13] | FOIDART M, FOIDART J M, ENGEL W K. Collagen localization in normal and fibrotic human skeletal muscle[J]. Arch Neurol, 1981, 38(3): 152–157. DOI: 10.1001/archneur.1981.00510030046006 |
| [14] | WOESSNER J F Jr. The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid[J]. Arch Biochem Biophys, 1961, 93(2): 440–447. DOI: 10.1016/0003-9861(61)90291-0 |
| [15] | ȘAHINE, GÜMÜȘLÜ S. Immobilization stress in rat tissues:alterations in protein oxidation, lipid peroxidation and antioxidant defense system[J]. Comp Biochem Physiol C:Toxicol Pharmacol, 2007, 144(4): 342–347. |
| [16] |
董亮, 何永志, 王远亮, 等. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报, 2013, 15(5): 53–58.
DONG L, HE Y Z, WANG Y L, et al. Research progress on application of superoxide dismutase (SOD)[J]. Journal of Agricultural Science and Technology, 2013, 15(5): 53–58. (in Chinese) |
| [17] | MONAGHAN P, METCALFE N B, TORRES R. Oxidative stress as a mediator of life history trade-offs:mechanisms, measurements and interpretation[J]. Ecol Lett, 2009, 12(1): 75–92. DOI: 10.1111/ele.2008.12.issue-1 |
| [18] | TEREVINTO A, CABRERA M C, SAADOUN A. Influence of feeding system on lipids and proteins oxidation, and antioxidant enzymes activities of meat from Aberdeen angus steers[J]. J Food Nutr Res, 2015, 3(9): 581–586. |
| [19] | WOOD J D, RICHARDSON R I, NUTE G R, et al. Effects of fatty acids on meat quality:a review[J]. Meat Sci, 2004, 66(1): 21–32. DOI: 10.1016/S0309-1740(03)00022-6 |
| [20] | SALAMI S A, GUINGUINA A, AGBOOLA J O, et al. Review:in vivo and postmortem effects of feed antioxidants in livestock:a review of the implications on authorization of antioxidant feed additives[J]. Animal, 2016, 10(8): 1375–1390. DOI: 10.1017/S1751731115002967 |
| [21] | CARPENTER R, O'GRADY M N, O'CALLAGHAN Y C, et al. Evaluation of the antioxidant potential of grape seed and bearberry extracts in raw and cooked pork[J]. Meat Sci, 2007, 76(4): 604–610. DOI: 10.1016/j.meatsci.2007.01.021 |
| [22] | YANG Q M, PAN X H, KONG W B, et al. Antioxidant activities of malt extract from barley (Hordeum vulgare L.) toward various oxidative stress in vitro and in vivo[J]. Food Chem, 2010, 118(1): 84–89. DOI: 10.1016/j.foodchem.2009.04.094 |
| [23] |
陈伟. 猪GPx4基因表达差异与骨骼肌抗氧化性能的研究[D]. 泰安: 山东农业大学, 2011.
CHEN W. Studies on GPx4 gene expression and antioxidative properties of skeletal muscle in pigs[D]. Tai'an:Shandong Agricultural University, 2011. (in Chinese) |
| [24] | AYALA A, MUOZ M F, ARGÜELLES S. Lipid peroxidation:production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal[J]. Oxid Med Cell Longev, 2014, 2014: 360438. |
| [25] |
薛颖, 董晓芳, 佟建明. 不同水平无机及有机复合微量元素对蛋鸡血浆抗氧化能力的影响[J]. 动物营养学报, 2016, 28(7): 2122–2131.
XUE Y, DONG X F, TONG J M. Effects of inorganic and organic complex trace elements at different levels on the plasma antioxidant activities of laying hens[J]. Chinese Journal of Animal Nutrition, 2016, 28(7): 2122–2131. (in Chinese) |
| [26] |
杨佳栋, 魏凤菊, 潘新新, 等. 动物过氧化氢酶(CAT)的研究进展[J]. 黑龙江畜牧兽医, 2016(13): 59–62.
YANG J D, WEI F J, PAN X X, et al. Research process of animal catalase (CAT)[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(13): 59–62. (in Chinese) |
| [27] | MARTIN D, ROJO A I, SALINAS M, et al. Regulation of heme oxygenase-1 expression through the phosphatidylinositol 3-kinase/Akt pathway and the Nrf2 transcription factor in response to the antioxidant phytochemical carnosol[J]. J Biol Chem, 2004, 279(10): 8919–8929. DOI: 10.1074/jbc.M309660200 |
| [28] | PANNIER L, PETHICK D W, BOYCE M D, et al. Associations of genetic and non-genetic factors with concentrations of iron and zinc in the longissimus muscle of lamb[J]. Meat Sci, 2014, 96(2): 1111–1119. DOI: 10.1016/j.meatsci.2013.08.013 |
| [29] | LINDAHL G, LUNDSTRÖM K, TORNBERG E. Contribution of pigment content, myoglobin forms and internal reflectance to the colour of pork loin and ham from pure breed pigs[J]. Meat Sci, 2001, 59(2): 141–151. DOI: 10.1016/S0309-1740(01)00064-X |
| [30] | O'GRADY M N, CARPENTER R, LYNCH P B, et al. Addition of grape seed extract and bearberry to porcine diets:influence on quality attributes of raw and cooked pork[J]. Meat Sci, 2008, 78(4): 438–446. DOI: 10.1016/j.meatsci.2007.07.011 |
| [31] | BOUTON P E, HARRIS P V, SHORTHOSE W R. Effect of ultimate pH upon the water-holding capacity and tenderness of mutton[J]. J Food Sci, 1971, 36(3): 435–439. DOI: 10.1111/jfds.1971.36.issue-3 |
| [32] | ZHANG L, YUE H Y, ZHANG H J, et al. Transport stress in broilers:I. Blood metabolism, glycolytic potential, and meat quality[J]. Poult Sci, 2009, 88(10): 2033–2041. DOI: 10.3382/ps.2009-00128 |
| [33] | SHORTHOSE W R, POWELL V H, HARRIS P V. Influence of electrical stimulation, cooling rates and aging on the shear force values of chilled lamb[J]. J Food Sci, 1986, 51(4): 889–892. DOI: 10.1111/jfds.1986.51.issue-4 |
| [34] | ABDULLAH A Y, QUDSIEH R I. Effect of slaughter weight and aging time on the quality of meat from Awassi ram lambs[J]. Meat Sci, 2009, 82(3): 309–316. DOI: 10.1016/j.meatsci.2009.01.027 |
| [35] | PURSLOW P P. Intramuscular connective tissue and its role in meat quality[J]. Meat Sci, 2005, 70(3): 435–447. DOI: 10.1016/j.meatsci.2004.06.028 |



