2. 杨凌示范区医院, 杨凌 712100;
3. 咸阳食品药品检测检验中心, 咸阳 712000;
4. 陕西飞天乳业有限公司, 宝鸡 721100
2. Yangling Demonstration Zone Hospital, Yangling 712100, China;
3. Xianyang Food and Drug Inspection Center, Xianyang 712000, China;
4. Shaanxi Feitian Dairy Co. Ltd., Baoji 721100, China
越来越多的研究表明,动物胎盘具有很好的医学价值和功能食品开发价值,胎盘中含有蛋白质、氨基酸、生物活性肽、细胞因子以及矿物质等多种活性物质和组分,营养价值丰富[1-2]。生物活性肽的组成和含量在其功能表达方面意义重大,它是特定的蛋白质片段,由2~20个氨基酸片段组成,在生命体中,除了作为氮源和氨基酸源外,还有许多潜在的生理功能[3]。抗氧化活性肽包含5~16个氨基酸片段,是目前研究较多的一类具有抑制脂质过氧化,清除自由基,抗衰老的生物活性肽,结构简单,性质稳定[4]。近年来,对抗氧化活性肽的研究主要集中在提取方法的创新、结构和功能的评价等方面。R.Kate等[5]通过酶解肉类废渣蛋白得到具有显著抗氧化能力的生物活性肽,A.S.Ahmed等[6]酶解羊乳得到具有抗氧化活性的多肽,并且鉴定出抗氧化肽序列。J.Ebner等[7]使用开菲尔粒发酵牛乳,通过对发酵过程中的肽谱分析,发现在生产过程中酪蛋白产生的236种多肽中,有16种新发现的生物活性肽具有镇静、抗氧化、抗血栓等功能。
对于动物胎次的研究大多集中在对牛、羊生产性能以及泌乳性能方面,多项研究表明,胎次对奶牛母体的体况、产仔性能、乳脂率、泌乳量、凝乳质量、体内激素水平等有显著影响[8-14],不同胎次山羊乳中营养成分具有显著差异[15]。对于动物胎盘多肽研究主要集中在结构和功能上[1, 6, 16-17],且以牛胎盘居多,而以多项指标综合考量的不同胎次羊胎盘提取物抗氧化活性的研究至今未见报道,并且在不同存放条件下抗氧化活性随时间延长的衰变研究亦较为鲜见。本研究以DPPH·清除率、·OH清除率、WSP含量为抗氧化活性评价指标,探讨不同存放条件对各胎次胎盘提取物抗氧化活性的影响规律,为其合理化应用提供技术支撑。
1 材料与方法 1.1 材料与试剂羊胎盘:由西安鑫龙门奶山羊良种场提供,于春季3~5月份收集新鲜莎能奶山羊胎盘,胎次为1、2、3胎,共18个;得到的健康羊胎盘,用生理盐水冲洗表面血渍,立即用灭菌容器盛装,放入-20 ℃冰箱中保存。
DPPH (分析纯)美国Sigma公司;牛血清白蛋白(纯度:98%)、考马斯亮蓝G-250(超纯)西安沃尔森生物技术有限公司;三氯乙酸、水杨酸、硫酸亚铁、乙醇、过氧化氢、酒石酸钾钠等均为分析纯。
1.2 仪器与设备FM200高剪切分散乳化机(上海弗鲁克有限公司);HC-3018高速冷冻离心机(安徽中科中佳科学仪器有限公司);SHP-250生化培养箱(上海森地实验仪器有限公司);0.45、0.22 μm混合纤维素膜(上海新亚净化器件厂);LGJ-25C型冷冻干燥机(北京四环科学仪器厂有限公司);PB-10型pH计(德国赛多利斯股份公司);Millex SamplicityTM Filters型超滤器(0.20 μm)(爱尔兰公司);UV-1780紫外可见分光光度计(日本岛津有限公司)。
1.3 方法 1.3.1 奶山羊胎盘提取物冻干粉制备将冷冻的奶山羊胎盘常温解冻,洗净血污后,用生理盐水冲洗胎盘,去筋膜,剪碎(1.0~1.5 cm),沥干水分,加入2倍胎盘质量的无菌生理盐水,高速剪切(剪切力6 000×g,2 min·次-1,循环15次),反复冻融3次,高速冷冻离心机离心,除去沉淀(10 000 g,15 min),收集上清液,依次用0.45、0.22 μm的膜系统进行抽滤,以除去不溶物质,得到初提品。将初提品用截留分子量为6 ku的超滤膜再次进行超滤,收集<6 ku的组分,冷冻干燥26 h,得到羊胎盘提取物冻干粉[18]。
1.3.2 紫外扫描法测定羊胎盘提取物的最大吸收峰扫描波长190~450 nm,蒸馏水作空白对照,石英比色皿中扫描测定。
1.3.3 多肽含量的测定[19]样品的处理:配制50 mg·mL-1样品溶液10 mL,加入15% (w/v)三氯乙酸溶液,定容,摇匀,放置10 min,沉淀酸不溶性蛋白质,6 000 g离心15 min后,取上清液,备用。
标准曲线测定:配制10 mg·mL-1的牛血清白蛋白标准溶液,取11支试管分2组,分别加入0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mL标准溶液,用水补足到1 mL,与4 mL双缩脲试剂充分摇匀后,室温下放置30 min,测定540 nm处的吸光值。以蛋白质的含量为横坐标,光吸收值为纵坐标绘制标准曲线(图 1)。
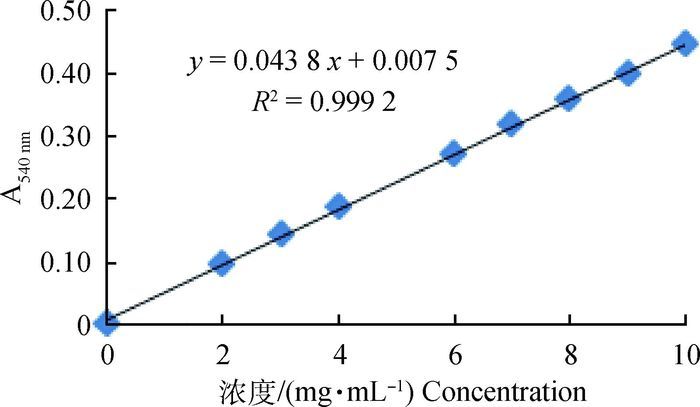
|
图 1 牛血清白蛋白标准曲线 Figure 1 Bovine serum albumin standard curve |
样品测定:取2~3个离心管,分别加入1 mL上清液,测定上清液的吸光值A0,对应标准曲线横坐标值为N0,多肽含量的计算公式:多肽含量(mg·mg-1)=
将干燥粉末封装于无菌的自封袋,在避光、干燥的环境中分别存放在室温、4 ℃条件下。每隔7 d测定其抗氧化活性、WSP含量的变化情况。
1.3.4.1DPPH·清除率和保全率测定[20]:将羊胎盘冻干粉配制成1 mg·mL-1的溶液,取2 mL样品液和1 mL蒸馏水与3 mL 0.1 mmol·L-1 DPPH·的无水乙醇溶液混匀,制得样品反应液;3 mL样品与3 mL无水乙醇溶液混匀,得到空白反应液;3 mL蒸馏水与3 mL含0.1 mmol·L-1 DPPH·的无水乙醇溶液混匀,制得对照反应液。3种反应液在25 ℃下,避光反应30 min后,测定在517 nm处的吸光值。DPPH·清除率和保全率的公式:
DPPH·清除率=(1-(A1-A2)/A3)×100%
保全率=S2/S1×100%
式中:A1表示样品的吸光度;A2表示空白的吸光度;A3表示对照的吸光度;S1表示样品初始清除率;S2表示样品放置末清除率。
1.3.4.2·OH清除率测定[2]:优化刘旺旺[2]的方法,加入2 mL 6 mmol·L-1的FeSO4·7H2O溶液,2 mL 6 mmol·L-1的H2O2溶液、2 mL 1 mg·mL-1的羊胎盘冻干粉溶液充分摇匀制成样品反应液;取2 mL样品液与2 mL蒸馏水混合后,加入2 mL 6 mmol·L-1的FeSO4·7H2O溶液,充分混匀制成对照反应液;2 mL蒸馏水与2 mL 6 mmol·L-1的H2O2溶液混合加入2 mL 6 mmol·L-1的FeSO4·7H2O溶液制成空白反应液;将3种反应液静置10 min,再加入2 mL 6 mmol·L-1的水杨酸无水乙醇溶液,摇匀,37 ℃下避光加热30 min后,4 000×g离心5 min,取上清液,测定510 nm处吸光值。
·OH清除率=(1-(A3-A2)/A1)×100%
式中:A1表示空白溶液的吸光值;A2表示对照溶液的吸光值;A3表示待测样品的吸光值。
1.3.4.3考马斯亮蓝法测定WSP含量[21]
1.3.4.3.1标准曲线的测定:取11支10 mL具塞试管,按表 1取样,涡流混合,放置10 min后, 用比色皿在595 nm下测吸光值,并绘制标准曲线。
|
|
表 1 绘制蛋白质标准曲线时各试剂加入量 Table 1 The reagent dosage for drawing protein standard curve |
样品液中蛋白质浓度的测定:取10 mL试管,加入1 mg·mL-1的羊胎盘冻干粉溶液1 mL,加入考马斯亮蓝G-250溶液5 mL,充分涡流混合,放置10 min后,在595 nm下测定吸光值。
1.3.4.3.3WSP保全率:与1.3.4.1同保全率公式相同。
1.4 数据分析数据经过整理后,采用Minitab 16.2.3进行单因子方差分析,Excel作图。结果以“均值±标准差(X±SD)”表示。
2 结果 2.1 紫外全波长扫描从图 2扫描结果看出,吸收峰集中在200~270 nm,最大吸收峰为204 nm,这是因为羊胎盘多肽中氨基酸分子之间的主要作用力是肽键,这种共价键的吸收波长为215 nm。图 2中第2个特征吸收峰出现在254 nm,核酸的紫外最大吸收波长在260 nm左右,表明提取液中有一定量的核酸存在。
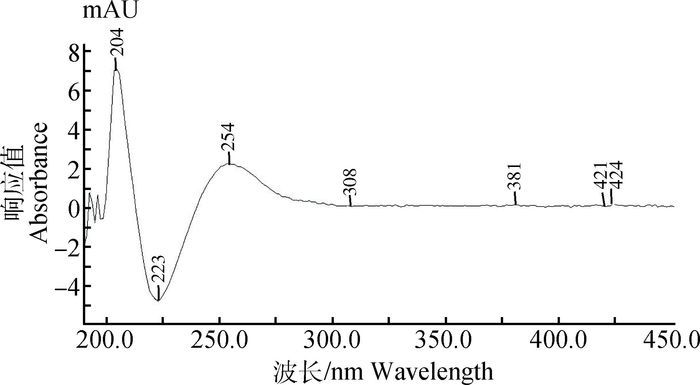
|
图 2 紫外全波长扫描结果 Figure 2 Ultraviolet full wavelength scanning results |
由表 2看出,第2胎中多肽含量最高可达(0.270±0.02) mg·mg-1冻干粉,显著高于其他胎次(P<0.05),第1、3胎多肽含量分别为(0.201±0.03)、(0.193±0.02) mg·mg-1冻干粉,但二者差异不显著(P>0.05)。结果表明,胎次对胎盘提取物中的多肽含量有影响,在研究范围内,第2胎胎盘提取物多肽含量最高。
|
|
表 2 不同胎次胎盘中多肽含量(n=6) Table 2 Different parities polypeptide content in placenta (n=6) |
图 3表明,不同存放条件下,3个胎次胎盘提取物的抗氧化活性、WSP含量衰变情况。4 ℃条件与常温条件相比,各个胎次提取物DPPH·清除率均相对较高,以第2胎最优,在存放周期内均呈现整体高于常温条件下的优势,9周后从53.20%衰减至41.95%,衰减率仅为21.15%,而常温条件下衰减率高达56.90%。图 3B显示了·OH清除率的变化,亦表现出同样的规律,第2胎衰减速率仅为28.07%,远低于常温条件下的衰减率60.72%。图 3C看出,9周时4 ℃条件存放的第2胎WSP含量与相同条件下第1、3胎及常温存放的各胎次相比优势明显,差异显著(P<0.05)。因此,4 ℃是胎盘提取物冻干粉存放的理想条件。
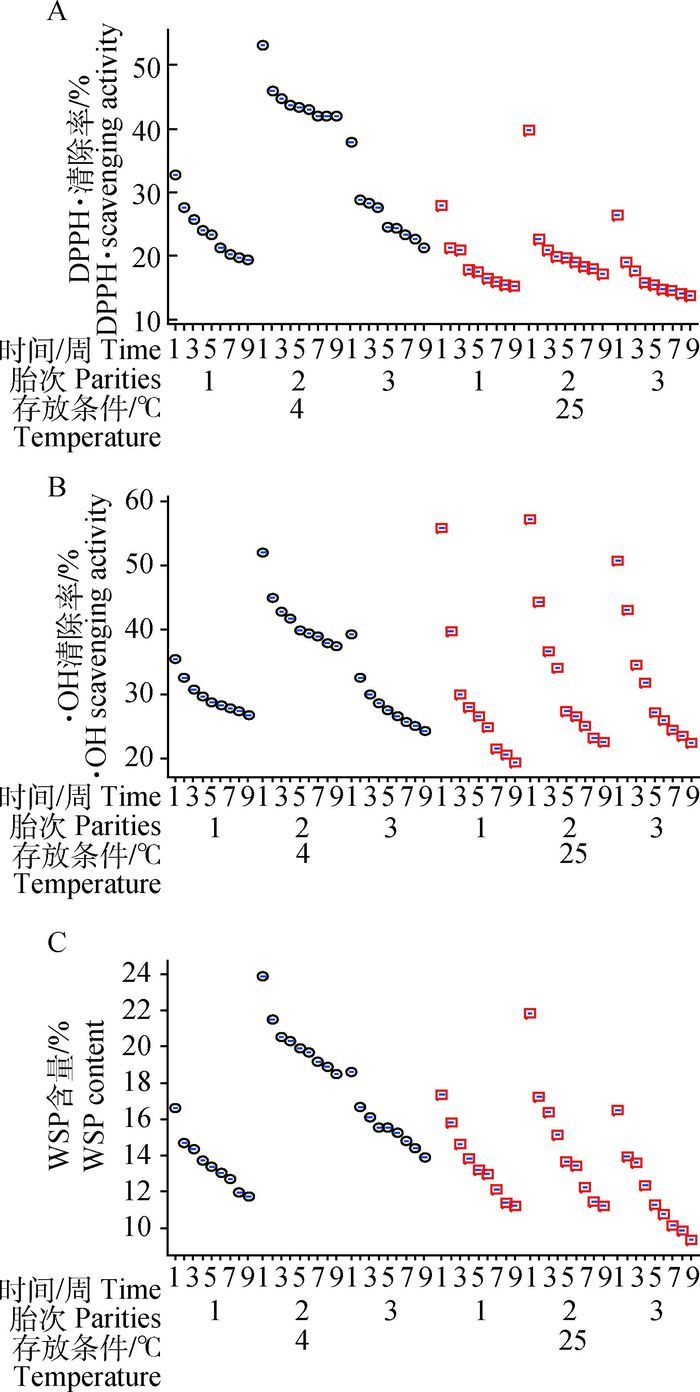
|
图 3 不同存放条件下各胎次胎盘提取物抗氧化活性以及WSP含量随时间的变化结果(n=18) Figure 3 Changes of antioxidant activity and water-soluble protein content in placenta extract about parities in different storage conditions (n=18) |
图 4A表明,各胎次胎盘提取物的DPPH·清除率随存放时间的延长呈现逐步下降的趋势。7~14 d第3胎提取物DPPH·清除率衰减显著(P<0.05),28 d衰减变缓,开始趋于稳定。第2胎胎盘提取物在整个存放周期内下降速率差异不显著(P>0.05)。胎次间比较结果可由图 4B体现出来,在存放周期内,第2胎胎盘提取物DPPH·清除率表现出整体优势,其冻干粉初始清除率最高,可达53.2%,远高于第1、3胎;统计分析第1、3胎间DPPH·清除率差异不显著(P>0.05),分别为32.75%、37.97%;1、3胎次存放63 d后分别衰减了40.78%、43.92%,第2胎衰减了21.15%,抗氧化活性保全率为78.85%,高于1、3胎次。
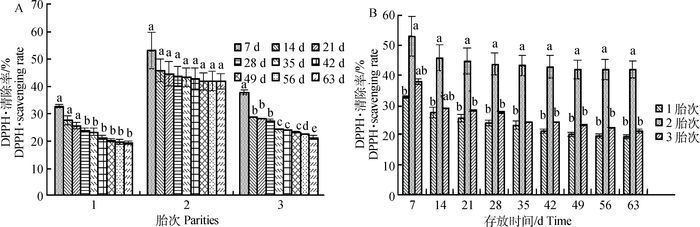
|
图 4 不同胎次胎盘提取物DPPH·清除率随时间变化结果(n=18) Figure 4 Results of DPPH· radical scavenging rates in placenta extract about parities with time (n=18) |
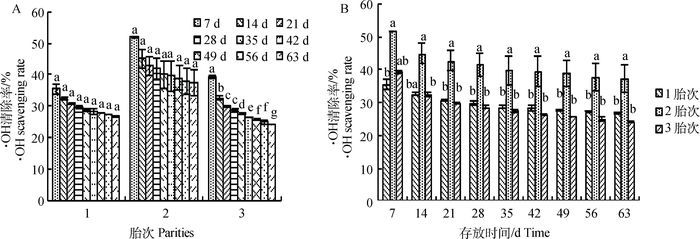
图 5显示,·OH清除率的衰变情况,变化规律同DPPH·清除率大致相同,但由图 5A可以看出第3胎7~14 d清除率下降速率达显著水平(P<0.05),由39.35%下降到32.49%。在整个存放时间内,第1、2胎·OH清除率衰减速率未达显著水平(P>0.05),最终三者清除率都趋向稳定。图 5B体现了同一时间段3个胎次的清除率相对高低情况,21 d后1、3胎次·OH清除率无显著差异(P>0.05),与第2胎相比差异显著(P<0.05),63 d第2胎的清除率仍处于最高水平为37.36%,衰减了28.07%,保全率为71.93%,稍低于第1胎的保全率75.39%,但高于第3胎保全率61.70%。
|
图 5 不同胎次胎盘提取物·OH清除率随时间变化结果(n=18) Figure 5 Results of ·OH radical scavenging rates in placenta extract about parities with time (n=18) |
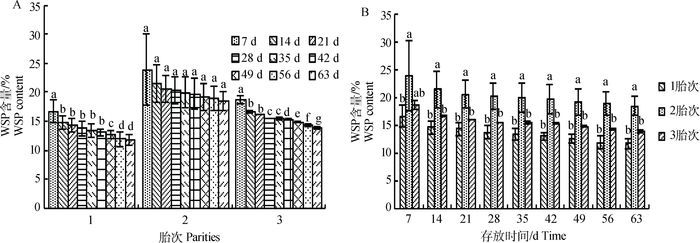
图 6A比较看出,3个胎次的羊胎盘提取物中WSP含量随存贮时间的延长呈现逐渐下降的趋势,7~14 d第1、2、3胎衰减速率相差不大,第2胎提取物中WSP含量由23.87%下降至21.48%冻干粉,衰减率10.00%,衰减速率不显著(P>0.05),第1、3胎WSP含量显著下降(P<0.05)。56 d后,3个胎次提取物中WSP含量都趋于稳定。图 6B表明,第2胎WSP含量显著高于第1、3胎(P<0.05),直到63 d一直处于优势,其WSP含量为18.46%,保全率为77.36%。
|
图 6 不同胎次胎盘提取物WSP含量随时间变化结果(n=18) Figure 6 Results of water soluble protein content in placenta extract about parities with time (n=18) |
胎盘是哺乳类胎生动物在怀胎时为胎儿供应养分,让胚胎生长的特殊组织,承担着气体交换、提供营养物质和排出代谢废物等功能,分娩时排出体外。山羊胎盘早已应用在中国传统医学,现代医学将胎盘作为一种特殊的药物治疗硬化症,降低尿酸等[22]。羊胎盘富含多种生物活性组分,其中蛋白质和多肽含量高达80%以上[23],具有抗氧化、催乳、提高机体免疫力等功效[24]。
多肽含量与样品种类、样品前处理方法、提取方法、分离纯化手段以及测定方法等因素有关。本研究中3个胎次胎盘提取物测得的多肽含量之间具有显著差异(P<0.05),第2胎胎盘提取物中多肽含量显著高于第1、3胎(P<0.05),表明胎次也是影响奶山羊胎盘提取物多肽含量的因素,且与先前所报道的结果均有所不同。刘旺旺等[25]分别用黑曲霉、枯草芽孢杆菌、米曲霉发酵羊胎盘提取物,发酵产物中多肽含量分别是187、180、176 μg·mL-1。马兴亮[26]将胎盘子叶剪碎,采用超滤和Superdex-75层析对混合小肽进行分离,得到的4个小肽组分含量分别是0.96、1.20、1.32、1.80 mg·g-1。因此即使同为羊胎盘测得的多肽含量也有所差别,可能是品种不同、羊胎盘所处孕期的阶段不同、研究羊胎盘部位不同等原因所引起的。
本研究对不同胎次羊胎盘提取物中多肽含量进行分析,试验结果表明, 与第1、3胎相比,第2胎胎盘提取物中的多肽含量显著提高(P<0.05),该结果与前期许多学者对胎次的研究报道相一致。魏鹏飞等[27]研究发现第2胎奶牛的奶品质最好,SCC数最高。王璐菊等[28]对荷斯坦牛305 d产奶量进行跟踪记录,发现产奶量随胎次的增加呈现先上升后降低的趋势,2胎时达到最高。韩英东等[8]发现胎次能够显著影响血液中PRL、INS的含量。PRL是脊椎动物腺垂体PRL细胞分泌的一种肽类激素;INS是由胰岛β细胞分泌的一种蛋白质激素,能够促进蛋白质的合成。因此,由胎次引起的差异,可能是血液中激素含量不同导致的,从而使机体新陈代谢和生理功能不同,第2胎时母羊体内各种激素水平最适宜,生育能力最佳,胎盘中各种组分含量丰富,生理功能最完善。
3.2 胎次对奶山羊胎盘提取物抗氧化活性、WSP含量的影响DPPH·是脂溶性自由基,一旦从抗氧化剂中得到电子或质子后,就会变成一个稳定的产物[29-30],造成机体组织氧化衰老,·OH是水溶性自由基也可作为抗氧化活性的测量指标[31]。要简单地反映抗氧化活性选择一种测定方法是可行的,但是只用一种测定方法反映其抗氧化活性却是不准确的。不同的测定方法具有其优势和劣势,比如DPPH·清除率操作简单,体系稳定性较好,结果重现性好,而·OH清除率测定时溶液配制比较麻烦,过程繁琐,结果重现性较差,需多次重复试验。因此全面评价一种抗氧化物质的抗氧化活性需要多种评价方法在不同条件下综合评价才更具有说服力,将两者结合起来能更加全面地评判胎盘多肽的抗氧化性。
多肽抗氧化活性与多肽的分子量大小、构型、构象、氨基酸组成、顺序紧密相关,而含硫基团如游离-SH、-S-S键与蛋白质分子结构和构象密切相关[17, 32]。一旦这些含硫键改变,就会导致多肽抗氧化活性的改变。T.B.Zou等[33]综合论述了天然蛋白质中抗氧化肽结构和功能之间的关系,分析抗氧化功能是由分子量、氨基酸组成、序列和疏水性等综合作用的结果。R.He等[34]通过固态发酵法制备菜籽肽,发现抗氧化活性与浓度存在依赖关系。徐雪峰[35]对赤灵芝多糖进行分离、纯化和体外抗氧化活性研究,结果表明,其抗氧化活性随浓度升高而增大,呈量效关系,分子量最大的组分抗氧化活性最强。周洁静等[16]和刘旺旺等[25]利用酶解或发酵羊胎盘制备抗氧化肽,对发酵液进行超滤后测定其分子量得到抗氧化活性与发酵液分子量分布的关系。
本研究主要针对奶山羊胎盘胎次与抗氧化活性之间的关系进行分析。结果表明,存放期间奶山羊胎盘提取物清除DPPH·和·OH能力呈现逐步下降趋势,WSP含量也表现出相同规律,这与唐文林之前的报道相一致[36]。在研究范围内,随着胎次的变化,抗氧化活性也不尽相同,多项指标均显示第2胎抗氧化活性最强。可能有两个原因:(1) 奶山羊首次受孕导致应激反应所引起的;(2) 首次受孕奶山羊生理机能表现不足引起的[37],因此需要进一步提升与强化。G.Cozzi等[38]研究胎次对牛奶品质的影响,发现胎次通过影响血液中总蛋白、球蛋白、肌酸酐、碱性磷酸酶、γ-谷氨酰转移酶等的浓度调控牛奶的品质,进一步说明激素水平是胎次间各性能产生显著差异的主要因素。
奶山羊处于第1胎时本身尚在生长发育阶段,一方面要满足自身生长,另一方面还要给胎盘提供营养,母体内激素供应不足,随着胎次增长,母体各项生理机能发育成熟,第2胎体况达到最好水平,第3胎时各个器官本身功能开始老化,激素水平降低,加之抵抗力下降,体况开始逐渐减弱,其体内的各项生理指标衰退,抗氧化活性就会受到影响[10, 37]。胎儿在子宫中发育,依靠胎盘从母体取得营养,因此,奶山羊胎盘提取物抗氧化活性下降的原因,除了激素水平减弱,抵抗力下降外,还与子宫的结构、功能在多次产后难以恢复到常态有关系[39]。综上表明,以抗氧化多肽为目的的加工利用应以第2胎胎盘为主。
4 结论 4.1第1、2、3胎各胎盘提取物冷冻干燥后,多肽含量分别为(0.201±0.03)、(0.270±0.02)、(0.193±0.02) mg·mg-1冻干粉;DPPH·清除率分别为32.75%、53.20%、37.97%;·OH清除率分别是35.45%、51.94%、39.35%;WSP含量分别为16.63%、23.87%、18.60%,表明第2胎各指标最佳,质量最优。
4.2各胎次提取物4 ℃条件时,随时间延长DPPH·清除率、·OH清除率、WSP含量3个指标保全率均明显优于常温存放(P<0.05)。第2胎提取物DPPH·清除率由53.20%衰减至41.95%,衰减了21.15%,常温条件下衰减了56.90%;·OH清除率衰减了28.07%,常温时衰减率为60.72%;WSP含量由23.87%降为18.46%,衰减了22.64%,常温条件下衰减了48.82%;综上,4 ℃条件存放,3个指标衰减情况均优于常温条件。
4.34 ℃条件下,存放至63 d时,第2胎胎盘提取物DPPH·清除率保全了78.85%;·OH清除率保全了71.93%;WSP含量保全率为77.36%。
综上,第2胎胎盘提取物经过冷冻干燥,4 ℃存放时,抗氧化活性优于常温保存。
| [1] |
王顺新. 酶法水解牛胎盘下脚料的工艺研究[J]. 食品安全导刊, 2016(9): 93–95.
WANG S X. Study on the technology of enzymatic hydrolysis of bovine placenta[J]. China Food Safety, 2016(9): 93–95. (in Chinese) |
| [2] |
刘旺旺, 侯银臣, 王皓, 等. 不同菌种发酵羊胎盘残留物制备活性肽研究比较[J]. 食品工业, 2015, 36(8): 149–153.
LIU W W, HOU Y C, WANG H, et al. Comparative study on activities of placenta peptide produced by different microbiological strains ferment goat placenta residue[J]. Food Industry, 2015, 36(8): 149–153. (in Chinese) |
| [3] | HARNEDY P A, FITZGERALD R J. Bioactive peptides from marine processing waste and shellfish:A review[J]. J Funct Foods, 2012, 4(1): 6–24. DOI: 10.1016/j.jff.2011.09.001 |
| [4] | SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins:A review[J]. Peptides, 2010, 31(10): 1949–1956. DOI: 10.1016/j.peptides.2010.06.020 |
| [5] | KATE R, EL-DIN B A, MICHELLE M, et al. Towards generation of bioactive peptides from meat industry waste proteins:generation of peptides using commercial microbial proteases[J]. Food Chem, 2016, 208: 42–50. DOI: 10.1016/j.foodchem.2016.03.121 |
| [6] | AHMED A S, EL-BASSIONY T, ELMALT L M, et al. Identification of potent antioxidant bioactive peptides from goat milk proteins[J]. Food Res Int, 2015, 74: 80–88. DOI: 10.1016/j.foodres.2015.04.032 |
| [7] | EBNER J, ARSLAN A A, FEDOROVA M, et al. Peptide profiling of bovine kefir reveals 236 unique peptides released from caseins during its production by starter culture or kefir grains[J]. J Proteomics, 2015, 117: 41–57. DOI: 10.1016/j.jprot.2015.01.005 |
| [8] |
韩英东, 杨亮, 潘晓花, 等. 胎次和泌乳阶段对荷斯坦奶牛血液乳成分前体物及泌乳相关激素含量的影响[J]. 动物营养学报, 2015, 27(4): 1135–1144.
HAN Y D, YANG L, PAN X H, et al. Effects of parity and stage of lactation on milk component precursor and lactation related hormone contents in blood of Holstein dairy cows[J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1135–1144. (in Chinese) |
| [9] |
吴双军, 尚娇, 尚海彬, 等. 不同年龄、胎次和泌乳月对奶牛乳脂率的影响[J]. 安徽农业科学, 2016, 44(14): 125–126.
WU S J, SHANG J, SHANG H B, et al. Effects of dairy cow age, fetal times and lactation month on the butter-fat percentage[J]. Journal of Anhui Agricultural Sciences, 2016, 44(14): 125–126. DOI: 10.3969/j.issn.0517-6611.2016.14.043 (in Chinese) |
| [10] |
金亚东, 李艳艳, 徐晓锋. 胎次和泌乳阶段对奶牛体细胞数和乳损失量的影响[J]. 乳业科学与技术, 2016, 39(3): 9–13.
JIN Y D, LI Y Y, XU X F. Effects of parity and lactation stage on somatic cell score and milk production loss in dairy cows[J]. Journal of Dairy Science and Technology, 2016, 39(3): 9–13. (in Chinese) |
| [11] |
刘志安, 刘武军, 孟军, 等. 不同胎次放牧伊犁马产乳性能及乳品质相关性研究[J]. 新疆农业科学, 2015, 52(2): 360–365.
LIU Z A, LIU W J, MENG J, et al. The correlation study of mare's milk performance and milk quality of different parity grazing Yili horses[J]. Xinjiang Agricultural Sciences, 2015, 52(2): 360–365. (in Chinese) |
| [12] |
李双红, 刘永峰, 韩裕睿, 等. 不同胎次奶牛乳中乳蛋白含量的近红外光谱定量分析[J]. 食品工业科技, 2014, 35(4): 60–65.
LI S H, LIU Y F, HAN Y R, et al. Quantitative analysis of milk protein content in different parities cows based on near infrared spectroscopy[J]. Science and Technology of Food Industry, 2014, 35(4): 60–65. (in Chinese) |
| [13] |
孙雨辰. 牛乳的酶凝固特性及其影响因素研究[D]. 长春: 吉林农业大学, 2015.
SUN Y C. Study on enzymatic coagulation properties of bovine milk and the influencing factors[D]. Changchun:Jilin Agricultural University, 2015. (in Chinese) |
| [14] | VASSEUR E, GIBBONS J, RUSHEN J, et al. Development and implementation of a training program to ensure high repeatability of body condition scoring of dairy cows[J]. J Dairy Sci, 2013, 96(7): 4725–4737. DOI: 10.3168/jds.2012-6359 |
| [15] |
邵尊亚, 雷赵民, 宫旭胤, 等. '河西绒山羊'乳营养成分及理化性质研究[J]. 甘肃农业大学学报, 2014, 49(2): 25–28.
SHAO Z Y, LEI Z M, GONG X Y, et al. Milk nutritional components and physic-chemical properties of 'Hexi cashmare goat'[J]. Journal of Gansu Agricultural University, 2014, 49(2): 25–28. (in Chinese) |
| [16] |
周洁静, 侯银臣, 刘旺旺, 等. 采用不同蛋白酶制备羊胎盘抗氧化肽的研究[J]. 食品工业科技, 2015, 36(5): 156–161.
ZHOU J J, HOU Y C, LIU W W, et al. Study on producting antioxidant peptide from goat placenta by different proteases[J]. Science and Technology of Food Industry, 2015, 36(5): 156–161. (in Chinese) |
| [17] | ARZENI C, MARTíNEZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. J Food Eng, 2012, 108(3): 463–472. DOI: 10.1016/j.jfoodeng.2011.08.018 |
| [18] |
焦艳丽, 杜冰, 郭晓明, 等. 超声提取羊胎盘水溶性活性蛋白[J]. 食品与发酵工业, 2011, 37(11): 224–228.
JIAO Y L, DU B, GUO X M, et al. Study on ultrasonic extraction of activity protein from sheep placenta[J]. Food and Fermentation Industries, 2011, 37(11): 224–228. (in Chinese) |
| [19] |
鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学, 2005, 26(7): 169–171.
LU W, REN G P, SONG J M. Determination of content of peptides in protein hydrolysates[J]. Food Science, 2005, 26(7): 169–171. (in Chinese) |
| [20] | WU H C, CHEN H M, SHIAU C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Res Int, 2003, 36(9-10): 949–957. DOI: 10.1016/S0963-9969(03)00104-2 |
| [21] |
罗群. 考马斯亮蓝法快速测定菜籽粕中可溶性蛋白质的含量[J]. 成都大学学报:自然科学版, 2014, 33(2): 125–126, 129.
LUO Q. Rapid determination of soluble protein content in rapeseed meal by coomassie brilliant blue method[J]. Journal of Chengdu University:Natural Science Edition, 2014, 33(2): 125–126, 129. (in Chinese) |
| [22] | DE FALCO S. The discovery of placenta growth factor and its biological activity[J]. Exp Mol Med, 2012, 44(1): 1–9. DOI: 10.3858/emm.2012.44.1.025 |
| [23] | FANG X P, XIA W S, SHENG Q H, et al. Purification and characterization of an immunomodulatory peptide from bovine placenta water-soluble extract[J]. Prep Biochem Biotechnol, 2007, 37(3): 173–184. DOI: 10.1080/10826060701386653 |
| [24] | HAN N R, KIM K Y, KIM M J, et al. Porcine placenta mitigates protein-energy malnutrition-induced fatigue[J]. Nutrition, 2013, 29(11-12): 1381–1387. DOI: 10.1016/j.nut.2013.04.016 |
| [25] |
刘旺旺, 侯银臣, 程永霞, 等. 羊胎盘多肽的制备及其清除自由基能力的研究[J]. 中国酿造, 2014, 33(9): 89–93.
LIU W W, HOU Y C, CHENG Y X, et al. Polypeptide preparation of sheep placenta and its free radicals scavenging activity[J]. China Brewing, 2014, 33(9): 89–93. DOI: 10.11882/j.issn.0254-5071.2014.09.022 (in Chinese) |
| [26] |
马兴亮. 奶山羊胎盘肽的分离提纯及其对小白鼠免疫功能的影响[D]. 泰安: 山东农业大学, 2008.
MA X L. Isolation of dairy goat placental peptide and effect on immune function of mice[D]. Tai'an:Shandong Agricultural University, 2008. (in Chinese) |
| [27] |
魏鹏飞, 张淑君, 滑国华. 不同养殖模式下产犊季节、泌乳季节及胎次对荷斯坦牛产奶量及乳品质的影响[J]. 中国奶牛, 2017(1): 21–25.
WEI P F, ZHANG S J, HUA G H. Effects of calving season, lactation season and parity on milk yield and quality in dairy cows[J]. China Dairy Cattle, 2017(1): 21–25. (in Chinese) |
| [28] |
王璐菊, 郭全奎, 张勇. 产犊季节及胎次对甘肃会宁地区荷斯坦牛产奶量的影响[J]. 中国牛业科学, 2015, 41(3): 42–46.
WANG L J, GUO Q K, ZHANG Y. Effects of different calving seasons and parities on milk production for Holstein cows in the Huining region of Gansu[J]. China Cattle Science, 2015, 41(3): 42–46. (in Chinese) |
| [29] | WANG B, LI Z R, CHI C F, et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of Sphyrna lewini muscle[J]. Peptides, 2012, 36(2): 240–250. DOI: 10.1016/j.peptides.2012.05.013 |
| [30] | ZHU L J, CHEN J, TANG X Y, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of alcalase-treated zein hydrolysate[J]. J Agric Food Chem, 2008, 56(8): 2714–2721. DOI: 10.1021/jf703697e |
| [31] | LUO H Y, WANG B, LI Z R, et al. Preparation and evaluation of antioxidant peptide from papain hydrolysate of Sphyrna lewini muscle protein[J]. LWT Food Sci Technol, 2013, 51(1): 281–288. DOI: 10.1016/j.lwt.2012.10.008 |
| [32] | TANG W L, ZHANG M, FANG Z X. Optimization of ultrasound-assisted-extraction of porcine placenta water-soluble proteins and evaluation of the antioxidant activity[J]. J Food Sci Technol, 2015, 52(7): 4042–4053. DOI: 10.1007/s13197-014-1444-1 |
| [33] | ZOU T B, HE T P, LI H B, et al. The structure-activity relationship of the antioxidant peptides from natural proteins[J]. Molecules, 2016, 21(1): 72. DOI: 10.3390/molecules21010072 |
| [34] | HE R, JU X R, YUAN J, et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J]. Food Res Int, 2012, 49(1): 432–438. DOI: 10.1016/j.foodres.2012.08.023 |
| [35] |
徐雪峰, 李桂娟, 闫浩, 等. 赤灵芝多糖分离纯化及体外抗氧化性研究[J]. 食品与机械, 2017, 33(1): 144–147.
XU X F, LI G J, YAN H, et al. Study on isolation and antioxidant activity of the polysaccharide from Ganoderma lucidum[J]. Food & Machinery, 2017, 33(1): 144–147. (in Chinese) |
| [36] |
唐文林. 猪胎盘综合利用工艺与应用研究[D]. 无锡: 江南大学, 2014.
TANG W L. The comprehensive utilization technology and application of porcine placenta[D]. Wuxi:Jiangnan University, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10295-1014380682.htm |
| [37] |
戴五洲, 郑云林. 胎次及分娩季节对母猪繁殖性能的影响[J]. 黑龙江畜牧兽医, 2016(6): 81–82.
DAI W Z, ZHENG Y L. Effects of pregnancy and delivery season on reproductive performance of sows[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(6): 81–82. (in Chinese) |
| [38] | COZZI G, RAVAROTTO L, GOTTARDO F, et al. Short communication:Reference values for blood parameters in Holstein dairy cows:Effects of parity, stage of lactation, and season of production[J]. J Dairy Sci, 2011, 94(8): 3895–3901. DOI: 10.3168/jds.2010-3687 |
| [39] |
曹迎春, 陈铁桥. 繁殖母猪胎次与生产性能及疾病的关系[J]. 畜牧与兽医, 2003, 35(3): 25–26.
CAO Y C, CHEN T Q. The relationship between sow parity and production performance and disease[J]. Animal Husbandry & Veterinary Medicine, 2003, 35(3): 25–26. (in Chinese) |



