成纤维细胞生长因子(Fibroblast growth factor, FGF)是由垂体和下丘脑分泌的多肽,成纤维细胞生长因子家族(Fibroblast growth factors, FGFs)总共有23个成员[1-3],至少包含18种分泌蛋白和4种胞内蛋白,通过与成纤维生长因子受体(Fibroblast growth factor receptor,FGFR)结合参与哺乳动物体内诸多生物学过程。FGFR总共有5种,均属于免疫球蛋白超家族成员,其中4种为酪氨酸激酶受体,分别是由4种基因编码的FGFR1、FGFR2、FGFR3和FGFR4,还有一种是不含酪氨酸激酶区域的受体FGFR5[4]。FGF信号在人体胚胎发育、内环境稳定、生殖细胞发育及再生等一系列生理过程中发挥着非常广泛的作用。因此,从分子水平上对FGF信号通路进行研究对于阐释人类生殖疾病发生和哺乳动物的繁殖机理非常必要。
1 FGFs及其受体的作用机制FGFs按其作用方式可分为3类,包括旁分泌型FGF、自分泌型FGF以及内分泌型FGF[5]。旁分泌型FGF是最典型的FGF,这类因子需分泌到细胞外并弥散至其邻近的靶细胞与其受体结合才能发挥其生理作用,且必需在肝素/硫酸乙酰肝素的辅助下才能发挥生物学功能[6];自分泌型FGF因缺乏相应的受体而使其只能在细胞本身或同种细胞中发挥作用,包含整个FGF11亚家族,这类因子的共同点在于需要在互作蛋白的辅助下通过钠离子通道进入邻近细胞中才能发挥生物学作用;内分泌型FGF不经导管而直接分泌到体液中,并通过体液对靶细胞产生效应,包含整个FGF15/FGF19亚家族,这类因子的共同点在于需要在辅助因子Klotho蛋白家族的协助下才能发挥功能。根据序列同源性和系统发育树可将FGFs划分为7个亚家族,如表 1所示。
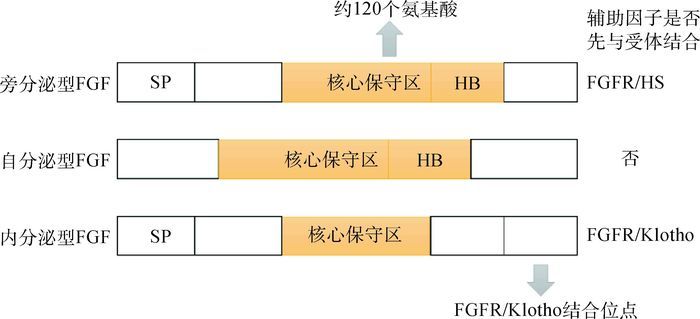
为了阐明FGFs与FGFRs的作用机制,科学家们对FGFs和FGFRs的基本结构进行了研究,得到了不同类型FGFs及FGFRs的结构并对其进行了分析。图 1显示的是不同类型FGFs的基本结构,其中,核心保守区长度约为120个氨基酸。
|
其中SP代表信号肽序列,橙色区域代表核心保守区,HB代表硫酸乙酰肝素结合位点,上下2个箭头分别指示核心保守区长度和成纤维细胞生长因子与受体或辅助因子结合位点[7] SP, orange part and HB indicate a secreted signal peptide sequence, conserved core and heparan sulfate-binding site, respectively; The up and down arrows indicate the length of conserved core and the binding site of FGF with FGFR/Klotho, respectively[7] 图 1 成纤维细胞生长因子家族的结构略图 Figure 1 Schematic representations of FGFs structures |
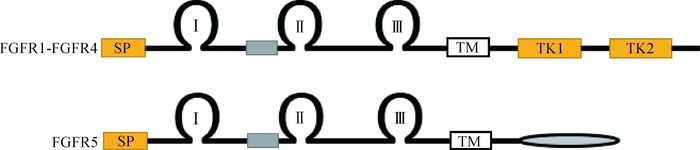
所有FGFR均包含3个胞外免疫球蛋白样的区域,区别在于FGFR1-FGFR4还存在2个胞内酪氨酸激酶区域,其中,FGFR1-FGFR3在Ⅲ处均存在2个剪接体,分别命名为Ⅲb和Ⅲc,而FGFR5则不含任何胞内激酶区域,胞内部分仅有一个短的尾巴。图 2显示的是不同FGFR的结构。
|
其中SP代表信号肽序列,TM代表跨膜区域,TK1和TK2代表胞内的2个酪氨酸激酶区域,Ⅰ、Ⅱ和Ⅲ代表的是3个免疫球蛋白样区域,灰色方格区域和椭圆区域分别代表一个含8个氨基酸残基的盒子和一个短的胞内区域[4] SP, TM, TK1 and TK2 indicate a secreted signal peptide sequence, transmembrane domain and 2 intracellular tyrosine domains, respectively; Ⅰ, Ⅱ and Ⅲ indicate 3 immunoglobulin-like domains; The gray box and ellipse districts indicate a box composed of 8 amino acid residues and a short cytoplasmic domain, respectively[4] 图 2 不同成纤维细胞生长因子受体的结构略图 Figure 2 Schematic representations of FGFRs structures |
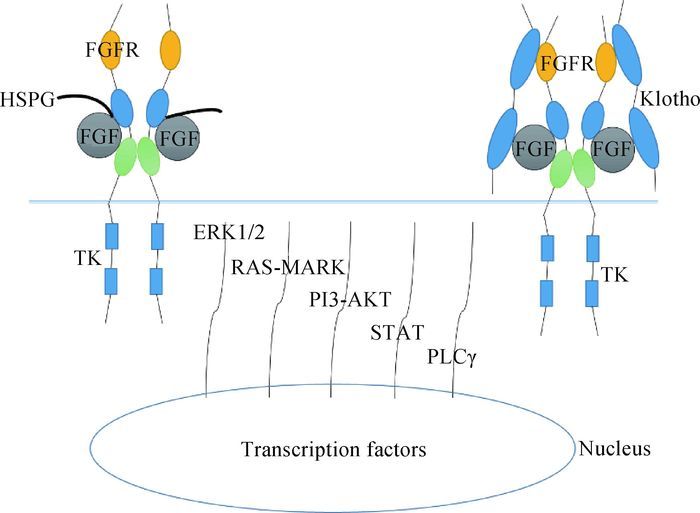
FGFs中除了自分泌型FGF以外的每个家族或成员均有其特异性的受体,但与不同受体结合具有选择性,其中,FGF1是唯一一个能够与所有受体结合的FGF。FGF必须先与其受体和辅助因子形成FGFs-辅助因子-FGFRs复合物,三者复合物形成之后引起构象变化形成二聚体,进而激活胞内的酪氨酸激酶活性,并参与ERK1/2、RAS-MARK、PI3-AKT、STAT以及PLCγ等代谢通路来指导细胞应答反应,如激活细胞内的磷酸化反应以及调控相关转录因子的表达等,最终实现对卵泡发育、生殖细胞的成熟、出生后发育、内环境稳态、神经发育、骨骼发育、组织再生以及代谢等多方面的调控[8-9]。FGFs与其受体的结合如图 3所示。
|
其中FGF代表成纤维细胞生长因子,FGFR代表成纤维细胞生长因子受体,HSPG代表硫酸乙酰肝素蛋白多糖,TK代表胞内酪氨酸激酶区域;ERK1/2、RAS-MARK、PI3-AKT、STAT以及PLCγ表示的是5条不同的信号通路[4, 10] FGF, FGFR, HSPG and TK indicate fibroblast growth factor, fibroblast growth factor receptor, heparan sulfate proteoglycan and intracellular tyrosine domains, respectively; ERK1/2, RAS-MARK, PI3-AKT, STAT and PLCγ indicate 5 different signaling pathways[4, 10] 图 3 成纤维细胞生长因子与其受体相互作用并参与生物学过程的简图 Figure 3 Schematic represents the combination of FGF and FGFR and the biological processes they engage in |
哺乳动物的卵巢发育是非常复杂而又有序的生物学过程,其中最重要的过程包括卵泡的发育、卵母细胞的成熟以及相关生殖激素的分泌等,这些过程受到多种因子的调节。通过对FGFs进行不断研究,研究者们发现了一些与动物卵巢发育相关的因子[11],深入研究这些因子在卵巢发育过程中的功能对于阐释哺乳动物的卵巢发育机制意义重大。目前,已经发现并进行研究的FGF主要有FGF2、FGF7、FGF8、FGF10、FGF17和FGF18等,且绝大部分属于旁分泌型FGF,它们的定位[12]及主要功能如表 2所示。
|
|
表 2 与卵巢发育相关的成纤维细胞生长因子的定位及其主要功能 Table 2 Localization and main functions of FGFs associated with ovary development |
哺乳动物的卵泡位于卵巢皮质内,由一个卵母细胞及其周围包裹的无数个颗粒细胞组成,根据卵泡发育过程中的形态和功能变化将其分为原始卵泡、初级卵泡和成熟卵泡。在哺乳动物出生以后,原始卵泡的数量就已经确定且不会进行生长和增殖,只有在相关因子的辅助下转变成初级卵泡,才能继续发育为成熟卵泡,并在完成排卵之后萎缩塌陷形成黄体[20]。哺乳动物原始卵泡向初级卵泡转变的过程是卵巢发挥生物学功能的一个关键过程,包含多个内分泌和旁分泌信号通路[12],其中就有FGFs参与的PI3/AKT信号通路。
FGF2和FGF7是与卵泡发育密切相关的两个成纤维细胞生长因子[21-24],1989年,FGF2被最初定位于大鼠的卵泡膜细胞中,它能够刺激颗粒细胞增殖,还能通过抑制类固醇生成而抑制颗粒细胞的分化,同时减少颗粒细胞凋亡,并且在卵泡发育的各个阶段表达[14]。也有研究报道,卵母细胞产生的FGF2能够作用于前体颗粒细胞,从而促进原始卵泡向初级卵泡转变[12]。此外,FGF2与促卵泡素(FSH)相互作用还能促进体外山羊原始卵泡起始发育和后期发育卵泡的生长[25]。
FGF7又名角质细胞生长因子(Keratinocyte growth factor, KGF),由J.S.Rubin等[26]于1989年从人的胚胎肺成纤维细胞培养上清中分离并纯化得到,它存在于多种器官和组织中,对于胚胎发育以及细胞增殖和分化过程非常关键。FGF7被最初定位于牛的卵泡膜细胞中,研究表明,FGF7具有组织特异性表达的特点,它仅在卵泡膜细胞中表达,在颗粒细胞和卵母细胞中不表达,但FGF7的受体FGFR2不仅存在于卵泡膜细胞,还存在于颗粒细胞、卵丘细胞以及卵母细胞中[12]。上皮-间充质间的相互作用对于组织器官等的发育均很重要,而在卵泡发育过程中,卵母细胞、颗粒细胞以及卵泡膜细胞之间的相互作用类似于上皮-间充质间的作用,它们两两之间的信息交换对于促进卵泡发育和卵母细胞的成熟十分关键。
J. H. Cho等[27]研究发现,牛卵泡膜细胞能够表达FGF7并分泌该蛋白,并通过KIT/KILLG信号通路与颗粒细胞相互作用,进而促进卵母细胞的生长。研究表明,卵泡膜细胞产生的FGF7能够作用于颗粒细胞的原因在于颗粒细胞能够表达FGF7的特异性受体FGFR2[28]。B. Berisha等[29]研究发现,FGF7在牛卵泡生长后期的卵泡膜中表达量较高,并通过研究排卵期母牛卵泡成熟过程中FGF7 mRNA的表达模式得出FGF7可能参与卵泡成熟以及黄体的生成[30]。但FGF7对于体外成熟条件下山羊初级卵泡的发育并没有促进作用,取代FGF7角色的是FGF10[15],由此可知,不同的因子对于不同的物种可能发挥不同的生物学作用,这还有待于进一步研究。P. Kezele等[28]通过培养出生4 d大鼠的卵巢组织发现,FGF7的存在使得65%的原始卵泡向初级卵泡转变,而对照组仅有45%,其原因在于原始卵泡中发育的颗粒细胞能够产生KITLG (KIT Ligand),KITLG是一种干细胞因子,在卵泡募集过程中发挥重要功能,能够显著增加进入募集周期的原始卵泡的数量,卵巢中的KITLG能够与FGF7相互作用对卵巢表面的上皮细胞和大有腔卵泡的生长进行调节。而卵泡膜细胞产生的FGF7能促进颗粒细胞产生KITLG,如此形成一个正反馈回路,共同促进卵泡发育,卵泡膜细胞产生的FGF7在该过程中的角色相当于一个间充质因子。
FGF10又名角化生长因子2(Keratinocyte growth factor 2, KGF2) [4],它与FGF7属于同一亚家族,且在哺乳动物卵巢中的表达模式与FGF7非常相似,主要表达部位是卵母细胞和卵泡膜细胞,但能够通过旁分泌的方式作用于颗粒细胞,从而影响卵泡发育,其特异性受体是FGFR1b和FGFR2b[31]。R. F. Pomini Pinto等[31]研究也表明,FGF10与其受体间的相互作用很可能是影响早期卵泡发育和颗粒细胞增殖的重要因素。此外,FGF8亚家族的FGF8[24]、FGF17和FGF18[32]均与哺乳动物的卵泡发育有关。其中,FGF8能增强大鼠颗粒细胞中的BMP-Smad信号,并与其相互作用影响类固醇激素的合成,对大鼠卵巢生理功能的维持十分重要[33]。F. Asgari等[34]研究表明,FGF8在牛卵泡形成和颗粒细胞增殖分化整个过程中的卵母细胞中表达[35],但与FGF2和FGF7等不同,FGF8在原始卵泡中不表达[36]。有研究表明,FGF8和FGF17与牛卵母细胞成熟也有一定的关系,这尚需进一步研究证实[37]。FGF18还与哺乳动物卵泡闭锁密切相关,下文中将详细介绍。
此外,FGFs中与卵泡发育相关的因子还有FGF1、FGF9以及FGF13等,它们的表达随着卵泡发育阶段的变化而发生改变,其中,牛卵泡膜中FGF13 mRNA的表达量随着卵泡的生长会上调,且最终会影响黄体的生成[38]。但总的来说对这些因子的研究还不够深入,要彻底了解它们在卵泡发育过程中如何发挥作用还有待于更加深入的研究。
2.2 成纤维细胞生长因子参与卵母细胞的生长和成熟卵母细胞的发育和成熟是一个很复杂的生物学过程,随着卵泡发育,卵母细胞也在不断生长,卵母细胞的成熟与卵母细胞的质量密切相关且容易受到外在因素的影响[39-40]。研究者们在对FGFs进行研究的时候也发现了一些与卵母细胞成熟相关的因子。S. H. Li等[13]研究发现,FGF2与血管内皮生长因子协同作用能够促进体外培养小鼠卵巢组织血管再生,并显著提高卵母细胞的质量和存活率。M. F. Machado等[18]在2015年曾报道,成纤维细胞生长因子家族中的FGF17能够促进体外培养牛卵丘细胞的扩张,但必须与骨形成蛋白15(Bone morphogenetic protein 15, BMP15) 协同作用才能完成。2017年,Y. J.Son等[41]通过向体外培养的猪卵丘卵母细胞复合体中加入不同浓度的FGF10以探索其在卵母细胞成熟过程中的作用,发现FGF10能显著提高卵丘细胞的扩张速度,同时促进卵母细胞的成熟。对影响哺乳动物卵母细胞成熟的机制进行研究对于体外受精、体外胚胎成熟以及胚胎移植等技术的实施具有重要的指导意义。
2.3 成纤维细胞生长因子参与卵泡闭锁哺乳动物卵泡闭锁是指在卵泡的周期性募集过程中,一旦优势卵泡确定之后,其周围的其他卵泡便不再发育而是发生闭锁,在哺乳动物的卵巢中,绝大部分卵泡在发育过程中都发生了闭锁,只有少数卵泡能够发育成熟直至最终排卵[42]。卵泡闭锁是卵巢卵泡发育、成熟以及排卵过程中的重要生理过程[43],它受到多种因素的综合影响,FGF18就是影响卵泡闭锁的因子之一。
2010年,V. M. Portela等[44]在健康牛闭锁卵泡中检测到高表达FGF18,提示FGF18可能参与颗粒细胞的凋亡。而目前在卵巢发育过程中发现的成纤维细胞生长因子如FGF2、FGF7以及FGF10等均表现为促进有丝分裂的特点,V. M. Portela等[19]为了深入了解FGF18参与卵泡闭锁的机制,建立了一个牛体内模型,并将FGF18直接注射进正在生长的优势卵泡中,注射24 h之后发现该卵泡停止生长,凋亡颗粒细胞的比率显著增加,由此可见,FGF18在卵巢发育过程中发挥的功能与FGF2、FGF7以及FGF10等不同,它能促进颗粒细胞凋亡,最终导致卵泡闭锁。深入研究表明,FGF18可能通过下调BBC3-MDM2信号通路中相关抗凋亡因子的表达而实现对颗粒细胞的促凋亡作用。
3 成纤维细胞生长因子在其他相关领域的研究进展FGFs除了能够在雌性哺乳动物的卵泡发育和卵母细胞成熟等过程发挥重要作用,同时还参与雄性哺乳动物的精原细胞发育以及相关激素调节等过程。研究FGFs在生精细胞分化发育过程和激素调节过程中的作用,并与其在雌性哺乳动物卵泡发育和卵母细胞成熟过程中的作用进行比较,有助于更全面深入地了解其作用机制,对于开展动物遗传育种相关研究具有很重要的意义。
3.1 成纤维细胞生长因子在生精细胞发育过程中的作用生精细胞包括精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子,这整个发育过程称之为精子发生,雄性哺乳动物的精子发生过程与雌性的卵子发生过程类似,受到多种因子的调节。原始生精细胞与原始卵泡一样,本身并不会进行增殖和生长发育,必须在某些因子的协助下转变为初级精母细胞才能进行生长发育,最终形成精子。E. Kawase等[45]对小鼠生精细胞发育过程中的FGFs进行检测发现,原始生精细胞中并不表达FGF4和FGF8,而在其邻近细胞中却检测到了FGF4和FGF8的表达,并且在进入性腺之后,原始生精细胞中开始表达FGF4和FGF8,由此可见,FGF4和FGF8可能是以旁分泌的方式对原始生精细胞的起始发育进行调节,推测其作用方式可能与FGF7在卵泡发育过程中的方式类似,但其确切机制目前尚不明确。
3.2 成纤维细胞生长因子参与激素调节FGFs除了能够促进卵泡发育、颗粒细胞增殖以及卵母细胞生长等以外,对于某些激素的分泌也会产生影响。如促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH)是由下丘脑中的GnRH神经元分泌的一种神经类激素,它通过对下丘脑促性腺激素的分泌进行调节,在脊椎动物的卵巢发育中发挥重要作用[46],包括对促卵泡素(Follicle-stimulating hormone, FSH)和黄体生成素(Luteotropic hormone, LH)等激素分泌的调控,GnRH在下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonad axis, HPG)中占据重要位置[47-48]。W. C. J. Chung等[49]研究发现,中断小鼠嗅基板中瞬时FGF8 mRNA转录本会导致整个促GnRH神经系统瘫痪,而上调FGF8会使GnRH神经元大量增加,提示FGF8可能是控制GnRH神经元数量的一个关键因子,并通过调节GnRH神经系统的功能对HPG轴产生影响,最终实现对动物生殖功能的调控。另外,研究发现,FGF10可以通过抑制颗粒细胞产生促卵泡素受体基因的表达而抑制雌二醇的分泌[50-51]。FGF17和FGF7与FGF10具有类似的抑制雌二醇分泌的作用,但与它们的不同之处在于FGF17只有在很高的浓度时才能抑制雌二醇的分泌,并且对孕酮的分泌也会产生影响[52]。雌二醇和孕酮等分泌量的改变会导致卵巢功能的异常,因此,相关研究对于卵巢的正常发育和功能维持具有重要意义。
4 小结与展望动物的卵泡发育、卵母细胞成熟以及生精细胞的发育等均是非常复杂的生物学过程,FGFs在这些过程中发挥着关键作用。研究表明,FGFs与原始卵泡向初级卵泡的转变、卵泡发育、卵母细胞成熟、卵泡闭锁、原始生精细胞向初级精原细胞转变、精原细胞的发育以及精子成熟等过程密切相关,对其进行挖掘和研究有助于明确生殖细胞的生长和发育机制,从而为提高肉用哺乳动物的繁殖力提供依据,对于动物遗传育种科研工作者深入开展相关方面的研究具有重要指导意义。
另外,FGFs在动物的胚胎发育、器官生成、组织修复、代谢以及疾病发生等多个方面发挥重要功能,不仅能够影响大脑、毛发、骨骼、牙齿、肌肉、血管等重要组织或器官的形成,还能对血糖、血脂、胆汁酸等多种代谢途径以及类固醇激素等的生成进行调节,从而影响生物体生命活动的各个方面。FGFs与人类多种生殖疾病密切相关,对其进行深入研究有助于明确相关疾病的发生机制,从而为治疗这些疾病及相关药物的研发提供参考。
| [1] | ITOH N, ORNITZ D M. Evolution of the FGF and fgfr gene families[J]. Trends Genet, 2004, 20(11): 563–569. DOI: 10.1016/j.tig.2004.08.007 |
| [2] | BEENKEN A, MOHAMMADI M. The FGF family:biology, pathophysiology and therapy[J]. Nat Rev Drug Discovery, 2009, 8(3): 235–253. DOI: 10.1038/nrd2792 |
| [3] | KORSENSKY L, RON D. Regulation of FGF signaling:Recent insights from studying positive and negative modulators[J]. Seminars Cell Dev Biol, 2016, 53: 101–114. DOI: 10.1016/j.semcdb.2016.01.023 |
| [4] | ORNITZ D M, ITOH N. The fibroblast growth factor signaling pathway[J]. Wires Dev Biol, 2015, 4(3): 215–266. DOI: 10.1002/wdev.2015.4.issue-3 |
| [5] | ONEILL C. The potential roles for embryotrophic ligands in preimplantation embryo development[J]. Hum Reprod Update, 2008, 14(3): 275–288. DOI: 10.1093/humupd/dmn002 |
| [6] | VENERO G M, KRAMER K L, PIOTROWSKI T. Heparan sulfate proteoglycans regulate FGF signaling and cell polarity during collective cell migration[J]. Cell Reports, 2015, 15(3): 414–428. |
| [7] | ITOH N, OHTA H, KONISHI M. Endocrine FGFs:evolution, physiology, pathophysiology, and pharmacotherapy[J]. Frontiers Endocrinol, 2015, 6(154): 1–9. |
| [8] | BUCHTOVA M, CHALOUPKOVA R, ZAKRZEWSKA M, et al. Instability restricts signaling of multiple fibroblast growth factors[J]. Cell Mol Life Sci, 2015, 72(12): 2445–2459. DOI: 10.1007/s00018-015-1856-8 |
| [9] | DIÓGENES M N, GUIMARÃES A L S, LEME L O, et al. Bovine in vitro embryo production:the effects of fibroblast growth factor 10(FGF10)[J]. J Assisted Reprod Genet, 2016: 1–8. |
| [10] | BREWER J R, MAZOT P, SORIANO P. Genetic insights into the mechanisms of FGF signaling[J]. Genes Dev, 2016, 30(7): 751–771. DOI: 10.1101/gad.277137.115 |
| [11] | CHAVES R N, DE MATOS M H, BURATINI J Jr, et al. The fibroblast growth factor family:involvement in the regulation of folliculogenesis[J]. Reprod Fertil Dev, 2012, 24(7): 905–915. DOI: 10.1071/RD11318 |
| [12] | PRICE C. Mechanisms of fibroblast growth factor signaling in the ovarian follicle[J]. J Endocrinol, 2016, 228(2): R31–R43. DOI: 10.1530/JOE-15-0414 |
| [13] | LI S H, HWU Y M, LU C H, et al. VEGF and FGF2 improve revascularization, survival, and oocyte quality of cryopreserved, subcutaneously-transplanted mouse ovarian tissues[J]. Int J Mol Sci, 2016, 17(8): 1–13. |
| [14] | MISHRA S R, THAKUR N, SOMAL A, et al. Expression and localization of fibroblast growth factor (FGF) family in buffalo ovarian follicle during different stages of development and modulatory role of FGF2 on steroidogenesis and survival of cultured buffalo granulosa cells[J]. Res Vet Sci, 2016, 108: 98–111. DOI: 10.1016/j.rvsc.2016.08.012 |
| [15] | FAUSTINO L R, ROSSETTO R, LIMA I M, et al. Expression of keratinocyte growth factor in goat ovaries and its effects on preantral follicles within cultured ovarian cortex[J]. Reprod Sci, 2011, 18(12): 1222–1229. DOI: 10.1177/1933719111410709 |
| [16] | CHAVES R N, LIMA-VERDE I B, CELESTINO J J H, et al. Fibroblast growth factor-10 maintains the survival and promotes the growth of cultured goat preantral follicles[J]. Domestic Anim Endocrinol, 2010, 39(4): 249–258. DOI: 10.1016/j.domaniend.2010.06.006 |
| [17] | CHEN M, YEH C R, SHYR C R, et al. Reduced prostate branching morphogenesis in stromal fibroblast, but not in epithelial, estrogen receptor α knockout mice[J]. Asian JAndrol, 2012, 14(4): 546–555. DOI: 10.1038/aja.2011.181 |
| [18] | MACHADO M F, CAIXETA E S, SUDIMAN J, et al. Fibroblast growth factor 17 and bone morphogenetic protein 15 enhance cumulus expansion and improve quality of in vitro-produced embryos in cattle[J]. Theriogenology, 2015, 84(3): 390–398. DOI: 10.1016/j.theriogenology.2015.03.031 |
| [19] | PORTELA V M, DIRANDEH E, GUERRERONETRO H M, et al. The role of fibroblast growth factor-18 in follicular atresia in cattle[J]. Biol Reprod, 2015, 92(1): 14. |
| [20] | KHAN D R, FOURNIER E, DUFORT I, et al. Meta-analysis of gene expression profiles in granulosa cells during folliculogenesis[J]. Reproduction, 2016, 151(6): R103–R110. DOI: 10.1530/REP-15-0594 |
| [21] | RODLER D. Localization of vascular endothelial growth factor and fibroblast growth factor 2 in the ovary of the ostrich (struthio camelus)[J]. Anat Histol Embryol, 2015, 45(6): 428–436. |
| [22] | PAIVA P, HANNAN N J, HINCKS C, et al. Human chorionic gonadotrophin regulates FGF2 and other cytokines produced by human endometrial epithelial cells, providing a mechanism for enhancing endometrial receptivity[J]. Hum Reprod, 2011, 26(5): 1153–1162. DOI: 10.1093/humrep/der027 |
| [23] | LIM W, BAE H, BAZER F W, et al. Stimulatory effects of fibroblast growth factor 2 on proliferation and migration of uterine luminal epithelial cells during early pregnancy[J]. Biol Reprod, 2016, 96(1): 185–198. |
| [24] | STERINGER J P, MÜLLER H M, NICKEL W. Unconventional secretion of fibroblast growth factor 2-a novel type of protein translocation across membranes?[J]. J Mol Biol, 2015, 427(6): 1202–1210. DOI: 10.1016/j.jmb.2014.07.012 |
| [25] | MATOS M H, LIMA-VERDE I B, BRUNO J B, et al. Follicle stimulating hormone and fibroblast growth factor-2 interact and promote goat primordial follicle development in vitro[J]. Reprod Fert Dev, 2007, 19(5): 677–684. DOI: 10.1071/RD07021 |
| [26] | RUBIN J S, OSADA H, FINCH P W, et al. Purification and characterization of a newly identified growth factor specific for epithelial cells[J]. PNAS, 1989, 86(3): 802–806. DOI: 10.1073/pnas.86.3.802 |
| [27] | CHO J H, ITOH T Y, HOSHI H. Fibroblast growth factor 7 stimulates in vitro growth of oocytes originating from bovine early antral follicles[J]. Mol Reprod Dev, 2008, 75(12): 1736–1743. DOI: 10.1002/mrd.v75:12 |
| [28] | KEZELE P, NILSSON E E, SKINNER M K. Keratinocyte growth factor acts as a mesenchymal factor that promotes ovarian primordial to primary follicle transition[J]. Biol Reprod, 2005, 73(5): 967–973. DOI: 10.1095/biolreprod.105.043117 |
| [29] | BERISHA B, SINOWATZ F, SCHAMS D. Expression and localization of fibroblast growth factor (FGF) family members during the final growth of bovine ovarian follicles[J]. Mol Reprod Dev, 2004, 67(2): 162–171. DOI: 10.1002/(ISSN)1098-2795 |
| [30] | BERISHA B, WELTER H, SHIMIZU T, et al. Expression of fibroblast growth factor 1(FGF1) and FGF7 in mature follicles during the periovulatory period after GnRH in the cow[J]. J Reprod Dev, 2006, 52(2): 307–313. DOI: 10.1262/jrd.17077 |
| [31] | POMINI PINTO R F, FONTES P K, LOUREIRO B, et al. Effects of FGF10 on bovine oocyte meiosis progression, apoptosis, embryo development and relative abundance of developmentally important genes in vitro[J]. Reprod Domestic Anim, 2015, 50(1): 84–90. DOI: 10.1111/rda.2015.50.issue-1 |
| [32] | NAGAYAMA T, OKUHARA S, OTA M S, et al. FGF18 accelerates osteoblast differentiation by upregulating BMP2 expression[J]. Congenit Anom, 2013, 53(2): 83–88. DOI: 10.1111/cga.12012 |
| [33] | MIYOSHI T, OTSUKA F, YAMASHITA M, et al. Functional relationship between fibroblast growth factor-8 and bone morphogenetic proteins in regulating steroidogenesis by rat granulosa cells[J]. Mol Cell Endocrinol, 2010, 325(1-2): 84–92. DOI: 10.1016/j.mce.2010.04.012 |
| [34] | ASGARI F, VALOJERDI M R, EBRAHIMI B, et al. Three dimensional in vitro culture of preantral follicles following slow-freezing and vitrification of mouse ovarian tissue[J]. Cryobiology, 2015, 71(3): 529–536. DOI: 10.1016/j.cryobiol.2015.11.001 |
| [35] | FATEHI R, EBRAHIMI B, SHAHHOSSEINI M, et al. Effect of ovarian tissue vitrification method on mice preantral follicular development and gene expression[J]. Theriogenology, 2014, 81(2): 302–308. DOI: 10.1016/j.theriogenology.2013.09.029 |
| [36] | JR B J, TEIXEIRA A B, COSTA I B, et al. Expression of fibroblast growth factor-8 and regulation of cognate receptors, fibroblast growth factor receptor-3c and -4, in bovine antral follicles[J]. Reproduction, 2005, 130(3): 343–350. DOI: 10.1530/rep.1.00642 |
| [37] | FERREIRA R M, CHIARATTI M R, MACABELLI C H, et al. The infertility of repeat-breeder cows during summer is associated with decreased mitochondrial dna and increased expression of mitochondrial and apoptotic genes in oocytes[J]. Biol Reprod, 2016, 94(3): 1–10. |
| [38] | COSTA I B, TEIXEIRA N A, RIPAMONTE P, et al. Expression of fibroblast growth factor 13(FGF13) mRNA in bovine antral follicles and corpora lutea[J]. Anim Reprod, 2009, 6(2): 409–415. |
| [39] | COTICCHIO G, DAL C M, MIGNINI R M, et al. Oocyte maturation:gamete-somatic cells interactions, meiotic resumption, cytoskeletal dynamics and cytoplasmic reorganization[J]. Hum Reprod Update, 2015, 21(4): 427–454. DOI: 10.1093/humupd/dmv011 |
| [40] | MACLENNAN M, CRICHTON J H, PLAYFOOT C J, et al. Oocyte development, meiosis and aneuploidy[J]. Seminars in Cell Dev Biol, 2015, 45: 68–76. DOI: 10.1016/j.semcdb.2015.10.005 |
| [41] | SON Y J, LEE S E, HYUN H, et al. Fibroblast growth factor 10 markedly improves in vitro maturation of porcine cumulus-oocyte complexes[J]. Mol Reprod Dev, 2017, 84(1): 67–75. DOI: 10.1002/mrd.v84.1 |
| [42] | LI J, GAO H, TIAN Z, et al. Effects of chronic heat stress on granulosa cell apoptosis and follicular atresia in mouse ovary[J]. J Anim Sci Biotechnol, 2016, 7(57): 1–10. |
| [43] | WORKU T, REHMAN Z U, TALPUR H S, et al. MicroRNAs:New insight in modulating follicular atresia:A review[J]. J Mol Sci, 2017, 18(2): 1–13. |
| [44] | PORTELA V M, MACHADO M, JR B J, et al. Expression and function of fibroblast growth factor 18 in the ovarian follicle in cattle[J]. Biol Reprod, 2010, 83(3): 339–346. DOI: 10.1095/biolreprod.110.084277 |
| [45] | KAWASE E, HASHIMOTO K, PEDERSEN R A. Autocrine and paracrine mechanisms regulating primordial germ cell proliferation[J]. Mol Reprod Dev, 2004, 68(1): 5–16. DOI: 10.1002/(ISSN)1098-2795 |
| [46] | ZHANG W, JOHNSON J I, TSAI P S. FGF8-deficient mice compensate for reduced gnrh neuronal population and exhibit normal testicular function[J]. Frontiers Endocrinol, 2014, 6(1): 190–194. |
| [47] | OKADA Y, MUROTAKAWANO A, KAKAR S S, et al. Evidence that gonadotropin-releasing hormone (GnRH) Ⅱ stimulates luteinizing hormone and follicle-stimulating hormone secretion from monkey pituitary cultures by activating the GnRH I receptor[J]. Biol Reprod, 2015, 69(4): 1356–1361. |
| [48] | LANNES J, GARREL G, COHENTANNOUDJI J. A microRNA-132/212 pathway mediates GnRH activation of FSH expression[J]. Mol Endocrinol, 2015, 29(3): 364–372. DOI: 10.1210/me.2014-1390 |
| [49] | CHUNG W C J, LINSCOTT M L, RODRIGUEZ K M, et al. The regulation and function of fibroblast growth factor 8 and its function during gonadotropin-releasing hormone neuron development[J]. Frontiers Endocrinol, 2016, 7(8): 1–7. |
| [50] | CASTILHO A C, PRICE C A, DALANEZI F, et al. Evidence that fibroblast growth factor 10 plays a role in follicle selection in cattle[J]. Reprod Fertil Dev, 2017, 29: 234–243. |
| [51] | WOHLRES-VIANA S, ARASHIRO E K, MACHADO M A, et al. Intrafollicular oestradiol production, expression of the LH receptor (LHR) gene and its isoforms, and early follicular deviation in Bos indicus[J]. Reprod Fert Dev, 2016. DOI: 10.1071/RD16284 |
| [52] | MACHADO M F, PORTELA V M, PRICE C A, et al. Regulation and action of fibroblast growth factor 17 in bovine follicles[J]. J Endocrinol, 2009, 202(3): 347–353. DOI: 10.1677/JOE-09-0145 |



