2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
玉米赤霉烯酮(zearalenone, ZEA)是饲料中常见的霉菌毒素之一,又称F-2毒素,是由镰刀菌产生的一种霉菌毒素。ZEA主要产毒菌株为禾谷镰刀菌,此外,粉红镰刀菌、尖孢镰刀菌、三线镰刀菌、串珠镰刀菌、黄色镰刀菌以及雪腐镰刀菌等也能产生ZEA。玉米、小麦、燕麦和大麦等作物易受到ZEA污染[1]。近几年来,ZEA在我国的检出率和检出范围不断增加,严重危害了我国仓储粮食以及动物仓储饲料的食用安全[2]。ZEA可降低饲料的营养价值,导致动物生长性能和繁殖性能下降,还具有免疫抑制作用,降低动物尤其是猪[3]对传染性疾病的抵抗力,导致慢性感染或降低疫苗接种和药物治疗的效果[4]。我国近几年来发生的猪无名高热病,就可能是霉菌毒素影响疫苗的免疫应答所导致的[5]。T细胞作为细胞免疫作用的主要免疫作用细胞,活化是其发挥免疫功能的重要前提条件。没有活化的T细胞在体内处于静息期,当其受到抗原或者淋巴细胞有丝分裂原刺激后,会活化成淋巴母细胞同时发挥相应的免疫效应[6]。目前,有关于ZEA对机体免疫系统毒性作用的体内外试验报道[7-11],但其作用机制尚未阐明。本研究以小鼠原代T淋巴细胞为模型,利用CCK-8法、流式细胞术等技术评价ZEA对小鼠T淋巴细胞活化,增殖等行为的影响,为ZEA机体免疫系统毒性作用的机制研究和临床防控提供理论依据。
1 材料与方法 1.1 实验动物清洁级BALB/c小鼠,雄性,6~8周龄,体重(20±2) g,购自扬州大学实验动物中心。
1.2 试验仪器CyAn ADP7流式细胞仪(Beckman Couiter,USA);CO2培养箱(Thermo,USA);Tecan Sunrise光吸收酶标仪(Tecan, Austria);5810R台式高速冷冻离心机(EPPendorf, Germany);SW-CJ-1F型单人双面净化工作台(苏州净化)。
1.3 主要试剂玉米赤霉烯酮(Zearalenone, ZEA)、刀豆蛋白A(concanavalin A, Con A)购自美国Sigma公司;CD3-Percp、CD69-FITC、CD4-FITC、CD25-PE流式抗体购自美国BD公司;RPMI-1640完全培养液:含10%胎牛血清(Gibco)、L-谷氨酰胺(2 mmol·L-1, sigma)、二巯基乙醇(50 μmoL·L-1,sigma)、1%青链霉素、RPMI-1640培养基粉末(Gibco);Cell Counting Kit-8(日本同仁);红细胞裂解液购自碧云天生物技术公司。
1.4 脾和胸腺淋巴细胞悬液的制备将BALB/c小鼠断颈处死,无菌摘取脾和胸腺,用组织研磨棒在200目滤网上研磨过滤,制备单细胞悬液。加入红细胞裂解液进行处理后,用无菌PBS液洗涤细胞2次,1 500 r·min-1离心10 min。将细胞稀释一定比例后重悬于1 mL 10%胎牛血清RPMI-1640完全培养液中,台盼蓝染色计数活细胞数(活细胞数占细胞总数95%以上),最终调整细胞密度为3×106·mL-1的淋巴细胞悬液。
1.5 CCK-8法检测ZEA对小鼠T淋巴细胞增殖的影响分别设细胞对照组(Blank组)、Con A组、Con A+ZEA 10 μmol·L-1组(10 ZEA + Con A组)、Con A+ZEA 20 μmol·L-1组(20 ZEA+Con A组)、Con A+ZEA 40 μmol·L-1组(40 ZEA+Con A组),将制得的淋巴细胞悬液接种于6孔板中,每孔2 mL,于药物处理组中加入相应浓度ZEA工作液各5 μL,除对照组外,每组加入Con A(终质量浓度为5 mg·L-1)[12-16]。之后在37 ℃、5% CO2培养箱继续培养48、72、96 h后混匀每孔中的培养液,分组加入96孔板中,每组设8个重复,100 μL·孔-1,同时设立空白对照孔(不加细胞)。加入CCK-8试剂,10 μL·孔-1,于37 ℃ CO2培养基中培养4 h后,立刻用酶标仪在450 nm处测定吸光度。
1.6 T细胞CD69、CD25表达情况检测采用直接免疫荧光标记法染色,细胞培养6 h后,取样离心2次后将细胞悬液浓缩至100 μL,分别加入CD69-FITC、CD3-Percp单克隆抗体各1 μg;细胞培养30 h后,分别加入CD25-PE、CD4-FITC单克隆抗体各1 μg,室温下避光孵育30 min,用冷PBS离心洗涤1次,重悬于500 μL的PBS中,立即上流式细胞仪(FACSCalibur)检测。
1.7 统计学分析所有数据以“x±s”表示,用GraphPad PrismV5.0软件进行单因素方差分析,组间比较采用配对t检验,P<0.05为差异有统计学意义。
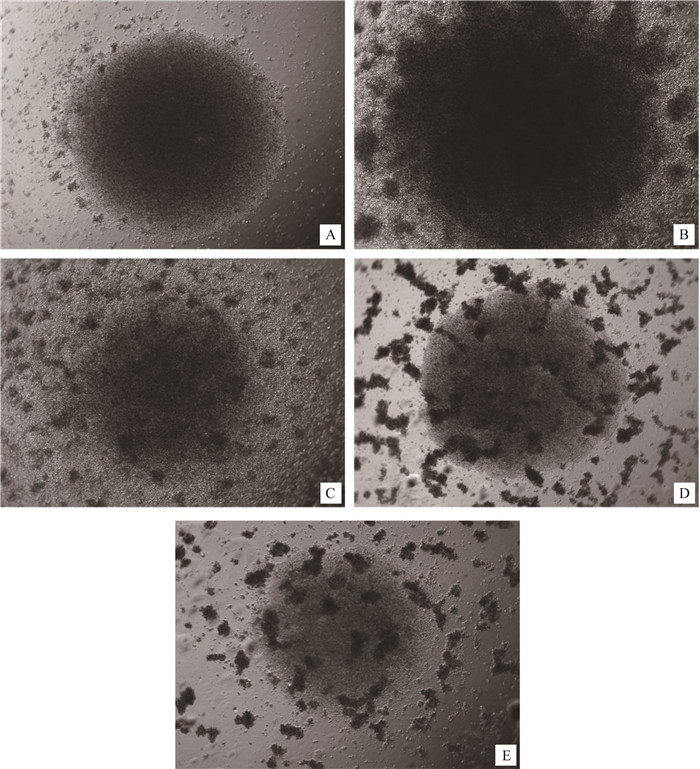
2 结果 2.1 ZEA对小鼠T淋巴细胞增殖的影响CCK-8法检测ZEA对小鼠T淋巴细胞增殖影响的结果见表 1,在Con A刺激48、72、96 h后,Con A组与细胞空白组相比均产生了明显的刺激增殖效应(P<0.01);与Con A对照组相比,ZEA染毒可明显抑制Con A刺激引起的T淋巴细胞的增殖作用,除10 μmol·L-1 ZEA组在72和96 h时间段差异显著外(P<0.05),其余染毒组在各时间段均差异极显著(P<0.01),并呈浓度-效应关系。T淋巴细胞培养结果见图 1,细胞分组在96孔板培养72 h后,可见不加Con A细胞对照组(图 1A)几乎见不到细胞克隆,Con A组出现了大量的细胞克隆(图 1B),在Con A+ZEA 10 μmol·L-1组可看到细胞克隆明显比Con A组减少(图 1C),在Con A+ZEA 20 μmol·L-1和Con A+ZEA 40 μmol·L-1组,可看到细胞克隆团继续减少并出现死细胞团的现象(图 1D、E)。
|
|
表 1 ZEA对T淋巴细胞增殖的影响(n=8, x±s) Table 1 Effect of ZEA on the proliferation of T lymphocytes stimulated by Con A (n=8, x±s) |
|
A. Blank; B. Con A; C.10 μmol·L-1 ZEA+Con A; D. 20 μmol·#183;L-1 ZEA+Con A; E.40 μmol·L-1ZEA+Con A 图 1 不同处理组小鼠T淋巴细胞72 h增殖情况(50×) Figure 1 Proliferation of T lymphocytes in different treatment groups (50×) |
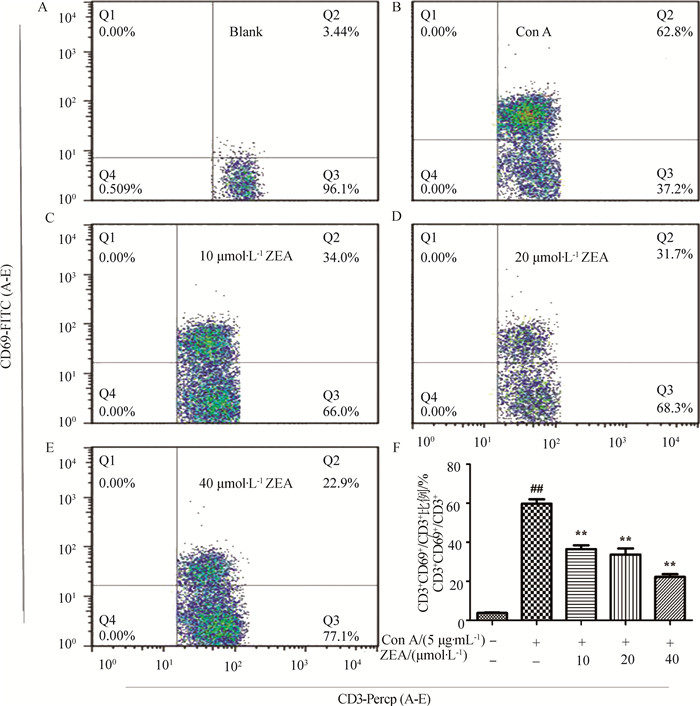
小鼠T淋巴细胞培养6 h后,用双抗体染色法结合流式细胞术检测T淋巴细胞早期活化抗原CD69的表达。流式结果及数据分析见图 2,对照组小鼠CD3+T细胞CD69的表达率为(3.23±0.61)%。在Con A刺激6 h后其CD69表达明显升高,达到(61.93±2.85)%,加入ZEA后,其表达量明显降低,ZEA在终浓度10、20、40 μmol·L-1下均抑制Con A介导的T细胞CD69表达(P<0.01),呈剂量-效应关系。
|
A~E. ZEA对Con A刺激的T细胞表达CD69的影响(仅在CD3阳性T淋巴细胞群分析); F.不同处理组CD3+CD69+占CD3+总细胞比例(n=3, 和空白组相比,##. P<0.01;和Con A组相比,*.P<0.05; **.P<0.01) A-E. Effects of ZEA on the expression of CD69 of T lymphocytes stimulated by Con A (Only analyzed in CD3 positive T lymphocytes); F. The proportion of CD3+CD69+ accounted for total CD3+ cells in different treatment groups, n=3; Compared with blank group, ##.P < 0.01; Compared with Con A group, *.P < 0.05, **.P < 0.01 图 2 ZEA对Con A刺激的T细胞表达CD69的影响及CD69+细胞占比分析 Figure 2 Effects of zearalenone (ZEA) on the expression of CD69 of T lymphocytes stimulated by Con A and the proportion of CD69+ cells |
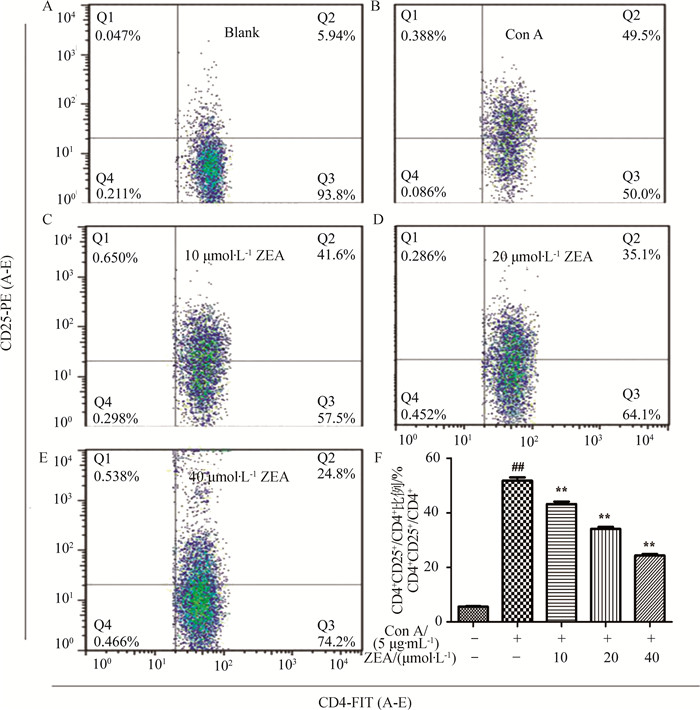
小鼠T淋巴细胞培养30 h后,用双抗体染色法结合流式细胞术检测调节T淋巴细胞中期活化抗原CD25的表达。流式结果见图 3,对照组小鼠CD4+T细胞CD25的表达率为(5.45±0.31)%。在Con A刺激30 h后其CD25表达明显升高,达到(56.43±0.83)%,加入ZEA后,其表达量明显降低,ZEA在终浓度10、20、40 μmol·L-1下均抑制Con A介导的T细胞CD25表达(P<0.01),呈剂量-效应关系。
|
A~E. ZEA对Con A刺激的T细胞表达CD25的影响(仅在CD4阳性T淋巴细胞群分析); F.不同处理组CD4+CD25+占CD4+总细胞比例(n=3, 和空白组相比,##. P<0.01;和Con A组相比,*.P<0.05; **.P<0.01) A-E. Effects of ZEA on the expression of CD25 of T lymphocytes stimulated by Con A (Only analyzed in CD4 positive T lymphocytes); F. The proportion of CD4+CD25+ accounted for total CD4+ cells in different treatment groups, n=3; Compared with blank group, ##.P < 0.01; Compared with Con A group, *.P < 0.05, **.P < 0.01 图 3 ZEA对Con A刺激的T细胞表达CD25的影响及CD25+细胞占比分析 Figure 3 Effects of zearalenone (ZEA) on the expression of CD25 of T lymphocytes stimulated by Con A and the proportion of CD25+ cells |
Z. H. Ren等[7]通过体内研究试验表明,ZEA可以导致小鼠血清IL-1、IL-4以及补体C3的失调,从而影响小鼠免疫功能,尤其在高浓度的情况下失调的现象更为明显。混合霉菌毒素染毒的情况下,ZEA与其他几种霉菌毒素具有协同作用。并且,在Z. H. Ren等[8]的研究中,将360只健康成年雌性小鼠随机分为九组进行为期12 d的研究,各组小鼠分别给予一个为期4 d的连续腹腔注射不同浓度的玉米赤霉烯酮或其他霉菌毒素,单独或混合注射,于0、3、5、8和12 d收集血液样本进行试验。结果表明,各试验组均可能导致小鼠血清中IgA、IgG和IgM水平的紊乱,进而影响小鼠的体液免疫。混合组,尤其是高浓度组,对免疫球蛋白的影响效果更明显。L. J. Yang等[9]将纯化的ZEA以0、(1.10±0.02)、(2.00±0.01)、(3.20±0.02) mg·kg-1分组混在饲料中连续投喂18 d,结果每组猪的血液生化指标都发生了一定的变化,并且高浓度ZEA组降低了血清中免疫球蛋白(尤其是IgG、IgM)的滴度,且呈浓度依赖性。淋巴细胞的增殖率以及外周血中的T细胞亚群(CD3+、CD4+、CD8+、CD56+)的比例也受到了一定的影响。体外试验中,有研究发现,高剂量ZEA会抑制小鼠脾淋巴细胞的增殖以及某些细胞因子的分泌[10]。潘顺叶等[11]研究证明,ZEA可以通过某些信号途径诱导CTLL-2细胞发生凋亡。D. E. Marin等[17-18]研究发现,ZEA及其衍生物对猪外周血淋巴细胞的增殖、抗体及细胞因子的合成均有抑制作用,进而改变体液和细胞免疫反应。
淋巴细胞是机体主要的免疫细胞,是免疫系统的核心成分,其中T淋巴细胞是淋巴细胞中数量最多、功能最复杂的一类,是特异免疫系统赖以实现免疫调节的重要细胞[19]。在免疫防御、免疫调节、炎症性疾病和自身免疫疾病当中起到相当重要的作用。而T淋巴细胞的活化和增殖是其执行免疫功能的基础,是免疫系统调控的中心环节[20]。T细胞有丝裂原Con A是经T细胞表面膜受体TCR/CD3而激活细胞内信号转导途径,通过Lck、Zap-70等上游的蛋白酪氨酸激酶(PTK)进行传导,从而介导CD69的表达[21]。CD69为T淋巴细胞早期活化的表面标志性抗原,其本身是一种细胞表面的磷酸化的同二聚体蛋白,它的表达依赖于新的RNA合成和翻译。静息T淋巴细胞极少表达CD69,而活化后的T淋巴细胞通过编码基因的转录可大量表达CD69,并产生大量的IL-2和高亲和力的IL-2R。IL-2和IL-2R特异性结合后选择性支持经抗原刺激而活化的T淋巴细胞进行扩增,因此CD69可作为T细胞早期活化标志[22-25]。而CD25是非CD4+调节性T淋巴细胞的中期活化标志,也是CD4+调节T淋巴细胞的标志。其是一种连续表达的分子, 作为组成高亲和力IL-2R的α亚基,是T淋巴细胞接受其自身分泌的IL-2信号所必需的受体。通过检测其表达可间接反映T淋巴细胞的中期活化程度[26-28]。本试验结果显示,ZEA能有效抑制CD69、CD25分子的表达,从而干扰IL-2的自分泌效应以及CD4+CD25+调节T细胞的免疫调节功能,这与其能够抑制T淋巴细胞增殖的结果一致,提示ZEA可以通过抑制活化抗原的表达而抑制T淋巴细胞的增殖和发挥免疫应答作用。因此推测其对T淋巴细胞活化的影响可能是由于降低了蛋白激酶的活性,从而干扰了T淋巴细胞的早中期活化现象,从而进一步抑制了T淋巴细胞的增殖反应。
长期以来,人们对ZEA毒性及其机制的研究集中在生殖系统[29-31],而对其免疫毒性方面的研究相对较少。本研究通过体外试验证明,ZEA对动物免疫细胞具有直接的毒性作用,可以显著性地抑制T淋巴细胞活化及增殖。该结论可以帮助人们更全面地认识ZEA的毒性作用,并可以为ZEA中毒及由其引起的免疫力降低相关疾病防控提供参考。ZEA抑制T淋巴细胞增殖、活化的机制,涉及细胞内多个信号通路,还需要更为深入的研究。
4 结论玉米赤霉烯酮抑制小鼠T淋巴细胞早期及中期活化标志CD69及CD25的表达,说明其可以抑制T淋巴细胞体外活化,干扰T淋巴细胞由静息期向淋巴母细胞的转化,从而抑制其增殖作用以及相关免疫功能。这一结果表明ZEA对动物免疫抑制作用的产生与其可直接抑制T淋巴细胞的活化和增殖有关。
| [1] | JI C, FAN Y, ZHAO L H. Review on biological degradation of mycotoxins[J]. Anim Nutr, 2016, 2(3): 127–133. DOI: 10.1016/j.aninu.2016.07.003 |
| [2] | WANG Y, LIU S L, ZHENG H, et al. T-2 toxin, zearalenone and fumonisin B1 in feedstuffs from China[J]. Food Addit Contam B, 2013, 6(2): 116–122. DOI: 10.1080/19393210.2013.764506 |
| [3] | YIN S T, MENG Q W, ZHANG B R, et al. Alleviation of zearalenone toxicity by modified halloysite nanotubes in the immune response of swine[J]. Food Addit Contam A, 2015, 32(1): 87–99. DOI: 10.1080/19440049.2014.987700 |
| [4] | CHENG Y H, WENG C F, CHEN B J, et al. Toxicity of different Fusarium mycotoxins on growth performance, immune responses and efficacy of a mycotoxin degrading enzyme in pigs[J]. Anim Res, 2006, 55(6): 579–590. DOI: 10.1051/animres:2006032 |
| [5] |
刘海军, 刘可越. 猪无名高热综合症流行的原因及预防措施[J]. 安徽农业科学, 2007, 35(24): 7476–7477.
LIU H J, LIU K Y. Research on the syndrome of pig with high temperature and its preventing measure[J]. Journal of Anhui Agricultural Sciences, 2007, 35(24): 7476–7477. DOI: 10.3969/j.issn.0517-6611.2007.24.047 (in Chinese) |
| [6] | LEE K H, HOLDORF A D, DUSTIN M L, et al. T cell receptor signaling precedes immunological synapse formation[J]. Science, 2002, 295(5559): 1539–1542. DOI: 10.1126/science.1067710 |
| [7] | REN Z H, DENG Y T, WANG Y C, et al. Effects of the Fusarium toxin zearalenone and/or deoxynivalenol on the serum IL-1, IL-4, and C3 levels in mice[J]. Food Agric Immunol, 2016, 27(3): 414–421. DOI: 10.1080/09540105.2015.1118019 |
| [8] | REN Z H, ZHOU R, DENG J L, et al. Effects of the Fusarium toxin zearalenone (ZEA) and/or deoxynivalenol (DON) on the serum IgA, IgG and IgM levels in mice[J]. Food Agric Immunol, 2014, 25(4): 600–606. DOI: 10.1080/09540105.2013.867928 |
| [9] | YANG L J, YANG W R, FENG Q, et al. Effects of purified zearalenone on selected immunological measurements of blood in post-weaning gilts[J]. Anim Nutr, 2016, 2(3): 142–148. DOI: 10.1016/j.aninu.2016.04.008 |
| [10] |
范小龙, 刘长永, 剡海阔, 等. 玉米赤霉烯酮对小鼠脾淋巴细胞增殖及分泌细胞因子的影响[J]. 中国畜牧兽医, 2011, 38(5): 48–54.
FAN X L, LIU C Y, YAN H K, et al. Effects of ZEN on in vitro proliferation and cytokines production of spleen lymphocyte in mice[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(5): 48–54. (in Chinese) |
| [11] |
潘顺叶, 王光光, 范文桐, 等. 玉米赤霉烯酮诱导CTLL-2细胞凋亡途径的研究[J]. 中国兽医科学, 2016, 46(3): 398–402.
PAN S Y, WANG G G, FAN W T, et al. Apoptosis induced by zearalenone in CTLL-2 cells[J]. Chinese Veterinary Science, 2016, 46(3): 398–402. (in Chinese) |
| [12] | POLASKY C, WEIGEND S, SCHRADER L, et al. Non-specific activation of CD8α-characterised γδ T cells in PBL cultures of different chicken lines[J]. Vet Immunol Immunopathol, 2016, 179: 1–7. DOI: 10.1016/j.vetimm.2016.07.008 |
| [13] | HAMMERICH L, WARZECHA K T, STEFKOVA M, et al. Cyclic adenosine monophosphate-responsive element modulator alpha overexpression impairs function of hepatic myeloid-derived suppressor cells and aggravates immune-mediated hepatitis in mice[J]. Hepatology, 2015, 61(3): 990–1002. DOI: 10.1002/hep.v61.3 |
| [14] | XIONG Y, ZHANG S, LU J, et al. Investigation of effects of farrerol on suppression of murine T lymphocyte activation in vitro and in vivo[J]. Int Immunopharmacol, 2013, 16(2): 313–321. DOI: 10.1016/j.intimp.2013.04.010 |
| [15] | XIE J, ZHANG J, WU H M, et al. The influences of age on T lymphocyte subsets in C57BL/6 mice[J]. Saudi J Biol Sci, 2017, 24(1): 108–113. DOI: 10.1016/j.sjbs.2016.09.002 |
| [16] | SONG B C, HUANG G R, TONG C Y, et al. Gossypol suppresses mouse T lymphocytes via inhibition of NFκB, NFAT and AP-1 pathways[J]. Immunopharmacol Immunotoxicol, 2013, 35(5): 615–621. DOI: 10.3109/08923973.2013.830126 |
| [17] | MARIN D E, TARANU I, BURLACU R, et al. Effects of zearalenone and its derivatives on porcine immune response[J]. Toxicol Vitro, 2011, 25(8): 1981–1988. DOI: 10.1016/j.tiv.2011.06.022 |
| [18] | MARIN D E, TARANU I, BURLACU R, et al. Effects of zearalenone and its derivatives on the innate immune response of swine[J]. Toxicon, 2010, 56(6): 956–963. DOI: 10.1016/j.toxicon.2010.06.020 |
| [19] |
徐占云, 秦睿玲, 褚耀诚, 等. 枸杞多糖对雏鸡淋巴细胞体外增殖及分泌IL-2的影响[J]. 畜牧兽医学报, 2013, 44(2): 322–328.
XU Z Y, QIN R L, CHU Y C, et al. Effects of Lycium barbarum polysaccharide on cell proliferation of chicken lymphocytes and IL-2 excretion in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(2): 322–328. (in Chinese) |
| [20] | CRASTON R, KOH M, DERMOTT A M, et al. Temporal dynamics of CD69 expression on lymphoid cells[J]. J Immunol Methods, 1997, 209(1): 37–45. DOI: 10.1016/S0022-1759(97)00143-9 |
| [21] | FULCHER D A, WONG S W J. Carboxyfluorescein succinimidyl ester-based proliferative assays for assessment of T cell function in the diagnostic laboratory[J]. Immunol Cell Biol, 1999, 77(6): 559–564. DOI: 10.1046/j.1440-1711.1999.00870.x |
| [22] | KRECHETOVA L V, VTORUSHINA V V, NIKOLAEVA M A, et al. Expression of early activation marker CD69 on peripheral blood lymphocytes from pregnant women after first trimester alloimmunization[J]. Bull Exp Biol Med, 2016, 161(4): 529–532. DOI: 10.1007/s10517-016-3453-8 |
| [23] | SANCHO D, GÓMEZ M, SÁNCHEZ-MADRID F. CD69 is an immunoregulatory molecule induced following activation[J]. Trends Immunol, 2005, 26(3): 136–140. DOI: 10.1016/j.it.2004.12.006 |
| [24] | CORTÉS J R, SÁNCHEZ-DÍAZ R, BOVOLENTA E R, et al. Maintenance of immune tolerance by Foxp3+ regulatory T cells requires CD69 expression[J]. J Autoimmun, 2014, 55: 51–62. DOI: 10.1016/j.jaut.2014.05.007 |
| [25] | LUND H, BOYSEN P, DEAN G A, et al. Interleukin-15 activated bovine natural killer cells express CD69 and produce interferon-γ[J]. Vet Immunol Immunopathol, 2012, 150(1-2): 79–89. DOI: 10.1016/j.vetimm.2012.08.011 |
| [26] | VAN LEEUWEN J E, SAMELSON L E. T cell antigen-receptor signal transduction[J]. Curr Opin Immunol, 1999, 11(3): 242–248. DOI: 10.1016/S0952-7915(99)80040-5 |
| [27] | WANG K P, GU J, NI X H, et al. CD25 signaling regulates the function and stability of peripheral Foxp3+ regulatory T cell derived from the spleen and lymph nodes of mice[J]. Mol Immunol, 2016, 76: 35–40. DOI: 10.1016/j.molimm.2016.06.007 |
| [28] | CHIEN M W, LIN M H, HUANG S H, et al. Glucosamine modulates T cell differentiation through down-regulating N-linked Glycosylation of CD25[J]. Biol Chem, 2015, 290(49): 29329–29344. DOI: 10.1074/jbc.M115.674671 |
| [29] | YU J Y, ZHENG Z H, SON Y O, et al. Mycotoxin zearalenone induces AIF-and ROS-mediated cell death through p53-and MAPK-dependent signaling pathways in RAW264.7 macrophages[J]. Toxicol Vitro, 2011, 25(8): 1654–1663. DOI: 10.1016/j.tiv.2011.07.002 |
| [30] | HOU Y J, ZHU C C, XU Y X, et al. Zearalenone exposure affects mouse oocyte meiotic maturation and granulosa cell proliferation[J]. Environ Toxicol, 2015, 30(10): 1226–1233. DOI: 10.1002/tox.v30.10 |
| [31] | ZHAO F, LI R, XIAO S, et al. Postweaning exposure to dietary zearalenone, a mycotoxin, promotes premature onset of puberty and disrupts early pregnancy events in female mice[J]. Toxicol Sci, 2013, 132(2): 431–442. DOI: 10.1093/toxsci/kfs343 |



