动物疫病一直是危害养殖业的大敌,尤其是病毒性疫病,多无有效的药物治疗,除了加强饲养管理之外,预防免疫是最有效的防控措施。然而一些疫苗,由于多种因素的影响达不到理想的免疫效果,只有配合免疫增强剂或免疫佐剂才能有效地提高防疫效果。但是,目前国内外广泛使用的铝佐剂和弗氏佐剂常有副作用大、局部刺激重、致癌、使用麻烦或不能足够提高弱抗原的免疫原性等弊病[1]。因此,研制开发新型免疫增强剂成为亟待解决的问题。
近年来,多糖成为研究的热点。研究发现,多糖除具有能量和结构功能作用外,还具有增强免疫、抗肿瘤、抗癌、抗氧化、抗病毒等多种生物学活性[2-4]。研究证实,多糖的活性直接或间接地受到其结构的制约,主链的糖单元组成和糖苷键类型直接决定多糖的活性,支链的类型、聚合度和在糖链上的分布及其取代度决定了多糖活性的大小[5]。因此可根据需要选择合适的分子修饰方法对多糖进行结构改造,利用糖残基上的羟基、羧基、氨基等基团进行化学修饰以引入新的基团,新基团的引入常常会增强多糖的活性或使多糖产生新的活性[6]。许多研究证明,硫酸化修饰、硒化修饰能显著提高多糖的增强免疫活性[7-8],且复方的作用明显强于单味药[9-10]。
本研究室前期通过系列研究,筛选出增强免疫活性较强的当归多糖(Chinese angelica polysaccharide, CAP)、党参多糖(Codonopsis pilosula polysaccharide, CPP)、大蒜多糖(Garlic polysaccharide, GP)等多糖,以及硒化当归多糖(selenizing CAP, sCAP)硒化党参多糖(selenizing CPP, sCPP)、硒化大蒜多糖(selenizing GP, sGP)等硒化多糖[11-12],并以其为组分药组成18个复方,比较它们的免疫增强活性作用,发现硒化党参多糖-大蒜多糖(sCPP-GP)复方的增强免疫作用最强。本研究进一步比较了sCPP-GP及其两个组分药sCPP和GP的增强免疫作用。本研究旨在验证sCPP和GP的协同增强免疫作用及其复方sCPP-GP的功效,为研制新型免疫增强剂提供理论依据。
1 材料与方法 1.1 中药和试剂党参饮片,购于徐州彭祖中药饮片有限公司。大蒜,购于南京农贸市场。
D(+)-葡萄糖,分析纯,上海源叶生物科技有限公司产品;苯酚,国药集团化学试剂有限公司产品;亚硝酸钠,山东西亚化学工业有限公司产品;无水乙醇、丙酮、乙醚、浓硫酸、盐酸、氢氧化钠、氯仿、正丁醇均为分析纯,上海试剂一厂产品;RPMI-1640细胞培养液(Gibco公司)用三蒸水溶解,0.22 μm微孔滤膜过滤除菌,4 ℃保存;小牛血清,杭州四季青公司产品;淋巴细胞分离液,天津市灏洋生物制品科技有限公司产品;肝素(Solarbio公司),用PBS溶液配成2 mg·mL-1溶液,0.22 μm微孔滤膜过滤除菌,-20 ℃保存;MTT,上海瑞永生物科技有限公司产品,用PBS溶液配成5 mg·mL-1溶液,0.22 μm微孔滤膜过滤除菌,4 ℃保存。
鸡新城疫低毒力活疫苗(La Sota株),购于南京天邦生物科技有限公司;新城疫检测抗原,由江苏省农业科学院兽医研究所提供。鸡血清IL-2、IFN-γ试剂盒,购于苏州卡尔文生物技术有限公司;mRNA提取试剂盒,南京奥青生物技术有限公司产品;PrimeScript TMRT Master Mix试剂盒,TaKaRa公司产品;SYBR® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒,TaKaRa公司产品;IL-2、IFN-γ和GAPDH基因的引物,上海英骏生物技术有限公司生产合成。
1.2 药物制备 1.2.1 CPP和GP的提取和纯化根据前期研究[11-12],取党参饮片粉碎干燥,加95%乙醇80 ℃水浴回流脱脂,水煎醇沉法提取粗多糖,过DEAE-纤维素柱,得到CPP。取大蒜去皮、切片,加95%乙醇80 ℃水浴回流脱脂,水煎醇沉提取粗多糖,过DEAE-纤维素柱,得到GP。用硫酸-苯酚法测得CPP和GP的糖含量分别为98.19%和94.5%。
1.2.2 CPP的硒化修饰用硝酸-亚硒酸钠法。根据以前通过活性比较筛选的优化条件[11-12],取CPP按照多糖与亚硒酸钠5:3的比例70 ℃反应8 h制得sCPP。经红外光谱鉴定硒化修饰成功,用硫酸-苯酚法测得sCPP糖含量分别为56.2%,用氢化物发生-原子荧光光谱法测得硒含量为11.86 mg·g-1。
1.2.3 sCPP-GP的制备以糖含量按照1:9的比例称取sCPP和GP,混合。
体外试验,根据安全浓度的测定结果,按最高安全浓度将sCPP-GP、sCPP和GP用RPMI-1640细胞培养液分别溶解稀释成20、2和18 μg·mL-1的溶液,0.22 μm微孔滤膜过滤除菌,4 ℃保存;临用前再用RPMI-1640细胞培养液分别倍比稀释至1.25、0.125和1.125 μg·mL-1(各5个浓度)。
体内试验,将sCPP-GP、sCPP和GP用生理盐水分别溶解稀释成10、1和9 mg·mL-1的溶液,0.22 μm微孔滤膜过滤除菌,4 ℃保存。
1.3 体外试验 1.3.1 淋巴细胞增殖测定取成年鸡心脏无菌采血,肝素抗凝,再加入等体积Hank’s液稀释,加到淋巴细胞分离液上层,2 000 r·min-1离心15 min,吸取中间云雾状细胞层,用Hank’s液洗2遍,活细胞计数大于90%后,用含10%小牛血清的RPMI-1640培养液调整细胞浓度为2.5×106个·mL-1,接种到96孔细胞板,每孔100 μL,然后加入5个浓度的各多糖溶液100 μL,每个浓度重复4孔;另设4孔细胞对照组(cell control, CC),仅加细胞培养液100 μL。将96孔细胞培养板置于37.5 ℃、5% CO2条件下培养44 h,每孔加入MTT 30 μL,继续培养4 h,每孔加裂解液DMSO 100 μL,将培养板置于微量振荡器上振荡5 min使沉淀完全溶解,用酶联免疫检测仪(Thermo Fisher公司产品)检测570 nm处的吸光度(A570 nm)值,作为T淋巴细胞增殖的指标;并计算5个浓度的平均淋巴细胞增殖率(average lymphocyte proliferation rate,ALPR)=(A多糖组-A对照组)/A对照组×100%(A为多糖组5个浓度或对照组4个孔的平均值)。
1.3.2 淋巴细胞IL-2和IFN-γ mRNA转录的测定同上法制备淋巴细胞悬液,接种到24孔细胞培养板中,每孔1 mL;然后加入前三个浓度[依次命名为高(H)、中(M)、低(L)浓度]的各多糖溶液1 mL,每个浓度重复4孔,同时设细胞对照孔,37.5 ℃、5% CO2条件下培养12 h,收集细胞,按照mRNA提取试剂盒说明书提取总RNA。
用TMRT Master Mix试剂盒配制cDNA反转录的反应液10 μL(5×PrimeScript RT Master Mix 2 μL,Total RNA 2 μL和Rnase Free dH2O 6 μL),进行反转录,反应条件为37 ℃反应15 min,85 ℃灭活5 s,4 ℃ 30 min。
IL-2和IFN-γ的引物由上海英骏生物技术有限公司合成,序列见表 1。
|
|
表 1 鸡IL-2、IFN-γ和GAPDH引物序列 Table 1 Primer sequences of chicken IL-2, IFN-γ and GAPDH for PCR |
以GAPDH为内标基因,用SYBR® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒配制Real-time PCR反应液20 μL:SYBR Premix Ex Taq (Tli RnaseH Plus, 10μL)、PCR Forward Primer (10 μmol·L-1, 0.4 μL)、PCR Reverse Primer (10 μmol·L-1, 0.4 μL)、ROX Reference Dye Ⅱ(0.4 μL)、DNA模板(2 μL)和dH2O (6.8 μL);用两步法PCR标准程序进行反应:第一步,94 ℃ 30 s预变性;第二步,95 ℃ 5 s、60 ℃ 34 s,40个循环,扩增目的基因。最后进行熔解曲线分析,2-ΔΔCt分析法统计IL-2和IFN-γ mRNA的相对转录量。设细胞对照组的2-ΔΔCt为1,ΔΔCt的计算公式为=(Ct目的基因-CtGAPDH基因)多糖组-(Ct目的基因-CtGAPDH基因)细胞对照组
1.4 体内试验 1.4.1 实验动物及分组处理1日龄非免疫健康罗曼蛋公鸡,饲养于“100 cm×60 cm×40 cm”规格铁丝笼内,饲喂商品化饲料,自由采食和饮水。初期1周,室温控制在37 ℃,全天24 h光照;然后逐步降至室温,每天光照12 h。饲养至14日龄时,测得新城疫母源抗体效价为2.8 log 2,选择150羽随机均分为5组,每组30羽。除空白对照组(blank control, BC)外均用鸡新城疫Ⅳ系疫苗免疫,28日龄二免。在每次免疫的同时,每羽分别肌肉注射各多糖溶液0.5 mL,免疫对照组(vaccination control, VC)和BC组注射等量生理盐水,每天1次,连续3 d。
1.4.2 淋巴细胞增殖的测定分别于首免后第7(D7)、14(D14)、21(D21)、28(D28)天,每组随机取4羽,心脏采血,同上法制备淋巴细胞悬液,测定A570 nm值,并计算各时间点的淋巴细胞增殖率(%)=[(A多糖-ABC)/ABC×100%](A为4个孔平均值)。
1.4.3 血清新城疫HI抗体效价测定分别于以上时间点,每组随机抽取6羽,翼静脉采血,分离血清,用β-微量法测定新城疫血凝抑制(HI)效价。
1.4.4 血清免疫因子的测定分别于以上时间点,每组随机抽取6羽,翼静脉采血,分离血清,用ELISA试剂盒测定血清IL-2和IFN-γ的含量。
1.5 数据处理数据以x“±sx”表示,用SPSS 20.0软件进行方差分析和多重比较。P < 0.05为差异显著。
2 结果 2.1 体外试验 2.1.1 各组淋巴细胞增殖的变化由表 2可知,sCPP-GP 5个浓度组的淋巴细胞A570 nm值均显著高于CC组(P < 0.05);sCPP在2~0.25 μg·mL-1、GP在18~4.5 μg·mL-1的淋巴细胞A570 nm值均显著高于CC组(P < 0.05);平均淋巴细胞增殖率:sCPP-GP 5个浓度组的平均淋巴细胞增殖率最高(29.83%),显著高于sCPP组(16.51%)和GP组(14.17%)(P < 0.05)。
|
|
表 2 体外试验不同浓度的sCPP、GP及其组合对鸡外周血淋巴细胞增殖的影响 Table 2 Effects of sCPP, GP and their compound at different concentrations on chicken peripheral lymphocyte proliferation in vitro test |
由图 1A可知,sCPP-GP中浓度组的IL-2 mRNA转录最高,其次为sCPP-GP高浓度组,两组均显著高于其余各组(P < 0.05);sCPP高浓度组的IL-2 mRNA转录显著高于CC组(P < 0.05)。
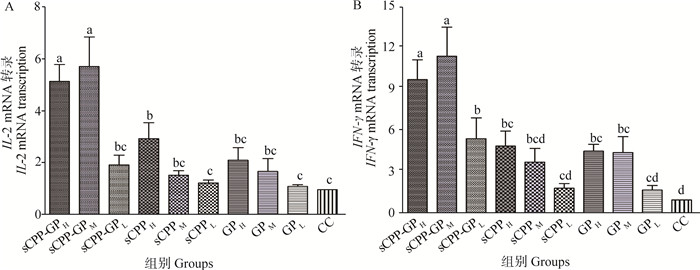
|
a~d.柱上标注没有相同字母者差异显著(P < 0.05) a-d. Bars without the same superscripts differ significantly (P < 0.05) 图 1 体外试验不同浓度的sCPP、GP及其组合对鸡外周血淋巴细胞IL-2、IFN-γ mRNA转录的影响 Figure 1 Effects of sCPP, GP and their compound at different concentrations on IL-2, IFN-γ mRNA transcription of chicken peripheral lymphocyte (in vitro test) |
由图 1B可知,sCPP-GP中浓度组的IFN-γ mRNA转录最高,其次为sCPP-GP高浓度组,两组均显著高于其余各组(P < 0.05);sCPP-GP低浓度、sCPP高浓度和GP的高、中浓度组的IFN-γ mRNA转录显著高于CC组(P < 0.05)。
2.2 体内试验 2.2.1 各组淋巴细胞增殖的变化由表 3可知,sCPP-GP组在4个时间点的淋巴细胞A570 nm值均为最高,显著高于VC和BC组(P < 0.05),在D28显著高于sCPP组、在D14显著高于GP组(P < 0.05);sCPP和GP组在4个时间点的细胞A570 nm值均高于VC和BC组,sCPP组在D14、GP组在D28显著高于VC和BC组(P < 0.05)。
|
|
表 3 体内试验sCPP、GP及其组合对鸡外周血淋巴细胞增殖的影响 Table 3 Effects of sCPP, GP and their compound on chicken peripheral lymphocyte proliferation in vivo test |
淋巴细胞增殖率:由图 2可知,sCPP-GP组在4个时间点的淋巴细胞增殖率均为最高,均显著高于VC组(P < 0.05),在D14和D28显著高于sCPP组(P < 0.05),在D7和D14显著高于GP组(P < 0.05);sCPP和GP组在4个时间点的淋巴细胞增殖率均高于VC组,sCPP组在D14、GP组在D14和D28显著高于VC组(P < 0.05)。
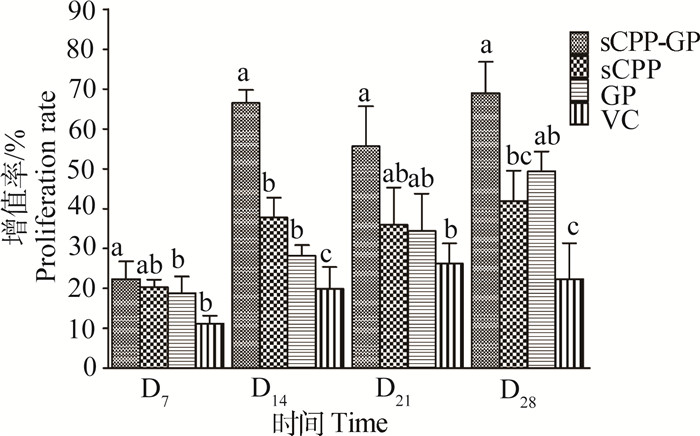
|
a~c.在同一时间点柱上标注没有相同字母者差异显著(P < 0.05) a-c. Bars at same time point without the same superscripts differ significantly (P < 0.05) 图 2 体内试验sCPP、GP及其组合对鸡外周血淋巴细胞增殖率的影响 Figure 2 Effects of sCPP, GP and their compound on chicken peripheral lymphocyte proliferation rates (in vivo test) |
由图 3可知,sCPP-GP组在4个时间点的HI抗体效价均为最高,均显著高于VC和BC组(P < 0.05),在D7和D14显著高于sCPP和GP组(P < 0.05);sCPP和GP组在4个时间点的HI抗体效价均高于VC和BC组,在D28显著高于VC和BC组(P < 0.05)。
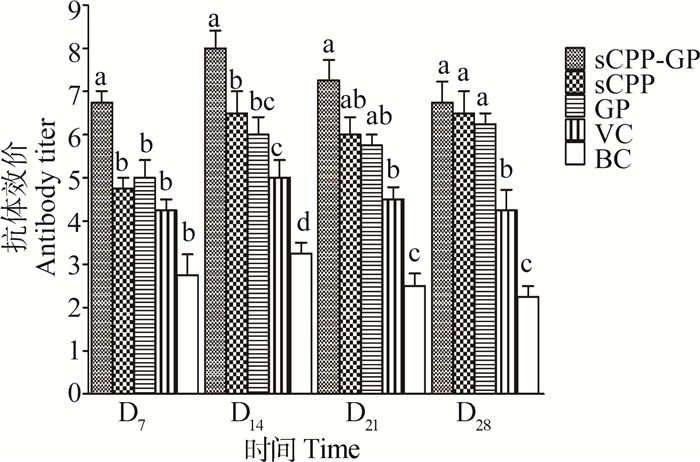
|
a~c.在同一时间点柱上标注没有相同字母者差异显著(P < 0.05) a-c. Bars at same time point without the same superscripts differ significantly (P < 0.05) 图 3 体内试验sCPP、GP及其组合对鸡血清HI抗体效价的影响 Figure 3 Effects of sCPP, GP and their compound on chicken serum HI antibody titers (in vivo test) |
由图 4A可知,sCPP-GP组在4个时间点的血清IL-2含量均为最高,均显著高于其余各组(P < 0.05);sCPP和GP组在4个时间点的血清IL-2含量均高于VC和BC组,sCPP组在D7和D21、GP组在D21和D28显著高于VC和BC组(P < 0.05)。
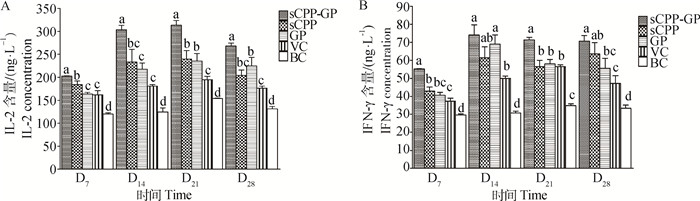
|
a~d.在同一时间点柱上标注没有相同字母者差异显著(P < 0.05) a-d. Bars at same time point without the same superscripts differ significantly (P < 0.05) 图 4 体内试验sCPP、GP及其组合对鸡血清IL-2、IFN-γ含量的影响 Figure 4 Effects of sCPP, GP and their compound on chicken serum IL-2, IFN-γ contents (in vivo test) |
由图 4B可知,sCPP-GP组在4个时间点血清IFN-γ含量均为最高,均显著高于VC和BC组(P < 0.05),在D7和D21显著高于sCPP和GP组、在D28显著高于GP组(P < 0.05);sCPP和GP组在4个时间点的血清IFN-γ含量均高于VC和BC组,sCPP组在D7和D28、GP组在D14显著高于VC和BC组(P < 0.05)。
3 讨论本研究中,笔者首先用MTT法[13]测定了sCPP-GP复方及其两个组分药对培养的鸡外周血淋巴细胞增殖的影响。淋巴细胞A570 nm值与淋巴细胞增殖呈正相关,A570 nm值越大,则增殖越显著。试验结果显示,sCPP-GP在所有浓度、sCPP在4个浓度、GP在3个浓度组的淋巴细胞A570 nm值均显著高于细胞对照组(P < 0.05),表明它们在这些浓度能显著促进淋巴细胞增殖。平均淋巴细胞增殖率的计算结果显示,sCPP-GP 5个浓度的平均淋巴细胞增殖率最高,显著高于sCPP和GP组,表明sCPP-GP复方的体外增强免疫活性最强,显著强于两个组分药sCPP和GP。
为了验证体外试验结果,将3种多糖配合新城疫疫苗免疫雏鸡,测定雏鸡外周血T淋巴细胞增殖、血清新城疫HI抗体效价和细胞因子的动态变化。T淋巴细胞主要介导细胞免疫[14]。试验结果显示,sCPP-GP组在4个时间点的淋巴细胞A570 nm值均为最高,均显著高于VC和BC组,在一些时间点显著高于sCPP和GP组;sCPP和GP仅在1个时间点的淋巴细胞A570 nm值显著高于VC和BC组,表明3个多糖均能增强细胞免疫;sCPP-GP组在4个时间点的淋巴细胞增殖率均为最高,均显著高于VC组,分别在2个时间点显著高于sCPP和GP组,表明sCPP-GP复方增强细胞免疫的作用最强,显著强于两个组分药sCPP和GP。
体液免疫是由B淋巴细胞介导的抗原抗体特异性反应,B淋巴细胞受到抗原刺激后增殖分化成大量的浆细胞,浆细胞合成和分泌特异抗体进入血液后与机体内特异性抗体发生反应[15]。血清特异性抗体效价的高低直接反映机体的体液免疫应答状态。本试验结果显示,sCPP-GP组在4个时间点的血清新城疫HI抗体效价均为最高,均显著高于VC和BC组,在2个时间点显著高于sCPP和GP组;sCPP和GP组仅在1个时间点的抗体效价显著高于VC和BC组,表明3个多糖均能增强体液免疫,sCPP-GP复方的作用最强,显著强于两个组分药sCPP和GP。
免疫增强剂的作用机制多与细胞因子有关。研究表明,多糖可以通过诱生多种细胞因子而发挥增强免疫作用[16-18]。IL-2和IFN-γ由辅助性T细胞分泌产生的细胞因子,它们可反过来促进T细胞的增殖和分化[19-20],因此血清IL-2和IFN-γ含量可作为机体免疫功能的指标。体内试验结果显示,sCPP-GP组在4个时间点的血清IL-2和IFN-γ含量均为最高,IL-2含量显著高于其余各组,IFN-γ含量显著高于VC和BC组,在一些时间点显著高于sCPP和GP组;sCPP和GP组的血清IL-2和IFN-γ含量仅在1~2个时间点显著高于VC和BC组;同时,体外试验结果也证明,sCPP-GP中、高浓度组IL-2和IFN-γ的mRNA转录均显著高于其余各组,sCPP高浓度组IL-2和IFN-γ的mRNA转录、GP高、中浓度组的IFN-γ mRNA转录显著高于细胞对照组。这些结果表明,3个多糖均能促进两种细胞因子的分泌及其mRNA的转录,sCPP-GP复方的作用最强,显著强于两个组分药sCPP和GP。
sCPP-GP是由sCPP和GP组成的复方。党参为桔梗科植物党参Codonopsis pilosula (Franch.) Nannf.等的干燥根,是常用的补气药,具有补中益气、健脾益肺功效[21],党参多糖为党参的主要活性成分,具有增强免疫、抗氧化、保肝、抗肿瘤等生物活性[22],尤其是硒化修饰后其增强免疫活性显著增强[23]。大蒜为百合科植物大蒜Allium sativium L.的鳞茎,既是食用蔬菜又可用作中药,具有理气开胃、解毒、止痢等功能[24]。大蒜多糖为主要活性成分之一,具有增强免疫、抗氧化等生物学活性[12]。因此由sCPP和GP组成的复方显示很强的增强免疫功效。
以上结果表明,sCPP-GP复方既显著增强细胞免疫,又能显著增强体液免疫,从而显著增强鸡新城疫疫苗的免疫效果。同时,sCPP-GP复方能显著促进鸡外周血淋巴细胞IL-2和IFN-γ的分泌及其mRNA的表达,可能是本方增强免疫的机制之一。至于其他可能的机制,有待进一步研究。
4 结论sCPP和GP能协同增强鸡外周血淋巴细胞和新城疫疫苗的免疫功效,sCPP-GP复方的作用显著强于两个组分药,可以作为新型免疫增强剂的候选方。
| [1] |
赵思俊, 孙晓亮, 曲志娜, 等. 新型免疫佐剂研究进展[J]. 中国动物检疫, 2016, 33(7): 58–61.
ZHAO S J, SUN X L, QU Z N, et al. Study progress of new type of immunoadjuvant[J]. China Animal Health Inspection, 2016, 33(7): 58–61. (in Chinese) |
| [2] |
王彦军. 中药多糖研究进展[J]. 医学理论与实践, 2009, 22(3): 279–281.
WANG Y J. Research progress of polysaccharides of traditional Chinese medicine[J]. Journal of Medical Theory & Practice, 2009, 22(3): 279–281. (in Chinese) |
| [3] | WANG E L, CHEN X, WANG K Y, et al. Plant polysaccharides used as immunostimulants enhance innate immune response and disease resistance against Aeromonas hydrophila infection in fish[J]. Fish Shellfish Immunol, 2016, 59: 196–202. DOI: 10.1016/j.fsi.2016.10.039 |
| [4] | CHEN B J, SHI M J, CUI S, et al. Improved antioxidant and anti-tyrosinase activity of polysaccharide from Sargassum fusiforme by degradation[J]. Int J Biol Macromol, 2016, 92: 715–722. DOI: 10.1016/j.ijbiomac.2016.07.082 |
| [5] |
刘占峰, 孙汉文. 多糖的化学修饰研究进展[J]. 河北大学学报:自然科学版, 2005, 25(1): 104–108.
LIU Z F, SUN H W. Progress of the research on chemically modifications of polysaccharide[J]. Journal of Hebei University: Natural Science Edition, 2005, 25(1): 104–108. (in Chinese) |
| [6] |
李玉华, 王凤山, 贺艳丽. 多糖化学修饰方法研究概况[J]. 中国生化药物杂志, 2007, 28(1): 62–65.
LI Y H, WANG F S, HE Y L. Research status of the chemical modification methods of polysaccharides[J]. Chinese Journal of Biochemical Pharmaceutics, 2007, 28(1): 62–65. (in Chinese) |
| [7] | HUANG X Y, HU Y L, ZHAO X N, et al. Sulfated modification can enhance the adjuvant activity of astragalus polysaccharide for ND vaccine[J]. Carbohyd Polym, 2008, 73(2): 303–308. DOI: 10.1016/j.carbpol.2007.11.032 |
| [8] | QIN T, CHEN J, WANG D Y, et al. Selenylation modification can enhance immune-enhancing activity of Chinese angelica polysaccharide[J]. Carbohydr Polym, 2013, 95(1): 183–187. DOI: 10.1016/j.carbpol.2013.02.072 |
| [9] | GUO L W, LIU J G, HU Y L, et al. Astragalus polysaccharide and sulfated epimedium polysaccharide synergistically resist the immunosuppression[J]. Carbohydr Polym, 2012, 90(2): 1055–1060. DOI: 10.1016/j.carbpol.2012.06.042 |
| [10] |
陈茜, 邢玉娟, 陈玉库, 等. 黄芪多糖和氧化苦参碱协同增强鸡新城疫疫苗免疫效果研究[J]. 西北农林科技大学学报:自然科学版, 2015, 43(6): 41–46.
CHEN Q, XING Y J, CHEN Y K, et al. Increasing immune efficacy of Newcastle disease vaccine in chicken by astragalus polysaccharide and oxymatrine[J]. Journal of Northwest A&F University: Natural Science Edition, 2015, 43(6): 41–46. (in Chinese) |
| [11] |
秦韬. 硒化当归多糖和硒化党参多糖的增强免疫和抗氧化的活性研究[D]. 南京: 南京农业大学, 2013.
QIN T. Immune-enhancing and antioxidant activities of selenizing Chinese angelica polysaccharide and selenizing Codonopsis pilosula polysaccharide[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese) |
| [12] | QIU S L, CHEN J, QIN T, et al. Effects of selenylation modification on immune-enhancing activity of garlic polysaccharide[J]. PLoS One, 2014, 9(1): e86377. DOI: 10.1371/journal.pone.0086377 |
| [13] | STEPANENKO A A, DMITRENKO V V. Pitfalls of the MTT assay: direct and off-target effects of inhibitors can result in over/underestimation of cell viability[J]. Gene, 2015, 574(2): 193–203. DOI: 10.1016/j.gene.2015.08.009 |
| [14] | LI C R, SANTOSO S, LO D D. Quantitative analysis of T cell homeostatic proliferation[J]. Cell Immunol, 2007, 250(1-2): 40–54. DOI: 10.1016/j.cellimm.2008.01.003 |
| [15] |
钱莉, 傅奕, 潘兴元, 等. TLR3激动剂对B细胞功能的影响[J]. 免疫学杂志, 2011, 27(10): 833–836.
QIAN L, FU Y, PAN X Y, et al. Effects of TLR3 agonist on B cell functions[J]. Immunological Journal, 2011, 27(10): 833–836. (in Chinese) |
| [16] | HOU R R, CHEN J, YUE C J, et al. Modification of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydr Polym, 2016, 142: 73–81. DOI: 10.1016/j.carbpol.2016.01.032 |
| [17] | FREYSDOTTIR J, LOGADOTTIR O T, OMARSDOTTIR S S, et al. A polysaccharide fraction from Achillea millefolium increases cytokine secretion and reduces activation of Akt, ERK and NF-κB in THP-1 monocytes[J]. Carbohydr Polym, 2016, 143: 131–138. DOI: 10.1016/j.carbpol.2016.02.017 |
| [18] | LI J W, LIU Y, LI B H, et al. A polysaccharide purified from Radix Adenophorae promotes cell activation and pro-inflammatory cytokine production in murine RAW264.7 macrophages[J]. Chin J Nat Med, 2016, 14(5): 370–376. |
| [19] | BUSSE D, DE LA ROSA M, HOBIGER K, et al. Competing feedback loops shape IL-2 signaling between helper and regulatory T lymphocytes in cellular microenvironments[J]. Proc Natl Acad Sci U S A, 2010, 107(7): 3058–3063. DOI: 10.1073/pnas.0812851107 |
| [20] | SCHRODER K, HERTZOG P J, RAVASI T, et al. Interferon-γ: an overview of signals, mechanisms and functions[J]. J Leukoc Biol, 2004, 75(2): 163–189. |
| [21] |
中国兽药典委员会.
中华人民共和国兽药典-2015年版二部[M]. 北京: 中国农业出版社, 2016: 416.
Commission of Chinese Veterinary Pharmacopeia. Veterinary pharmacopoeia of the people's republic of China, 2015 Part Ⅱ[M]. Beijing: China Agriculture Press, 2016: 416. (in Chinese) |
| [22] | SUN Y X, LIU J C. Structural characterization of a water-soluble polysaccharide from the roots of Codonopsis pilosula and its immunity activity[J]. Int J Biol Macromol, 2008, 43(3): 279–282. DOI: 10.1016/j.ijbiomac.2008.06.009 |
| [23] | QIN T, REN Z, LIN D, et al. Effects of selenizing Codonopsis pilosula polysaccharide on macrophage modulatory activities[J]. J Microbiol Biotechnol, 2016, 26(8): 1358–1366. DOI: 10.4014/jmb.1601.01094 |
| [24] |
郑敏, 熊娟, 赵骥, 等. 大蒜多糖C对正常小鼠外周血淋巴细胞亚群的影响[J]. 咸宁学院学报:医学版, 2007, 21(1): 9–12.
ZHENG M, XIONG J, ZHAO J, et al. Effects of garlic polysaccharide C on lymphocyte subsets in the peripheral blood in mice[J]. Journal of Xianning College: Medical Sciences, 2007, 21(1): 9–12. (in Chinese) |



