2. 河北农业大学动物医学院 河北省兽医生物技术工程技术研究中心, 保定 071000;
3. 保定市动物疫病预防控制中心, 保定 071001
2. Hebei Engineering and Technology Research Center of Veterinary Biotechnology, College of Veterinary Medicine, Hebei Agricultural University, Baoding 071000, China;
3. The Center for Animal Disease Control and Prevention, Baoding 071001, China
防御素(defensin)是广泛分布于动植物等多种生物类群中富含精氨酸和半胱氨酸残基的一类阳离子内源性抗微生物肽,一般由18~54个氨基酸组成,相对分子质量为2 ~ 6 ku。根据防御素的来源、分子结构特征及其表达部位的不同,可分为α-、β-、θ-防御素[1]。G. Diamond等于1991年首次在牛的气管黏膜上皮细胞中发现β-防御素,并将其命名为TAP(Tracheal antimicrobial peptide)[2]。迄今在猪体内仅发现β-防御素,通过基因组序列分析等生物信息学方法鉴定,猪体内共编码了13种猪β-防御素(porcine β-defensin,pBD)[3]。其中,pBD1是猪体内最早发现的防御素,分布于猪的呼吸道、消化道、胸腺、脾、肝和外周血嗜中性粒细胞和巨噬细胞中,其核苷酸序列具有多态性[4, 5]。防御素极易被肠道吸收,抗菌谱广,且不易产生细菌耐药性[6-8],并具有抗病毒、抗肿瘤、抗氧化等作用,在机体天然和获得性免疫中起着重要作用[9-12]。因此,防御素是最具潜力的抗炎症和感染性疾病治疗的新型生物制品之一。
寻找新型、安全有效的抗生素替代产品是目前生物制品研制的热点,因此利用基因工程技术研究开发新型生物制剂具有广阔的应用前景,对畜牧业可持续发展具有极为重要的现实意义。本研究通过体外和体内试验评价重组pBD1的抗菌活性及其对大肠杆菌感染病鸡的治疗效果,旨在为新型抗感染制剂在畜禽生产中的研究和开发奠定基础。
1 材料与方法 1.1 菌株与载体试验用E. coli BL21菌株、E. coli O141、SJZ1株和SJZ2株,均由本实验室保存。pBD1重组表达质粒(pET-pBD1) 及重组表达菌(pET-pBD1/BL21),由本实验室构建[13]、鉴定和保存。
1.2 试验动物11日龄健康海兰褐雏鸡40只,购于河北某种禽有限公司,由专人饲喂和管理。饲料为专门配制的不含任何抗生素的全价饲料,自由饮水。
1.3 主要试剂IPTG、SephadexTM G-25、N,N′-二甲基甲叉双丙烯酰胺、丙烯酰胺等为Solarbio公司产品;Ni-Agarose His标签蛋白纯化试剂盒,购自北京康为世纪生物有限公司。
1.4 重组pBD1的诱导表达将重组表达菌pET-pBD1/BL21接种到5 mL Amp/2×YT培养基中,37 ℃、200 r·min-1振摇培养过夜,按照菌液与培养基体积比(1:100) 接种到500 mL Amp/2×YT培养基中,参照文献[13]进行蛋白质诱导表达。同时以E. coli BL21和携带空质粒的BL21(pET/BL21) 为对照进行诱导表达。收集诱导表达后的菌体,经SDS-PAGE电泳分析目的蛋白质的表达情况,并通过薄层扫描软件分析目的蛋白质在菌体中的含量。
1.5 重组pBD1的纯化和Western blot鉴定根据生产厂商提供的蛋白质纯化步骤,应用Ni-Agarose His标签蛋白纯化试剂盒,纯化表达的重组pBD1,经SDS-PAGE电泳检测纯化产物,并通过Western blot对表达产物进行鉴定,即蛋白质经SDS-PAGE电泳后,将分离条带转至PVDF膜上,封闭后与抗His标签鼠单克隆抗体(1:800) 于37 ℃下孵育1 h;加入HRP-山羊抗小鼠IgG(H+L)(1:2 000) 于室温下反应1 h;将膜置DAB底物显色液中显色3~5 min,去离子水终止显色反应,拍照记录结果。将纯化的pBD1经Sephadex G-25层析柱过滤脱盐,过滤除菌后分装,冷冻干燥,-20 ℃保存备用。
1.6 体外抑制试验 1.6.1 琼脂扩散试验取E. coli O141、SJZ1和SJZ2株分别划线接种于普通营养琼脂平板,37 ℃培养24 h。挑取单一菌落接种到5 mL LB中,37 ℃ 200 r·min-1培养16 h;取菌液100 μL均匀涂布普通营养琼脂平板上,待菌液吸收完全,打孔器均匀打孔(Φ=6 mm),每孔加入100 μL重组pBD1(0.862 mg·mL-1),37 ℃培养24 h,重复3次试验,记录抑菌圈直径大小。
1.6.2 微量抑菌试验在96孔细胞培养板中用营养肉汤将重组pBD1稀释为0.141、0.071、0.035、0.018和0.009 mg·mL-1,然后接种等量的大肠杆菌肉汤培养物,每孔总体积为200 μL,每个浓度重复3孔。同时设立肉汤培养基对照和不加防御素的细菌对照孔。将培养板置37 ℃下培养24 h,测量OD630 nm值,分析细菌生长情况。
1.7 鸡大肠杆菌病的治疗试验 1.7.1 动物感染将40只11 d的健康雏鸡随机分为A、B、C、D和E组,每组8只。A组为防御素治疗组;B组为抗生素治疗组;C组为防御素与抗生素联合治疗组;D组为感染非治疗组;E组为空白对照组。A、B、C和D组每只鸡感染大肠杆菌O141株的剂量为1 LD50(2.5×109 cfu·mL-1),分别通过颈部皮下注射和口服途径各接种1 mL菌液。E组:每只颈部皮下注射1 mL营养肉汤,同时口服1 mL肉汤。E组与其他四个组严格隔离饲养。感染后,观察各组鸡的临床症状,记录发病率和死亡率,测量感染后第0、5和7天各组鸡的平均体重。
1.7.2 感染鸡的治疗及其效果检查当感染鸡出现嗜睡、食欲下降、腹泻等症状时,对各感染组进行差别治疗。A组:口服重组pBD1 50 μg·(只·次)-1;B组:口服头孢曲松钠(药敏试验筛选高效抗生素,纯度≥98%)50 mg·kg-1(按体重给药,下同);C组:口服重组pBD1 50 μg·(只·次)-1和头孢曲松钠50 mg·kg-1;D组:口服等体积的无菌生理盐水。各组每日口服1次。E组:正常饲喂。感染后连续观察7 d,记录各组鸡的临床症状及死亡率;剖检病死鸡以及感染存活鸡,比较不同组的病理变化。分析比较pBD1与头孢曲松钠的治疗效果。
2 结果 2.1 重组pBD1的诱导表达与SDS-PAGE分析猪pBD1重组表达菌pET-pBD1/BL21用IPTG诱导4 h后,经SDS-PAGE电泳检测,在24.5 ku位置处出现了一条目的蛋白质带,而E. coli BL21和空质粒携带菌pET/BL21未见此蛋白质条带,表明在体外成功表达了重组pBD1(图 1)。薄层扫描分析表明,重组pBD1表达量可达菌体总蛋白质含量的46.7%。
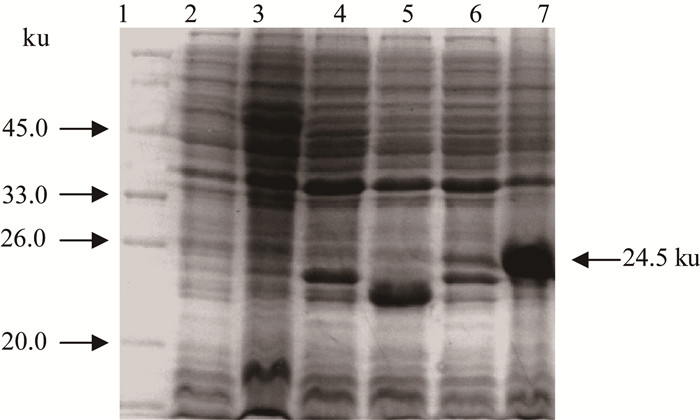
|
1.蛋白质低相对分子质量标准;2. E. coli诱导前;3. BL21菌体诱导4 h;4. pET/BL21诱导前;5. pET/BL21诱导4 h;6. pET-pBD1/BL21诱导前;7. pET-pBD1/BL21诱导4 h 1. Low molecular weight protein marker; 2. E. coli BL21 bacteria before induction; 3. E. coli BL21 induced for 4 h; 4. pET/BL21 before induction; 5. pET/BL21 induced for 4 h; 6. pET-pBD1/BL21 before induction; 7. pET-pBD1/BL21 induced for 4 h 图 1 IPTG诱导大肠杆菌表达重组pBD1的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of recombinant pBD1 expressed in E. coli BL21 induced by IPTG |
应用Ni-Agarose His标签蛋白纯化试剂盒纯化表达的重组pBD1,经SDS-PAGE电泳检测,表明已经除去了菌体的杂蛋白质,重组pBD1蛋白已被纯化(图 2A)。Western blot鉴定结果显示,IPTG诱导后的重组表达菌pET-pBD1/BL21与纯化蛋白质均在约24.5 ku处出现一条很清晰的反应条带,与预期大小相符,而IPTG诱导后的空质粒携带大肠杆菌pET/BL21在相应位置未出现预期大小的反应条带。该结果表明,成功表达了重组pBD1蛋白(图 2B)。
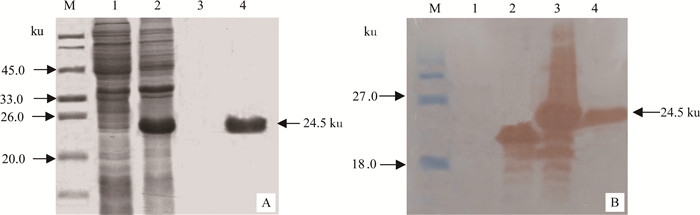
|
A.纯化重组pBD1的SDS-PAGE分析(M.蛋白质低相对分子质量标准;1. pET-pBD1/BL21诱导前;2. pET-pBD1/BL21诱导4 h;3.纯化流穿峰收集液;4.纯化洗脱峰收集液);B.重组pBD1的Western blot鉴定(M.预染蛋白marker Ⅲ; 1. BL21菌体蛋白;2. pET/BL21诱导4 h;3. pET-pBD1/BL21诱导4 h;4.纯化的重组pBD1) A. SDS-PAGE analysis of the purified recombinant pBD1 (M. Low molecular weight protein marker; 1. pET-pBD1/BL21 before induction; 2. Deposition of pET-pBD1/BL21 induced for 4 h; 3. Liquid collected from the flow-through peak; 4. Liquid collected from elution peak); B. Western blot identification of the recombinant pBD1 (M. Pre-stained marker Ⅲ; 1. BL21; 2. pET/BL21 induced for 4 h; 3. pET-pBD1/BL21 induced for 4 h; 4. Purified recombinant protein pBD1) 图 2 纯化重组pBD1的SDS-PAGE分析与Western blot鉴定 Figure 2 SDS-PAGE analysis and Western blot of purified recombinant pBD1 |
利用琼脂打孔扩散法测定重组pBD1对大肠杆菌O141、SJZ1和SJZ2株的抑菌活性,结果表明,重组pBD1对三株大肠杆菌均有抑制作用,抑菌圈直径为(9.17±0.29)~(15.34 ± 0.40) mm。微量抑菌试验测定结果显示,在9~141 μg·mL-1质量浓度范围内,重组pBD1对三株大肠杆菌均有抑制作用,并且随着pBD1浓度升高,菌液的OD630 nm值逐渐降低。结果表明重组pBD1浓度越高抑制菌体生长的效果越强,具有浓度依赖性(图 3)。
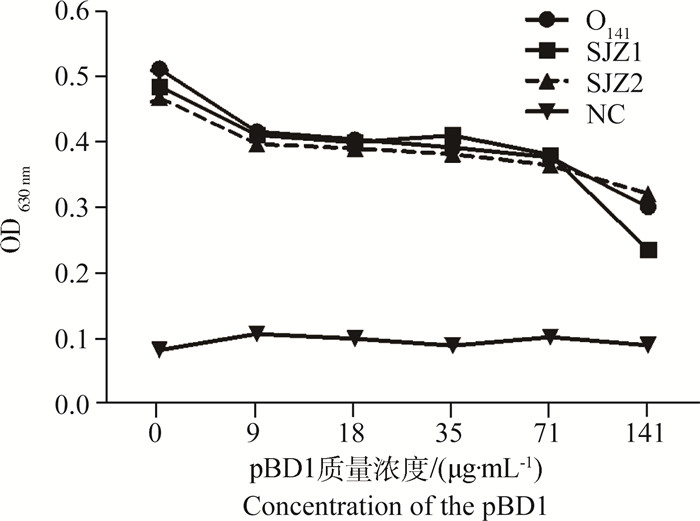
|
NC.营养肉汤对照 NC. Nutrient broth control 图 3 重组pBD1对大肠杆菌生长的抑制作用 Figure 3 The inhibitory effect of the recombinant pBD1 on the growth of E. coli |
感染后5 h,除空白对照组外,各感染组均出现精神沉郁、嗜睡,食欲下降,个别雏鸡腹泻等临床症状,于此时立即实施治疗。由表 1可见,防御素治疗组(A组)、抗生素治疗组(B组)、防御素与抗生素联合治疗组(C组)和感染非治疗组(D组)的死亡率分别为25%(2/8)、25%(2/8)、0(0/8) 和50%(4/8)。治疗后A、B、C组的临床症状明显减轻,尤其是C组恢复速度明显比A、B两组快;感染后第2天,C组的精神、食欲恢复;感染后第4天,A组和B组中各有1只鸡精神不振和腹泻,其余均恢复正常,而D组中仍然有50%鸡精神、食欲不正常(表 1)。对各组病死鸡和感染后第7天存活的鸡进行剖检,发现A、B、C三个治疗组中出现肝周炎、心包炎、气囊炎病变的鸡数量少于D组,且病变程度轻,尤其是C组有病变鸡数量及病变程度均低于A和B组,E组未见肉眼可见病理变化。
|
|
表 1 各组雏鸡的临床症状 Table 1 The clinical presentations of chickens in every group |
感染后第5天,A、B、C三个治疗组的平均体重均高于D组,其中A组的体重显著高于D组(P<0.05),A、B、C组与非感染对照(E)组之间无显著差异(P>0.05),而D组极显著低于E组(P<0.01)。感染后第7天,A和C组的平均体重(分别为125.13 g和122.30 g)极显著高于D组(100.07 g)(P<0.01),接近E组的体重(124.60 g)。B组的体重(113.28 g)虽然高于D组,但差异不显著(P>0.05)。各组鸡的体重变化提示,三个治疗组中存活鸡恢复较快,其中A和C组优于B组的恢复状态(表 1)。
上述治疗结果表明,重组pBD1和头孢曲松钠对鸡大肠杆菌病均有治疗效果,能够减轻发病程度,降低死亡率,缩短病程,但在病鸡恢复过程中,防御素、防御素与抗生素联合优于抗生素单独治疗的效果,尤其是防御素与抗生素联合治疗,效果更佳。
3 讨论抗生素的不当使用引起细菌耐药性普遍发生,并导致药物残留严重,影响人类健康和畜禽业的发展,这种现状已经成为人们重点关注的公共卫生问题。β-防御素是重要的内源性抗微生物肽,为机体抵抗外界病原微生物入侵的第一道防线,在抗感染免疫和促进伤口愈合中发挥重要作用[10, 14]。pBD1可以保护仔猪免受支气管博代杆菌感染,参与抵抗鼠伤寒沙门菌感染[15-16]。重组pBD1对大肠杆菌、金黄色葡萄球菌和胸膜肺炎放线杆菌均具有体外抑制作用[7, 17],本研究通过体外试验证明,重组pBD1对O141、SJZ1和SJZ2三株大肠杆菌均具有明显的抑制活性,且具有浓度依赖性。
防御素不仅具有抗菌活性,而且对宿主天然和获得性抗感染免疫具有重要调节作用,并通过对感染局部环境的改善而提高宿主抗感染能力[18-19]。在断奶仔猪饲料中添加重组猪β-防御素2能够显著降低断奶仔猪腹泻发病率,提高猪日平均体重增加值,改善十二指肠和空肠肠绒毛的整齐度[18]。实验感染产毒素性大肠杆菌的断奶仔猪口服猪β-防御素2或硫酸新霉素后,两者均可以降低肠道内大肠杆菌数量,抑制黏膜炎症因子如肿瘤坏死因子-α、白细胞介素(IL)-1β和IL-8的表达,但口服β-防御素2组猪的盲肠内容物中双歧杆菌和乳酸杆菌的含量显著高于口服硫酸新霉素猪的含量,说明β-防御素2除具备抗菌活性外,还具备改善肠道益生菌菌群的作用[19]。尽管不同种类的防御素具有相似的抗菌活性,但有关重组pBD1的抗菌活性多为体外研究结果[7, 17],尚未见其体内抗菌活性的相关报道。本研究发现重组pBD1、头孢曲松钠以及重组pBD1和头孢曲松钠联合应用,均能够明显减轻大肠杆菌O141感染雏鸡的临床症状和解剖病变,降低死亡率,并延缓病程的发展,表明重组pBD1在体内对大肠杆菌也具有良好的抗感染活性。但是重组pBD1和头孢曲松钠单独治疗组均有25%的鸡死亡,而重组pBD1和头孢曲松钠联合治疗组在试验期间没有鸡死亡,提示重组pBD1和头孢曲松钠联合应用优于其各自单独治疗的效果。考虑到在一定浓度范围内,随着浓度增加,重组pBD1的体外抑菌活性升高,能否通过改善重组pBD1的使用剂量而提高治疗效果,需要进一步试验证明。值得注意的是感染后第7天,三个治疗组的平均体重虽然都高于感染非治疗组,但头孢曲松钠治疗组与感染非治疗组之间的体重无显著差异,而重组pBD1与联合治疗组的平均体重均显著高于感染非治疗组的体重,表明这两个组的恢复状态优于头孢曲松钠治疗组。这可能与防御素除了具备抗菌活性外,还具备免疫调节、血管生成和改善肠道菌群等功能有关,从而有利于机体恢复,使体重增加更快[19-21],对此需要进一步研究证明。
4 结论重组猪β-防御素1对大肠杆菌具有明显的抑制活性,对大肠杆菌感染病鸡的治疗效果优于头孢曲松钠,可降低死亡率,缩短病程,有助于病鸡恢复。当重组猪β-防御素1与头孢曲松钠联合使用时,疗效更佳。该研究结果可以为大肠杆菌病的治疗及新型抗菌制剂pBD1的研究与开发提供重要科学依据。
| [1] | GANZ T. The role of antimicrobial peptides in innate immunity[J]. Integr Comp Biol, 2003, 43(2): 300–304. DOI: 10.1093/icb/43.2.300 |
| [2] | DIAMOND G, ZASLOFF M, ECK H, et al. Tracheal antimicrobial peptide, a cysteine-rich peptide from mammalian tracheal mucosa: peptide isolation and cloning of a cDNA[J]. Proc Natl Acad Sci U S A, 1991, 88(9): 3952–3956. DOI: 10.1073/pnas.88.9.3952 |
| [3] | GAO C Y, XU T T, ZHAO Q J, et al. Codon optimization enhances the expression of porcine β-defensin-2 in Escherichia coli[J]. Genet Mol Res, 2015, 14(2): 4978–4988. DOI: 10.4238/2015.May.12.1 |
| [4] | PRUTHVIRAJ D R, USHA A P, VENKATACHALAPATHY R T. Identification of a novel single nucleotide polymorphism in porcine beta-defensin-1 gene[J]. Asian-Australas J Anim Sci, 2016, 29(3): 315–320. DOI: 10.5713/ajas.15.0638 |
| [5] | ZHANG G L, WU H, SHI J S, et al. Molecular cloning and tissue expression of porcine β-defensin-1[J]. FEBS Lett, 1998, 424(1-2): 37–40. DOI: 10.1016/S0014-5793(98)00134-3 |
| [6] | SHI J S, ZHANG G L, WU H, et al. Porcine epithelial β-defensin 1 is expressed in the dorsal tongue at antimicrobial concentrations[J]. Infect Immun, 1999, 67(6): 3121–3127. |
| [7] | LI C L, XU T T, CHEN R B, et al. Cloning, expression and characterization of antimicrobial porcine β defensin 1 in Escherichia coli[J]. Protein Expr Purif, 2013, 88(1): 47–53. DOI: 10.1016/j.pep.2012.11.015 |
| [8] | SILVA O N, MULDER K C L, BARBOSA A E A D, et al. Exploring the pharmacological potential of promiscuous host-defense peptides: from natural screenings to biotechnological applications[J]. Front Microbiol, 2011, 2: 232. |
| [9] | BROWN K L, POON G F T, BIRKENHEAD D, et al. Host defense peptide LL-37 selectively reduces proinflammatory macrophage responses[J]. J Immunol, 2011, 186(9): 5497–5505. DOI: 10.4049/jimmunol.1002508 |
| [10] | CHARNLEY M, MOIR A J G, DOUGLAS C W I, et al. Anti-microbial action of melanocortin peptides and identification of a novel X-Pro-D/L-Val sequence in Gram-positive and Gram-negative bacteria[J]. Peptides, 2008, 29(6): 1004–1009. DOI: 10.1016/j.peptides.2008.02.004 |
| [11] |
薛现凤, 韩菲菲, 高彦华, 等. 猪β-防御素体外抗菌活性和抗氧化活性研究[J]. 农业生物技术学报, 2012, 20(11): 1291–1299.
XUE X F, HAN F F, GAO Y H, et al. In vitro detections of antimicrobial and antioxidant activities of porcine β-defensins[J]. Journal of Agricultural Biotechnology, 2012, 20(11): 1291–1299. (in Chinese) |
| [12] | NGUYEN L T, HANEY E F, VOGEL H J. The expanding scope of antimicrobial peptide structures and their modes of action[J]. Trends Biotechnol, 2011, 29(9): 464–472. DOI: 10.1016/j.tibtech.2011.05.001 |
| [13] |
袁洪兴, 李红园, 赵驻军, 等. 猪β防御素-1基因克隆及其表达载体的构建[C]//第三届京津冀畜牧兽医科技创新研讨会暨"瑞普杯"新思想、新方法、新观点论坛论文集. 天津: 天津市畜牧兽医学会, 北京畜牧兽医学会, 河北省畜牧兽医学会, 2012: 267-269. YUAN H X, LI H Y, ZHAO Z J, et al. Clone of porcine β-
defensins-1 gene and construction of its expression vector[C]//The Third Symposium on Animal Husbandry and Veterinary Medicine Scientific and Technological Innovation in Beijing-Tianjin-Hebei Region. Tianjin: Tianjin Institute of Animal Husbandry and Veterinary Medicine, Beijing Institute of Animal Husbandry and Veterinary Medicine, Hebei Provincial Institute of Animal Science and Veterinary Medicine, 2012: 267-269. (in Chinese) http://d.wanfangdata.com.cn/Conference/7759382 |
| [14] | HIRSCH T, SPIELMANN M, ZUHAILI B, et al. Human beta-defensin-3 promotes wound healing in infected diabetic wounds[J]. J Gene Med, 2009, 11(3): 220–228. DOI: 10.1002/jgm.v11:3 |
| [15] | ELAHI S, BUCHANAN R M, ATTAH-POKU S, et al. The host defense peptide beta-defensin 1 confers protection against Bordetella pertussis in newborn piglets[J]. Infect Immun, 2006, 74(4): 2338–2352. DOI: 10.1128/IAI.74.4.2338-2352.2006 |
| [16] | VELDHUIZEN E J A, KOOMEN I, ULTEE T, et al. Salmonella serovar specific upregulation of porcine defensins 1 and 2 in a jejunal epithelial cell line[J]. Vet Microbiol, 2009, 136(1-2): 69–75. DOI: 10.1016/j.vetmic.2008.09.072 |
| [17] | YANG X, CHENG Y T, TAN M F, et al. Overexpression of porcine beta-defensin 2 enhances resistance to Actinobacillus pleuropneumoniae infection in pigs[J]. Infect Immun, 2015, 83(7): 2836–2843. DOI: 10.1128/IAI.03101-14 |
| [18] | PENG Z X, WANG A R, XIE L Q, et al. Use of recombinant porcine β-defensin 2 as a medicated feed additive for weaned piglets[J]. Sci Rep, 2016, 6: 26790. DOI: 10.1038/srep26790 |
| [19] | TANG Z R, XU L, SHI B S, et al. Oral administration of synthetic porcine beta-defensin-2 improves growth performance and cecal microbial flora and down-regulates the expression of intestinal toll-like receptor-4 and inflammatory cytokines in weaned piglets challenged with enterotoxigenic Escherichia coli[J]. Anim Sci J, 2016, 87(10): 1258–1266. DOI: 10.1111/asj.2016.87.issue-10 |
| [20] | DONNARUMMA G, PAOLETTI I, FUSCO A, et al. β-defensins: work in progress[M]//DONELLI G. Advances in Microbiology, Infectious Diseases and Public Health. Switzerland: Springer International Publishing, 2016, 901: 59-76. |
| [21] | BRUHS A, SCHWARZ T, SCHWARZ A. Prevention and mitigation of experimental autoimmune encephalomyelitis by murine β-defensins via induction of regulatory T cells[J]. J Invest Dermatol, 2016, 136(1): 173–181. DOI: 10.1038/JID.2015.405 |



