沙门菌是一种无芽孢直杆菌,常寄生于人和动物肠道内,由此导致沙门菌病[1]。沙门菌在我国引起的食物中毒居细菌性食物中毒首位[2-3],每年由沙门菌导致的疾病占食源性疾病的70%~80%[4]。沙门菌的危害与毒力基因、血清型以及宿主的身体状况有关。沙门菌血清型众多,约20种血清型能够引发人兽共患病[5]。危害较大的有鼠伤寒、猪霍乱以及肠炎沙门菌。
肠炎沙门菌属于副伤寒沙门菌,该菌会污染家禽肉蛋制品,继而会导致人类因为消费污染的食品,发生呕吐及腹泻反应等胃肠道疾病[6-7]。
沙门菌的宿主广泛,生物媒介引起沙门菌的广泛传播。英国对产蛋鸡场相关的研究发现,母鸡、鸡蛋、野生动物媒介、小鼠等均能分离到肠炎沙门菌[8]。在产蛋禽上小鼠是肠炎沙门菌传播的重要媒介[9],一粒鼠粪球含有105CFU肠炎沙门菌[10]。无脊椎动物及昆虫也会在体外或者体内携带沙门菌,如蝇、蟑螂和蜈蚣等[11-13]。沙门菌能在鸡群内或者鸡群之间传播,感染的鸡与未感染的鸡相邻饲养,在未感染的鸡粪便和内脏检测到肠炎沙门菌[14-15]。因此研究该菌的生物学特性和传播途径对于有效防治肠炎沙门菌的感染、控制沙门菌的传播具有重要的意义。
本研究以肠炎沙门菌SDBL-1分离株为对象探究其生物学特性,通过人工感染6周的SPF鸡探究其传播途径,为研究肠炎沙门菌的致病机制及防控等方面提供一定借鉴。
1 材料与方法 1.1 细菌S.enteritidis分离株来源于2015年山东泰安地区AA肉鸡脏器,经过前增菌、增菌、鉴别培养基分离、PCR鉴定、血清分型为肠炎沙门菌,命名为SDBL-1。
1.2 主要试剂缓冲蛋白胨水(BPW)、木糖赖氨酸脱氧胆盐琼脂(XLD)购自青岛高科园海博生物技术有限公司;亚硒酸盐胱氨酸增菌液培养基(SC)购自北京奥博星生物技术有限公司;鸡外周血淋巴细胞分离液kit购自天津市灏洋生物制品科技有限公司,PE-anti-CD4抗体、FITC-anti-CD8a抗体、SPRD-anti-CD3抗体购自SouthernBiotech公司。
1.3 肠炎沙门菌SDBL-1分离株生物学特性探究 1.3.1 半数致死量(LD50)的测定将冻存的SDBL-1分离株复苏培养后分别接种30只4日龄的SPF鸡,设置6个剂量梯度(1.07×104~1.07×109CFU·mL-1),每个梯度接种5只SPF鸡,分别胸肌注射500 μL,攻毒后观察1周并统计死亡数据,将死亡的雏鸡取脏器分离沙门菌,按照改良寇氏法计算LD50。
接种30只SPF级的小鼠,设置6个剂量梯度(3.69×104~3.69×109 CFU·mL-1),每个梯度接种5只小鼠,分别腹腔注射200 μL,攻毒后观察2周并统计死亡数据,将死亡的小鼠去脏器分离沙门菌,按照改良寇氏法计算LD50。
1.3.2 生长曲线的测定对SDBL-1分离株进行生长曲线的测定,将SDBL-1分离株加入15 mL LB液体培养基中,调节使其终浓度为105 CFU·mL-1(OD600 nm=0.05),37 ℃、180 r·min-1振荡培养;连续培养24 h,每隔2 h测定培养物OD600 nm值,并绘制细菌生长曲线,观察其生长速度。
1.3.3 药敏试验的测定挑选SDBL-1分离株纯菌落3~4菌落置于灭菌0.9%氯化钠中,制成菌悬液。经与浊度管(0.5麦氏单位比浊管)比较,浊度一致。取100 μL均匀涂布于LB固体平皿上。用纸片琼脂扩散法(K-B法),按使用说明书将平板于35 ℃孵育15 min,然后倒置培养16~18 h取出。培养后取出平板,测量抑菌圈的直径,重复3次试验求平均值。
1.3.4 毒力因子的测定参照相关文献发表的沙门菌hilA、hilC、hilD、sopB、sopD、sopE2、sipA、sipC、avrA、sptP毒力基因序列[3],设计10对沙门菌毒力基因扩增引物。以SDBL-1分离株的DNA为模板,利用10对毒力基因引物进行毒力基因检测。反应体系为25 μL:2×Taq Master Mix 12.5 μL,上游引物0.5 μL,下游引物0.5 μL,ddH2O 9.5 μL,模板1 μL。反应条件:95 ℃预变性5 min,94 ℃ 30 s,Tm[3]退火30 s,72 ℃ 30 s,30个循环。
1.4 SDBL-1分离株传播途径试验试验选取6周龄SPF公鸡24只,随机分为3组:感染组(Infection)、空气传播组(Airborne transmission)、对照组(Control),每组8只。感染组每只灌服7.09×109CFU·mL-1肠炎沙门菌0.5 mL,空气传播组和对照组灌服等量的0.9%生理盐水。感染组与空气传播组之间水平隔开且水料不接触,对照组饲喂在另一间动物房。
1.4.1 空气传播组体重变化分别在灌服SDBL-1分离株后的2~20 d,每隔2 d称量感染组、空气传播组、对照组的体重,统计各组体重并分析。
1.4.2 空气传播组血液指标变化分别在灌服SDBL-1分离株后的2~20 d,每隔2 d无菌采集感染组、空气传播组、对照组EDTA抗凝血,用全自动动物血细胞分析仪测定血液常规指标(白细胞总数、淋巴细胞比率、中间细胞比率、粒细胞比率等)并分析。
1.4.3 空气传播组淋巴细胞亚群变化分别在灌服SDBL-1分离株后的2~20 d,每隔2 d采集1 mL肝素纳抗凝血,按照使用说明书使用外周淋巴细胞分离液分离外周血中单个核细胞(peripheral blood mononuclear cell,PMBC),将PMBCs用PE-anti-CD4抗体、FITC-anti-CD8a抗体、SPRD-anti-CD3抗体4 ℃避光孵育20 min,PBS洗涤后,流式细胞仪分析CD4+、CD8+的数量和比例。
1.4.4 空气传播组脏器及免疫器官影响灌服SDBL-1分离株后21 d,称量鸡体重后剖杀空气传播组、对照组两组,采集心、肝、脾、胸腺、法氏囊并称重,计算各器官指数(器官质量/体重)并分析。
1.4.5 空气传播组鸡排毒规律在灌服SDBL-1分离株后的2~20 d,每隔2 d采集空气传播组鸡粪便,同时采集感染组、对照组,进行沙门菌的分离鉴定,统计结果并分析。
1.4.6 空气传播组不同材料沙门菌分离规律在灌服SDBL-1分离株后2~20 d,每隔2 d采集空气传播组鸡的口腔拭子、泄殖腔拭子、羽毛囊进行沙门菌的分离鉴定,统计结果并分析。
1.4.7 空气传播组不同脏器沙门菌分离规律在灌服SDBL-1分离株后21 d,剖检空气传播组的鸡,采集心、脾等脏器分离沙门菌,统计结果并分析。
1.4.8 饲料、饮水等沙门菌分离规律灌服SDBL-1分离株后,在10~34 d采集水线乳头水和饲料样品,在34 d采集羽毛样品,在9、15、28~34 d采集蚊蝇样品,分离、鉴定沙门菌,统计结果并分析。
1.4.9 空气传播组抗体产生规律在灌服SDBL-1分离株后的2~20 d每隔2 d采集空气传播组、感染组和对照组血液样品并分离血清,用自制的肠炎沙门菌诊断抗原测定血清中的肠炎沙门菌抗体。
2 结果 2.1 肠炎沙门菌SDBL-1分离株生物学特性探究 2.1.1 半数致死量(LD50)测定结果SDBL-1分离株对小鸡的致病性,原液组死亡2只,其余各组均无死亡,从死亡的鸡中分离得到肠炎沙门菌。根据寇氏改良法测定肠炎沙门菌SDBL-1分离株对雏鸡LD50为1.905×109CFU。
SDBL-1分离株对小鼠的致病性,原液组死亡5只,10-1稀释度(3.69×108CFU·mL-1)死亡3只,10-2稀释度(3.69×107 CFU·mL-1)死亡1只,其余各组均无死亡,从死亡的小鼠中分离得到肠炎沙门菌。根据寇氏改良法测定肠炎沙门菌SDBL-1分离株对小鼠LD50为1.84×108CFU。
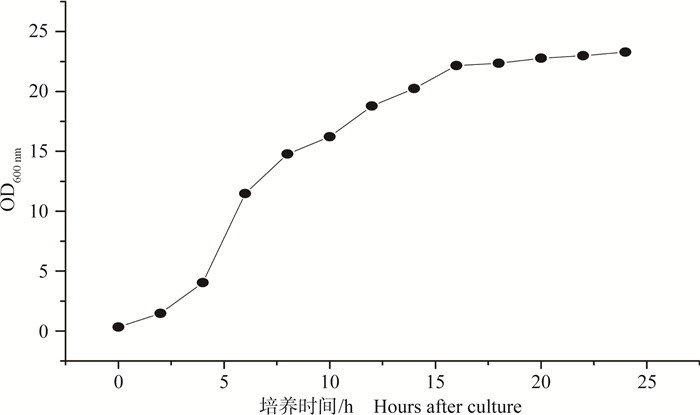
2.1.2 生长曲线的测定结果SDBL-1分离株的初始浓度为5×105 CFU·mL-1,其生长曲线如图 1。
|
图 1 分离株的生长曲线 Figure 1 Growth curve of Salmonella enteritidis SDBL-1 |
测定SDBL-1分离株的耐药性,SDBL-1分离株对苯唑西林、卡那霉素、红霉素、麦迪霉素、呋喃妥因、万古霉素、克拉霉素、克林霉素耐药(药敏圈直径在7~13 mm)。
2.1.4 毒力基因测定结果测定SDBL-1分离株的毒力基因,SDBL-1分离株含有毒力基因sopE2、sopB、hilD、sptP、sipC、hilA、hilC、avrA、sopD、sipA。
2.2 SDBL-1分离株传播途径 2.2.1 SDBL-1分离株对SPF鸡体重的影响在灌服SDBL-1分离株后2~20 d,空气传播组、感染组、对照组之间的鸡体重差异不显著(P > 0.05)。
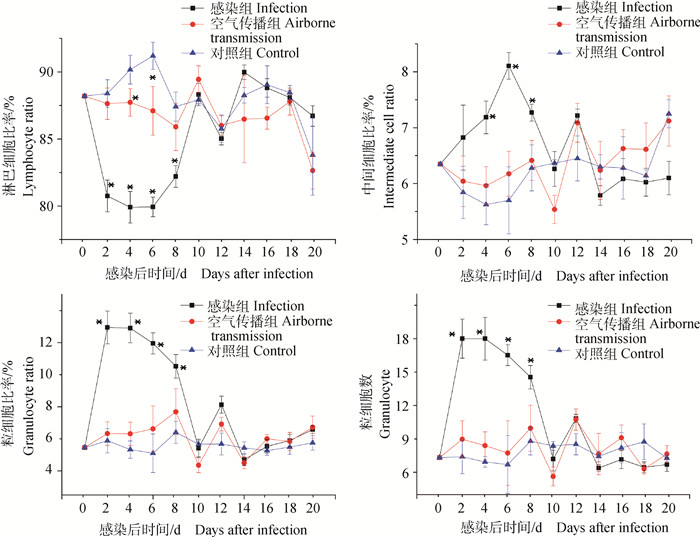
2.2.2 SDBL-1分离株对空气传播组鸡血液指标的影响结果见图 2。与对照组相比,空气传播组淋巴细胞比率在2~8 d下降,而粒细胞比率、粒细胞数量以及中间细胞比率在2~8 d上升;感染组在2~8 d淋巴细胞比率显著下降(P < 0.05),粒细胞比率、粒细胞数量显著上升(P < 0.05),中间细胞比率在4~8 d显著上升(P < 0.05)。
|
与对照组相比,*.P < 0.05 Compared with control group, *.P < 0.05 图 2 SDBL-1分离株对SPF鸡血液指标的影响 Figure 2 Effect of SDBL-1 on blood indexes of SPF chicken |
灌服SDBL-1分离株后,空气传播组、感染组、对照组血液常规指标中白细胞总数、红细胞总数、血红蛋白、红细胞压积、红细胞平均体积、血红蛋白含量、血红蛋白浓度、红细胞分布宽度SD、红细胞分布宽度CV、血小板总数、血小板平均体积、血小板分布宽度、血小板压积、血小板大细胞比率各组之间差异不显著(P > 0.05)。
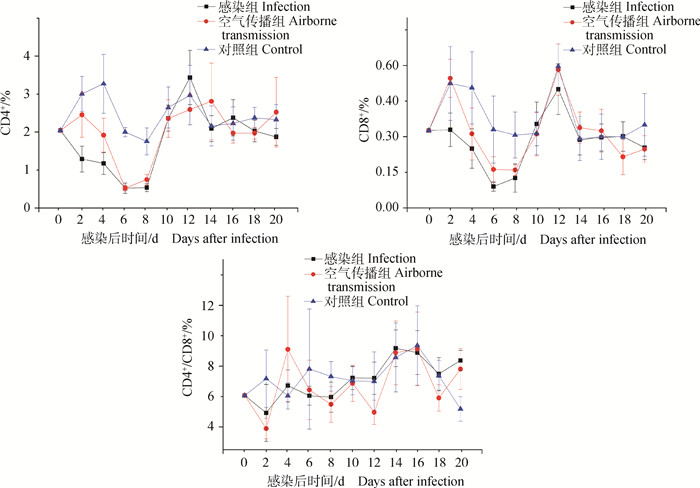
2.2.3 SDBL-1分离株对SPF鸡淋巴细胞亚群影响的结果结果见图 3。空气传播组的淋巴细胞亚群CD4+含量在4 d时开始下降,在6 d达到最低,然后上升, 在12~14 d达到最高。感染组的淋巴细胞亚群CD4+比例在2 d时开始下降,在6 d达到最低;然后上升,在12 d达到最高。与感染组相比,空气传播组的淋巴细胞亚群CD4+比例下降趋势出现晚2 d。
|
图 3 SDBL-1分离株对SPF鸡淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的影响 Figure 3 Effect of SDBL-1 on CD4+, CD8+, CD4+/CD8+ proportion of SPF chicken |
空气传播组和感染组灌服SDBL-1分离株后2 d,CD8+比例出现上升,在4 d开始下降。在8 d时空气传播组CD8+比例达到最低,在6 d时感染组CD8+比例达到最低;随后两组CD8+比例逐渐上升,在12 d时,两组CD8+比例达到最高,14~20 d呈现波动趋势。
空气传播组、感染组在灌服SDBL-1分离株后2~8 d(除4 d)的CD4+/CD8+比例低于对照组,在灌服后10~20 d,感染组、空气传播组CD4+/CD8+比例与对照组接近。
2.2.4 SDBL-1分离株感染对空气传播组脏器的影响与对照组相比,空气传播组胸腺指数显著小于对照组(P < 0.05),法氏囊指数有差异但不显著,肝指数显著大于对照组(P < 0.05),脾指数也大于对照组,差异不显著(表 1)。
|
|
表 1 SDBL-1分离株对空气传播组鸡脏器的影响(x±s) Table 1 Effect of SDBL-1 on the organs of chickens in airborne transmission group (x±s) |
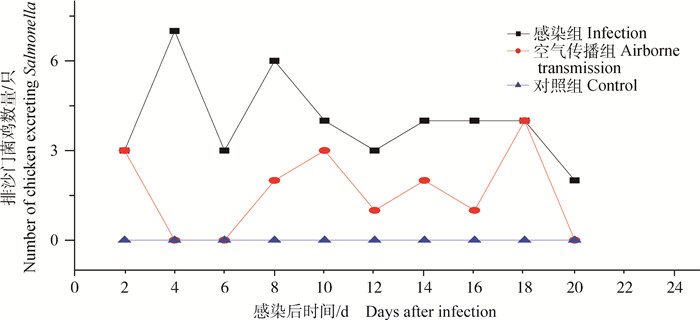
灌服SDBL-1分离株后,空气传播组和感染组的粪便均分离出沙门菌,感染组2~20 d粪便持续分离出沙门菌,空气传播组在2、8~18 d分离到沙门菌(图 4)。
|
图 4 SDBL-1感染后不同组鸡粪便排出沙门菌结果 Figure 4 The results of Salmonella excretion in different groups |
空气传播组粪便在2、8~18 d分离到沙门菌;口腔拭子在4~8 d分离到沙门菌;羽毛囊在6、12 d分离到沙门菌;泄殖腔拭子10、12、20 d分离到沙门菌(图 5)。不同材料的沙门菌的分离结果不同,不同材料之间不能相互替代。
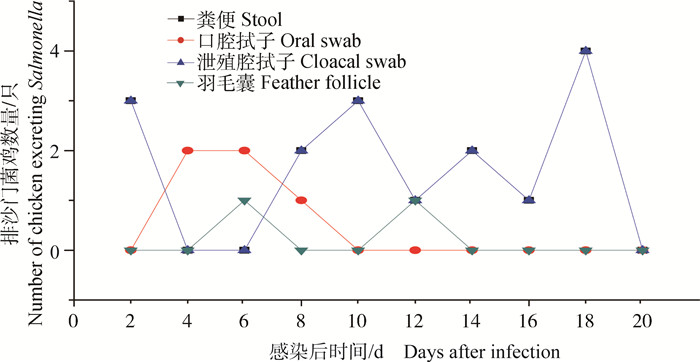
|
图 5 空气传播组不同材料沙门菌分离结果 Figure 5 The results Salmonella isolated from different materials in airborne transmission group |
灌服SDBL-1后21 d,剖检空气传播组共8只鸡,采集心、脾等脏器分离沙门菌,结果显示,沙门菌在食道分离率最高,为37.5%,而心、腺胃、十二指肠、胸腺没有分离到沙门菌。
2.2.8 饲料、饮水等沙门菌分离结果灌服SDBL-1分离株后,在水线乳头、饲料中分离到沙门菌(10~34 d,共计11次),其阳性率分别为14.0%、4.7%(表 2)。但在羽毛(人工感染后34 d)、蚊蝇中(人工感染试验后9、15、28~34 d,共计6次)并没有分离出沙门菌。
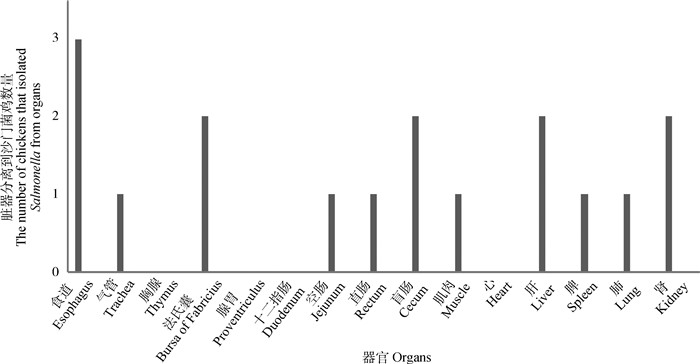
|
图 6 空气传播组不同脏器沙门菌分离结果 Figure 6 The results Salmonella isolated from different organs in airborne transmission group |
|
|
表 2 饲料、饮水等沙门菌分离结果 Table 2 The results Salmonella isolated from feed and drink water |
灌服SDBL-1分离株后4 d,感染组、空气传播组血清中出现沙门菌抗体;在灌服SDBL-1分离株8 d,感染组所有鸡血清为沙门菌抗体阳性,而空气传播组在14 d所有鸡沙门菌抗体阳性(表 3)。
|
|
表 3 SDBL-1分离株感染后不同组鸡的抗体产生规律 Table 3 Antibody production of SDBL-1 infected with different groups of chickens |
随着家禽养殖业的发展、养殖水平提高,引起消费者的消费方式以及营养需求的改变,禽产品成为人类动物蛋白质的主要来源,禽肉和蛋的消费大幅度提高,而禽产品易受沙门菌的污染,因此控制沙门菌感染具有重要的公共卫生和经济意义。
沙门菌感染可引起禽类各种急性和慢性疾病,许多国家对被感染禽和禽产品采取有效的检测计划。但随着现代家禽养殖业规模的扩大,沙门菌的传播更加复杂。空气介导的沙门菌传播是禽舍沙门菌传播的潜在途径[16];相关研究发现1 d平养鸡口服肠炎沙门菌后,鸡舍空气样品呈现沙门菌阳性[17];对5个商品蛋鸡舍内外空气进行采样,检测均为沙门菌阳性[18]。
本研究通过对比空气传播组、感染组与对照组各项指标来证明肠炎沙门菌可以通过空气传播引起空气传播组感染。
空气传播组体重指标与感染组、对照组没有明显差异;空气传播组淋巴细胞比率出现先下降后上升,粒细胞数量、粒细胞比率出现先上升后下降趋势,其趋势与感染组相同。鸡和火鸡的异嗜细胞对沙门菌具有很强的吞噬和杀菌能力[19],异嗜细胞在早期肠炎沙门菌对器官的侵袭有很强的限制作用[20]。但雏鸡发生沙门菌感染时,能引起淋巴细胞缺失。
空气传播组的淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的比例与感染组的趋势相同,CD4+比例、CD8+比例呈先下降后上升的趋势,但与感染组相比,趋势出现延迟。相关文献报道在产蛋鸡感染肠炎沙门菌后的第二周B淋巴细胞和T淋巴细胞出现增殖[21],这与本试验的趋势相一致。CD4+/CD8+比例在2~8 d(除4 d)低于对照组,在10~20 d与对照组接近。
对空气传播组进行剖检,脏器沙门菌分离显示在大部分脏器分离到沙门菌(包括脾、肺、肝等)。肝显著增大,而胸腺显著萎缩。相关研究发现蛋鸡口服肠炎沙门菌后仅1 h即可从内脏中分离到该菌[22]。产蛋母鸡口服肠炎沙门菌可以从肝、脾、卵巢、输卵管、心以及腹膜等多个器官分离到该菌[15, 23],沙门菌也能侵嗜小鼠多个脏器[24]。感染沙门菌能引起淋巴细胞的缺失、淋巴器官的萎缩和免疫抑制[25]。
空气传播组在2、8~18 d分离到沙门菌,且口腔拭子、泄殖腔拭子以及羽毛囊均分离到沙门菌,饲料、饮水分离到沙门菌,但羽毛、蚊蝇中未分离到沙门菌。相关研究发现,肠炎沙门菌感染成年家禽主要是阴性感染,并不表现明显的临床症状,但是肠炎沙门菌会长时间定居于家禽的肠道和生殖道,并且会持续排毒,定居于生殖道的肠炎沙门菌会污染禽蛋产品,危害严重[26]。
本试验空气传播组在4 d血清抗体开始呈现阳性,在14 d时,所有鸡表现为抗体阳性。灌服肠炎沙门菌7 d后,大部分鸡产生血清抗体,14 d后抗体浓度达到峰值[27-28]。
本研究探究了肠炎沙门菌的生物学特性和传播途径,有助于了解其传播和流行的特点,预防该病的发生和流行提供依据。
4 结论SDBL-1分离株能通过空气传播并引起鸡的感染,导致机体炎症反应,造成免疫功能紊乱和器官不同程度损伤;感染鸡通过粪便、口腔、泄殖腔间歇性排毒,环境拭子(如料槽中的饲料、水线)可分离到沙门菌。
| [1] |
陆承平.
兽医微生物学[M]. 北京: 中国农业出版社, 2001.
LU C P. Veterinary microbiology[M]. Beijing: China Agriculture Press, 2001. (in Chinese) |
| [2] |
吕世明, 陈杖榴, 陈建新, 等. 应用PCR快速检测食品中沙门氏杆菌方法的研究[J]. 食品科学, 2006, 27(12): 607–611.
LÜ S M, CHEN Z L, CHEN J X, et al. Study on the PCR method of rapid detection to Salmonella in food samples[J]. Food Science, 2006, 27(12): 607–611. DOI: 10.3321/j.issn:1002-6630.2006.12.153 (in Chinese) |
| [3] |
田质高. 蛋源沙门氏菌毒力岛的检测及标志基因的研究[D]. 扬州: 扬州大学, 2009: 28-30.
TIAN Z G. Detection of Salmonella typhimurium and its marker gene[D]. Yangzhou: Yangzhou University, 2009: 28-30. (in Chinese) http://d.wanfangdata.com.cn/Thesis_Y1701723.aspx |
| [4] |
杨保伟, 申进玲, 席美丽, 等. 2007-2008年西安地区鸡肉源沙门氏菌相关特性分析[J]. 食品科学, 2011, 32(19): 130–136.
YANG B W, SHEN J L, XI M L, et al. Antibacterial susceptibility and subtypes of Salmonella isolates from retail chicken in Xi'an in 2007-2008[J]. Food Science, 2011, 32(19): 130–136. (in Chinese) |
| [5] |
黄凯, 陈素娟, 黄骏, 等. 动物源性沙门氏菌的耐药性分析及氟苯尼考类耐药基因的鉴定[J]. 中国畜牧兽医, 2015, 42(2): 459–466.
HUANG K, CHEN S J, HUANG J, et al. Analysis of antibiotic resistance of Salmonella isolated from animals and identification of its florfenicol resistant gene[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(2): 459–466. (in Chinese) |
| [6] | BARUA H, BISWAS P K, TALUKDER K A, et al. Poultry as a possible source of non-typhoidal Salmonella enterica serovars in humans in Bangladesh[J]. Vet Microbiol, 2014, 168(2-4): 372–380. DOI: 10.1016/j.vetmic.2013.11.020 |
| [7] | GUARD-PETTER J. The chicken, the egg and Salmonella enteritidis[J]. Environ Microbiol, 2001, 3(7): 421–430. DOI: 10.1046/j.1462-2920.2001.00213.x |
| [8] | LIEBANA E, GARCIA-MIGURA L, CLOUTING C, et al. Molecular fingerprinting evidence of the contribution of wildlife vectors in the maintenance of Salmonella enteritidis in layer farms[J]. J Appl Microbiol, 2003, 94(6): 1024–1029. DOI: 10.1046/j.1365-2672.2003.01924.x |
| [9] | SCHLOSSER W D, HENZLER D J, MASON J, et al. Salmonella enterica serovar enteritidis pilot project[M]//SAEED A M G R, POTTER M E, WALL P G. Salmonella enterica Serovar enteritidis in Humans and Animals: Epidemiology, Pathogenesis and Control. Ames, Iowa: Iowa State University Press, 1999: 353-365. |
| [10] | HENZLER D J, OPITZ H M. The role of mice in the epizootiology of Salmonella enteritidis infection on chicken layer farms[J]. Avian Dis, 1992, 36(3): 625–631. DOI: 10.2307/1591757 |
| [11] | OLSEN A R, HAMMACK T S. Isolation of Salmonella spp. from the housefly, Musca domestica L., and the dump fly, Hydrotaea aenescens (Wiedemann) (Diptera: Muscidae), at caged-layer houses[J]. J Food Protect, 2000, 63(7): 958–960. DOI: 10.4315/0362-028X-63.7.958 |
| [12] | KOPANIC R J Jr, SHELDON B W, WRIGHT C G. Cockroaches as vectors of Salmonella: laboratory and field trials[J]. J Food Protect, 1994, 57(2): 125–135. DOI: 10.4315/0362-028X-57.2.125 |
| [13] | DAVIES R H, BRESLIN M. Persistence of Salmonella enteritidis phage type 4 in the environment and arthropod vectors on an empty free-range chicken farm[J]. Environ Microbiol, 2003, 5(2): 79–84. DOI: 10.1046/j.1462-2920.2003.00387.x |
| [14] | GAST R K, BEARD C W. Production of Salmonella enteritidis-contaminated eggs by experimentally infected hens[J]. Avian Dis, 1990, 34(2): 438–446. DOI: 10.2307/1591433 |
| [15] | GAST R K, BEARD C W. Isolation of Salmonella enteritidis from internal organs of experimentally infected hens[J]. Avian Dis, 1990, 34(4): 991–993. DOI: 10.2307/1591394 |
| [16] |
蔡蕊. 利用空气负离子减少鸡肠炎沙门氏菌空气传播的试验[J]. 中国禽业导刊, 1999(20): 23.
CAI R. Effect of air negative ion on airborne propagation of Salmonella enteritis[J]. Guide to Chinese Poultry, 1999(20): 23. (in Chinese) |
| [17] | HOLT P S, MITCHELL B W, GAST R K. Airborne horizontal transmission of Salmonella enteritidis in molted laying chickens[J]. Avian Dis, 1998, 42(1): 45–52. DOI: 10.2307/1592575 |
| [18] | ROSE N, BEAUDEAU F, DROUIN P, et al. Risk factors for Salmonella enterica subsp. enterica contamination in French broiler-chicken flocks at the end of the rearing period[J]. Prevent Vet Med, 1999, 39(4): 265–277. DOI: 10.1016/S0167-5877(99)00002-1 |
| [19] | STABLER J G, MCCORMICK T W, POWELL K C, et al. Avian heterophils and monocytes: phagocytic and bactericidal activities against Salmonella enteritidis[J]. Vet Microbiol, 1994, 38(4): 293–305. DOI: 10.1016/0378-1135(94)90148-1 |
| [20] | KOGUT M H, TELLEZ G I, MCGRUDER E D, et al. Heterophils are decisive components in the early responses of chickens to Salmonella enteritidis infections[J]. Microb Pathog, 1994, 16(2): 141–151. DOI: 10.1006/mpat.1994.1015 |
| [21] | HENDERSON S C, BOUNOUS D I, LEE M D. Early events in the pathogenesis of avian salmonellosis[J]. Infect Immun, 1999, 67(7): 3580–3586. |
| [22] | HENNESSY T W, HEDBERG C W, SLUTSKER L, et al. A national outbreak of Salmonella enteritidis infections from ice cream[J]. New Engl Med, 1996, 334(20): 1281–1286. DOI: 10.1056/NEJM199605163342001 |
| [23] | HUMPHREY T J, BASKERVILLE A, WHITEHEAD A, et al. Influence of feeding patterns on the artificial infection of laying hens with Salmonella enteritidis phage type 4[J]. Vet Rec, 1993, 132(16): 407–409. DOI: 10.1136/vr.132.16.407 |
| [24] |
罗薇, 冉丹丹, 陈冬平, 等. 天鹅源丙型副伤寒沙门菌感染实验小鼠的组织病理学及抗原分布[J]. 畜牧兽医学报, 2016, 47(8): 1667–1675.
LUO W, RAN D D, CHEN D P, et al. Histopathology and antigen distribution in the mice infected with Salmonella paratyphi C separated from swan[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8): 1667–1675. (in Chinese) |
| [25] | TIMONEY J F, SHIVAPRASAD H L, BAKER R C, et al. Egg transmission after infection of hens with Salmonella enteritidis phage type 4[J]. Vet Rec, 1989, 125(24): 600–601. |
| [26] |
塞夫. 禽病学[M]. 12版. 苏敬良, 高福, 索勋, 译. 北京: 中国农业出版社, 2012: 129-151.
SAIF Y M. Diseases of poultry[M]. 12th ed. SU J L, GAO F, SUO X, Trans. Beijing: China Agriculture Press, 2012: 129-151. (in Chinese) |
| [27] | GAST R K, BEARD C W. Serological detection of experimental Salmonella enteritidis infections in laying hens[J]. Avian Dis, 1990, 34(3): 721–728. DOI: 10.2307/1591270 |
| [28] | GAST R K, HOLT P S. The relationship between the magnitude of the specific antibody response to experimental Salmonella enteritidis infection in laying hens and their production of contaminated eggs[J]. Avian Dis, 2001, 45(2): 425–431. DOI: 10.2307/1592982 |



