2. 云南省畜牧兽医科学院, 昆明 650224
2. Yunnan Animal Science and Veterinary Institute, Kunming 650224, China
蓝舌病(bluetongue, BT)是由蓝舌病病毒(bluetongue virus, BTV)引起,经雄性库蠓通过吸血叮咬传播的虫媒病毒病,18世纪首次在南非好望角发现,1902年首次报道此病。蓝舌病分布于全世界热带、亚热带和温带地区,是世界动物卫生组织(OIE)规定的必须通报的动物传染病[1]。该病造成严重的经济损失[2-3],全世界每年因蓝舌病造成的损失在30亿美元以上[4-5]。蓝舌病病毒呈二十面体对称,无囊膜,由10条双链RNA组成,编码7种结构蛋白(VP1~VP7) 和5种非结构蛋白(NS1~NS3、NS3A、NS4)[6-8]。VP7蛋白由S7基因编码,是BTV内衣壳的主要结构蛋白,具有群特异性抗原决定位点,不同血清型BTV的VP7蛋白氨基酸序列的相似性可达94%以上[9]。BTV的外层衣壳蛋白VP2由基因节段Seg2编码,诱导BTV特异性中和抗体的产生,是BTV血清型特异性的主要决定因素[10]。VP2蛋白高度变异,其氨基酸序列在不同血清型毒株间的差异在22.7%(BTV-4与BTV-20)~72.9%(BTV-6与BTV-22) 之间。目前,世界已发现的BTV共有27个血清型(BTV-1至BTV-27),其中BTV-25至BTV-27分别是2008年从瑞士山羊[11]、2011年从科威特的绵羊[12]以及2014年从法国科西嘉的山羊[13-15]中分离到的新血清型。不同血清型毒株之间缺乏有效的交叉免疫保护,给BT的防控带来了严峻的挑战。
我国于1979年首次在云南分离到BTV[16],后来各地陆续分离到此病毒,已分离到的BTV血清型是1、2、3、4、12、15和16型,其中1型和16型为优势血清型[17-19]。本课题组从所采集的牛血液样品中检测到BTV核酸阳性,由细胞培养分离到病毒,经RT-PCR、电镜观察以及对VP2、VP7基因进行测序和进化分析、中和试验,结果表明分离毒株为BTV-7型,将其命名为GD/ST2014,这是国内首次报道分离的血清型7型BTV。
1 材料与方法 1.1 材料本课题组选择广东某一奶牛场作为BTV监控点,投放BTV抗原及抗体阴性的10头1岁以下小牛作为监控动物,每周定期采血,监测BTV抗原抗体转阳情况,在监控期间,牛群曾出现轻微发热,精神沉郁,随后自行康复。共采集130份血液样品,每份血样包括全血、EDTA-K2抗凝血和肝素钠抗凝血,抗凝血于4 ℃保存;9~11日龄健康鸡胚购自广东省农业科学院动物科学研究所;C6/36细胞和BHK-21细胞由云南省畜牧兽医科学院提供;中和试验所用的BTV 24个血清型国际参考毒株和24个血清型标准阳性血清由云南省畜牧兽医科学院保存。免疫荧光反应所用的豚鼠抗BTV-7型参考毒株多克隆抗体由云南省畜牧兽医科学院制备。FITC标记的羊抗鼠IgG抗体购自Abcam公司。
MEM培养基购自GIBCO公司;新生牛血清购自Hyclone公司;E. coli DH5α感受态细胞、DNA胶回收试剂盒购自天根公司;病毒RNA提取试剂盒、PrimeScript One Step RT-PCR试剂盒、Premix Ex Taq、pMD-18 T Vector、DNA Marker(DL2000) 均购自TaKaRa公司;琼脂糖购自Promega公司。
引物:根据OIE推荐的BTV检测方法,采用引物扩增NS1蛋白基因,BTV-M6-A/BTV-M6-B为第一次RT-PCR引物(扩增NS1基因中272碱基),BTV-M6-C/BTV-M6-D为套式PCR引物(扩增NS1基因中101碱基),引物序列如下,BTV-M6-A:5′-GTTCTCTAGTTGGCAACCACC-3′;BTV-M6-B:5′-CCCGATCATACATTGCTTCCT-3′;BTV-M6-C:5′-GCAGCATTTTGAGAGAGCGA-3′;BTV-M6-D:5′-CCCGATCATACATTGCTTCCT-3′。根据BTV较为保守的VP7基因片段设计一对特异性引物,引物序列如下,BTV-S7-A:5′-GTAAGTGTAATCTAAGAGA-3′;BTV-S7-B:5′-GTAAGTTTAAATCGCAAGACG-3′,预期扩增片段长度为1 156 bp,引物均由上海英骏生物技术有限公司合成。
1.2 方法 1.2.1 病原核酸检测扩增BTV之NS1蛋白基因,取待检EDTA-K2抗凝血1 mL,1 000 r·min-1离心10 min,弃上清;加入1 mL PBS重悬,1 000 r·min-1离心10 min,弃上清;重新加入1 mL RNase-free ddH2O,剧烈振荡以裂解红细胞,取此红细胞裂解液200 μL,用病毒RNA提取试剂盒提取RNA。所提取的RNA 5 μL,于PCR仪中95 ℃变性5 min,取出置冰上。RT-PCR扩增采用25 μL体系,其中RNA 5 μL,2×1 Step Buffer (Dye plus) 12.5 μL,PrimeScript 1 Step Enzyme Mix 1 μL,引物BTV-S6-A/BTV-S6-B各0.5 μL,RNase Free dH2O 5.5 μL。反应程序:45 ℃反转录40 min;94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环,最后72 ℃延伸5 min。取此PCR产物再进行套式PCR扩增,采用25 μL体系:RT-PCR产物1 μL,Premix Ex Taq Ver.2 (longing Dye Mix) 12.5 μL,引物BTV-S6-C/BTV-S6-D各0.5 μL,RNase Free dH2O 10.5 μL。反应程序:94 ℃预变性1 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 20 s,40个循环,最后72 ℃延伸5 min。琼脂糖凝胶电泳检测目的条带。
1.2.2 病毒分离套式PCR检测BTV核酸阳性的动物,取其相应的肝素钠抗凝血100 μL,加入1 mL PBS溶液混匀,1 000 r·min-1离心10 min,弃上清;加入900 μL灭菌双蒸水,涡旋混匀,使红细胞完全裂解,取此红细胞裂解液静脉接种10日龄健康鸡胚,0.1 mL·胚-1,35 ℃孵化箱培养,废弃接种后24 h内死亡的鸡胚,收获24~120 h死亡鸡胚的肝,每个鸡胚加0.9 mL MEM培养液研磨,2 000 r·min-1离心10 min,取上清液接种于长成单层的C6/36细胞瓶,按200 μL·25 cm-2接种,28 ℃ CO2培养箱培养7 d,收获,转接长成单层的BHK-21细胞,37 ℃ CO2培养箱培养7 d,连续盲传3代,观察细胞病变(CPE)。
1.2.3 分离毒株VP7基因的RT-PCR扩增、克隆、测序出现CPE的细胞液,提取RNA,并于95 ℃ 5 min进行双链RNA变性。采取RT-PCR扩增VP7基因,RT-PCR用25 μL体系:变性RNA 5 μL,RNase Free dH2O 5.5 μL,2×1 Step Buffer (Dye plus) 12.5 μL,PrimeScript 1 Step Enzyme Mix 1 μL,引物BTV-S7-A/BTV-S7-B各0.5 μL。RT-PCR反应程序:45 ℃反转录40 min;94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,40个循环,最后72 ℃延伸5 min。琼脂糖凝胶电泳检测目的条带,回收RT-PCR产物,连接至pMD18-T载体,转化E. coli DH5α感受态细胞,阳性克隆菌由上海英骏生物技术有限公司进行测序。
1.2.4 间接免疫荧光反应检测待检毒株接种12孔板BHK-21,并设空白对照细胞,培养72 h出现CPE,弃培养液,PBS洗涤;用预冷的甲醇、丙酮混合液(1:1),室温固定20 min,PBS洗涤;用5%脱脂奶于37 ℃封闭1 h;弃掉封闭液,加入100 μL 40倍稀释的BTV-7多克隆抗体,37 ℃孵育1 h,洗涤;加入100 μL 50倍稀释的FITC标记的羊抗鼠抗体,37 ℃孵育45 min,弃掉二抗,蒸馏水洗涤,于荧光显微镜下观察。
1.2.5 电镜观察将第3代病毒感染BHK-21细胞,收获病毒培养液100 mL,8 000×g离心30 min,去除细胞碎片,上清液经60 000×g超速离心2 h,沉淀用PBS溶解过夜,加样于铜网上,磷钨酸负染后电镜观察病毒粒子。
1.2.6 血清型鉴定蓝舌病病毒VP2基因决定病毒的血清型,扩增VP2基因,并进行系统发育树分析。由于Seg2序列在同一血清型之间仍然存在较大的序列差异(30%),因此根据Western地域型BTV设计的BTV血清型鉴定引物往往无法进行同一个血清型Eastern毒株的Seg2的有效扩增,故而中和试验作为经典的定型方法一直在使用。分离毒株在BHK-21细胞上连续传3代后,与24个血清型的标准阳性血清进行中和试验鉴定血清型。中和试验是采用固定病毒稀释血清的方法:先将24个血清型的阳性血清以1:32稀释度与100 TCID50的待鉴定病毒进行初筛,结果显示,只有BTV-7与BTV-19的阳性血清在1:32的稀释度,仍可以使接种细胞不产生细胞病变(BTV-7与BTV-19在血清学上有一定的交叉性)。然后再将BTV-7与BTV-19阳性血清继续做2倍梯度稀释,与100 TCID50病毒进行中和,结果显示,BTV-19阳性血清在1:64还能中和病毒,到了1:128就无法中和病毒了;而BTV-7阳性血清,在1:128、1:256倍稀释仍能有效中和病毒,不出现细胞病变,BTV-7阳性血清的中和效价明显高于BTV-19,因此认为分离病毒为BTV-7型。
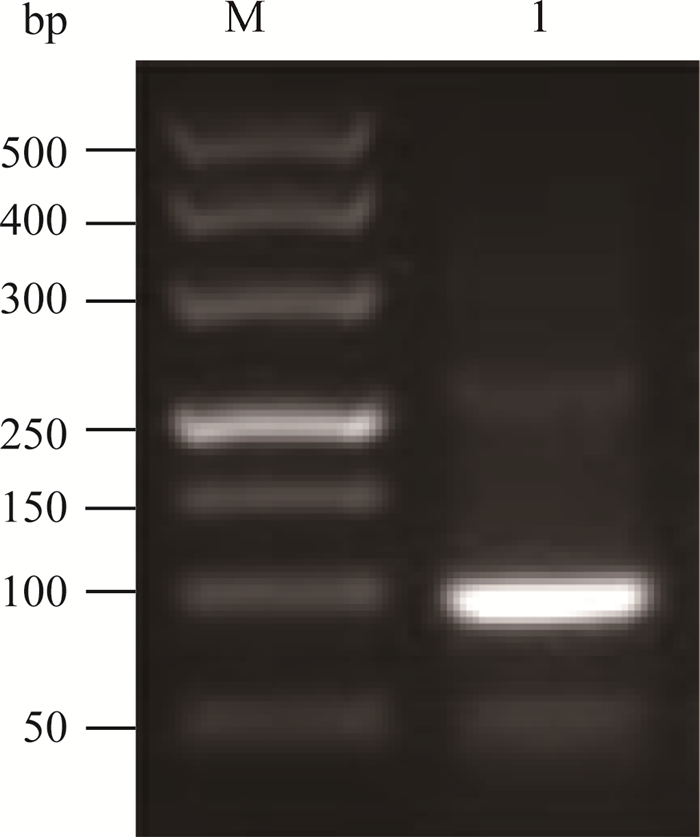
2 结果 2.1 病原核酸检测使用BTV NS1基因特异引物BTV-M6-A/BTV-M6-B以及BTV-M6-C/BTV-M6-D进行套式PCR扩增检测,阳性样品可检测到101 bp的目的条带(图 1)。
|
M. DL500 DNA相对分子质量标准;1.被检样品 M. DL500 DNA marker; 1.Tested sample 图 1 样品的RT-PCR检测 Figure 1 RT-PCR detection of sample |
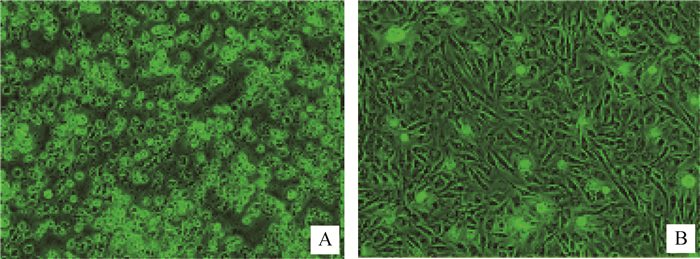
经BTV核酸检测的阳性血样经处理后静脉接种10日龄健康鸡胚,收集接种24 h后死亡鸡胚的肝,研磨,接种C6/36细胞1代后,再转接BHK-21细胞,传至第3代,出现明显的细胞病变(CPE):细胞萎缩、脱落(图 2)。
|
A.分离病毒感染细胞;B.对照细胞 A. Isolated virus-infected cells; B. Control cells 图 2 病毒感染的细胞病变 Figure 2 Virus-infected cytopathic effect |
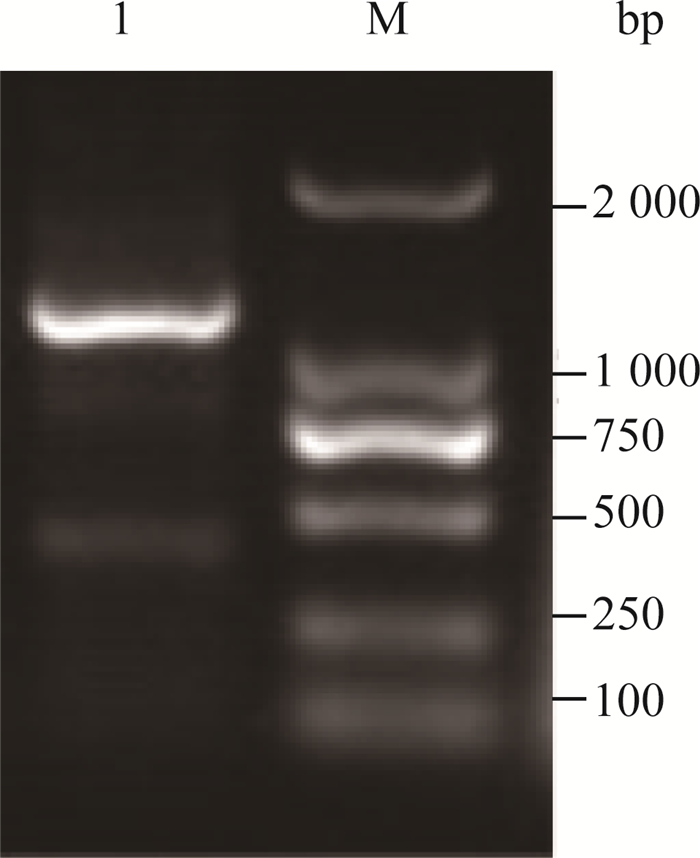
80%细胞出现病变时,收获细胞培养液,提取RNA,使用BTV VP7特异引物BTV-S7-A/ BTV-S7-B,经RT-PCR扩增出VP7基因(图 3),回收目的条带,连接至pMD18-T载体,转化E. coli DH5α感受态细胞,阳性克隆菌经测序,大小为1 156 bp,与预期结果相符。分离株GD/ST2014 VP7基因序列上传至GenBank,序列号为KT002584。
|
M. DL2000 DNA相对分子质量标准;1.VP7 PCR产物 M. DL2000 DNA marker; 1. VP7 PCR products 图 3 GD/ST2014 VP7基因扩增PCR产物 Figure 3 GD/ST2014 VP7 gene applified PCR products |
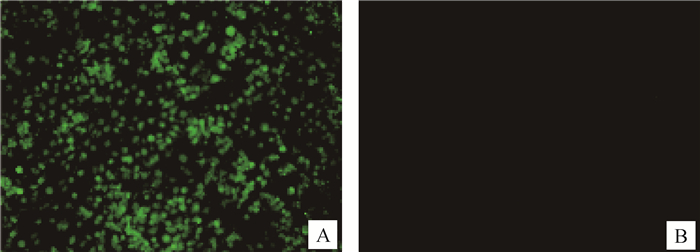
分离病毒GD/ST2014感染细胞能与BTV-7型抗体作用,产生绿色荧光,正常对照细胞无荧光(图 4),表明分离的病毒为BTV-7型。
|
A. GD/ST2014分离毒株;B.对照细胞 A. GD/ST2014 isolated strain; B. Control cell 图 4 分离毒株的间接免疫荧光检测结果 Figure 4 Indirect immunofluorescence assay of isolated strain |
分离病毒株GD/ST2014经离心纯化浓缩,负染后在电镜下观察发现无囊膜、直径为70~80 nm的球形病毒粒子(图 5)。
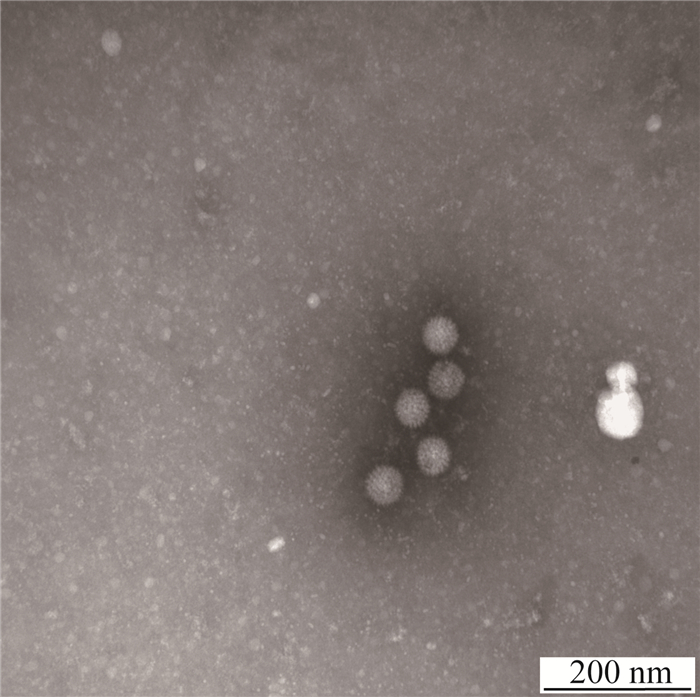
|
图 5 BTV分离株的电镜观察 Figure 5 Electron microscopy observation of isolated BTV |
将分离毒株GD/ST2014的VP7基因与其他BTV毒株的基因序列通过NCBI BLAST在线分析,其与国内外分离株的相似性达96%~97%,结果表明GD/ST2014毒株为BTV。将所得VP7序列与其他BTV VP7核甘酸序列构建的系统发育树(图 6),GD/ST2014与中国毒株(AF172827和AF172831) 的亲缘关系最近。
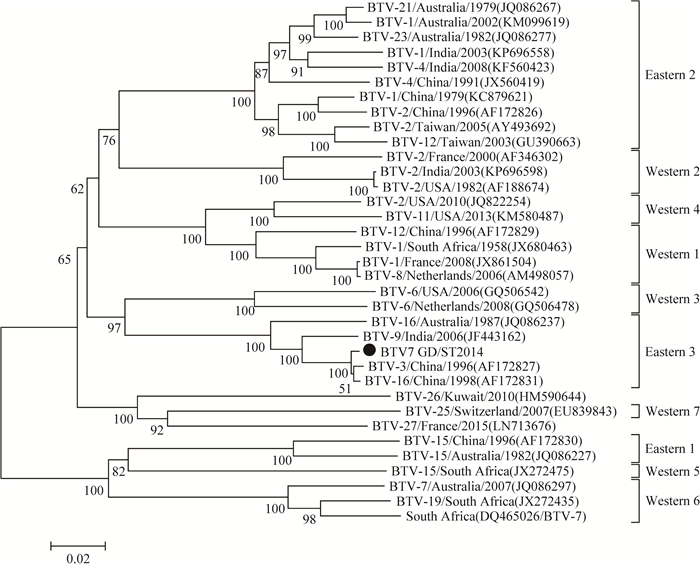
|
图 6 基于NJ法的BTV-7 Seg-7序列的系统发育分析 Figure 6 Phylogenetic analyses of available BTV-7 Seg-7 with the Neighbor-Joining method |
扩增分离毒株GD/ST2014 VP2基因序列上传至GenBank,序列号为KT002579,将其与其他BTV毒株的VP2基因序列进行同源性分析,并构建系统发育树(图 7),分离株GD/ST2014 VP2序列和南非毒株BTV-7(AJ585128)、以及澳大利亚毒株BTV-7(JQ086292) 的亲缘关系最近,处在同一分支上,结果表示分离到的毒株为BTV-7型。
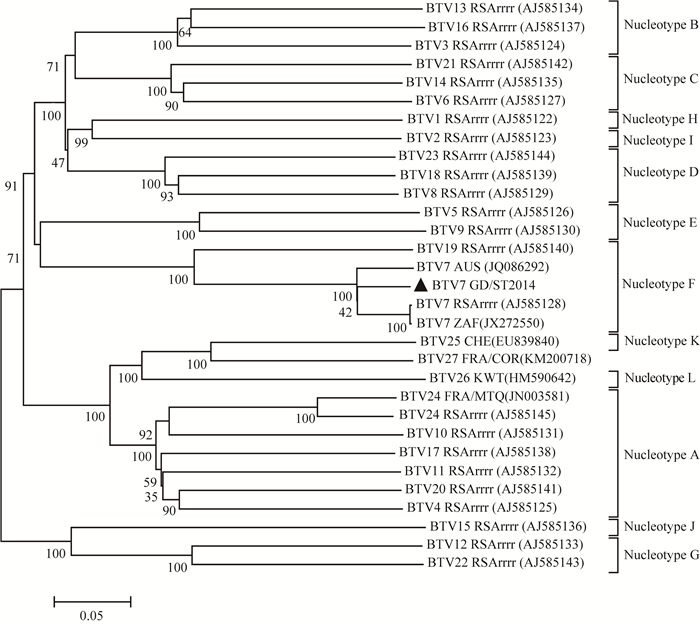
|
图 7 基于NJ法的BTV-7 Seg-2序列的系统发育分析 Figure 7 Phylogenetic analyses of available BTV-7 Seg-2 sequences in GenBank with the Neighbor-Joining method |
分离毒株GD/ST2014与24个血清型的标准阳性血清进行中和试验,结果显示,BTV-7阳性血清型1:256稀释度仍可中和100 TCID50的GD/ST2014毒株,接种细胞无CPE出现,而其他血清型的血清与GD/ST2014毒株无出现中和反应,因此认为分离病毒株为BTV-7型,结合Seg2测序结果,进一步确定GD/ST2014为BTV-7型。
3 讨论通过检测牛血液样品的蓝舌病病毒核酸阳性的样品,从中成功分离到蓝舌病病毒,命名为GD/ST2014,并对其进行RT-PCR检测蓝舌病病毒的VP2、VP7基因,序列分析,病毒粒子电镜观察,血清型鉴定,确定分离到的毒株为BTV-7型,此为国内首次报道的蓝舌病病毒血清7型的分离鉴定。
本课题组此次分离的BTV-7是从监控动物(牛)中分离到的,之前国内尚未见有报道发现血清7型,由此推断是否由被感染的媒介被风从境外吹来引起的,尚有待考究。本课题组先后在广东省分离到多株BTV[20],血清型分别为BTV-2、BTV-4、BTV-12、BTV-16,由此提示广东BT感染情况不容小视。广东省位于大陆最南部,属东亚季风区,是大陆光、热、水资源最为丰富的地区,年平均气温22.3 ℃,年平均日照数在1 750 h左右;广东雨量充沛,年平均降水量为1 300~1 600 mm。广东的湿热环境适宜库蠓等媒介昆虫的生长繁殖,为BT在广东的流行提供有利条件。由于库蠓个体小,仅1~3 mm,虽然自身飞行能力弱,但可借助风力被带到较远的地方,全球气候变暖也导致库蠓活动范围扩大,种群规模扩增及活动率增强,从而导致BTV传播范围大增,而且BTV各血清型之间无交叉免疫保护作用[21],给BT的防控带来严峻的考验。我们通过对BTV进行血清型的鉴定,了解广东BT各血清型的流行状况,为有效防控BT提供了基础数据,具有重要意义。
4 结论从采自广东的牛蓝舌病病毒核酸阳性血液样品中成功分离到蓝舌病病毒,命名为GD/ST2014,经鉴定确定分离到BTV-7型毒株。
| [1] | PATEL A, ROY P. The molecular biology of bluetongue virus replication[J]. Virus Res, 2014, 182: 5–20. DOI: 10.1016/j.virusres.2013.12.017 |
| [2] | MACLACHLAN N J, DREW C P, DARPEL K E, et al. The pathology and pathogenesis of bluetongue[J]. J Comp Pathol, 2009, 141(1): 1–16. DOI: 10.1016/j.jcpa.2009.04.003 |
| [3] | KIRKLAND P D. Akabane and bovine ephemeral fever virus infections[J]. Vet Clin North Am Food Anim Pract, 2002, 18(3): 501–514. DOI: 10.1016/S0749-0720(02)00026-9 |
| [4] | TABACHNICK W J. The genetics of Culicoides variipennis and the epidemiology of bluetongue disease in North America[J]. Annu Rev Entomol, 1996, 45: 20–40. |
| [5] | TABACHNICK W J. Culicoides variipennis and bluetongue-virus epidemiology in the United States[J]. Annu Rev Entomol, 1996, 41: 23–43. DOI: 10.1146/annurev.en.41.010196.000323 |
| [6] | RATINIER M, CAPORALE M, GOLDER M, et al. Identification and characterization of a novel non-structural protein of bluetongue virus[J]. PLoS Pathog, 2011, 7(12): e1002477. DOI: 10.1371/journal.ppat.1002477 |
| [7] | ROY P. Bluetongue virus proteins and particles and their role in virus entry, assembly, and release[J]. Adv Virus Res, 2005, 64: 69–123. DOI: 10.1016/S0065-3527(05)64004-3 |
| [8] | BELHOUCHET M, MOHD JAAFAR F, FIRTH A E, et al. Detection of a fourth orbivirus non-structural protein[J]. PLoS One, 2011, 6(10): e25697. DOI: 10.1371/journal.pone.0025697 |
| [9] | MARTYN J C, GOULD A R, EATON B T. High level expression of the major core protein VP7 and the non-structural protein NS3 of bluetongue virus in yeast:use of expressed VP7 as a diagnostic, group-reactive antigen in a blocking ELISA[J]. Virus Res, 1991, 18(2-3): 165–178. DOI: 10.1016/0168-1702(91)90016-O |
| [10] | HASSAN S S, ROY P. Expression and functional characterization of Bluetongue virus VP2 protein:role in cell entry[J]. J Virol, 1999, 73(12): 9832–9842. |
| [11] | HOFMANN M A, REUZULLO S, MADER M, et al. Genetic characterization of toggenburg orbivirus, a new bluetongue virus, from goats, Switzerland[J]. Emerg Infect Dis, 2008, 14(12): 1855–1861. DOI: 10.3201/eid1412.080818 |
| [12] | MAAN S, MAAN N S, NOMIKOU K, et al. Novel bluetongue virus serotype from Kuwait[J]. Emerg Infect Dis, 2011, 17(5): 886–889. DOI: 10.3201/eid1705.101742 |
| [13] | ZIENTARA S, SAILLEAU C, VIAROUGE C, et al. Novel bluetongue virus in goats, corsica, france, 2014[J]. Emerg Infect Dis, 2014, 20(12): 2123–2125. DOI: 10.3201/eid2012.140924 |
| [14] | JENCKEL M, BRÉARD E, SCHULZ C, et al. Complete coding genome sequence of putative novel bluetongue virus serotype 27[J]. Genome Announc, 2015, 3(2): e00016–15. |
| [15] | SCHULZ C, BRÉARD E, SAILLEAU C, et al. Bluetongue virus serotype 27:detection and characterization of two novel variants in Corsica, France[J]. J Gen Virol, 2016, 97(9): 2073–2083. DOI: 10.1099/jgv.0.000557 |
| [16] |
张念祖, 张开礼, 李志华, 等. 绵羊蓝舌病的调查研究报告[J]. 云南畜牧兽医, 1989(4): 3–13.
ZHANG N Z, ZHANG K L, LI Z H, et al. Investigation report on bluetongue disease in sheep[J]. Yunnan Journal of Animal Science and Veterinary Medicine, 1989(4): 3–13. (in Chinese) |
| [17] |
魏鹏. 蓝舌病病毒1型VP2、VP5蛋白单克隆抗体的制备及其抗原表位的鉴定[D]. 哈尔滨: 中国农业科学院, 2013.
WEI P. Preparation of the monoclonal antibodies against VP2 and VP5 protein of bluetongue virus serotype 1 and identification of B-cell epitopes[D]. Harbin:Chinese Academy of Agricultural Sciences, 2013. (in Chinese) http: //cdmd. cnki. com. cn/Article/CDMD-82101-1013357700. htm |
| [18] |
韩春来, 李全录, 卢旺. 国内外蓝舌病检测技术研究进展[J]. 中国动物检疫, 2012, 27(1): 67–69.
HAN C L, LI Q L, LU W. Research progress on detection technology of bluetongue at home and abroad[J]. China Animal Health Inspection, 2012, 27(1): 67–69. (in Chinese) |
| [19] | ZHANG N, MACLACHLAN N J, BONNEAU K R, et al. Identification of seven serotypes of bluetongue virus from the People's Republic of China[J]. Vet Rec, 1999, 145(15): 427–429. DOI: 10.1136/vr.145.15.427 |
| [20] |
林丽琴, 吕敏娜, 孙铭飞, 等. 广东某奶牛场蓝舌病病毒分离株血清型与基因型的鉴定[J]. 中国兽医科学, 2015, 45(6): 615–621.
LIN L Q, LV M N, SUN M F, et al. Serotype and genotype identification of bluetongue virus isolates from a dairy farm in Guangdong Province[J]. Chinese Veterinary Science, 2015, 45(6): 615–621. (in Chinese) |
| [21] | MACLACHLAN N J, WILSON W C, CROSSLEY B M, et al. Novel serotype of bluetongue virus, Western North America[J]. Emerg Infect Dis, 2013, 19(4): 665–666. |



