高脂血症(Hyperlipemia)是由先天性的基因缺乏或脂代谢紊乱引起的体内血脂水平过高[1]。伴随着生活水平的提高和生活方式的改变,高脂血症在人群中的发病率逐年升高,并且有年轻化趋势。由于高脂血症与血栓、高血压、动脉粥样硬化等心血管疾病有紧密联系,因此预防高脂血症,降低血脂水平对有效预防心血管疾病的发生,发挥着重要的作用[2]。在伴侣动物中由于缺乏运动,食物结构的改变及食物摄入过多等原因,导致肥胖、血脂异常等的发病率日益增加,已严重威胁宠物健康与动物福利[3-4]。因此,高脂血症引起医学和兽医学科研人员的关注,并成为研究的热点和难点。
高脂血症动物模型,在研究降血脂药物的药效和作用机制方面发挥着重要的作用。目前,啮齿类动物在高脂血症动物模型中使用较为普遍,造模的方法也较多,如:喂饲法、基因敲除法、卵蛋白注射法等[5-6]。相关文献报道,不同配方的高脂饲料在较短时间内(4~8周)即可引起金黄地鼠、大鼠等血脂水平的显著变化[7-9]。然而,长期饲喂高脂饲料对大鼠血脂水平、肝病理组织学变化,以及肠道菌群的影响等的研究尚未见报道。
本研究拟采用血脂水平测定、病理组织学检查和16S rDNA扩增子测序等手段,观察长期(13周)饲喂高脂饲料对大鼠血脂、肝及肠道菌群的影响,并挖掘肠道菌群与血脂异常的潜在联系,以期探究高脂血症的病理机制,为伴侣动物健康饮食管理提供参考。
1 材料与方法 1.1 材料大鼠维持饲料和高脂饲料均由北京科澳协力饲料有限公司提供。高脂饲料配方:维持料77.8%,蛋黄粉10%,猪油10%,胆固醇2%,胆酸盐0.2%。维持饲料的主要营养成分为12.3%脂类, 63.3%碳水化合物和24.4%蛋白质(kcal%);高脂饲料主要营养成分为41.5%油脂,40.2%碳水化合物和18.3%蛋白质(kcal%)。
高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TCH)和甘油三脂(TG)检测试剂盒购自宁波美康生物科技股份有限公司。分析纯伊红、美兰、甲醇等试剂购于国药集团化学试剂有限公司。
1.2 仪器DHP-9082型电热恒温培养箱(上海朵弗实业有限公司),RM-2235精密转轮半自动螺旋切片机,13395H2X光学显微镜,XP-600E偏振光显微镜(均为德国LEICA公司),XL-640全自动生化分析仪(德国Erba公司),Illumina HiSeq测序平台。
1.3 动物及分组清洁级健康雄性SD大鼠20只,体重250~280 g,由甘肃省中医药大学提供。随机分为对照组(Control)和高脂饲料组(High fat diet, HFD),每组10只,分别连续自由采食维持饲料和高脂饲料13周。
1.4 样品采集与处理为了探讨血脂水平在试验期间的变化,在给予高脂饲料后第8及第13周末,自大鼠尾尖采血,以检测血脂水平。血液样本采集方法:大鼠腹腔注射戊巴比妥钠(30 mg·kg-1)进行麻醉,尾部40 ℃温浴2 min后,断尾采集血液1.5 mL,4 000 r·min-1离心15 min制备血清,用于血脂分析。饲喂高脂饲料13周后,采集肝组织及盲肠内容物用于病理组织学和肠道菌群的分析。肝组织切成1 cm×1 cm×0.6 cm大小,10%中性多聚甲醛磷酸盐缓冲液固定,常规石蜡包埋,切片,苏木精-伊红染色,进行病理组织学观察。盲肠内容物分装于离心管中,液氮速冻后,于-80 ℃保存。
1.5 Illumina HiSeq测序分析利用Illumina HiSeq测序平台,对细菌的16S rDNA基因V4区进行高通量测序,并对测序结果进行生物信息学分析。
1.5.1 盲肠内容物总DNA提取利用基因组DNA提取试剂盒提取大鼠盲肠内容物样品中微生物的总DNA (PowerFecalTM DNA Isolation kit, USA)。利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,使用无菌水稀释DNA样品至1 ng·μL-1。所提取的DNA于-20 ℃保存备用。
1.5.2 16S rDNA的扩增以稀释后的基因组DNA为模板,针对16S rDNA基因V4区,合成带有Barcode的特异性引物515F(5′-GTTTCGGTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GATCAGGGACTACHVGGGTWTCTAAT-3′)。PCR扩增采用Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶反应体系,以确保扩增效率和准确性。PCR产物用2%的琼脂糖凝胶电泳进行检测,目的条带(400~450 bp)用相应的回收试剂盒回收纯化(Qiagen Gel Extraction Kit,Germany)。
1.5.3 文库构建与测序用建库试剂盒(TruSeq® DNA PCR-Free Sample Preparation Kit)进行文库构建,具体步骤按说明书操作。利用Qubit@ 2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 system对构建好的文库进行评估。文库合格后采用Illumina HiSeq2500 PE250平台进行测序。
1.5.4 生物信息学分析各样品数据截去Barcode和引物序列后使用FLASH对数据进行拼接得到原始数据,经Qiime软件过滤、UCHIME Algorithm软件去除嵌合体后,与数据库比对(Gold database),得到有效数据。用Uparse软件对有效数据在97%水平上进行操作分类单元(Operational taxonomic unit,OTU)聚类。采用Mothur法与SILVA的SSUrRNA数据库进行物种注释分析(阈值:0.8~1)。使用PyNAST软件与GreenGene数据库进行快速多序列比对,得到的所有OTUs代表序列的系统发生关系。R软件绘制稀释曲线以评估测序深度。各样品的数据进行均一化处理后,采用Qiime软件进行样品复杂度分析(Alpha diversity)和多样品比较分析(Beta diversity)。运用PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States),并结合KEGG数据库,对肠道菌群的功能进行预测。
1.6 统计分析血脂检测结果用“Mean±SD”表示,采用SPSS 13.0对结果进行统计学分析(t检验),P<0.05表示差异有统计学意义。
2 结果 2.1 高脂饲料对大鼠血脂水平的影响大鼠饲喂高脂饲料8周后进行血脂水平检测,以评估高脂饲料对血脂的影响(表 1)。相比于对照组,饲喂高脂饲料大鼠的TG、TCH和LDL水平均显著增高(P<0.01),HDL显著降低(P<0.01)。高脂饲料持续饲喂至13周,TG,TCH及LDL相对于对照组均显著增高(P<0.01),而HDL差异不显著。通过比较8周与13周模型组大鼠的血脂水平,探讨延长高脂饲料饲喂时间对血脂水平的影响。结果表明,延长高脂饲料饲喂时间5周,可显著增高TCH和HDL水平(P<0.01)。
|
|
表 1 饲喂高脂饲料8周和13周后大鼠血脂水平的变化(Mean±SD, n=10) Table 1 Blood lipid changes in rats after feeding with high fat diet for 8 weeks and 13 weeks (Mean±SD, n=10) |
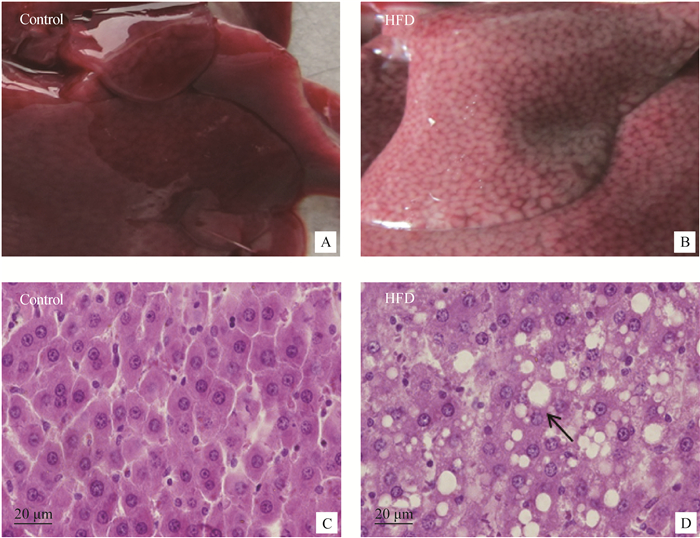
眼观,对照组肝呈红褐色,肝组织质地柔软(图 1 A);相比于对照组,饲喂高脂饲料13周后,大鼠肝肿大,体积明显增大,被膜紧张,肝实质呈土黄色,边缘变钝、质脆,表面光滑且有油腻感(图 1 B)。镜检,对照组大鼠肝细胞结构正常,结构清晰(图 1C);高脂饲料组大鼠肝细胞发生不同程度的变性、坏死,部分细胞核坏死、崩解、淡染;肝细胞发生严重的脂肪变性,形成大小不等的脂滴空泡(图 1D)。
|
对照组肝的轮廓、颜色及细胞结构正常(A和C);高脂饲料组中肝呈土黄色,生成大量脂滴(B和D) In control group, the contour, color and cell architecture of liver are normal (A and C); In HFD group, the color of liver became yellow, and many large fat droplets are found (B and D) 图 1 饲喂高脂饲料13周后大鼠肝的病理变化 Figure 1 Pathological changes of liver from the rats fed with high fat diet for 13 weeks |
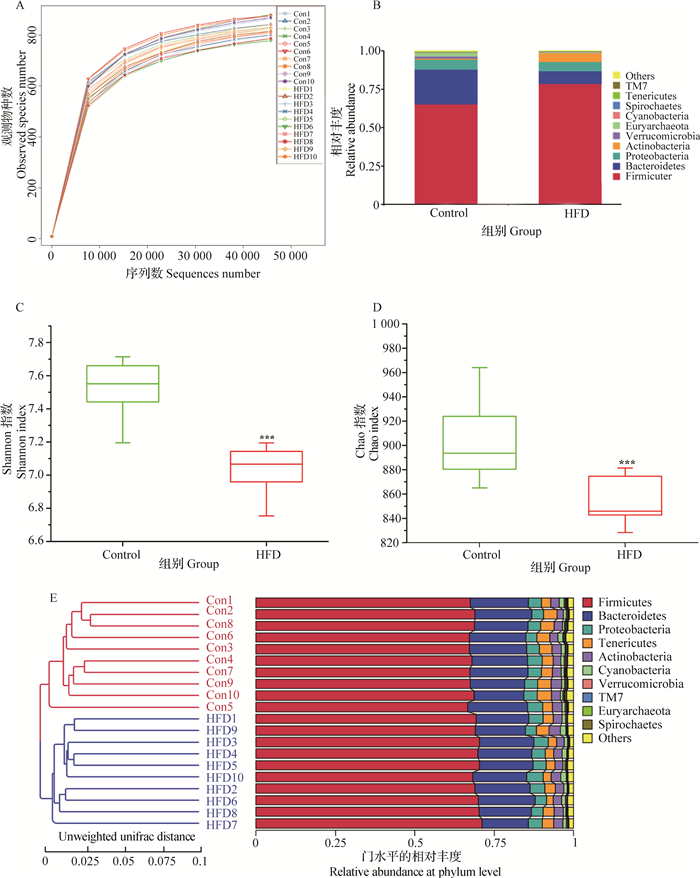
采用Illumina HiSeq测序平台得到原始数据(Raw Data)后,为了使信息分析的结果更加准确、可靠,对原始数据进行拼接、过滤,以得到有效数据(Effective tags)。以97%的一致性将有效数据聚类成为OTUs,并进行物种注释用于后续分析(表 2)。稀释曲线趋向平坦说明测序数据量渐进合理(图 2A)。
|
|
表 2 肠道菌群测序数据统计 Table 2 Statistical results of sequencing data of gut microbiota |
|
A.稀释曲线;B.肠道菌群的堆积柱状图(门水平);C、D. Shannon和Chao指数;E.基于UPGMA的聚类分析。***. P<0.001相比于对照组 A. Rarefaction curve; B. Stacked histogram of gut microbiota (phylum level); C, D. Shannon and Chao indices between control and HFD groups; E. Cluster analysis based on UPGMA. ***. P < 0.001 compared with the control group 图 2 高脂饲料对大鼠肠道菌群的影响 Figure 2 Effects of HFD on gut microbiota in rats |
连续饲喂高脂饲料13周后,相比于正常组,高脂饲料可显著改变盲肠菌群的组成(图 2B)。统计学结果表明,相比于对照组,高脂饲料组的厚壁菌门及放线菌门显著增加(P<0.01),拟杆菌门、广古菌门、柔膜菌门和TM7门显著减少(P<0.01);同时,高脂饲料也显著降低了其他菌群的丰度(P<0.05);变形菌门、疣微菌门、蓝藻门及螺旋体门在两组之间差异不显著(表 3)。此外,对照组和高脂饲料组之间有26个属的细菌,统计学差异显著(P<0.05)。相比于对照组,高脂饲料组中12个种属的细菌的丰度显著升高(如:Faecalibacterium, Holdemania, Ruminococcus等),14个种属的细菌的丰度显著降低(如:Jeotgalicoccus, YRC22, Parabacteroides等),见表 4。
|
|
表 3 对照组与高脂饲料组肠道菌群门水平的统计分析(Mean±SD) Table 3 Statistical analysis of gut microbiota (phylum level) between control and HFD groups (Mean±SD) |
|
|
表 4 对照组与高脂饲料组肠道菌群属水平的统计分析(Mean±SD) Table 4 Statistical analysis of gut microbiota (genus level) between control and HFD groups (Mean±SD) |
为了研究样品间的相似性,结合最大相对丰度排名前十的物种,采用UPGMA(Unweighted Pair-group Method with Arithmetic Mean)的分析方法,对样品进行聚类分析。结果表明,所有的菌群样本被分为两大类,对照组为一类样本,高脂饲料组为一类样本,其聚类分析结果与样本处理的分类结果保持一致(图 2E)。
2.3.3 高脂饲料对菌群多样性的影响Chao和Shannon指数用来评估菌群多样性的变化。相比于对照组,高脂饲料组的Shannon和Chao指数均极显著的降低(图 2C, D),表明高脂饲料可显著降低肠道菌群的多样性。
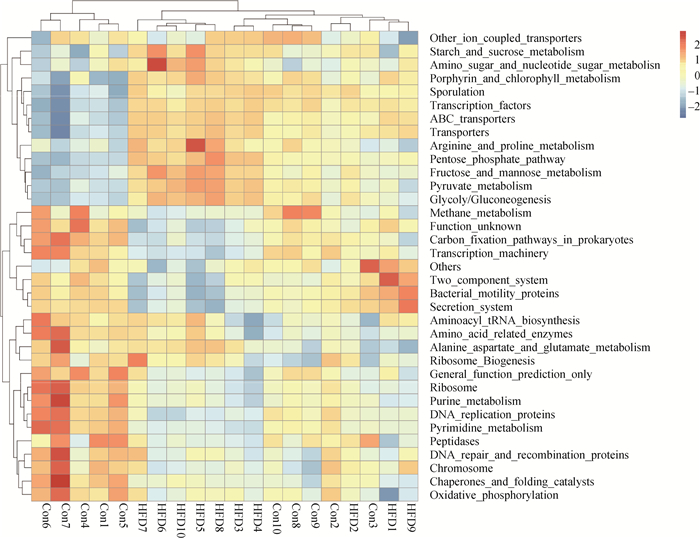
2.3.4 肠道菌群的PICRUSt分析PICRUSt分析用来挖掘与肠道菌群改变相关的代谢通路(KEGG level 3),来说明菌群和高脂饲料之间的联系。试验结果表明,两组之间共有35个代谢通路存在差异(图 3)。高脂饲料组中与能量相关的代谢通路丰度相对较高,其主要包括淀粉-蔗糖代谢、果糖-甘露糖代谢、戊糖磷酸盐途径、糖酵解与糖异生途径以及部分氨基酸的代谢等。而对照组中涉及肽酶、细菌运动蛋白、分泌系统核糖体及DNA修复等代谢通路的丰度相对较高。
|
图 3 对照组和高脂饲料组PICRUSt分析(KEGG第三层级代谢通路) Figure 3 PICRUSt analysis between control and HFD groups (the third level of KEGG pathway) |
近几年来,诸多原因导致的食物结构不合理,至使伴侣动物长期处于亚健康状态如肥胖、高血脂等,已成为非常突出的问题[10-11]。高脂血症通常表现为TG、TCH和LDL的升高及HDL的降低。TCH和TG是机体重要的组成成分,主要来自肝的合成和食物摄取,且在血液中的浓度恒定,当其浓度过高时则引起相应的疾病。HDL可将周围组织中的胆固醇运送至肝,将其转化为胆汁酸或者直接通过胆汁从肠道排出[12-13]。本研究中采用高脂饲料诱导大鼠高脂血症的发生,结果表明,饲喂高脂饲料8周即可显著升高TG、TCH和LDL,降低HDL。罗朵生等的研究表明,高脂饮食(30天)可显著增加大鼠TG、TCH和LDL,并降低HDL水平[14],和本试验结果基本一致。然而,13周后两组之间HDL指标差异不显著,其原因可能是由于高脂饲料饲喂时间及组成成分之间的差异导致(如饱和脂肪酸含量低等)[15]。相比于第8周,随着高脂饲料饲喂时间的延长,TCH及HDL水平进一步增加。高脂饲料饲喂时间的延长可能导致肝细胞合成胆固醇增多;伴随着血脂水平的提高,大鼠自身需要更多的HDL来转运增加的胆固醇,从而导致HDL水平的升高。因此,HDL的升高可能是大鼠通过自身调节对高脂饲料的一种适应结果。肝的病理学检查结果与血脂检测结果呈正相关,血脂水平的升高对肝造成了不同程度的损伤,胆固醇合成的增加以及脂类的积累可能是造成肝脂肪变性的主要原因[16-17]。
肠道菌群是一个极其复杂的微生态系统,与宿主的生理、病理、代谢等有着密切的相互作用[18]。近年来相关研究证实,肠道菌群在生殖、营养吸收、肥胖以及免疫等方面发挥着重要作用[19-21]。本研究中,高脂饲料组的Chao及Shannon指数显著低于对照组,说明肠道菌群的多样性显著降低。黄红丽等通过高脂饮食构建非酒精性脂肪肝动物模型,并分析其肠道菌群的特点[22],结果证实,高脂饲料可显著降低肠道菌群多样性,与本研究结果一致。E.Le Chatelier等报道,非肥胖者和肥胖者的肠道微生物的多样性存在显著差别,其结果表明,肠道微生物多样性的降低与肥胖程度、血脂异常及胰岛素抗性呈正相关关系[23]。因此,高脂饲料所导致的菌群多样性的降低对机体构成潜在的威胁。
朱超霞等报道,随着高脂饮食的摄入,大鼠肠道菌群呈现高比例的厚壁菌门和低比例的拟杆菌门[24]。本研究结果也显示,高脂饮食在门水平上对物种组成比例的影响较大,主要表现为厚壁菌门和放线菌门的增加,拟杆菌门的减少。厚壁菌门与拟杆菌门比值的增大,将导致肠道菌群更为有效地从食物中获取能量,增加机体的能量获取,从而促进脂肪、胆固醇等的合成引发血脂升高或脂肪肝病变。因此,高脂饲料可通过影响肠道菌群组成,增加能量摄入而导致血脂异常。D.W.Chen等报道,高脂饲料可导致大鼠Dorea及Bacteroides丰度的增加,同时引起Ruminococcus、Allobaculum和Collinsella丰度的降低[25]。本研究中,Dorea丰度的变化与其报道一致,而Bacteroides、Ruminococcus、Allobaculum及Collinsella的丰度变化与报道结果存在差异,这种属水平菌群的差异,可能是由于高脂饲料饲喂时间的不同所导致。不同种属的细菌对宿主发挥着不同的作用,如Collinsella能够产生短链脂肪酸,并且有助于维护肠黏膜屏障的完整[26];Ruminococcus与能量获取有紧密关系[27],而高脂饲料对这些菌的影响,以及细菌对宿主发挥作用的机制尚不完全清楚,需要进一步的研究。
本研究通过PICRUSt来预测相关的代谢通路,研究高脂饲料对肠道菌群的影响。高脂饲料组中,大多数发生变化的代谢通路主要与能量代谢相关,其结果与肠道菌群组成的改变相符。因此,可以推测,长期饲喂高脂饲料引起菌群结构的改变,导致了能量相关代谢通路的过度富集,进而引发能量代谢异常以至于血脂异常和肝病变。这些与能量代谢相关的通路可作为桥梁来说明高脂饲料、肠道菌群及宿主之间作用的关系。对照组中所涉及的代谢通路主要与细菌的生存与繁殖相关,如DNA修复等,而高脂饲料所引起的这些通路的改变可能与肠道菌群多样性的降低相关。虽然PICRUSt分析对于肠道菌群功能的解读有很大的帮助,但由于数据库及方法的限制,其存在一定的缺陷,需要结合更多的方法(宏基因组、转录组等)对试验结果加以确认。
4 结论肠道菌群在高脂饲料引发的血脂异常中发挥着重要的作用,但限于现有的技术条件,高脂饲料对肠道菌群的影响及其血脂异常的具体机制尚不完全清楚。本研究从血脂、肝病理学及肠道菌群的角度说明了长期饲喂高脂饲料的危害,为探讨血脂异常的成因提供了依据,并对伴侣动物饮食管理有一定的指导作用。
| [1] | ZHOU C Y, LI G, LI Y C, et al. A high-throughput metabolomic approach to explore the regulatory effect of mangiferin on metabolic network disturbances of hyperlipidemia rats[J]. Mol Biosyst, 2015, 11(2): 418–433. DOI: 10.1039/C4MB00421C |
| [2] | FOROUZANFAR M H, ALEXANDER L, ANDERSON H R, et al. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks in 188 countries, 1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 386(10010): 2287–2323. DOI: 10.1016/S0140-6736(15)00128-2 |
| [3] | MAO J F, XIA Z F, CHEN J N, et al. Prevalence and risk factors for canine obesity surveyed in veterinary practices in Beijing, China[J]. Prev Vet Med, 2013, 112(3-4): 438–442. DOI: 10.1016/j.prevetmed.2013.08.012 |
| [4] | CORBEE R J. Obesity in show cats[J]. J Anim Physiol Anim Nutr, 2014, 98(6): 1075–1080. DOI: 10.1111/jpn.2014.98.issue-6 |
| [5] | MOGHADASIAN M H, FROHLICH J J, MCMANUS B M. Advances in experimental dyslipidemia and atherosclerosis[J]. Lab Invest, 2001, 81(9): 1173–1183. DOI: 10.1038/labinvest.3780331 |
| [6] | ROSINI T C, SILVA A S R D, MORAES C D. Diet-induced obesity:rodent model for the study of obesity-related disorders[J]. Rev Assoc Med Bras, 2012, 58(3): 383–387. |
| [7] | WU Q, ZHANG H, DONG X, et al. UPLC-Q-TOF/MS based metabolomic profiling of serum and urine of hyperlipidemic rats induced by high fat diet[J]. J Pharm Anal, 2014, 4(6): 360–367. DOI: 10.1016/j.jpha.2014.04.002 |
| [8] | MIAO H, CHEN H, PEI S W, et al. Plasma lipidomics reveal profound perturbation of glycerophospholipids, fatty acids, and sphingolipids in diet-induced hyperlipidemia[J]. Chem Biol Interact, 2015, 228: 79–87. DOI: 10.1016/j.cbi.2015.01.023 |
| [9] | TANG C H, ZHANG K, ZHAO Q Y, et al. Effects of dietary genistein on plasma and liver lipids, hepatic gene expression, and plasma metabolic profiles of hamsters with diet-induced hyperlipidemia[J]. J Agric Food Chem, 2015, 63(36): 7929–7936. DOI: 10.1021/acs.jafc.5b01590 |
| [10] |
满都日娃, 马利芹, 利凯, 等. 犬、猫肥胖症的防止[J]. 河北北方学院学报:自然科学版, 2009, 25(3): 58–59, 63.
MAN D R W, MA L Q, LI K, et al. Prevention of obesity in pet dog and cats[J]. Journal of Hebei North University:Natural Science Edition, 2009, 25(3): 58–59, 63. (in Chinese) |
| [11] |
叶妍琳, 白正广, 张斌恺, 等. 犬、猫肥胖症病因分析及管理[J]. 上海畜牧兽医通讯, 2015(1): 62–63.
YE Y L, BAI Z G, ZHANG B K, et al. Analysis and management of obesity in dog and cat[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2015(1): 62–63. (in Chinese) |
| [12] | XU S W, LIU Z P, LIU P Q. HDL cholesterol in cardiovascular diseases:the good, the bad, and the ugly[J]. Int J Cardiol, 2013, 168(4): 3157–3159. DOI: 10.1016/j.ijcard.2013.07.210 |
| [13] | WANG Z, LI P, WANG C J, et al. Protective effects of Arctium lappa L. root extracts (AREs) on high fat diet induced quail atherosclerosis[J]. BMC Complement Altern Med, 2016, 16: 6. |
| [14] |
罗朵生, 李坤平, 朴胜华, 等. 高脂血症大鼠造模过程中血液代谢组学研究[J]. 中药新药与临床药理, 2016, 27(1): 70–74.
LUO D S, LI K P, PIAO S H, et al. Study of blood metabonomics in rat hyperlipidemia model[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2016, 27(1): 70–74. (in Chinese) |
| [15] |
周云枫, 李沙, 苏文, 等. 不同脂肪含量的高脂纯化配方饲料对大、小鼠代谢综合征发生的影响[J]. 基础医学与临床, 2012, 32(3): 273–277.
ZHOU Y F, LI S, SU W, et al. Effect of diets with different fat content on metabolic syndrome of rats and mice[J]. Basic & Clinical Medicine, 2012, 32(3): 273–277. (in Chinese) |
| [16] | YAO W F, GU H W, ZHU J J, et al. Integrated plasma and urine metabolomics coupled with HPLC/QTOF-MS and chemometric analysis on potential biomarkers in liver injury and hepatoprotective effects of Er-Zhi-Wan[J]. Anal Bioanal Chem, 2014, 406(28): 7367–7378. DOI: 10.1007/s00216-014-8169-x |
| [17] |
陈眷华, 卢占军, 徐在品, 等. 大黄醇提液抗家兔实验性动脉粥样硬化作用的病理形态学研究[J]. 畜牧兽医学报, 2007, 38(7): 728–734.
CHEN J H, LU Z J, XU Z P, et al. Pathological study on anti-experimental atherosclerotic effects of rhubarb ethanol-extract in rabbits[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(7): 728–734. (in Chinese) |
| [18] |
孟良艳, 陈秀琴, 石达友, 等. 四君子汤对脾虚大鼠肠道菌群多样性的影响[J]. 畜牧兽医学报, 2013, 44(12): 2029–2035.
MENG L Y, CHEN X Q, SHI D Y, et al. Influence of Sijunzi decoction on intestinal flora diversity in spleen-deficient rat[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(12): 2029–2035. (in Chinese) |
| [19] | ZHAO L P. The gut microbiota and obesity:from correlation to causality[J]. Nat Rev Microbiol, 2013, 11(9): 639–647. DOI: 10.1038/nrmicro3089 |
| [20] | CHENG M, QIAN L T, SHEN G D, et al. Microbiota modulate tumoral immune surveillance in lung through a γδT17 immune cell-dependent mechanism[J]. Cancer Res, 2014, 74(15): 4030–4041. DOI: 10.1158/0008-5472.CAN-13-2462 |
| [21] | HUANG Y E, WANG Y, HE Y, et al. Homogeneity of the vaginal microbiome at the cervix, posterior fornix, and vaginal canal in pregnant Chinese women[J]. Microb Ecol, 2015, 69(2): 407–414. DOI: 10.1007/s00248-014-0487-1 |
| [22] |
黄红丽, 周永健, 郑啼婴, 等. 肠道菌群在非酒精性脂肪性肝病大鼠中的变化及意义[J]. 广东医学, 2016, 37(9): 1283–1286.
HUANG H L, ZHOU Y J, ZHENG T Y, et al. Changes of intestinal flora in rats with non-alcoholic fatty liver disease and its significance[J]. Guangdong Medical Journal, 2016, 37(9): 1283–1286. (in Chinese) |
| [23] | LE CHATELIER E, NIELSEN T, QIN J J, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500(7464): 541–546. DOI: 10.1038/nature12506 |
| [24] |
朱超霞, 仓桢, 加孜热亚·再依拿提, 等. 盐酸小檗碱对高脂饮食诱导的非酒精性脂肪性肝病大鼠肠道菌群的影响[J]. 上海交通大学学报:医学版, 2015, 35(4): 483–488.
ZHU C X, CANG Z, JIAZIREYA Z, et al. Effects of berberine on gut microbiota of rats with non-alcoholic fatty liver disease induced by high-fat diet[J]. Journal of Shanghai Jiao Tong University:Medical Science, 2015, 35(4): 483–488. (in Chinese) |
| [25] | CHEN D W, YANG Z Q, CHEN X, et al. Effect of lactobacillus rhamnosus hsryfm 1301 on the gut microbiota and lipid metabolism in rats fed a high-fat diet[J]. J Microbiol Biotechnol, 2015, 25(5): 687–695. DOI: 10.4014/jmb.1409.09085 |
| [26] | YIN X C, PENG J H, ZHAO L P, et al. Structural changes of gut microbiota in a rat non-alcoholic fatty liver disease model treated with a Chinese herbal formula[J]. Syst Appl Microbiol, 2013, 36(3): 188–196. DOI: 10.1016/j.syapm.2012.12.009 |
| [27] | PANASEVICH M R, MORRIS E M, CHINTAPALLI S V, et al. Gut microbiota are linked to increased susceptibility to hepatic steatosis in low-aerobic-capacity rats fed an acute high-fat diet[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 311(1): G166–G179. DOI: 10.1152/ajpgi.00065.2016 |



