在现代家禽生产中,影响生产性能的最大限制因素是主动采食量不足[1]。家禽的采食行为受到外界环境、饲养管理、自身代谢产物、中枢系统和外周信号因子的综合调控[2],下丘脑是中枢神经系统调节采食量的重要部位,它在接受、整合与释放食欲调节信号中发挥着关键作用。Visfatin是日本科学家在2005年发现并命名的新型脂肪细胞因子[3],cDNA测序发现,Visfatin和前B细胞克隆增强因子(PBEF)以及烟酰胺磷酸核糖转移酶(NAMPT)是同一种蛋白质的不同表现型,Visfatin或PBEF实质上只是NAMPT的细胞外形式[4]。其广泛存在于细菌、啮齿动物,鸡和人类等生物体中[5-7],在脂肪、肌肉、脑、内脏、子宫、睾丸等组织中均有表达[8]。近年,Visfatin在糖脂代谢、胰岛素抵抗、细胞分化增殖、免疫应激和癌症等方面的作用引起广泛关注[9-13]。
2008年,M.A.Cline等[14]研究表明,向肉仔鸡脑室内注射人的重组Visfatin可引起采食量增加,提示Visfatin可能是一个潜在的增食欲素;2011年,L.Brunetti等[15]推测产生该效应的部分原因可能是下丘脑中多巴胺(DA)、可卡因-苯丙胺调控转录肽(CART)以及CRH活性的降低,但其作用机理并不明确。由此提示,Visfatin在家禽采食量调控中可能扮演关键角色。目前,Visfatin的研究主要集中在哺乳动物,在家禽领域鲜有报道,且研究重点主要是Visfatin在不同组织中的表达,关于其与动物食欲的相关研究非常少。代谢组学是继基因组学、转录组学和蛋白质组学之后快速发展起来的一门新兴学科[16],它不仅能检测样品中所含代谢物的成分而且可以对其含量进行准确测量,描述其变化规律,进而揭示调节机制[17]。
本试验以雏鸡为研究对象,通过脑室定位和微量注射技术给予雏鸡不同剂量的Visfatin,观察累积采食量变化,并借助于GC-MS检测技术对其下丘脑组织进行代谢组学检测,旨在进一步探索Visfatin对家禽采食调控的作用机制,为完善家禽的食欲调控和能量平衡理论奠定基础。
1 材料与方法 1.1 试验动物与分组本试验于2015年9月—2016年3月在河南省家禽种质资源创新工程研究中心实验室完成。河南省华罗家禽育种有限公司提供的1日龄罗曼褐新生健康雏鸡,常规饲粮饲养至10日龄进行下丘脑注射导管埋置,术后恢复3 d,挑选20只体重相近的健康雏鸡分为4个处理,分别记作对照组C(PBS)、低浓度组L(40 ng Visfatin)、中浓度组M(200 ng Visfatin)、高浓度组H(400 ng Visfatin)。
1.2 样本采集 1.2.1 脑室导管埋置麻醉剂(速眠新Ⅱ)与生理盐水按照1:2的比例混合均匀,通过腹腔注射(0.2 mL·kg-1)将试验鸡麻醉。头部剪毛后,将鸡只固定在三维脑立体定位仪上,头皮消毒后做一个“十”字切口暴露定位点。该点位于矢状缝与冠状缝交点(大脑横裂与小脑纵裂交汇处)正上方约0.5 mm处。用柔性颅骨钻在定位点开一圆形微孔,保持耳棒与喙角的连线与水平面呈45°角,套管针垂直插入约9 mm即可立体定位于丘脑下部,创口进行消炎处理后,使用牙科水泥将套管固定在雏鸡颅骨上,并安装套管帽。雏鸡术后恢复3 d,挑选出体重相近的健康雏鸡20只,备用。
1.2.2 试剂注射鸡只提前禁食3 h,使用微量注射器(量程10 μL),PBS为Visfatin的溶剂,处理组每只鸡分别注射不同剂量Visfatin 5 μL,对照组注射5 μL PBS,相应溶液经微量注射器缓慢注入下丘脑内,留针约1 min后再将注射内管缓慢拔出。注射完成后立即给料,60 min后撤出料槽计算累积采食量。同时,将雏鸡快速处死,采集下丘脑组织,液氮速冻,-80 ℃条件下保存备用。
1.3 组织样本预处理取-80 ℃冷储的鸡下丘脑组织样本,置于预先添加400 μL冰冷氯仿/甲醇/水(体积比2:5:2) 的均相混合液1.5 mL的EP管中,于冰水浴中进行组织匀浆;匀浆液离心(14 000 r·min-1,4 ℃,15 min),吸取300 μL上清液置于新的2 mL EP管中,向沉淀中加入250 μL色谱级甲醇,充分混匀后,4 ℃静置10 min,离心(14 000 r·min-1,4 ℃,15 min),取250 μL上清液,与第一次的上清液合并,涡旋混合;移取200 μL提取液,加入到预先添加10 μL半乳糖醇Dulcitol (0.05 mg·mL-1)内标溶液的高回收率玻璃衍生小瓶中,温和氮气吹干提取液;向干燥小瓶中加入30 μL甲氧胺盐酸盐吡啶溶液(20 μg·mL-1),涡旋30 s,37 ℃肟化反应90 min;加入30 mL的BSTFA衍生试剂,涡旋5 s,70 ℃反应60 min;取出样本,室温放置冷却,进行GC-MS代谢组学分析。
1.4 GC-MS检测本试验的仪器分析平台为Agilent 7890A/5975C GC/MS系统,毛细管色谱柱为Agilent J & W Scientific公司的HP-5 ms(30 m×0.25 mm×0.25 μm)。检测以高纯氦气(纯度大于99.999%)作为载气,不分流进样,进样量1.0 μL。升温程序为:初始温度70 ℃,维持2 min,以6 ℃·min-1的速度升至160 ℃,继续再以10 ℃·min-1的速度升至240 ℃,接着再按20 ℃·min-1的速度升至300 ℃并维持6 min。进样口温度250 ℃,EI离子源温度290 ℃,四极杆温度230 ℃,碰撞能量设为70 Ev。本研究采用全扫描模式进行质谱检测,质谱检测范围为50~600 m·z-1。此外,为了避免因仪器信号波动而造成的影响,我们采用随机顺序进行连续样本分析。
1.5 代谢组学数据分析GC-MS从每个样本中获得大量色谱峰和原始数据,通过提取、校对、解卷积等处理,将GC-MS原始数据在R软件平台下采用自写的程序代码进行预处理。主要包括:基线过滤、峰识别、积分、保留时间校正、峰对齐和质谱碎片归属分析,参考X.F.Gao等[18]已出版的协议。质量窗口设置为80~600 m·z-1。最后在Excel 2007软件中进行后期编辑,包括来自于柱流失和样本制备造成的杂质峰的剔除和定量离子选择等,将最终结果组织为二维数据矩阵,包括变量、观察量(样本)和积分面积。所有数据归一化到总信号积分,将编辑后的数据矩阵导入Simca-P软件(版本11.0) 分别进行主成分分析(PCA)和偏最小二乘方判别分析(PLS-DA)。模型的质量由R2X或R2Y值所描述。一般来说,它们的值大于0.5即表示模型质量较好。
1.6 差异代谢物的鉴定人们在寻找差异性代谢物的时候,要考察两组之间的统计显著性。在峰强度标准归一化过程中,差异性代谢物的筛选标准是PLS-DA(VIP>1) 和Student’s t test(P<0.05)。变化倍数(Fold change)由两组间的平均归一化峰强度比值取以2为底的对数而计算得到。Fiehn GC-MS Metabolomics RTL Library、Golm Metabolome Database和NIST商业数据库,将已纯化的质谱自动与内部标准库进行比对。
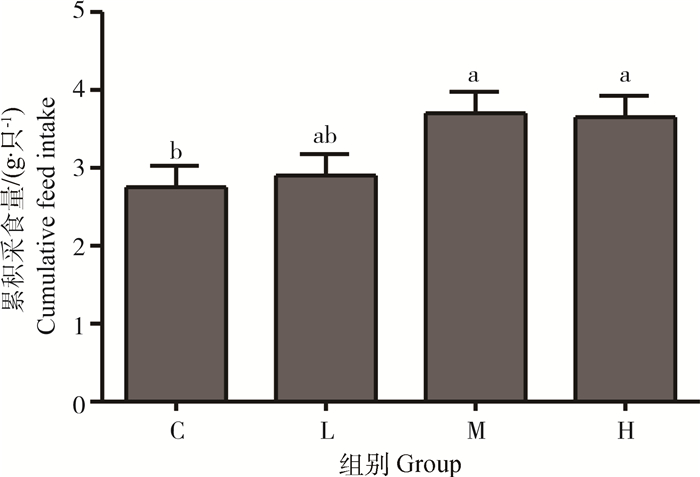
2 结果 2.1 脑室注射Visfatin对雏鸡采食量的影响不同剂量Visfatin处理雏鸡的累计采食量见图 1。由图 1可知,脑室注射Visfatin 60 min后,中浓度处理M组和高浓度处理H组与对照组C组相比,雏鸡的累积采食量显著升高(P<0.05);低浓度处理L组的采食量与其余各组相比差异均不显著(P>0.05),但其与对照组C组相比有增加趋势。
|
不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05) Different small letters means significant difference (P < 0.05), the same letter means no significant difference (P > 0.05) 图 1 不同剂量Visfatin处理雏鸡的累积采食量 Figure 1 The cumulative feed intake of chicks treated with different concentration Visfatin |
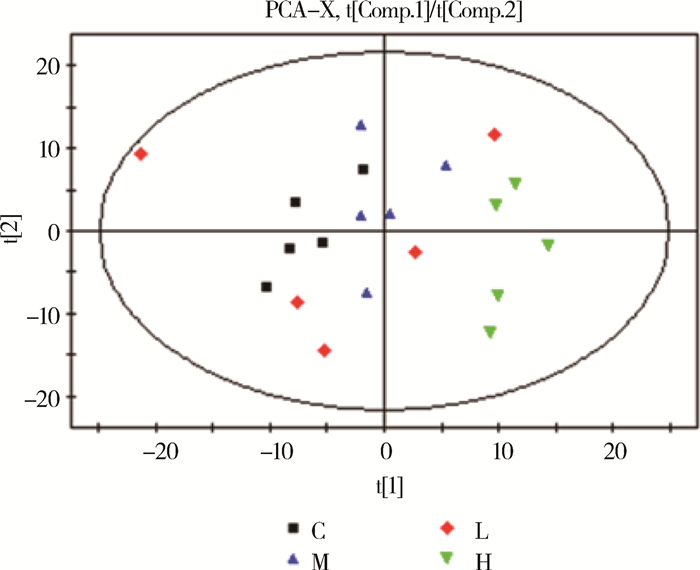
对4组样本进行主成分分析,PCA得分如图 2所示,共获得4个主成分,其模型累积解释率为R2X=0.58。一般来说R2X值大于0.5就表示该模型可靠,因此当前PCA模型能可靠地用于反映4组样本之间的代谢差异。所有样本处于95%置信区间内,没有异常样本。从PCA得分图中可以看出L组组内变异非常大,与C组和M组无显著的分离。C组、M组和H组3组样本之间在PC1和PC2上具有显著的分离,说明经过Visfatin处理后中浓度组M、高浓度组H与对照组相比具有显著的代谢差异。
|
横坐标表示第1主成分即PC1,用t[1]表示;纵坐标表示第2主成分即PC2,用t[2]表示 X-axis show the first principal component, t[1]; Y-axis show the second principal component, t[2] 图 2 PCA得分图 Figure 2 PCA score plot |
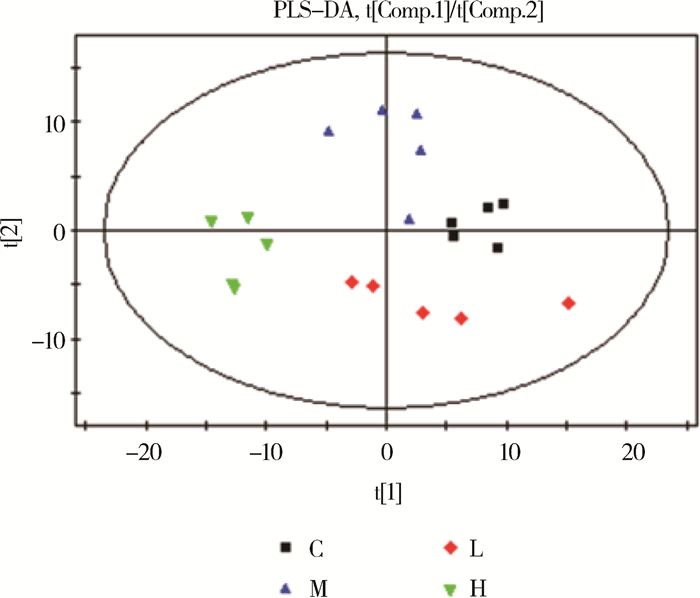
为了消除背景噪音的影响,采用PLS-DA这种监督性的统计分析方法,主要是消除组内差异,凸显组间差异。通过对4组样本的PLS-DA分析共获得7个主成分,模型解释率R2Y=0.539,说明PLS-DA模型能很好解释4组样本之间的差异。如图 3所示,H组和C组分别处于PC1(t[1]表示)的左右两侧,而L组和M组处于过渡阶段,且L组的5个样本的组内变异非常大,暗示L组处于剧烈变化阶段。
|
横坐标表示第1主成分即PC1,用t[1]表示;纵坐标表示第2主成分即PC2,用t[2]表示 X-axis show the first principal component, t[1]; Y-axis show the second principal component, t[2] 图 3 PLS-DA得分图 Figure 3 PLS-DA score plot |
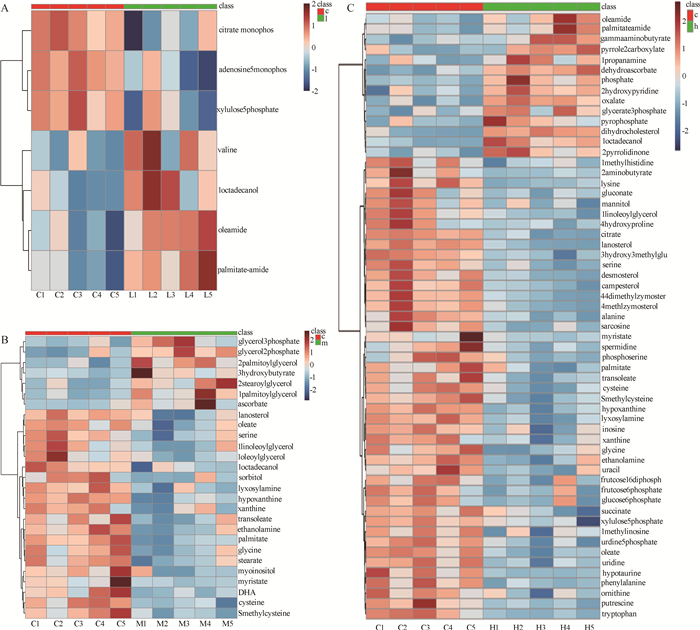
为了表示差异物之间的聚落关系,对定量信息进行热图分析。图 4中行代表差异性代谢物,列代表样品编号,上方的树状结构代表样本之间的相似度聚类关系,左侧的树状结构表示差异性代谢物之间的相似度聚类关系(图 4)。L组与C组共筛选并定性到7个(图 4 A)差异性代谢物,其中3个下降,4个上升;M组与C组相比有27个(图 4 B)差异性代谢物,20个下降,7个上升;H组与C组相比得到的差异物质最多,共59个(图 4 C)差异性代谢物,其中45个下降,14个上升。对所得差异代谢物进一步统计分析,发现共获得无重复差异代谢物73个,至少在2个对比组中有显著差异的代谢物共有20个(表 1),并将其分别归类到脂、糖、氨基酸和核苷酸代谢4个方面。很显然,从总体来看M组与对照组,H组与对照组中共同的差异代谢物多达16个,比率为80%,这与采食量的表观变化一致。此外,值得注意的是,至少在2个对比组中有显著差异的10个代谢物均归于脂代谢,这10个差异代谢物中,4个归于脂肪酸代谢通路。
|
A. L组与C组差异性代谢物的热图;B. M组与C组差异性代谢物的热图;C.H组与C组差异性代谢物的热图 A. Heatmap of differential metabolite between L and C groups; B. Heatmap of differential metabolite between M and C groups; C. Heatmap of differential metabolite between H and C groups 图 4 处理组与对照组差异代谢物的热图 Figure 4 Heatmap of differential metabolites between treatment groups and control group |
|
|
表 1 脑室注射Visfatin后雏鸡下丘脑中部分代谢差异物分类 Table 1 Classification of differential metabolite partly in chick hypothalamus after injected Visfatin |
使用软件MetaboAnalyst对差异代谢物进行通路分析。结果显示,处理组(L、M、H)与对照组(C)获得的差异代谢物分别富集到9条、26条和43条通路上,其中无重复通路共51条。通过综合分析,5图显示了通路的影响大小及相关P值,找寻对代谢物影响较大的通路。如图 5所示,图中圆点越大、颜色越红,说明富集的差异代谢物越多,差异代谢物对该点代表的通路的影响越大。较为关键的通路有三羧酸循环、甘氨酸代谢、丝氨酸代谢、苏氨酸代谢、精氨酸代谢、脯氨酸代谢和嘌呤代谢。其中,M组与C组的4个差异物在脂肪酸生物合成通路中显著富集,FDR值为0.030 1。
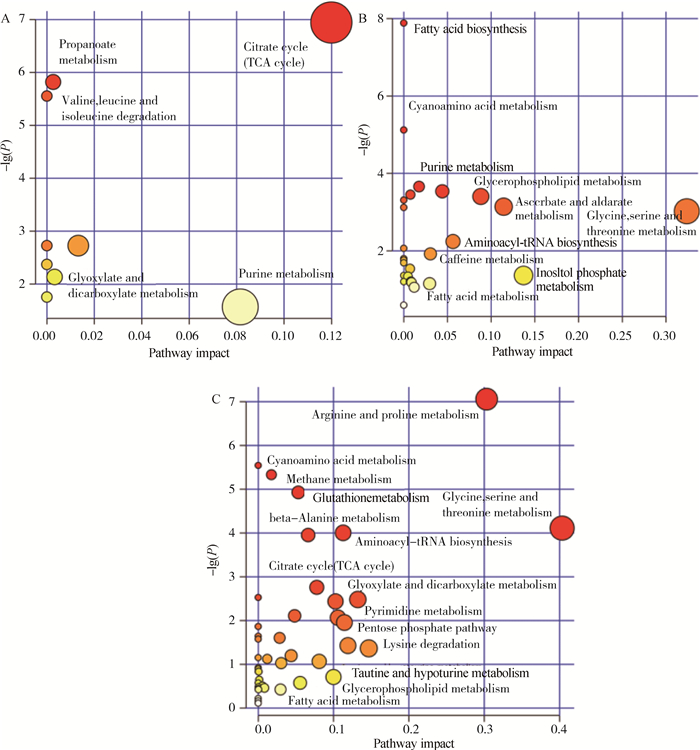
|
A. L组与C组的差异性代谢物通路;B. M组与C组的差异性代谢物通路;C.H组与C组的差异性代谢物通路。横坐标表示通路影响值;纵坐标表示转换后的P值。圆点的大小表示富集的差异代谢物数量,点越大,富集代谢物越多。颜色表示显著性,颜色越深,P值越小 A. Pathway of differential metabolite between L and C groups; B. Pathway of differential metabolite between M and C groups; C. Pathway of differential metabolite between H and C groups. X-axis show the pathway impact; Y-axis show the converted P-value.The size of dot means the amount of enriched metabolites, the larger dot means the more enriched metabolites; Colour means significance, the deeper color means the smaller P-value 图 5 处理组与对照组差异性代谢物的通路图 Figure 5 Pathway of differential metabolite between treatment groups and control group |
随着大数据时代的迅猛发展,气相色谱-质谱联用技术(GC-MS)具有灵敏度和峰值分辨率高且重现性强等特点,已被证明是研究复杂代谢物的最可靠方法之一,并得到了广泛应用[19]。早在1984年,Y.Kaburagi等[20]对小鼠的下丘脑和垂体前叶进行了GC-MS分析;后来,J.C.Lin等[21]利用GC-MS技术对大鼠的脑组织进行了氨基酸和有机酸的分析,但有关鸡下丘脑代谢组学研究的相关报道还很少见到。
本研究选取雏鸡下丘脑组织,通过GC-MS检测平台探究Visfatin作用后下丘脑相关代谢物发生的变化,发现,随着Visfatin剂量的增加,差异代谢物也相应增多,其中处理组与对照组间共鉴定获得73个差异性代谢物,至少在2个对比组中有显著差异的代谢物共有20个,将其分别归类到糖、脂、氨基酸和核苷酸代谢4个方面。其中脂代谢通路上油酸、反式油酸、棕榈酸、肉豆蔻酸、十八烯酸、亚麻酸、乙醇胺,氨基酸代谢通路上半胱氨酸、丝氨酸、甘氨酸、S-甲基半胱氨酸,糖代谢通路上柠檬酸、5-磷酸木酮糖以及核苷酸代谢通路上黄嘌呤和次黄嘌呤均显著降低。通路分析表明,差异代谢物富集最多的是脂代谢通路,其次是氨基酸代谢通路。研究表明,脑室注射Visfatin影响机体代谢,造成糖、脂和氨基酸等供能物质的稳态发生变化,而动物为保持机体平衡,其采食量(食欲)和能量支出必须保持协调,正是这种中枢供能物质的减少促进了采食量的增加,这与最初解释采食量调控的恒糖、恒脂和恒氨基酸学说完全相符,试验鸡的表现再次证明了这一现象,并与M.A.Cline等[14]研究结果是一致的。
下丘脑是维持机体能量平衡的中枢,含有能感知机体营养状态的神经元,脂肪酸作为能量信号[22],作用于下丘脑脂质敏感性神经元,传达机体的能量状态,参与摄食行为。1975年,Y.Oomura等[23]发现,脂肪酸可以激活下丘脑的神经元,揭开了脂肪酸可作为营养信号分子的研究序幕。S.Obici等[24-25]在脑室内连续6 h输注油酸后,发现大鼠出现明显食欲下降,肝葡萄糖生成减少。本研究中,肉豆蔻酸、油酸、反式油酸和棕榈酸在处理组含量都显著下调,它们都是脂肪酸代谢途径的产物,提示注射Visfatin后,脂肪酸合成途径受到抑制,中枢神经系统感应到脂肪酸的降低,通过改变交感神经活性[26]、调节神经元离子通道的开闭[27]和影响神经递质的释放[24]等方式来促进采食量的增加,以满足机体需求。
动物体内的甘氨酸、丝氨酸和半胱氨酸都属于生糖氨基酸[28],能够在糖缺乏状态下,转换成葡萄糖为机体提供能量。本研究中,处理组中它们的含量显著下降,糖异生的原料减少,葡萄糖浓度降低,信号传递至下丘脑中被整合分析,并调控采食。
三羧酸循环[29]是由三大物质分解代谢的乙酰CoA与草酰乙酸缩合成含有3个羧基的柠檬酸开始的,是机体获得能量的主要方式。柠檬酸是三羧酸循环的第一个产物,琥珀酸是琥珀酰CoA在琥珀酰CoA合成酶的催化下生成的,两者都参与三羧酸循环[30]。本研究中,处理组的柠檬酸和琥珀酸含量都显著下降,但琥珀酸含量只在高浓度Visfatin组显著高于对照组,提示注射Visfatin的剂量对三羧酸循环是有影响的,三羧酸循环产能减少,导致机体能量不足,通过增加采食量来改变这种能量负平衡的状态。
4 结论研究证明,脑室注射Visfatin可以显著提高雏鸡采食量,基于GC-MS的雏鸡下丘脑代谢组学分析,得到了脑室注射不同剂量Visfatin组以及空白对照组样品的下丘脑组织代谢轮廓,其中共获得无重复差异代谢物73个,富集到51条通路上。至少在两个对比组中有显著差异的代谢物共有20个,并将其分别归类到糖、脂、氨基酸和核苷酸代谢4个方面。在代谢水平上,下丘脑中营养物质的代谢产物降低,刺激能量稳态平衡发生改变,从而使得动物机体采食量增加可能是Visfatin发挥促食作用的主要机制。
致谢: 感谢上海谱领生物科技有限公司提供的气相色谱质谱试验和数据分析。| [1] |
张盼盼, 商鹏飞, 田方圆, 等. 鸡Visfatin蛋白的原核表达、纯化及其活性研究[J]. 畜牧兽医学报, 2016, 47(9): 1785–1794.
ZHANG P P, SHANG P F, TIAN F Y, et al. Prokaryotic expression, purification and bioactivity identification of recombinant chicken visfatin protein[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(9): 1785–1794. (in Chinese) |
| [2] |
于继英, 黄美珍. 畜禽采食量的调节[J]. 中国畜牧兽医, 2005, 32(9): 6–8.
YU J Y, HUANG M Z. Effect of dietary oliseeds supplementation on milk regulation of feed intake[J]. China Animal Husbandry and Veterinary Medicine, 2005, 32(9): 6–8. (in Chinese) |
| [3] | FUKUHARA A, MATSUDA M, NISHIZAWA M, et al. Visfatin:a proteinsecreted by visceral fat that mimics the effects of insulin[J]. Science, 2005, 307(5708): 426–430. DOI: 10.1126/science.1097243 |
| [4] | REVOLLO J R, KÖMER A, MILLS K F, et al. Nampt/PBEF/visfatin regulates insulin secretion in β cells as a systemic NAD biosynthetic enzyme[J]. Cell Metab, 2007, 6(5): 363–375. DOI: 10.1016/j.cmet.2007.09.003 |
| [5] | DIOT M, REVERCHON M, RAMÉ C, et al. Expression and effect of NAMPT (visfatin) on progesterone secretion in hen granulosa cells[J]. Reproduction, 2015, 150(1): 53–63. DOI: 10.1530/REP-15-0021 |
| [6] | REVERCHON M, CORNUAU M, CLOIX L, et al. Visfatin is expressed in human granulosa cells:regulation by metformin through AMPK/SIRT1 pathways and its role in steroidogenesis[J]. Mol Hum Reprod, 2013, 19(5): 313–326. DOI: 10.1093/molehr/gat002 |
| [7] | REVERCHONM, RAMÉ C, BERTOLDO M, et al. Adipokines and the female reproductive tract[J]. Int J Endocrinol, 2014, 2014: 232454. |
| [8] |
温宇, 杨姗姗, 刘婧, 等. 性激素对3T3-L1脂肪细胞Visfatin表达的影响[J]. 中国动脉硬化杂志, 2012, 20(10): 871–875.
WEN Y, YANG S S, LIU J, et al. Regulation of sex steroid hormone on Visfatin expression in adipocytes and preadipocytes[J]. Chinese Journal of Arteriosclerosis, 2012, 20(10): 871–875. (in Chinese) |
| [9] | MOSCHEN A R, GERNER R R, TILG H. Pre-B cell colony enhancing factor/NAMPT/visfatin in inflammation and obesity-related disorders[J]. Curr Pharm Des, 2010, 16(17): 1913–1920. DOI: 10.2174/138161210791208947 |
| [10] | ZHANG L Q, HERUTH D P, YE S Q. Nicotinamide phosphoribosyltransferase in human diseases[J]. J Bioanal Biomed, 2011, 3(1): 13–25. |
| [11] | CHEN M P, CHUNG F M, CHANG D M, et al. Elevated plasma level of visfatin/pre-B cell colony-enhancing factor in patients with type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2006, 91(1): 295–299. DOI: 10.1210/jc.2005-1475 |
| [12] | OGNJANOVIC S, BRYANT-GREENWOOD G D. Pre-B-cell colony-enhancing factor, a novel cytokine of human fetal membranes[J]. Am J Obstet Gynecol, 2002, 187(4): 1051–1058. DOI: 10.1067/mob.2002.126295 |
| [13] | YE S Q, SIMON B A, MALONEY J P, et al. Pre-B-cell colony-enhancing factor as a potential novel biomarker in acute lung injury[J]. Am J Respir Crit Care Med, 2005, 171(4): 361–370. DOI: 10.1164/rccm.200404-563OC |
| [14] | CLINE M A, NANDAR W, PRALL B C, et al. Central visfatin causes orexigenic effects in chicks[J]. Behav Brain Res, 2008, 186(2): 293–297. DOI: 10.1016/j.bbr.2007.08.016 |
| [15] | BRUNETTI L, RECINELLA L, NISIO C, et al. Effects of visfatin/PBEF/NAMPT on feeding behaviour and hypothalamic neuromodulators in the rat[J]. J Biol Regul Homeost Agents, 2012, 26(2): 295–302. |
| [16] | NICHOLSON J K, LINDON J C. Systems biology:metabonomics[J]. Nature, 2008, 455(7216): 1054–1056. DOI: 10.1038/4551054a |
| [17] | FIEHN O, KOPKA J, DÖRMANN P, et al. Metabolite profiling for plant functional genomics[J]. Nat Biotechnol, 2000, 18(11): 1157–1161. DOI: 10.1038/81137 |
| [18] | GAO X F, PUJOS-GUILLOT E, SÉBÉDIO J L. Development of a quantitative metabolomic approach to study clinical human fecal water metabolome based on trimethylsilylation derivatization and GC/MS analysis[J]. Anal Chem, 2010, 82(15): 6447–6456. DOI: 10.1021/ac1006552 |
| [19] | WOLTHERS B G, KRAAN G P B. Clinical applications of gas chromatography and gas chromatography-mass spectrometry of steroids[J]. J Chromatogr A, 1999, 843(1-2): 247–274. DOI: 10.1016/S0021-9673(99)00153-3 |
| [20] | KABURAGI Y, FUKABORI Y, TAKAHASHI E, et al. The metabolism of testosterone in the central nervous system (1). Analysis of testosterone metabolites in the anterior pituitary and hypothalamus using gas chromatography-mass spectrometry (GC-MS), and subcellular localization of testosterone converting enzyme[J]. Nihon Naibunpi Gakkai Zasshi, 1984, 60(11): 1314–1327. |
| [21] | LIN J C, SU M M, WANG X Y, et al. Original paper multiparametric analysis of amino acids and organic acids in rat brain tissues using GC/MS[J]. J Sep Sci, 2008, 31(15): 2831–2838. DOI: 10.1002/jssc.v31:15 |
| [22] | LÓPEZ M, LAGE R, SAHA A K, et al. Hypothalamic fatty acid metabolism mediates the orexigenic action of ghrelin[J]. Cell Metab, 2008, 7(5): 389–399. DOI: 10.1016/j.cmet.2008.03.006 |
| [23] | OOMURA Y, NAKAMURA T, SUGIMORI M, et al. Effect of free fatty acid on the rat lateral hypothalamic neurons[J]. Physiol Behav, 1975, 14(4): 483–486. DOI: 10.1016/0031-9384(75)90015-3 |
| [24] | OBICI S, FENG Z H, MORGAN K, et al. Central administration of oleic acid inhibits glucose production and food intake[J]. Diabetes, 2002, 51(2): 271–275. DOI: 10.2337/diabetes.51.2.271 |
| [25] | OBICI S, FENG Z H, ARDUINI A, et al. Inhibition of hypothalamic carnitine palmitoyltransferase-1 decreases food intake and glucose production[J]. Nat Med, 2003, 9(6): 756–761. DOI: 10.1038/nm873 |
| [26] | CRUCIANI-GUGLIELMACCI C, HERVALET A, DOUARED L, et al. Beta oxidation in the brain is required for the effects of non-esterified fatty acids on glucose-induced insulin secretion in rats[J]. Diabetologia, 2004, 47(11): 2032–2038. DOI: 10.1007/s00125-004-1569-2 |
| [27] | FUJIWARA K, MAEKAWA F, DEZAKI K, et al. Oleic acid glucose-independently stimulates glucagon secretion by increasing cytoplasmic Ca2+ via endoplasmic reticulum Ca2+ release and Ca2+ influx in the rat islet α-cells[J]. Endocrinology, 2007, 148(5): 2496–2504. DOI: 10.1210/en.2006-1156 |
| [28] | ASECHI M, KURAUCHI I, TOMONAGA S, et al. Relationships between the sedative and hypnotic effects of intracerebroventricular administration of L-serine and its metabolites, pyruvate and the derivative amino acids contents in the neonatal chicks under acute stressful conditions[J]. Amino Acids, 2008, 34(1): 55–60. DOI: 10.1007/s00726-007-0596-y |
| [29] | GIBALA M J, YOUNG M E, TAEGTMEYER H. Anaplerosis of the citric acid cycle:role in energy metabolism of heart and skeletal muscle[J]. Acta physiol Scand, 2000, 168(4): 657–665. DOI: 10.1046/j.1365-201x.2000.00717.x |
| [30] | HE W H, MIAO F J P, LIN D C H, et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors[J]. Nature, 2004, 429(6988): 188–193. DOI: 10.1038/nature02488 |



