2. 中国农业科学院北京畜牧兽医研究所, 农业部畜禽遗传资源与利用重点开放实验室, 北京 100193;
3. 湖南农业大学动物医学院, 长沙 410128;
4. 北京农业职业学院, 北京 102442;
5. 北京市畜牧总站, 北京 100107;
6. 石家庄天泉良种奶牛有限公司, 石家庄 050020
2. The Key Laboratory for Farm Animal Genetic and Utilization of Ministry of Agriculture of China, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China;
4. Beijing Vocational College of Agriculture, Beijing 102442, China;
5. Animal Husbandry Station of Beijing, Beijing 100107, China;
6. Shijiazhuang Tianquan Elite Dairy Ltd., Shijiazhuang 050020, China
繁殖效率是奶牛场经济效益重要影响因素之一[1],提高发情鉴定与排卵时间预测准确性是提高奶牛繁殖效率的关键[2-3]。奶牛发情鉴定主要有外部观察与体温[4-5]、阴道黏液电阻值(简称电阻值)[6]、活动量[7]、孕酮浓度[8-9]、产奶量[10]检测等方法。人工外部观察法简单有效、错误率低[11],对夜间发情[12-13]、发情持续时间短、无站立发情表现[14-15]或隐性发情牛漏检较多[16-18]。准确、有效、简便的发情鉴定方法,对提高奶牛场繁殖效率有重要意义。
1954年,J.B.Roelofs等[19]应用活动量变化进行奶牛发情鉴定。研究发现,93%的母牛发情期活动量激增至平时的400% [11],使用活动量鉴定发情,奶牛发情检出率可高达83.0%~91.5%,假阳性率为8.0%~11.3% [19-20]。但从开始发情~排卵平均约为(29.0±3.9) h(22~39 h),有的则稍短一些,11.5%牛 < 20 h,14.7%牛>30 h[20]。使用活动量鉴定奶牛发情效果较好,但用于预测排卵时间则存在一定局限性,很难准确确定输精时间。奶牛发情除伴随活动量变化外,还伴随着阴道黏液电阻值的规律性变化,黄体期电阻值最高,卵泡发育期电阻值较低[21-22],排卵前25 h,电阻值达到最低值[18]。发情牛与未发情牛电阻值差异显著,电阻值用于发情鉴定具有很高的灵敏性与特异性[6]。电阻值与卵泡直径成负相关[23],但排卵与电阻值的关系未明确揭示。活动量与电阻值结合用于预测奶牛发情排卵具有明显优势,相关研究未见报道。
本团队自行研发了一套发情监测系统(一种基于奶牛活动量变化的发情监测系统,专利号:CN201520109489.6)。使用该系统自动检测试验牛活动量,同时使用发情排卵仪手动测定试验牛电阻值,结合观察发情与直肠检查结果确定奶牛发情、排卵状态。探究奶牛发情排卵与活动量、电阻值的相关性,为建立奶牛发情自动监测技术与准确确定输精时间提供重要参考。
1 材料与方法 1.1 试验时间地点本试验于2015年10月—2016年3月在河北天泉良种奶牛场进行。
1.2 试验动物及饲养随机选择产后60~90 d二胎健康、西门塔尔牛与产后60~90 d头胎健康荷斯坦奶牛各10头为试验牛,所有试验牛个体间不存在血缘关系。试验牛采用散栏饲养、全混合日粮(TMR)饲喂,每天6:00、14:00、18:00 3次投放饲料、保证清洁饮水。
1.3 试验仪器本团队自行研发的发情监测系统(一种基于奶牛活动量变化的发情监测系统,专利号:CN201520109489.6):活动量检测装置(计步器,采用加速度传感器检测活动量)、采集器(收集计步器检测到的活动量数据,并上传至上位机系统)及上位机系统(包括上位机通信模块与上位机软件,用于接收与储存采集器上传的数据,并经分析后通过上位机软件显示),发情排卵仪(BATERSUARG®)。
1.4 两次PG法诱导同期发情牛产后发情周期任意一天第1次注射前列腺素F2α(Prostaglandin F2α,PGF2α),11 d后, 第2次注射PGF2α,试验牛第2次注射PGF2α后,2~5 d内发情,该处理发情率可达90%[24],对于发情母牛进行后续检测分析。
1.5 发情鉴定 1.5.1 外部观察第2次注射PGF2α后第2天开始,每4 h观察1次发情(每次30 min)。参考J.B.Roelofs等[19]记录方法,将首次观察~发情的时间-2 h定为发情开始时间,最后一次观察~发情的时间+2 h定为发情结束时间,同时进行直肠检查与活动量确定。此外,通过直肠检查确定排卵时间,排卵时间定义为最后一次摸到卵泡的时间+2 h。
1.5.2 电阻值检测第2次注射PGF2α后立即检测电阻值,注射后第2天开始每4 h测定1次电阻值,直至排卵后6 h,测定结束。
1.5.3 活动量检测试验前将计步器固定于牛后腿跖部,采用实时监测方式检测活动量,每检测到1次加速度则活动量记为1,并以30 min为周期累计活动量数据。采集器每4 h采集1次计步器储存的活动量数据,并传到电脑储存,经过初步分析后通过软件显示。当活动量超过前10 d(间情期)平均值的3倍,并持续2 h以上时认为开始发情,活动量降至前10 d(间情期)相同时间点平均值的3倍以下时,定义为发情结束,并通过观察发情、直肠检查结果进行确认。
1.6 数据分析电阻值数据与活动量数据均使用SAS 9.2进行方差分析,检验发情期与间情期、不同品种间差异显著性。由于牛发情起始时间、结束时间及排卵时间均不同步,发情持续时间也不同,因此,进行电阻值与活动量变化规律研究时,将发情开始时间与排卵时间均定为0,并分别向前后截取一段时间进行统计分析。采用t检验分析不同品种牛发情持续时间、开始发情~排卵时间、发情结束~排卵时间的差异显著性。
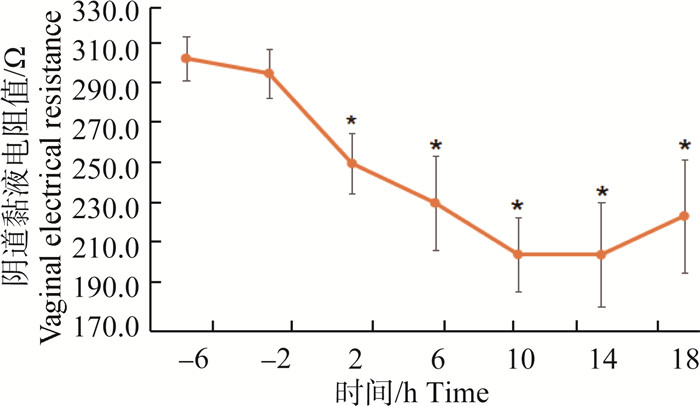
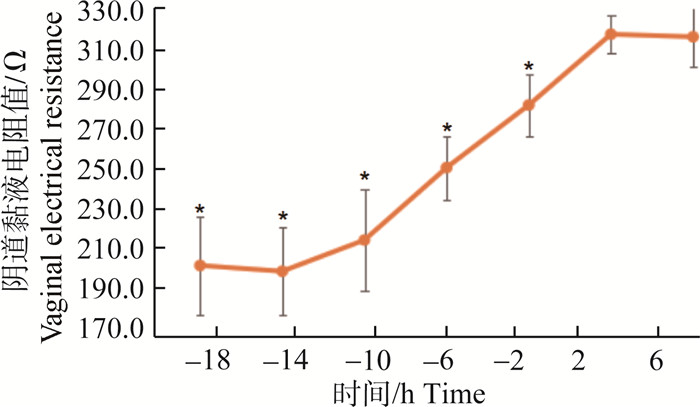
2 结果 2.1 发情期电阻值与活动量变化规律 2.1.1 牛发情排卵时电阻值变化规律对西门塔尔牛(肉牛)与荷斯坦奶牛(奶牛)电阻值的方差分析,肉牛与奶牛发情期((221±26) Ω vs (219±29) Ω)与间情期((299±11) Ω vs (302±14) Ω)阴道黏液电阻值无品种差异(P>0.05),但间情期电阻值((300±12) Ω)显著高于发情期((220±27) Ω)(P<0.05)。将发情(排卵)开始时间定为0 h,发情(排卵)开始前时间为负数,发情(排卵)开始后时间为正数。发情开始前后与排卵前后电阻值变化规律见图 1和图 2(不区分品种)。图 1显示,间情期电阻值维持在最高水平((300±12) Ω),发情开始前4 h电阻值迅速下降,到发情后8~12 h下降至最低值((220±27) Ω),之后电阻值逐渐上升,至排卵结束恢复至间情期水平(图 2),间情期与发情期电阻值最大平均差值为(114±18) Ω(P<0.05),电阻值最低值至排卵的时间为(15.0 ±1.3) h。
|
*.P < 0.05。下同 *.P < 0.05.The same as below 图 1 发情开始前后电阻值变化规律 Figure 1 The variation of VER before and after the onset of oestrus |
|
图 2 排卵前后电阻值变化规律 Figure 2 The variation of VER before and after ovulation |
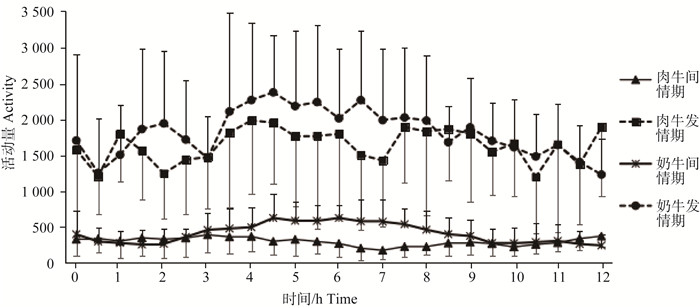
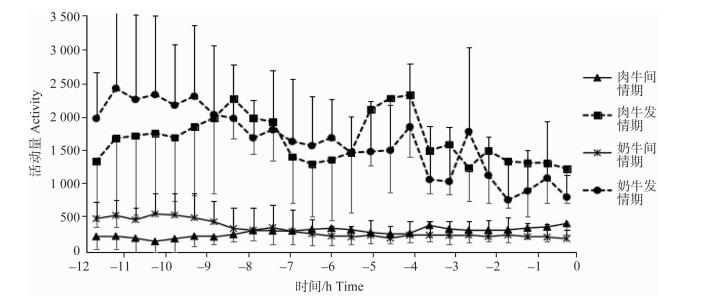
分别统计西门塔尔牛和荷斯坦奶牛发情期活动量平均值与间情期10 d相同时间点活动量平均值,两品种牛发情开始后与发情结束前活动量变化规律如图 3、图 4。结果表明,间情期肉牛与奶牛发情时活动量较低,其中肉牛活动量均 < 500,奶牛大部分活动量 < 500,仅有部分时间段>500。发情后活动量急剧增加,肉牛整个发情期活动量均>1 000,奶牛有部分时间活动量 < 1 000。发情开始后4.5 h左右奶牛活动量增加至最大值(2 370±790),肉牛发情后4.0 h左右活动量增加至最大值(1 979±1 019);肉牛与奶牛活动量分别于发情结束前4.0与11.5 h左右达最高。母牛活动量高峰后,随发情进程活动量逐渐降低,至发情结束后恢复至正常值。
|
图 3 发情开始后活动量变化规律 Figure 3 Activity variation after the onset of oestrus |
|
图 4 发情结束前活动量变化规律 Figure 4 Activity variation before the end of oestrus |
本研究共监测了20头牛的活动量与阴道黏液电阻值数据,将活动量超过间情期3倍,并持续2 h定义为开始发情,活动量降至间情期3倍以下定义为发情结束,结合电阻值、外部观察与直肠检查结果,确认19头牛发情并排卵。发情后与发情前数据统计分析结果见表 1。表 1表明,发情后活动量平均增加(10.8±7.0) 倍,肉牛增加倍数显著高于奶牛(P<0.05)。发情持续时间平均为(15.6±2.8) h,43.75%牛发情持续时间集中为17~18 h,81.25%持续时间为14~19 h,肉牛发情持续时间显著短于奶牛P<0.05。发情开始~排卵的时间平均为(26.8±4.2) h,发情开始~排卵的时间为26~30 h的占49.5%,奶牛显著长于肉牛(P<0.05)。发情结束~排卵时间平均为(11.3±4.3) h,主要集中在8~14 h(62.5%),肉牛与奶牛间差异不显著(P>0.05)。阴道黏液电阻值出现最低值~排卵的时间为(15.0±1.3) h,肉牛显著短于奶牛(P<0.05)。
|
|
表 1 牛发情、排卵时间及活动量变化规律 Table 1 Oestrus and ovulation time and the variation of activity |
本研究同期处理20头牛,经外部观察及直肠检查确认(表 2),共鉴定出19头牛发情,1头未发情,同期发情率95%。表 2显示,同期处理后发情的19头牛中,17头活动量变化明显(西门塔尔牛9头,荷斯坦牛8头),16头电阻值变化明显(西门塔尔与荷斯坦各8头),活动量与阴道黏液电阻值均明显变化的14头(西门塔尔牛与荷斯坦牛各7头)。单独使用活动量与阴道黏液电阻值的发情检出率,西门塔尔牛分别为90%与80%,荷斯坦奶牛均为88.9%,而两参数的整合发情鉴定率则可达100%。
|
|
表 2 以活动量与电阻值为指标的发情鉴定效果 Table 2 Oestrus detected efficiency based on VER and activity |
奶牛运动量的影响因素可能有品种、胎次、泌乳阶段、气候及个体差异等因素[25]。采用统一阈值的算法将增加奶牛发情鉴定错误率。基于广义似然比及时间概率进行奶牛活动量数据统计,采用统一阈值进行发情鉴定,对44头奶牛活动量数据分析,发情检测灵敏度达88.9%,错误率达5.9%[26]。孙保贵等将128步定为阈值,和当天活动量与前1 d运动量的差值相比较,发情检出率90%,错误率3.7%[27-28]。本研究将当天活动量与前10 d相同时间点的个体平均值进行比较,充分考虑了个体变化因素,避免了品种、胎次、泌乳阶段、气候及个体差异等因素的影响,并设定当差值达到3倍,且持续2 h时,认为开始发情,低于阈值后则认为发情结束,未采用全场固定的阈值,降低了系统误差和错误率,增加了发情检出率。该系统阈值可根据不同牛场发情活动量变化规律个性化设定,减少了由于牧场管理方式、饲养水平等差异引起的错误率。
雌激素是刺激下丘脑诱导发情的最主要信号,而高产奶牛雌二醇水平低于低产牛,导致高产奶牛发情时活动量低于低产奶牛[29]。荷斯坦奶牛发情期活动量变化规律研究表明,初产牛发情时活动量增加倍数显著高于经产牛((354.8±8.4)% vs. (323.9±6.0)%)[30]。也有研究表明,头胎牛与二胎牛发情活动量差异不显著[27]。本研究发现,奶牛发情后活动量低于肉牛,原因可能奶牛产奶消耗较大,卵泡发育不如肉牛更充分,导致奶牛发情后活动量显著低于肉牛,但本测定结果也高于A.M.L.Madureira等[30]研究结果(8.5倍vs. 3.5倍),具体原因有待深入研究。
对98头泌乳奶牛发情期活动量规律研究发现,奶牛发情持续期为(13.0±0.8) h,其中97头牛,开始发情~排卵时间为(25.7±0.4) h,发情结束~排卵时间为(13.1±0.8) h[20]。对282头发情牛的研究也发现了相似结果[31]。而J.B.Roelofs等[19]发现,奶牛排卵分别发生在发情开始后(29.3±3.9) h,及发情结束后(19.4±4.4) h,时间稍长一些。研究荷斯坦奶牛发情持续时间发现,初产牛显著长于经产牛((12.0±0.3) h vs. (10.2±0.2) h)[30]。也有研究未发现经产牛与初产牛间发情持续时间有显著差异[32]。本研究发现,发情持续时间平均为(15.6±2.8) h,但初产牛与经产牛之间发情持续时间差异与A.M.L.Madureira等[30]研究结果基本一致,可能初产牛产奶任务较轻,卵泡发育较充分,发情持续时间相对较长。
黄体期电阻值最高,卵泡发育期电阻值最低[21-22],与本研究结果一致,但其未明确揭示发情周期变化规律,本文首次揭示间情期电阻值最高((300±12) Ω),发情前迅速下降,至发情后8~12 h降至最低值((220±27) Ω),排卵前后恢复至间情期水平。关于电阻值与卵泡直径负相关的研究结果[23]与本研究基本一致。但本研究发现排卵前(15.0±1.3) h阴道黏液电阻值达最低,显著短于以往排卵前25 h电阻值达到最低值的报道[18]。本研究发现,阴道黏液电阻值达最低至排卵时间较集中,可利用该指标准确预测排卵时间。本研究结合二参数可进一步提高牧场的发情鉴定效率,进而提高妊娠效率。与传统观察发情相比,本团队研发的奶牛发情监测系统实现了24 h全覆盖检测,有望能大大提高发情持续时间短与夜间发情牛只检出率,同时,一旦实现电阻值自动化检测,将大大提高排卵时间预测的准确性,大幅降低传统观察发情的劳动时间与强度,解放生产力,对提高奶牛场经济效益具有现实意义。
4 结论本研究初步揭示了西门塔尔牛、荷斯坦奶牛发情期活动量与电阻值变化规律,利用该规律获得了较高的发情检出率,为自动化发情监测及排卵预测技术的研发及应用提供了重要参考。
| [1] |
田育峰. 营养因素对奶牛繁殖效率的影响[J]. 中国畜禽种业, 2016(9): 70.
TIAN Y F. Effects of nutritional factors on reproductive efficiency of dairy cows[J]. The Chinese Livestock and Poultry Breeding, 2016(9): 70. (in Chinese) |
| [2] |
李小俊, 王振玲, 陈晓丽, 等. 奶牛体温变化规律及繁殖应用研究进展[J]. 畜牧兽医学报, 2016, 47(12): 2331–2341.
LI X J, WANG Z L, CHEN X L, et al. Study progress on the rule of body temperature and its application in reproduction of dairy cattle[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2331–2341. (in Chinese) |
| [3] | ROELOFS J B, SOEDE N M, KEMP B. Insemination strategy based on ovulation prediction in dairy cattle[J]. Vlaams Diergen Tijds, 2006, 75(2): 70–78. |
| [4] | TALUKDER S, KERRISK K L, INGENHOFF L, et al. Infrared technology for estrus detection and as a predictor of time of ovulation in dairy cows in a pasture-based system[J]. Theriogenology, 2014, 81(7): 925–935. DOI: 10.1016/j.theriogenology.2014.01.009 |
| [5] |
寇红祥, 赵福平, 任康, 等. 奶牛体温与活动量检测及变化规律研究进展[J]. 畜牧兽医学报, 2016, 47(7): 1306–1315.
KOU H X, ZHAO F P, REN K, et al. The progress on detection method and the regularities of body temperature and activities in dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1306–1315. (in Chinese) |
| [6] | HOCKEY C D, NORMAN S T, MORTON J M, et al. Use of vaginal electrical resistance to diagnose oestrus, dioestrus and early pregnancy in synchronized tropically adapted beef heifers[J]. Reprod Dom Anim, 2010, 45(4): 629–636. |
| [7] | AUNGIER S P, FOCHE J F, SHEEHY M, et al. Effects of management and health on the use of activity monitoring for estrus detection in dairy cows[J]. J Dairy Sci, 2011, 95: 2452–2466. |
| [8] | FRIGGENS N C, CHAGUNDA M G G. Prediction of the reproductive status of cattle on the basis of milk progesterone measures:model description[J]. Theriogenology, 2005, 64(1): 155–190. DOI: 10.1016/j.theriogenology.2004.11.014 |
| [9] |
钱伟东, 张洪友, 夏成, 等. 检测奶牛乳汁孕酮的免疫生物传感器优化[J]. 畜牧与兽医, 2015, 47(9): 10–14.
QIAN W D, ZHANG H Y, XIA C, et al. Optimization of immune biosensors for milk progesterone in dairy cows[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(9): 10–14. (in Chinese) |
| [10] | GAILLARD C, BARBU H, SØRENSEN M T, et al. Milk yield and estrous behavior during eight consecutive estruses in Holstein cows fed standardized or high energy diets and grouped according to live weight changes in early lactation[J]. J Dairy Sci, 2016, 99(4): 3134–3143. DOI: 10.3168/jds.2015-10023 |
| [11] | KIDDY C A. Variation in physical activity as an indication of estrus in dairy cows[J]. J Dairy Sci, 1977, 60(2): 235–243. DOI: 10.3168/jds.S0022-0302(77)83859-9 |
| [12] |
王根林.
养牛学[M]. 北京: 中国农业出版社, 2000.
WANG G L. Cattle breeding science[M]. Beijing: China Agriculture Press, 2000. (in Chinese) |
| [13] |
孙保贵. 奶牛运动量辅助发情诊断及电导率辅助乳房炎诊断参数的研究[D]. 泰安: 山东农业大学, 2011.
SUN B G. A study on parameters for estrus detection based on activity record and subclinical mastitis diagnosis based on milk conductivity in lactating cows[D]. Tai'an:Shandong Agricultural University, 2011. (in Chinese) |
| [14] | VAN EERDENBURG F J, LOEFFLER H S, VAN VLIET J H. Detection of oestrus in dairy cows:a new approach to an old problem[J]. Vet Q, 1996, 18(2): 52–54. DOI: 10.1080/01652176.1996.9694615 |
| [15] | DRANSFIELD M B G, NEBEL R L, PEARSON R E, et al. Timing of insemination for dairy cows identified in estrus by a radiotelemetric estrus detection system[J]. J Dairy Sci, 1998, 81(7): 1874–1882. DOI: 10.3168/jds.S0022-0302(98)75758-3 |
| [16] | WILLIAMS W F, YVER D R, GROSS T S. Comparison of estrus detection techniques in dairy heifers[J]. J Dairy Sci, 1981, 64(8): 1738–1741. DOI: 10.3168/jds.S0022-0302(81)82757-9 |
| [17] | AT-TARAS E E, SPAHR S L. Detection and characterization of estrus in dairy cattle with an electronic heatmount detector and an electronic activity tag[J]. J Dairy Sci, 2001, 84(4): 792–798. DOI: 10.3168/jds.S0022-0302(01)74535-3 |
| [18] | FIRK R, STAMER E, JUNGE W, et al. Automation of oestrus detection in dairy cows:a review[J]. Livest Prod Sci, 2002, 75(3): 219–232. DOI: 10.1016/S0301-6226(01)00323-2 |
| [19] | ROELOFS J B, VAN EERDENBURG F J C M, SOEDE N M, et al. Pedometer readings for estrous detection and as predictor for time of ovulation in dairy cattle[J]. Theriogenology, 2005, 64(8): 1690–1703. DOI: 10.1016/j.theriogenology.2005.04.004 |
| [20] | STEVENSON J S, HILL S L, NEBEL R L, et al. Ovulation timing and conception risk after automated activity monitoring in lactating dairy cows[J]. J Dairy Sci, 2013, 97(7): 4296–4308. |
| [21] | SCHAMS D, SCHALLENBERGER E, HOFFMANN B, et al. The oestrous cycle of the cow:hormonal parameters and time relationships concerning oestrus, ovulation, and electrical resistance of the vaginal mucus[J]. Acta Endocrinol (Copenh), 1977, 86(1): 180–192. |
| [22] | CANFIELD R W, BUTLER W R. Accuracy of predicting the LH surge and optimal insemination time in Holstein heifers using a vaginal resistance probe[J]. Theriogenology, 1989, 31(4): 835–842. DOI: 10.1016/0093-691X(89)90028-9 |
| [23] | ZULUAGA J F, SALDARRIAGA J P, COOPER D A, et al. Evaluation of vaginal electrical resistance as an indicator of follicular maturity and suitability for timed artificial insemination in beef cows subjected to a synchronization of ovulation protocol[J]. Anim Reprod Sci, 2008, 109(1-4): 17–26. DOI: 10.1016/j.anireprosci.2007.10.002 |
| [24] | ODDE K G. A review of synchronization of estrus in postpartum cattle[J]. J Anim Sci, 1990, 68(3): 817–830. DOI: 10.2527/1990.683817x |
| [25] | ARNEY D R, KITWOOD S E, PHILLIOS C J C. The increase in activity during oestrus in dairy cows[J]. Appl Anim Behav Sci, 1994, 40(3-4): 211–218. DOI: 10.1016/0168-1591(94)90062-0 |
| [26] | JÓNSSONA R, BLANKE M, POULSEN N K, et al. Oestrus detection in dairy cows from activity and lying data using on-line individual models[J]. Comput Electron Agric, 2011, 76(1): 6–15. DOI: 10.1016/j.compag.2010.12.014 |
| [27] |
孙保贵, 郭予伟, 陈茂学, 等. 奶牛运动量辅助发情诊断参数的研究[J]. 中国畜牧杂志, 2015, 51(13): 71–75.
SUN B G, GUO Y W, CHEN M X, et al. Study on estrus detection parameter based on activity record in lactating cows[J]. Chinese Journal of Animal Science, 2015, 51(13): 71–75. DOI: 10.3969/j.issn.0258-7033.2015.13.016 (in Chinese) |
| [28] |
孙保贵, 郭予伟, 陈茂学, 等. 奶牛运动量辅助发情诊断参数的研究[C]//中国畜牧兽医学会养牛学分会2011年学术研讨会论文集. 北京: 中国畜牧兽医学会, 2011: 272-278.
SUN B G, GUO Y W, CHEN M X, et al. A study on estrus detection parameter based on activity record in lactating cows[C]//The 11th Session Academic Seminar of Cattel Breeding Branch of the China Animal Husbandry and Veterinary Medicine. Beijing:Chinese Association of Animal Science and Veterinary Medicine, 2011:272-278. (in Chinese) |
| [29] | SANGSRITAVONG S, COMBS D K, SARTORI R, et al. High feed intake increases liver blood flow and metabolism of progesterone and estradiol-17β in dairy cattle[J]. J Dairy Sci, 2002, 85(11): 2831–2842. DOI: 10.3168/jds.S0022-0302(02)74370-1 |
| [30] | MADUREIRA A M L, SILPER B F, BURNETT T A, et al. Factors affecting expression of estrus measured by activity monitors and conception risk of lactating dairy cows[J]. J Dairy Sci, 2015, 98(10): 7003–7014. DOI: 10.3168/jds.2015-9672 |
| [31] | SILPER B F, ROBLES I, MADUREIRA A M L, et al. Automated and visual measurements of estrous behavior and their sources of variation in Holstein heifers. I:walking activity and behavior frequency[J]. Theriogenology, 2015, 84(2): 312–320. DOI: 10.1016/j.theriogenology.2014.12.029 |
| [32] | LYIMO Z C, NIELEN M, OUWELTJES W, et al. Relationship among estradiol, cortisol and intensity of estrous behavior in dairy cattle[J]. Theriogenology, 2000, 53(9): 1783–1795. DOI: 10.1016/S0093-691X(00)00314-9 |



